- Home
- Volume 15 (2011)
- numéro 2
- Techniques de séchage des starters lactiques et mécanismes affectant la viabilité cellulaire suite à la lyophilisation
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Techniques de séchage des starters lactiques et mécanismes affectant la viabilité cellulaire suite à la lyophilisation

Editor's Notes
Reçu le 5 novembre 2009, accepté le 24 aout 2010
Résumé
La plupart des starters lactiques ont d'importants besoins nutritionnels et possèdent peu de résistance vis-à-vis des conditions environnementales entourant leur production (séchage, stockage, etc.) et leur utilisation in vivo (propriétés physico-chimiques du tractus digestif). Cette situation amène régulièrement les industriels à développer, avec les microbiologistes, des projets de recherche de nouvelles bactéries lactiques capables de supporter l'ensemble des procédés de production, de stockage et de formulation sans perdre leurs propriétés fonctionnelles. Parmi les différentes méthodes de séchage (atomisation, fluidisation et lyophilisation), la lyophilisation permet d'obtenir une déshydratation poussée compatible avec des durées de conservation très longues. Cette méthode implique des changements de la température du produit assez agressifs pour les micro-organismes car elle nécessite une congélation, ce qui n'est pas sans conséquence pour les cellules. Dans certains cas, elle occasionne des altérations cellulaires (peroxydation des acides gras) et génétiques (modification des protéines). L'utilisation de cryoprotecteurs au cours de la lyophilisation et d'antioxydants pendant le stockage augmente sensiblement le taux de viabilité de ces cellules.
Abstract
Preservation of industrial's lactic acid bacteria (probiotics) by freeze-drying. Majority of the lactic acid bacteria have important nutritional needs and do not have resistance against the environmental conditions surrounding their production (drying, storage, etc.) and their use in vivo (physico-chemical properties of the digestive tract). In this condition, industrialists and microbiologists develop regularly research projects of new lactic bacteria able to support the whole of the processes of production, storage and formulation without losing their functional properties. Among the various methods of drying (atomization, fluidization and freeze-drying), freeze-drying makes it possible to obtain a thorough dehydration compatible with very long storage times. This method involves changes in product temperature and is enough aggressive for microorganisms because they require freezing that is not without consequences for cells. In other cases, it causes cellular (peroxydation of the fatty-acids) and genetic (modification of proteins) deteriorations. The use of cryoprotecteurs during freeze-drying and of antioxidants during storage appreciably increases the rate of viability of these cells.
Table of content
1. Généralités sur le séchage des micro-organismes
1.1. Introduction
1La commercialisation de souches microbiennes, qu'il s'agisse de bactéries, de levures ou de moisissures, nécessite de les conditionner sous une forme durable stable (Leslie et al., 1995). En effet, en raison de leur physiologie, les cellules microbiennes ne se conservent pas à l'état natif dans leur milieu de culture. Leur développement est souvent assuré en fermenteur dans un substrat liquide. Conservées dans ce milieu après leur croissance, les cellules y consomment les derniers nutriments disponibles et expriment, pour la plupart, un métabolisme fermentaire qui nuit à la qualité du produit (modification du pH, émanation d'odeurs, etc.). De plus, les cellules, après avoir brûlé leurs réserves, meurent en grand nombre (Zhao et al., 2005). Il est donc indispensable de stabiliser la population microbienne. Le séchage des cellules apparait alors comme une solution pratique. En éliminant l'eau, le métabolisme cellulaire est bloqué, les cellules sont figées dans un état physiologique déterminé. Outre la conservation des micro-organismes, le séchage facilite la manipulation et le stockage et en réduit les couts. Les méthodes de séchage seront passées en revue, surtout les méthodes appliquées à l'échelle industrielle, à savoir l'atomisation, la fluidisation et la lyophilisation. Elles sont assez agressives vis-à-vis des micro-organismes car elles impliquent de fortes variations de la température du produit (Mille et al., 2005). L'utilisation de cryoprotecteurs au cours de la lyophilisation et d'antioxydants pendant le stockage augmente significativement le taux de viabilité des cellules.
1.2. Types de séchage dans les industries agro-alimentaires
2Concentration, dessiccation, séchage, déshydratation, autant de termes que l'on regroupera sous le terme général d'élimination d'eau. Toutes ces opérations obéissent en effet, fondamentalement, aux mêmes lois et leurs objectifs sont les mêmes. Alors que la concentration traite un produit liquide pour aboutir à un liquide, le séchage part d'un produit liquide ou solide, pour aboutir à un solide. Le séchage est un procédé de conservation extrêmement ancien qui, privant l'aliment d'eau libre, interdit toute activité microbienne ou enzymatique. La concentration ne donne lieu qu'à une élimination d'eau partielle, mais elle permet d'obtenir un produit dont la pression osmotique est parfois suffisante pour entraver tout développement microbien (Thonart, 2004). C'est ainsi que l'élimination d'eau permet de tamponner les caractères saisonniers de certaines activités agricoles (fenaison) ou industrielles (concentrés de jus de pommes en cidrerie). Des produits secs, tels que le lait en poudre, se conservent pendant des années. Le séchage consiste à éliminer un solvant emprisonné dans un solide en l'évaporant dans la phase gazeuse qui le baigne (Aller, 1998). Pour cela, il faut apporter de l'énergie pour compenser à la fois l'énergie de liaison solide-liquide (due à des forces de Van Der Waals) et la chaleur latente de vaporisation du solvant (Bayrock et al., 1997). Cet apport peut être fait par la phase gazeuse (on parle alors de séchage par convection) ou par une source externe (chauffage par effet Joule, par radiation infrarouge ou par courants de haute fréquence). Il faut aussi éviter la saturation en solvant de la phase gazeuse, ce qui est assuré par un balayage de l'atmosphère, qui maintient la pression partielle en solvant au voisinage du solide, inférieure à la pression de vapeur saturante.
3Atomisation. En agro-alimentaire, l'atomisation est une méthode de déshydratation d'un liquide (jus, lait, etc.). Lors de la déshydratation par atomisation, les aliments liquides sont projetés dans une chambre chauffante sous forme de fines gouttelettes, ce qui permet de faire évaporer l'eau et de recueillir l'aliment déshydraté en poudre à la base de l'appareil. Cette méthode est utilisée notamment pour la déshydratation du lait. Elle se déroule en quatre grandes étapes : la nébulisation ou la dispersion en un spray homogène du liquide, le contact du spray avec l'air chaud (150 °C), l'évaporation de l'eau des gouttelettes et la séparation du produit déshydraté (50-60 °C) et de l'air. Elle a l'inconvénient de faire perdre aux aliments leurs arômes qui sont entrainés avec la vapeur d'eau et aussi, par suite du chauffage, de dénaturer certains composants car lorsque les cellules sont séchées avec une teneur faible en eau, un certain nombre des composants cellulaires, comme l'ADN ou l'ARN, et des protéines sont affligées (Santivarangkna et al., 2008).
4Fluidisation. Cette technique s'applique aux produits solides sous forme de particules ou susceptibles de se désagréger par frottement. La fluidisation consiste à faire passer une phase fluide (très souvent un gaz) à travers un lit de particules, supportées par une grille, pour les mettre en suspension. Le terme fluidisation vient du fait que la suspension gaz/solide est amenée dans un état semblable à celui des fluides. La technique du séchage par lit fluidisé est la conjonction de deux idées : le séchage et la fluidisation. Si le courant est envoyé à une vitesse suffisante, elle provoque une désagrégation du solide ; par contre, si cette vitesse n'est pas trop forte, les grains, au lieu d'être entrainés, ont une agitation désordonnée comparable à l'agitation moléculaire (Rasul et al., 2000). C'est ce qu'on appelle un lit fluidisé. Le but de la fluidisation est notamment d'augmenter la surface de contact gaz-solide pour faciliter le séchage. Il existe trois grands types de lit fluidisé : lit fluidisé simple, l'air assure à la fois la fluidisation, l'apport de chaleur et l'évacuation des vapeurs désorbées ; lit fluidisé vibré, l'apport de chaleur est encore assuré par l'air, mais la fluidisation se fait cette fois par un procédé mécanique ; lit fluidisé à échangeur interne, l'air n'assure que la fluidisation et l'évacuation des vapeurs, l'apport de chaleur est effectué par un échangeur externe, placé à l'intérieur du lit.
5Lyophilisation. La technique consiste à ôter l'eau d'un produit liquide, pâteux ou solide, à l'aide de l'action combinée du froid et du vide. Le principe de base est que lorsqu'on réchauffe de l'eau à l'état solide à très basse pression, l'eau se sublime, c'est-à-dire qu'elle passe directement de l'état solide à l'état gazeux (De Beer et al., 2006). La vapeur d'eau (ou de tout autre solvant) quitte le produit et on la capture par congélation à l'aide d'un condensateur ou piège. Cette technique permet de conserver à la fois le volume et l'aspect du produit traité. Elle peut avoir lieu naturellement (séchage en montagne), ou, plus rapidement, dans un lyophilisateur (Chouvenc et al., 2004). La lyophilisation comporte généralement trois étapes : la congélation, la sublimation et la dessiccation secondaire.
2. Lyophilisation des bacteries lactiques
6La lyophilisation s'est développée pendant la seconde guerre mondiale pour le stockage du plasma sanguin (Pegg, 2002). Ainsi, pour des vaccins, comme pour un grand nombre de médicaments et de micro-organismes, la lyophilisation est la seule technique permettant une conservation à long terme des principes actifs à l'état sec (Tang et al., 2004). Dans le domaine des industries alimentaires, les ferments lactiques (probiotiques et starters) sont de plus en plus utilisés sous la forme lyophilisée.
2.1. Description et principes de la lyophilisation
7La première phase de l'opération consiste à congeler le produit, c'est-à-dire à amener l'eau qu'il contient à l'état solide ; ceci implique de lui soustraire de l'énergie. La seconde phase consiste à extraire l'eau du produit par volatilisation en lui fournissant de l'énergie thermique (Shalaev et al., 2002). Cette seconde opération se déroule dans une enceinte où règne une pression très largement inférieure à la pression atmosphérique (de l'ordre de 0,1 à 1 m Bar).
8Congélation. Au cours de la congélation, la solution liquide de départ est supposée homogène, une partie de l'eau se sépare des substances dissoutes pour cristalliser à l'état pur. Le reste de l'eau se solidifie ensuite peu à peu en mélange avec les solutés pour former une matière interstitielle (entre les cristaux de glace) qui adopte une structure amorphe (non cristalline ou vitreuse). En général, à partir d'une solution complexe, les substances dissoutes ne cristallisent pas (Shuck et al., 2004). Un paramètre important à prendre en compte pour l'étape de la congélation est la vitesse de congélation qui conditionne la dimension des cristaux de glace. En effet, plus les cristaux de glace formés sont grands, plus le diamètre des pores est important et par conséquent, plus la vitesse de dessiccation est élevée. Il est donc important, du point de vue technologique, de produire de petits cristaux de glace par une congélation rapide conduisant à l'obtention de petits cristaux intracellulaires non dommageables pour les cellules (De Angelis et al., 2004).
9Dessiccation. Elle se déroule en deux temps : d'abord la sublimation de l'eau cristallisée (séchage primaire, l'eau passe directement de l'état solide à l'état gazeux), puis la phase de désorption et d'évaporation de l'eau liée qui a adopté, lors de la congélation, une forme non cristalline ou vitreuse (séchage secondaire). Celle-ci résulte de la solidification sans réarrangement des molécules en raison de la très grande augmentation de la viscosité (Caillet et al., 2007). Ces états (cristallin et vitreux) peuvent coexister dans des proportions variables pour un même échantillon, la proportion d'eau à l'état vitreux étant d'autant plus grande que la vitesse de congélation et la viscosité sont grandes (Hausman et al., 2005). Les cavités laissées par les cristaux après la sublimation de l'eau confèrent la porosité nécessaire à l'évaporation de l'eau située dans l'espace interstitiel (Fonseca et al., 2001).
10L'eau présente dans la masse vitreuse doit d'abord subir une diffusion moléculaire au sein de la matière avant d'atteindre les cavités et les canaux qui la mèneront vers l'extérieur. On comprend dès lors que la manière selon laquelle la congélation est menée conditionne la qualité du séchage. Des cristaux de grande taille et jointifs donnent lieu à un réseau de cavités qui communiquent entre elles et qui conduisent bien l'eau vers l'extérieur. De plus, la réhydratation est aussi facilitée avec moins de risque d'obtenir des « flotteurs », c'est-à-dire des matières de charges en suspension. Un degré de cristallisation élevé (c'est-à-dire qu'une forte proportion de l'eau totale est sous forme cristalline) favorise l'établissement de jonctions entre les cristaux et réduit l'épaisseur des cloisons de matière vitreuse qui séparent les cristaux, comme l'indique la figure 1.
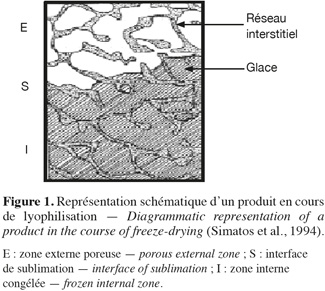
11Affaissement/collapse. De manière schématique, la structure congelée peut être considérée comme une substance poreuse initialement remplie de glace. Les parois de ce pore sont constituées de la phase cryo-concentrée (soluté et eau « liée »). Lorsque la glace est éliminée par sublimation, les parois du pore ne sont plus soutenues par la glace. Si la température du produit est suffisamment faible, la phase cryo-concentrée est maintenue dans un état solide amorphe et on observe une rétention de structure (les parois ne subissent pas d'écoulement visqueux et se maintiennent dans leur forme initiale). Au contraire, si la température remonte, le matériau constituant les parois du pore peut subir une transition vitreuse et l'écoulement visqueux qui en résulte entraine l'affaissement de la structure. Selon Shah et al. (1995), l'affaissement du produit est observable quand l'écoulement visqueux est induit par les forces de tension de surface qui tendent à minimiser la surface spécifique du produit.
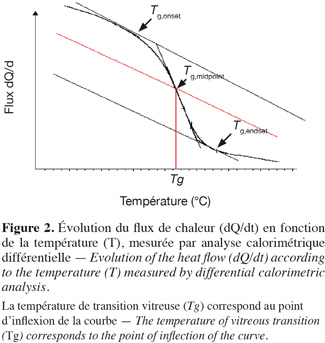
12Affaissement/température de transition vitreuse. Selon Matthieu (2002), la température de transition vitreuse, définie comme la température où a lieu la transition entre deux formes de l'état amorphe, les formes « vitreuse rigide » et « caoutchouteuse » (Figure 2), est un paramètre important pour la caractérisation d'un produit. En effet, les matériaux amorphes, comme les produits alimentaires, sont plus stables dans leur état vitreux largement au-dessus de la température de transition vitreuse (Tg). Cela est dû à la viscosité élevée et à la mobilité moléculaire beaucoup plus réduite dans l’état vitreux que dans l'état caoutchouteux (Fonseca et al., 2001). Par convention, la température de transition vitreuse (Tg) est le lieu où la valeur de la viscosité atteint 1012 Pa.s-1 (Matthieu, 2002). La viabilité et l'activité des bactéries diminuent généralement pendant les différentes étapes de la fabrication et le stockage. Composées principalement d'hydrates de carbones et de protéines, les bactéries congelées sont susceptibles de subir les phénomènes de transition vitreuse et de collapse. La mobilité moléculaire et les propriétés physico-chimiques des matériaux biologiques congelés sont fortement liées à l’activité d’eau et à la température. La technique d'analyse thermique [analyse calorimétrique différentielle (ACD)] consiste à maintenir une différence de température nulle entre la substance étudiée et une substance inerte de référence, lorsque les deux échantillons sont soumis à la même variation linéaire de température et au même environnement, et à mesurer l'énergie nécessaire fournie, soit à l'échantillon étudié soit à la référence (généralement par effet Joule). Ces diagrammes sont habituellement établis avec des mesures effectuées par analyse calorimétrique différentielle (ACD). Associés aux isothermes de sorption d'eau des produits secs, ils sont souvent employés pour expliquer la stabilité de ces produits pendant le stockage (Hausman et al., 2005). En revanche, le phénomène d’affaissement intervient dans la couche sèche, en cours de dessiccation. L’étude des propriétés physiques susmentionnées réalisée sur les bactéries lactiques est susceptible d’expliquer certains changements qui se produisent pendant leur traitement et leur stockage.
2.2. Facteurs agissants sur la conservation des cellules séchées
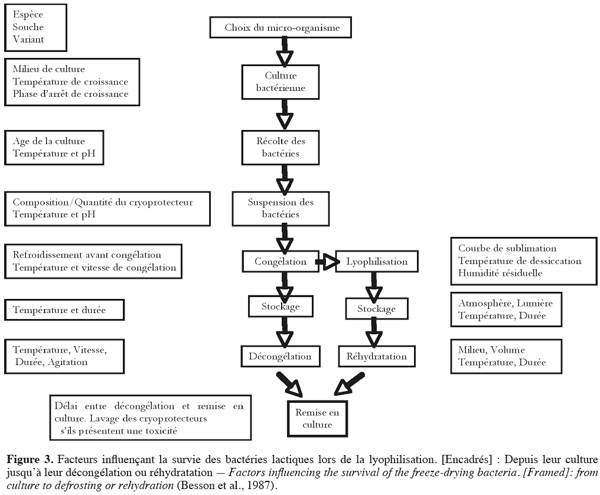
13La maitrise des procédés de congélation ou de lyophilisation ne doit pas se borner aux conditions de changements de l'état de l'eau ; le succès est intimement lié à l'état dans lequel se trouve le produit biologique au moment du traitement. Les nombreux facteurs qui influencent directement la survie des souches sont représentés sur la figure 3 : facteurs physiques de refroidissement, de congélation et de décongélation ou de dessiccation, mais aussi facteurs biologiques d'adaptabilité du micro-organisme au traitement (Roméo et al., 2001). Le nombre et la diversité de ces facteurs expliquent la difficulté d'obtenir des résultats reproductibles de la survie d'un micro-organisme, d'autant plus qu'il est malaisé de les étudier isolément. D'autres facteurs comme le rayonnement U.V. ou solaire et l'oxygène favorisent les réactions d'oxydation. Pour une conservation optimale, un conditionnement sous vide ou sous atmosphère inerte (azote pur) en flacon scellé ou bouché hermétiquement est recommandé (King et al., 1998). La perte de viabilité des cellules sèches est une conséquence des dommages causés aux cellules au niveau de différentes cibles, à savoir la paroi cellulaire, la membrane cellulaire et l'ADN (Teixeira et al., 1995). Le séchage est responsable de différentes formes de dommages cellulaires, principalement en raison des changements dans l'état physique des lipides membranaires et dans la structure des protéines sensibles qui conduisent souvent à une perte sévère de la viabilité bactérienne (Leslie et al., 1995). La dessiccation impose un stress sévère aux micro-organismes par l'élimination de l'eau et induit des changements de conformation des protéines et de la membrane cellulaire (Strasser et al., 2009).
14Pour préserver le produit lyophilisé et lui assurer une longue conservation, il est parfois souhaitable de rétablir la pression atmosphérique dans la chambre de stockage à l'aide d'un gaz inerte et sec (N2, Ar). Par ailleurs, plus la température de stockage est basse, meilleure est la conservation, comme l'ont démontré Gardiner et al. (2000) au niveau des starters lactiques. Les produits lyophilisés sont caractérisés par les propriétés importantes pour leur conservation, leur manipulation ou leur usage : humidité résiduelle, masse spécifique, couleur ou luminance (l'intensité lumineuse émise/réfléchie dans une direction donnée par unité de surface), leur friabilité et leur réhydratabilité (Abdel Gawad et al., 1989).
3. Utilisation des cryoprotecteurs
3.1. Cryoprotection des bactéries lactiques
15Il existe des substances protectrices qui permettent aux cellules de mieux supporter une congélation ou une décongélation lentes et un stockage à température supérieure à - 50 °C appelées cryoprotecteurs (Fonseca et al., 2001). Les cryoprotecteurs sont groupés en deux classes qui ne sont pas forcément exclusives (Tableau 1). On distingue ainsi les substances qui pénètrent dans les cellules (cryoprotecteurs intracellulaires, CPI) et celles qui demeurent à l'extérieur des cellules (cryoprotecteurs extracellulaires, CPE). Les bactéries contiennent naturellement des cryoprotecteurs : les sucres (sucrose et tréhalose), chez les bactéries gram+ (Bert et al., 1998) ; les polyols (glycérol, sorbitol et mannitol), que l'on retrouve chez les algues, les champignons, les levures, les plantes et certaines bactéries (Kets et al., 1996), les acides aminés et dérivés (bétaïne et carnitine), chez plusieurs groupes de bactéries (Csonka, 1989) et l'acide tetrahydroxypyrimidine carboxylique (hydroxyectoïne) chez les bactéries halophiles (Del Moral et al., 1994), le glutamate, la glutamine, la proline et l'alanine chez Escherichia coli, Staphylococcus aureus, Pseudomonas et d'autres micro-organismes et les acides aminés bêta chez les bactéries méthanogènes.

3.2. Mécanismes d'action des cryoprotecteurs
16Les mécanismes de la cryoprotection sont l'objet de nombreuses études de nos jours. Les modes d'action les plus probables sont : un accroissement du volume de la phase liquide interstitielle, à une température donnée, par dépression du point de congélation commençante et donc réduction des effets liés à un refroidissement lent ; une diminution de la taille des cristaux de glace par abaissement de la température de nucléation, une réduction de leur vitesse de croissance et une stabilisation de la configuration native des protéines (Leslie et al., 1995). Lorsque les premiers cristaux de glace apparaissent, les CPE se concentrent uniquement à l'extérieur des cellules, contrairement aux autres solutés qui se concentrent à l'intérieur et à l'extérieur des cellules. La perte d'eau des cellules conduit donc à une concentration en solutés. Celle-ci est plus faible en l'absence de CPE, ce qui minimise ainsi les effets de l'accroissement de concentration en liquide interstitiel (Fonseca et al., 2001). Au niveau des membranes cellulaires séchées, des sucres comme le tréhalose et le saccharose peuvent remplacer les molécules d'eau dans leur liaison avec les groupes polaires des phospholipides, empêchant ainsi les dommages durant la réhydratation (Leslie et al., 1995). Le tréhalose et le saccharose stabilisent la structure des protéines intracellulaires par ce phénomène de remplacement de l'eau (Carpenter et al., 1993). D'autres études ont montré que les cryoprotecteurs étaient indispensables lors de la congélation, quelles que soient les courbes de refroidissement. Tous les cryoprotecteurs ne pénètrent pas dans les cellules (Pegg et al., 1988). Les cryoprotecteurs diffusants vont se substituer à une partie de l'eau intracellulaire et permettre ainsi une déshydratation partielle des cellules, en plus de limiter la formation de cristaux de glace intracellulaire. Ils réduisent également la vitesse de croissance de ces cristaux, abaissent la température de solidification de l'eau intracellulaire, tel un « antigel » et modifient la forme des cristaux de glace (O'Byrne et al., 2002). Quant aux cryoprotecteurs pénétrants (non diffusants), ils protègent aussi au cours de la congélation et de la décongélation en réduisant la taille des cristaux de glace et en induisant des formes de cristaux moins traumatisantes. Ils permettent, via l'augmentation de la viscosité du milieu, la diminution de la rapidité des mouvements de l'eau et de chocs osmotiques importants. De plus, ils permettent, via l'augmentation de la pression osmotique, la réduction de la quantité de cryoprotecteurs pénétrants nécessaires à une bonne conservation (Mille et al., 2005).
4. Acides gras et oxydation cellulaire
4.1. Rôles des acides gras au niveau des bactéries et mécanismes d'oxydation des lipides
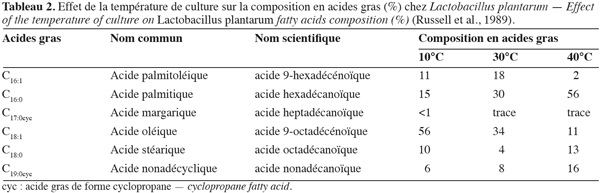
17Les lipides membranaires sont l'objet d'intenses modifications en vue de maintenir une fluidité et ainsi assurer la perméabilité des membranes cellulaires. Cette activité est indispensable pour le bon fonctionnement des cellules en cas de stress. L’élévation de la température d’incubation chez L. plantarum (Tableau 2) a un impact sur l’augmentation de la synthèse des acides gras insaturés (C18:1 principalement) d’une part et d’autre part, sur l’augmentation de la synthèse des C16:0, afin de réguler la fluidité membranaire (Russell et al., 1995). Dans les mêmes conditions, pour L. monocytogenes, on note une baisse de la synthèse des C15:0 et une augmentation de la synthèse des C17:0 ainsi que des C18:1 (Russell et al., 1995). Au cours du stockage, les phénomènes d’oxydation des lipides membranaires sont responsables des dégradations des cellules issues de la lyophilisation et de la baisse de viabilité. Ayant pour substrats les acides gras insaturés, le degré d’oxydation et la vitesse seront fonction des insaturations (Rousch et al., 2003). La différence fondamentale entre les acides gras saturés et les acides gras polyinsaturés existe au niveau de la température, tandis que les acides gras saturés s’oxydent à une température supérieure à 60 °C, les acides gras polyinsaturés s’oxydent même lors de l’entreposage des aliments à l’état congelé (Niki et al., 2005). Plusieurs mécanismes naturels de contrôle de l'oxydation se déroulent au niveau des cellules et ont pour but de prévenir la destruction oxydative des lipides membranaires, des protéines et des acides nucléiques (Pereira et al., 2003). Les mécanismes de régulation des systèmes pro-oxydants et antioxydants sont mis en place pour maintenir l'équilibre entre les facteurs impliqués dans les réactions d'oxydation. Mais cette régulation des facteurs pro- et antioxydants est perturbée durant les processus de transformation et de stockage des produits, ce qui favorise le développement des réactions d'oxydation (Niki et al., 2000). Selon les travaux effectués par Steinberg et al. (1989), les facteurs qui influencent ou qui initient l'oxydation des lipides sont de deux types :
18– des facteurs intrinsèques tels que la composition en acides gras des lipides (nombre et position des insaturations), la présence de pro-oxydants (ions métalliques, enzymes, etc.) ou d'antioxydants naturels (tocophérols, caroténoïdes, etc.)
19– des facteurs externes tels que la température, la lumière, la pression partielle en oxygène, l'activité de l'eau, les conditions de stockage et de transformation (Steinberg et al., 1989).
20La classification de l'oxydation est fonction des agents initiateurs, ainsi on distingue trois types d'oxydation des lipides :
21– l'auto-oxydation catalysée par la température, les ions métalliques et les radicaux libres,
22– la photo-oxydation, initiée par la lumière en présence de photosensibilisateurs,
23– l'oxydation enzymatique initiée par la présence des enzymes d'oxydation.
4.2. Auto-oxydation
24Dans la nature, il existe un certain nombre d'auto-oxydations, dont celle du dioxygène (O2) qui donne naissance à l'ozone (O3). Dans l'organisme, l'auto-oxydation, ou oxydation spontanée de certains composants, forme essentiellement des peroxydes, dégradés ensuite par des enzymes spécifiques : les peroxydases. Pour ce qui est des lipides, l'oxydation est une réaction auto-catalytique. Il s'agit d'un enchainement de réactions radicalaires se déroulant en trois étapes. Une première réaction produit un radical libre par élimination d'un hydrogène de l'acide gras (Phase d'initiation). La réaction s'auto-entretient, puis les réactions s'enchainent pour produire plusieurs radicaux libres (Phase de propagation), les lipides insaturés disparaissent progressivement et la concentration en hydroperoxydes croît pour atteindre son maximum au milieu de la phase de propagation (Pereira et al., 2003). Les réactions d'auto-oxydations conduisent à la formation de radicaux libres puis d'hydroperoxydes, composés intermédiaires, qui à leur tour se décomposent en donnant naissance à des composés volatils, composés furaniques et surtout aldéhydes saturés et insaturés. Les hydroperoxydes, les premiers produits de l'oxydation des lipides, sont instables (Noguchi et al., 2002). Cette instabilité engendre une série de réactions complexes qui aboutissent à une myriade de composés ayant des poids moléculaires variables.
4.3. Photo-oxydation
25Comme évoqué pour l'auto-oxydation, la photo-oxydation qui est une oxydation induite en grande partie par la présence de la lumière et de photosensibilisateurs tels que les hémoprotéines, la chlorophylle ou la riboflavine, est aussi une voie importante de production d'hydroperoxydes en présence d'oxygène. Pour ce qui est du mécanisme, les photosensibilisateurs (Sens) absorberaient l'énergie lumineuse afin d'atteindre un état de triplet excité (Sens3). Ces photosensibilisateurs interviennent dans l'oxydation des lipides selon deux types de mécanismes (Noguchi et al., 2002).
26Le premier type de mécanisme est induit par des photosensibilisateurs (type I), tels que la riboflavine, qui agissent comme des radicaux libres initiateurs. Dans leur état triplet, elles arrachent un atome d'hydrogène ou un électron aux molécules lipidiques pour former un radical capable de réagir avec l'oxygène :
27Sens3 + RH —› Sens H + R° (1)
28Selon le second mécanisme, les molécules photosensibles de type II, telles que la chlorophylle et l'érythrosine, réagissent dans leur état excité (Sens3) avec l'oxygène triplet auquel elles transfèrent leur énergie pour donner de l'oxygène singulet (1O2) :
29Sens3 + 3O2 —› 1O2 + Sens (2)
30L'oxygène singulet ainsi formé est très électrophile et peut réagir directement sur un acide gras insaturé (RH) formant ainsi un hydroperoxyde (ROOH) :
311O2 + RH —› ROOH (3)
32Les réactions radicalaires interviennent en chaine par la suite de cette auto-oxydation. Selon les travaux effectués par Laine et al. (2006), les hydroperoxydes ainsi formés sont différents de ceux formés par auto-oxydation.
4.4. Oxydation enzymatique
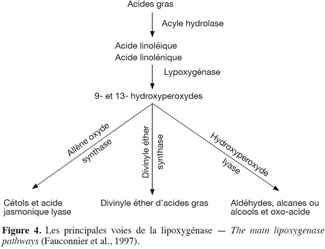
33Après l'auto-oxydation et la photo-oxydation, un troisième type d'oxydation a lieu au niveau des lipides issus généralement des plantes. Cette oxydation est initiée par des enzymes, d'où le phénomène d'oxydation des acides gras insaturés d'origine enzymatique. Les deux enzymes principalement impliquées sont la lipoxygénase et la cyclooxygénase. La lipoxygénase catalyse l'insertion d'une molécule d'oxygène sur un acide gras insaturé selon une réaction stéréospécifique et aboutit à la formation d'hydroperoxydes (Pereira et al., 2003). Elle agit spécifiquement sur les acides gras non estérifiés. Son activité est donc souvent couplée avec celle des lipases et des phospholipases comme l’indique la figure 4 (Fauconnier et al., 1997). La cyclooxygénase est une lipoxygénase qui incorpore deux molécules d'oxygène au niveau d'un acide gras insaturé pour former des hydroperoxydes spécifiques. L'oxydation enzymatique se produit même à basse température. Durant le stockage, à l'état congelé, l'activité enzymatique est ralentie. À - 40 °C, l'oxydation enzymatique des lipides est complètement arrêtée. Cependant, dès la décongélation amorcée et des températures de 0 °C à 4 °C atteintes, cette activité reprend et s'accentue.
5. Principaux facteurs de l'oxydation des lipides et ses impacts sur la viabilité cellulaire
34Plusieurs facteurs sont impliqués dans l'oxydation des lipides au cours des procédés de transformation et de conservation des aliments. Parmi celles-ci, citons la température, le pH, l'activité de l'eau (aw) et la pression partielle en oxygène (PO2) (Chatterjee et al., 2000). Une élévation de la température favorise l'oxydation des lipides. Cette oxydation est d'autant plus rapide que la température est importante. Ainsi, les opérations de cuisson, par exemple, sont bien connues pour avoir un effet pro-oxydant marqué (Howlett et al., 1997). Quant à la congélation, par contre, elle se révèle comme un bon moyen pour augmenter la durée de conservation des aliments, car la vitesse d'oxydation des lipides est notablement réduite à faible température. L'influence du pH dans le déroulement de l'oxydation se manifeste par le biais de plusieurs mécanismes. Premièrement, pour les réactions d'oxydo-réduction faisant intervenir des protons (H+), le potentiel redox décroît linéairement avec le pH. Un pH acide favorise donc la réaction d'oxydation, en particulier quand les espèces pro-oxydantes (ions des métaux de transition) ou antioxydantes (acide ascorbique, BHT et BHA) solubles en phase aqueuse sont présentes. L'activité de l'eau d'un système influence les réactions d'oxydation des lipides. En effet, l'eau permet la mobilisation des substances pro-oxydantes ou antioxydantes (Chen et al., 2006). En général, une activité d'eau (aw) comprise entre 0,2 et 0,3 correspond aux vitesses d'oxydation les plus faibles. Ces valeurs correspondent à la formation d'une couche monomoléculaire d'eau autour des constituants. Par contre, une aw comprise entre 0,6 et 0,8 correspond aux vitesses d'oxydation les plus grandes. L’oxydation des lipides genère des hydroperoxydes.
35Les dommages causés aux LAB pendant le stockage sont également attribués aux modifications dans le profil des acides gras (taux d'acides gras saturés et d'acides gras insaturés) de la membrane, pour laquelle l'oxydation des lipides est une cause importante (Castro et al., 1995 ; Castro et al., 1996 ; Teixeira et al., 1996 ; Andersen et al., 1999). L'oxydation des lipides peut donner lieu à des changements physiques dans les fonctions et les structure membranaires (In 't Veld et al., 1992 ; Borst et al., 2000). La perte rapide de la viabilité tend à se produire au début de la période de conservation (Korobkina et al., 1982 ; Brennan et al., 1983 ; King et al., 1993), tandis que les changements dans la composition lipidique de la membrane cellulaire augmentent au cours du stockage (Teixeira et al., 1996). En outre, il est établi aujourd'hui que la conséquence des nombreuses oxydations biologiques est la formation de radicaux libres, qui sont l'une des principales causes de la mort cellulaire (Van de Guchte et al., 2002). L'attaque des acides gras par les radicaux libres diminue l'hydrophobicité en raison de l'introduction de groupes hydrophiles et affaiblit, par conséquent, l'interaction hydrophobe des protéines membranaires (Santivarangkna et al., 2008). Par exemple, une diminution de l'activité de l'ATPase membranaire a été suggérée comme conséquence du changement de cette interaction (Castro et al., 1996). Les changements affectent aussi, dans la membrane, certains mécanismes de contrôle liés à la régulation et à la réplication de l'ADN, car l'initiation de la synthèse d'ADN et son maintien requièrent l'attachement du complexe d'ADN à la membrane cytoplasmique (Israeli et al., 1975). En outre, les radicaux libres peuvent aussi bien directement provoquer des dommages de l'ADN (Inouye, 1984 ; Akasaka, 1986 ; Hruszkewycz, 1988). Bien qu'il soit plausible d'ajouter un antioxydant pour diminuer l'oxydation des lipides, l'addition doit être exercée avec soin. Ces méthodes et composés serviront dans la suite à définir les différentes approches afin d'inhiber l'oxydation cellulaire.
6. Différentes approches pour inhiber l'oxydation des starters lactiques lyophilisés au cours du stockage
36Le contrôle ou l'inhibition de l'oxydation des lipides est basée sur la maitrise des paramètres : température, pH, aw et concentration en oxygène (Coulibaly et al., 2009). Selon Buettner (1999), les antioxydants susceptibles de protéger les lipides de l'oxydation peuvent être répartis en deux types : les antioxydants préventifs qui empêchent la formation d'espèces réactives de l'oxygène ou interceptent les espèces responsables de l'initiation de la lipoperoxydation et les antioxydants « chain breaking » qui interceptent les radicaux propagateurs de la peroxydation lipidique et retardent la peroxydation (période d'induction).
6.1. Mécanismes d'action des antioxydants préventifs
37Les chélateurs des métaux de transition. Le cycle redox de certains métaux, responsable dans la production des radicaux libres, est bloqué par des chélateurs de métaux. Ce sont des protéines telles que la transferrine, la ferritine, la lactalbumine qui séquestrent le fer, la céruloplasmine et l'albumine qui sequestrent le cuivre (Muggli, 1993). Notons au passage que les flavonoïdes sont de bons chélateurs du fer, ce qui est un des mécanismes de leur activité antioxydante (Van Acker et al., 1998 ; Morel et al., 1993).
38Les désactivateurs (quencher) de l'oxygène singulet. Selon Buettner, ils peuvent agir par désactivation chimique en se fixant sur une molécule telle qu'un acide gras pour donner un hydroperoxyde : 1O2 + LOH LOOH, ou encore par désactivation physique éliminant l'énergie d'excitation sans changement chimique : 1O2 + β-carotène O2 + β-carotène. Les caroténoïdes sont particulièrement efficaces. Le lycopène est le plus réactif.
39Élimination des hydroperoxydes. Les hydroperoxydes sont générateurs de radicaux libres, leur élimination prévient l'oxydation des biomolécules. Les hydroperoxydes (LOOH) peuvent être réduits par des enzymes. La glutathion peroxydase (GPx) élimine les hydroperoxydes organiques et le peroxyde d'hydrogène (H2O2).
40Les piégeurs d'oxygène. Ce sont des molécules telles que les sulfites ou l'acide ascorbique.
6.2. Mécanismes d'action des antioxydants de type « chaine rompue » (« chain breaking »)
41Cette catégorie d'antioxydants va réagir le plus souvent avec les radicaux peroxyles (LOO°) ou alcoxyles (LO°) interrompant ainsi la réaction de propagation de la peroxydation. Cette catégorie d’antioxydants va réagir le plus souvent avec les radicaux peroxyles ou alcoxyles, interrompant ainsi la réaction de propagation de la peroxydation. Il est à noter que ces antioxydants n’inhiberont pas par conséquent l’autoxydation des lipides par l’oxygène singulet. Ces antioxydants peuvent agir selon deux mécanismes.
42Les donneurs d'hydrogène. Ces antioxydants sont principalement des composés phénoliques mono- ou polyhydroxylés (tocophérols, tocotriènols, BHT, BHA, flavonoïdes, etc.). Ils sont susceptibles de céder un hydrogène au radical alcoxyle et au radical peroxyle. Après la réaction d'oxydation, l'antioxydant est transformé en un radical qui doit être suffisamment stable pour inhiber la formation d'un autre radical et arrêter ainsi la propagation de la chaine radicalaire. Il doit ensuite évoluer vers un produit d'oxydation stable, ce qui conduit à la consommation de l'antioxydant. Le tocophérol donnera un radical tocophéroxyle qui évoluera vers un composé d'oxydation non radicalaire tel que la tocophérylquinone ou un composé de dimérisation ou de polymérisation supérieure.
43Les antioxydants « sacrifiés ». Le qualificatif de « chain breaking antioxidant sacrificial » employé par Buettner concerne des molécules, elles-mêmes radicalaires, qui réagissent avec les radicaux peroxyles ou alcoxyles pour donner des produits non radicalaires, interrompant ainsi la propagation de la peroxydation. Deux radicaux sont connus pour se combiner avec les radicaux peroxyles, le monoxyde d'azote (NO) et l'anion superoxyde (O2-) :
44LOO + NO→LOONO et LO + NO→LONO
45Mécanismes d'action mixtes des antioxydants. Certains antioxydants ont des modes d'action mixtes. Deux exemples peuvent illustrer ces mécanismes multiples. L'exemple de l'acide ascorbique, qui est un désactivateur de l'oxygène singulet, élimine l'oxygène moléculaire ; il est aussi un donneur d'hydrogène aux radicaux lipidiques et aux radicaux tocophéroxyles pour régénérer le tocophérol. Quant aux flavonoïdes tels que les anthocyanines, les catéchines, les flavones, les flavonols, les isoflavones et les proanthocyanidines, ce sont des chélateurs de métaux, piégeurs d'anions superoxyde et donneurs d'hydrogène. L'utilisation des antioxydants (tocophérols, polyphénols, flavonoïdes, vitamine E, vitamine C, etc.) est souvent la méthode la plus courante en industrie agro-alimentaire pour inhiber l'oxydation des lipides. Les antioxydants utilisés sont soit des agents de prévention qui bloquent la phase d'initiation en réagissant avec les initiateurs de la réaction (O2, lumière, métaux, etc.), soit des agents de terminaison qui bloquent la poursuite de la phase de propagation en réagissant avec les radicaux libres et en les transformant en composés stables (Niki et al., 2000).
7. Conclusion
46Il est donc possible de conserver par lyophilisation un grand nombre de bactéries lactiques, à l'échelle du laboratoire, mais aussi industrielle. Les conditions opératoires qui permettent d'obtenir une bonne conservation de l'activité métabolique des bactéries sont relativement bien connues, à l'inverse des mécanismes de leur altération. La résolution des difficultés, telles que la mauvaise conservation de certaines souches à l'état lyophilisé et la reprise d'activité souvent trop lente des ferments destinés aux ensemencements directs, passe certainement par une meilleure compréhension de ces mécanismes. Pour optimiser la conservation, plusieurs techniques et voies de recherches doivent être menées de concert. Parmi les plus prometteuses, on peut citer l'étude des modifications subies par les structures membranaires au cours des traitements de conservation, la recherche de formulation incorporant des cryoprotecteurs plus efficaces, l'induction des mécanismes de résistance à ces traitements (par adaptation des bactéries, par leur culture, dans des conditions appropriées ou éventuellement par utilisation d'antioxydant afin de bloquer le phénomène de peroxydation).
47Remerciements
48Nous remercions très sincèrement le personnel du CWBI (Centre Wallon de Biologie Industrielle) pour son assistance et son dévouement ainsi que Maryse Hardenne, Vincent Hotte et Dany Trisman de l'Unité de Chimie organique de Gembloux Agro-Bio Tech. Je remercie également la République de Côte d'Ivoire pour son soutien financier.
Bibliographie
Abdel Gawad A.M., Nassar A.M. & Hilali M., 1989. Isolation of Toxoplasma gondii, Isospora felis and Isospora rioolfa from the meat of some farm animals. J. Egypt. Vet. Med. Assoc., 49, 405-414.
Akasaka S., 1986. Inactivation of transforming activity of plasmid DNA by lipid peroxidation. Biochim. Biophys. Acta, 867, 201-208.
Aller R.C., 1998. Mobile deltaic and continental shelf muds as suboxic, fluidized bed reactors. Mar. Chem., 61, 143-155.
Anchordoguy T., Rudolph A.S., Carpenter J.F. & Crowe J, 1987. Mode of interaction of cryoprotectants with membrane phospholipids during freezing. Cryobiology, 24, 324-331.
Andersen A.B., Fog-Peterson M.S. & Skibsted L.H., 1999. Storage stability of freeze-dried starter cultures (Streptococcus thermophilus) as related to physical state of freezing matrix. Food Sci. Technol., 32, 540-547.
Bayrock D. & Ingledew W.M., 1997. Fluidized bed drying of baker's yeast: moisture levels, drying rates and viability changes during drying. Food Res. Int., 30, 407-415.
Bert P. & Glaasker E., 1998. Regulation of compatible solute accumulation in bacteria. Mol. Microbiol., 29, 397-407.
Besson P. & Cutayar S., 1987. Stabilité et conservation des micro-organismes. Paris : Société Française de Microbiologie, Section Microbiologie industrielle.
Borst J.W., Visser N.V., Kouptsova O. &Visser A.J., 2000. Oxidation of unsaturated phospholipids in membrane bilayer mixtures is accompanied by membrane fluidity changes. Biochim. Biophys. Acta, 1487, 61-73.
Brennan M., Wanismail B. & Bibek R., 1983. Prevalence of viable Lactobacillus acidophilus in dried commercial products. J. Food Prot., 46, 887-892.
Buettner G., 1999. Singlet oxygen toxicity is cell line-dependant: a study of lipid peroxidation in nine leukemia cell lines. Photochem. Photobiol., 70, 858-867.
Caillet A. et al., 2007. Crystallization of monohydrate citric acid. Part 1: in situ monitoring through the joint use of raman spectroscopy and image analysis. Cryst. Growth Des., 7, 2080-2087.
Carpenter J.F., Prestrelski S.J. & Arakawa T., 1993. Separation of freezing- and drying-induced denaturation of lyophilized proteins using stress-specific stabilization. I. Enzyme activity and calorimetric studies. Arch. Biochem. Biophys., 303, 456-464.
Castro H.P., Teixeira P. & Kirby R., 1995. Storage of lyophilized cultures of Lactobacillus bulgaricus under different relative humidities and atmospheres. Appl. Microbiol. Biotechnol., 44, 172-176.
Castro H.P., Teixeira P.M. & Kirby R., 1996. Changes in the cell membrane of Lactobacillus bulgaricus during storage following freeze-drying. Biotechnol. Lett., 18, 99-104.
Chatterjee M.T., Seunath A., Khalawan S.A. & Curran B.P.G., 2000. Cellular lipid composition influences stress activation of the yeast general stress response elements (STRE). Microbiology, 146, 877-884.
Chen Z.-H. et al., 2006. Adaptive response induced by lipid peroxidation products in cell cultures. FEBS Lett., 580, 479-483.
Chouvenc P., Vessot S., Andrieu J. & Vacus P., 2004. Optimization of the freeze-drying cycle: a new model for pressure rise analysis. Drying Technol., 22, 1577-1601.
Coulibaly I. et al., 2009. Survival of freeze-dried Leuconostoc mesenteroides and Lactobacillus plantarum related to their cellular fatty acids composition during storage. Appl. Biochem. Biotechnol., 157, 70-84.
Crowe J.H., Crowe L.M. & Mouradian R., 1983. Stabilization of biological membranes at low water activities. Cryobiology, 20, 346-356.
Csonka L.N., 1989. Physiological and genetic responses of bacteria to osmotic stress. Microbiol. Rev., 53, 121-147.
De Angelis M. & Gobbetti M., 2004. Environmental stress responses in Lactobacillus: a review. Proteomics, 4, 106-122.
De Beer M.D., Glud A., Epping E. & Kûhl M., 2006. In situ fluxes and zonation of microbial activity in surface sediments of the håkon mosby mud volcano. Limnol. Oceanogr., 51, 1315-1331.
Del Moral A. et al., 1994. Compatible solutes in new moderately halophilic isolates. FEMS Microbiol. Lett., 12, 165-172.
Fauconnier M.L., Perez A.G., Sanz C. & Marlier M., 1997. Purification and characterization of tomato leaf (Lycopersicon esculentum Mill.) hydroperoxide lyase. J. Agric. Food Chem., 45, 4232-4236.
Fonseca F. & Corrieu G., 2001. Cryoprotection and freezing influence on acidification activity of thermophilic lactic acid bacteria. Relationships between biologic and thermodynamic properties. Thèse de doctorat : Institut national agronomique Paris-Grignon (France).
Gardiner G.E. et al., 2000. Comparative survival rates of human-derived probiotic Lactobacillus paracasei and L. salivarius strains during heat treatment and spray drying. Appl. Environ. Microbiol., 66, 2605-2612.
Hausman D.S., Cambron R.T. & Sakr A., 2005. Application of on-line Raman spectroscopy for characterizing relationships between drug hydration state and tablet physical stability. Int. J. Pharm., 299, 19-33.
Howlett N. & Avery S.V., 1997. Induction of lipid peroxidation during heavy metal stress in Saccharomyces cerevisiae and influence of plasma membrane fatty acid unsaturation. Appl. Environ. Microbiol., 63, 2971-2976.
Hruszkewycz A.M., 1988. Evidence for mitochondrial DNA damage by lipid peroxidation. Biochem. Biophys. Res. Commun., 153, 191-197.
In ‘t Veld G., Driessen A.J.M. & Konings W.N., 1992. Effect of the unsaturation of phospholipid acyl chains on leucine transport of Lactococcus lactis and membrane permeability. Biochim. Biophys. Acta, 1108, 31-39.
Inouye S., 1984. Site-specific cleavage of double-strand DNA by hydroperoxide of linoleic acid. FEBS Lett., 172, 231-234.
Israeli E., Giberman E. & Kohn A., 1975. Membrane malfunctions in freeze-dried Escherichia coli. Cryobiology, 11, 473-477.
Kets E.P.W. et al., 1996. Mannitol: a novel bacterial compatible solute in Pseudomonas putida S12. J. Bacteriol., 178, 6665-6670.
King V.A.-E., Lin H.-J. & Liu C.-F., 1993. Studies on the control of the growth of Saccharomyces cerevisiae by using response surface methodology to achieve effective preservation at high water activities. Int. J. Food. Sci. Technol., 28, 519-529.
King V.A.-E., Lin H.-J. & Liu C.-F., 1998. Accelerated storage testing of freeze-dried and controlled low-temperature vacuum dehydrated Lactobacillus acidophilus. J. Gen. Appl. Microbiol., 44, 161-165.
Korobkina G.S. et al., 1982. Development of dried L. acidophilus milk formulae for infant feeding. Dairy Sci. Abst., 44, 396.
Laine G. et al., 2006. Study of precursors responsible for off-flavor formation during storage of potato flakes. J. Agric. Food Chem., 54, 5445-5452.
Leslie S.B., Lighthart I.B., Crowe J.H. & Crowe L.M., 1995. Trehalose and sucrose protect both membranes and proteins in intact bacteria during drying. Appl. Environ. Microbiol., 61, 3592-3597.
Matthieu M., 2002. Rigidity transitions and constraint counting in amorphous networks: beyond the mean-field approach. Europhys. Lett., 58, 830-836.
Mille Y., Beney L. & Gervais P., 2005. Compared tolerance to osmotic stress in various microorganisms: towards a survival prediction test. Biotechnol. Bioeng., 92, 479-484.
Morel I., Lescoat G. & Cogrel P., 1993. Antioxidant and iron-chelating activities of the flavonoids catechin, quercetin and diosmetinon iron-loaded rat hepatocytes cultures. Biochem. Pharmacol., 45, 13-19.
Muggli R., 1993. Free radical tissue damage: the protective role of antioxidant nutrients. In: Conrongiu F., Banni S. & Dessi M.A., eds. Free radicals and antioxidants in nutrition. London: Richelieu Press, 189-204.
Niki E. et al., 2000. Free radicals in the 1900’s: from in vitro to in vivo. Free Radical Res., 33, 693-704.
Niki E. et al., 2005. Lipid peroxidation: mechanisms, inhibition, and biological effects. Biochim. Biophys. Res. Commun., 338, 668-676.
Noguchi N. et al., 2002. The specificity of lipoxygenase-catalyzed lipid peroxidation and the effects of radical-scavenging antioxidants. Biol. Chem., 383, 619-626.
O'Byrne C.P. & Booth I.R., 2002. Osmoregulation and its importance to food-borne microorganisms. Int. J. Food Microbiol., 74, 203-216.
Pegg D.E., 2002. The history and principles of cryopreservation. Semin. Reprod. Med., 20, 5-13.
Pegg D.E. & Diaper M.P., 1988. On the mechanism of injury to slowly frozen erythrocytes. Biophys. J., 54, 471-488.
Pereira E.D.J., Panek A.D. & Eleutherio E.C.A., 2003. Protection against oxidation during dehydratation of yeast. Cell Stress Chaperone, 8, 120-124.
Rasul M.G., Rudolph V. & Wang F.Y., 2000. Particles separation using fluidization techniques. Int. J. Mineral Process., 60, 163-179.
Roméo H.E. et al., 2001. The glossopharyngeal nerve as a new pathway in immune-to-brain interactions: relevance to neuroimmune surveillance of the oral cavity. J. Neuroimmunology, 115, 91-100.
Rousch J.M., Scott E.B. & Milton R.S., 2003. Changes in fatty acid profiles of thermo-tolerant marine diatoms during temperature stress. J. Exp. Mar. Biol. Ecol., 295, 145-156.
Russell N.J., 1989. Functions of lipids: structural roles and membranes functions. In: Ratledge C. & Wilkinson S.C., eds. Microbial lipids. Vol. 2. London: Academic Press, 279-365.
Russell N.J. et al., 1995. Membrane as a target for stress adaptation. Int. J. Food Microbiol., 28, 255-261.
Santivarangkna C., Kulozik U. & Foerst P., 2008. Inactivation mechanisms of lactic acid starter cultures preserved by drying processes. J. Appl. Microbiol., 105, 1-13.
Schuck P. et al., 2004. Séchage des lactosérums et dérivés : rôle du lactose et de la dynamique de l'eau. Lait, 84, 243-268.
Shah N.P., Lankaputhra W.E.V., Britz M.L. & Kyle W.A.K., 1995. Survival of Lactobacillus acidophilus and Bifidobacterium bifidum in commercial yoghurt during refrigerated storage. Int. Dairy J., 5, 515-521.
Shalev U., Grimm J.W. & Shaham Y., 2002. Neurobiology of relapse to heroin and cocaine seeking: a review. Pharmacol. Rev., 54, 1-42.
Simatos D., Blond G., Le Meste M. & Morice M., 1994. Conservation des bactéries lactiques par congélation et lyophilisation. In : de Roissart H. & Luquet F.M., eds. Bactéries lactiques, aspects fondamentaux et technologiques. Vol. 1. Uriage, France : Édition Lorica, 555-573.
Steinberg D., Parthasarathy S., Carew T.E. & Witztum J.L., 1989. Beyond cholesterol. Modifications of low-density lipoprotein that increase its atherogenicity. N. Engl. J. Med., 320, 915-924.
Strasser S. et al., 2009. Influence of lyophilization, fluidized bed drying, addition of protectants, and storage on the viability of lactic acid bacteria. J. Appl. Microbiol., 107, 167-177.
Tang X.D., Garcia M.L., Heinemann S.H. & Hoshi T., 2004. Reactive oxygen species impair Slo1 BK channel function by altering cysteine-mediated calcium sensing. Nat. Struct. Mol. Biol., 11, 171-178.
Teixeira P.C., Castro M.H., Malcata F.X. & Kirby R.M., 1995. Survival of Lactobacillus delbruckii ssp. bulgaricus following spray drying. J. Dairy. Sci., 78, 1025-1031.
Teixeira P.C., Castro M.H. & Kirby R.M., 1996. Evidence of membrane lipid oxidation of spray-dried Lactobacillus bulgaricus during storage. Lett. Appl. Microbiol., 22, 34-38.
Thonart Ph., 2004. Les applications des bactéries lactiques. In : Séminaire sur la sélection, la production et le conditionnement des ferments lactiques, Compte-rendu des allocutions et des conférences, École Supérieure des Industries Alimentaires de Tunis et Centre wallon de Biologie Industrielle-Liège, 8-31.
Van Acker S., Bast A. & Van Der Vijgh W., 1998. Stuctural aspects of antioxidant activity of flavonoids. In: Rice-Evans C. & Packer L., eds. Flavonoids in health and disease. New York, USA: Marcel Decker, 221-251.
Van de Guchte M. et al., 2002. Stress responses in lactic acid bacteria. Antonie van Leeuwenhoek, 82, 187-216.
Zhao G. & Zhang G., 2005. Effect of protective agents, freezing temperature, rehydration media on viability of malolactic bacteria subjected to freeze-drying. J. Appl. Microbiol., 99, 333-338.
To cite this article
About: Ibourahema Coulibaly
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle. Unité de Bio-industrie. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : coul_lam@yahoo.fr
About: Robin Dubois-Dauphin
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle. Unité de Bio-industrie. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: Sabine Danthine
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Technologie agro-alimentaire. Passages des Déportés, 2. B-5030 Gembloux (Belgique).
About: Lamia Majad
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle. Unité de Bio-industrie. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: Thami Mejoub
Univ. Liège. Centre Wallon de Biologie Industrielle. Unité de Technologie microbienne. Sart-Tilman. B40. B-4000 Liège (Belgique).
About: Jacqueline Destain
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle. Unité de Bio-industrie. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: François Béra
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Technologie agro-alimentaire. Passages des Déportés, 2. B-5030 Gembloux (Belgique).
About: Jean-Paul Wathelet
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Chimie organique. Passages des Déportés, 2. B-5030 Gembloux (Belgique).
About: Philippe Thonart
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle. Unité de Bio-industrie. Passage des Déportés, 2. B-5030 Gembloux (Belgique) – Univ. Liège. Centre Wallon de Biologie Industrielle. Unité de Technologie microbienne. Sart-Tilman. B40. B-4000 Liège (Belgique).






