- Portada
- Volume 20 (2016)
- Numéro 1
- Utilisation de la fluorescence chlorophyllienne pour l’évaluation du statut azoté des cultures (synthèse bibliographique)
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Utilisation de la fluorescence chlorophyllienne pour l’évaluation du statut azoté des cultures (synthèse bibliographique)

Notes de la rédaction
Reçu le 23 avril 2015, accepté le 6 octobre 2015
Résumé
Introduction. La gestion optimale de la fertilisation azotée des cultures nécessite l’utilisation de méthodes qui permettent d’évaluer rapidement et avec précision le statut azoté de la biomasse aérienne en cours de saison. C’est le cas des mesures optiques sur le végétal et parmi celles-ci, les approches basées sur la mesure de la fluorescence chlorophyllienne (ChlF) des feuilles occupent une place intéressante. Les potentialités de la ChlF sont étudiées depuis plusieurs années pour détecter et quantifier différents stress biotiques et abiotiques des plantes et la ChlF peut s’envisager pour l’évaluation du statut azoté. Ces approches permettent a priori de pallier certaines limitations des méthodes souvent utilisées pour l’évaluation du statut azoté basées sur la transmission ou la réflexion de la lumière et reliées à la teneur en chlorophylle des feuilles.
Littérature. Dans cette revue, deux approches basées sur la ChlF sont examinées. La première étudie la ChlF variable, ou cinétique de Kautsky, qui représente l’approche classiquement abordée par la majorité des auteurs. La seconde approche repose sur l’estimation par la ChlF de la concentration en composés foliaires métabolites de la plante, plus spécifiquement la chlorophylle et les composés phénoliques (en particulier les flavonoïdes). Pour chaque approche, les caractéristiques de la ChlF sont examinées, expliquant leurs liens et leurs applications dans l’évaluation du statut azoté des cultures.
Conclusions. Parmi les deux approches analysées, l’utilisation du rapport de ChlF qui combine l’estimation de la concentration en chlorophylle et en flavonoïdes au niveau de la feuille apparait comme une approche potentiellement pertinente pour évaluer le statut azoté des cultures, ces deux concentrations étant en relation étroite avec la teneur en azote des feuilles.
Abstract
Use of chlorophyll fluorescence for the evaluation of crops nitrogen status. A review
Introduction. Optimizing the nitrogen (N) fertilization of crops requires the use of methods that quickly and accurately assess the N status of aboveground biomass during the growing season. Optical measurements on plants allow the achievement of this goal and, among these approaches, the leaf chlorophyll fluorescence based method (ChlF) appears promising. The potential of ChlF has been studied for many years. The value of this method for detecting and quantifying various biotic and abiotic plant stresses has been assessed as well as its potential for the evaluation of crop N status (CNS). For this last application, ChlF could offer solutions to the limitations of the usual methods for evaluating CNS, which are based on light transmittance or reflectance and are related to leaf chlorophyll content.
Literature. In this report, two ChlF based approaches are reviewed. The first approach is variable ChlF, or Kautsky kinetics, which represents the approach taken in the majority of the published work examined in the field of ChlF. The second approach is based on ChlF sensing methods for the estimation of the concentration of leaf metabolite compounds in plants, particularly that of leaf chlorophyll and phenolic compounds (mainly flavonoids). The characteristics and the applications of these two fluorescence approaches are studied for their potential use for the in-season monitoring of CNS.
Conclusions. Of these two approaches, the use of the ratio of fluorescence combining the estimation of concentrations of leaf chlorophyll and flavonoid content appears to be a relevant potential method to assess CNS, as both concentrations are in close relationship with leaf N concentration.
Tabla de contenidos
1. Introduction
1La gestion optimale de la fertilisation azotée des cultures nécessite l’utilisation de méthodes optiques qui permettent d’évaluer rapidement et avec précision le statut azoté de la biomasse aérienne en cours de saison. Une carence en azote induit des changements de concentrations de certains pigments et métabolites foliaires affectant les propriétés optiques des feuilles, ces dernières pouvant être rapidement estimées par des mesures de transmittance, d’absorbance, de réflectance ou de fluorescence chlorophyllienne (ChlF). En situation de carence, la proportion de l’énergie lumineuse absorbée pour la photosynthèse et celles menant à la ChlF et à la dissipation de l’énergie sous forme de chaleur sont modifiées, de même que les parts transmise et réfléchie de la lumière incidente. Cette revue de la littérature s’intéresse spécifiquement aux potentialités de la ChlF comme outil de gestion de la fertilisation azotée des cultures. Pour situer le phénomène de ChlF d’une part et son intérêt pour évaluer le statut azoté de la biomasse végétale d’autre part, il est nécessaire de considérer d’abord le devenir d’une lumière incidente naturelle ou artificielle lorsqu’elle impacte le végétal. Cette lumière présente différentes possibilités d’évolution. Comme l’illustre la figure 1 pour le rayonnement solaire, une part importante de la lumière est absorbée par la chlorophylle contenue dans les chloroplastes, une autre est transmise et une troisième est réfléchie. De la part absorbée, une petite fraction seulement rentre dans les processus photochimiques (en relation avec la photosynthèse), une fraction très importante se dissipe sous forme de chaleur et la fraction restante se dissipe via une émission de fluorescence dite chlorophyllienne. Ces proportions varient fortement, d’une part selon la composition chimique et physique des feuilles et d’autre part, selon la dynamique de régulation qui est fonction de l’intensité lumineuse absorbée. Sous faible intensité lumineuse, la majeure partie (plus de 80 %) de l’énergie absorbée va vers la photochimie et cette proportion diminue fortement sous de fortes intensités lumineuses, soit lorsque l’énergie absorbée excède la capacité d’assimilation de la photosynthèse.
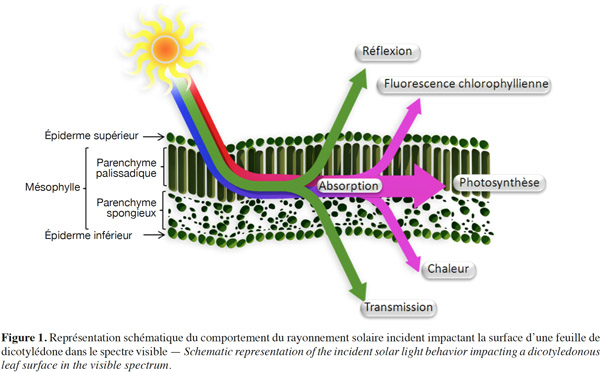
2Le changement des caractéristiques spectrales des feuilles permet d’établir des indicateurs rapides et non destructifs de l’état nutritionnel en azote de la biomasse aérienne d’une culture. Les indicateurs reliés à la concentration en chlorophylle des feuilles, par ses propriétés d’absorption, de réflexion et de fluorescence, occupent une place majeure. De nombreux auteurs ont mis en évidence la relation étroite entre les concentrations en azote et en chlorophylle des feuilles (Vos et al., 1993 ; Blackmer et al., 1995). D’autres pigments foliaires en relation avec le statut azoté d’une culture peuvent également être estimés par la ChlF : il s’agit des composés phénoliques (les flavonoïdes en particulier).
3Divers outils optiques ont déjà été étudiés ou sont en cours d’étude pour l’estimation du statut azoté de diverses cultures (Goffart et al., 2008 ; Tremblay et al., 2011 ; Muñoz-Huerta et al., 2013). Ces outils reposent sur des mesures non destructrices de transmission ou de réflexion des rayonnements lumineux par la biomasse en lien avec la concentration en chlorophylle des feuilles. Transmission (mesurée par des chlorophyllomètres) et réflexion (mesurée par des radiomètres) sont deux concepts qui sont exploités depuis des décennies pour la mise au point de méthodes rapides d’estimation du statut azoté des cultures (Blackmer et al., 1995 ; Denuit et al., 2002 ; Gianquinto et al., 2004). Les potentialités de la ChlF ont été explorées plus récemment dans cette même optique (Thoren et al., 2009 ; Zhang et al., 2010 ; Tremblay et al., 2012).
4Contrairement aux mesures de réflectance souvent utilisées, la ChlF, bien qu’ayant un signal relativement plus faible, possède l’avantage d’être spécifique à la plante par la caractérisation de l’activité photosynthétique (Buschmann, 2007) et de présenter une plus grande sensibilité, puisque le signal de fluorescence ne provient que des parties vertes du végétal (Lichtenthaler et al., 1988). Via les mesures de réflectance, il est aussi plus difficile de faire la distinction entre des variables corrélées telles que la biomasse et la teneur en azote (Thoren et al., 2009). Les mesures de transmittance à l’aide du chlorophyllomètre, quant à elles, détectent essentiellement des situations de déficience marquée en azote et pourraient présenter un retard de détection par rapport à l’entrée réelle en carence azotée (Tremblay et al., 2012).
5La ChlF est aussi décrite comme étant une signature spectrale précoce pour détecter les carences en azote (Samson et al., 2000 ; Cadet, 2008). Ces auteurs décrivent que les variations de la ChlF induite sous ultra-violets (UV) suite à un stress azoté précèdent ou accompagnent l’inhibition de croissance. Sinclair et al. (2002) ont par ailleurs mis en évidence qu’en situation de carence azotée, la croissance est inhibée avant que la photosynthèse, liée à la concentration en chlorophylle des feuilles, ne soit affectée. Cadet (2008) en déduit que la ChlF induite sous UV et liée à l’accumulation des composés phénoliques permet une détection plus précoce d’une carence en azote de la plante que les détections basées sur les changements de réflectance ou de transmittance liés uniquement à la diminution de la concentration en chlorophylle des feuilles.
6Les connaissances importantes acquises sur la ChlF combinées aux développements récents d'instruments miniaturisés et appropriés et de méthodologies adaptées ont augmenté les possibilités d’application de cette signature spectrale.
7L’utilisation de la ChlF pour l’estimation du statut azoté des cultures repose sur deux approches. La première approche étudie la ChlF comme indicateur de l’activité photosynthétique des plantes, véritable carrefour sur lequel se répercute tout état de stress, en se basant sur la ChlF variable encore appelée cinétique de Kautsky. La seconde approche de la ChlF repose sur l’estimation des composés métabolites foliaires de la plante, la chlorophylle et certains composés phénoliques, considérés comme des indicateurs intrinsèques potentiels pour l’évaluation du statut azoté des plantes.
8Cette revue vise à présenter les principes de base des phénomènes de la ChlF pour les deux approches considérées, englobant les aspects physique, moléculaire et physiologique, et expliquant les liens et les applications de ces approches dans l’évaluation du statut azoté d’une biomasse végétale.
2. Méthodologie
9Cette revue bibliographique a utilisé la base de données Bielefeld Academic Search Engine, le moteur de recherche Google scholar, les ressources documentaires disponibles dans les bibliothèques de Gembloux Agro-Bio Tech et les ressources électroniques disponibles dans les collections de l’Université de Liège. Les mots-clés suivants en français – et leur équivalent en anglais – ont été utilisés : fluorescence chlorophyllienne, fluorescence chlorophyllienne variable, chlorophylle, composés phénoliques, azote.
2.1. La fluorescence chlorophyllienne
10Une molécule fluorescente, ou fluorophore, possède la propriété d'absorber de l'énergie lumineuse (lumière d'excitation) et de la restituer rapidement sous forme de lumière fluorescente (lumière d'émission). Dans le cas de figure de la molécule de chlorophylle, l’absorption d’un photon fait passer la molécule de chlorophylle d’un état énergétique fondamental S0 à un état excité singulet S1 ou S2, selon la longueur d’onde absorbée respectivement dans le rouge (R) ou dans le bleu (B) (Figure 2) (Huot et al., 2010). Cet état excité est très instable, nécessitant ainsi de restituer l’excédent d’énergie pour revenir à l’état initial. La ChlF correspond à une transition énergétique sous forme de photon entre S1 et un des niveaux vibrationnels de l’état S0. La fluorescence est en compétition avec deux autres processus de désexcitation de l’énergie absorbée, la photochimie et la dissipation thermique (Krause et al., 1991). Le photon ainsi émis par fluorescence correspond à une énergie plus faible que le photon initialement absorbé induisant un déplacement du spectre de fluorescence vers les grandes longueurs d’onde par rapport au spectre d’absorption (déplacement de Stokes).
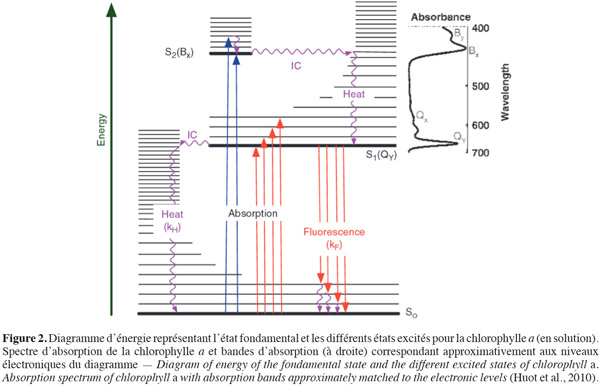
11La fluorescence provient de la chlorophylle a, la chlorophylle b étant non fluorescente in vivo et détenant un rôle de pigment accessoire qui transmet l’énergie absorbée à la chlorophylle a (Cerovic et al., 1999).
12La fluorescence est caractérisée par différentes variables. En général, la première approche étudie le rendement quantique de fluorescence qui est défini comme le rapport du nombre de photons émis sur le nombre de photons absorbés. La seconde approche étudie l’intensité de fluorescence pour une longueur d’onde qui est définie comme le nombre de photons émis par unité de temps.
13Fluorescence chlorophyllienne variable. In vivo, le rendement de fluorescence varie de 0,5 à 3-5 % de la lumière absorbée (Krause et al., 1991). La variation du rendement de la fluorescence, également appelée cinétique de Kautsky, peut être expliquée par les mécanismes du quenching. Le quenching de la fluorescence est la diminution du rendement de la fluorescence déterminée d’une part par le quenching photochimique (qP), qui est l’utilisation de l’énergie d’excitation pour la photochimie au niveau des accepteurs d’électrons des centres réactionnels du photosystème II (PSII) et par le quenching non photochimique (qN) qui favorise la dissipation de l'énergie d’excitation par des mécanismes de perte de chaleur. Lorsque tous les centres réactionnels sont ouverts et, de ce fait, prêts à transférer l'énergie absorbée le long de la chaine de transfert des électrons, le qP est à son maximum et le niveau minimal de la fluorescence (F0) est observé (Figure 3). Ce niveau de fluorescence est généralement mesuré suite à une illumination de feuilles préalablement conditionnées à l’obscurité. Au contraire, lorsque tous les centres réactionnels sont fermés, le qP est à son minimum et le niveau maximal de la fluorescence (Fm) est atteint. Ce niveau Fm est mesuré sous lumière saturante. La différence entre F0 et Fm est définie comme la fluorescence variable Fv. La fluorescence Fm diminue ensuite jusqu’au niveau Fs (suite à l’augmentation du qP et à l’induction du mécanisme du qN). L’excès d’énergie qui ne peut être utilisé pour la réaction photochimique est dissipé sous forme de chaleur. D’autres paramètres ont également été introduits par Genty et al. (1989). Il s’agit du niveau de fluorescence F’ observé pour des feuilles adaptées à la lumière, du niveau Fm’ lorsque les centres réactionnels du PSII sont fermés et du niveau FV’ pour la fluorescence variable au niveau de ces feuilles. Les rapports Fv/Fm et (Fm’-F’)/Fm’ sont les paramètres les plus couramment utilisés pour la détection de divers types de stress au niveau de la plante. Le paramètre Fv/Fm est défini comme l’efficience photochimique maximale du PSII (Butler, 1978). Pour une large gamme de plantes saines, le rapport Fv/Fm est de 0,8 à 0,833 (Björkman et al., 1987). Le rapport (Fm’-F’)/Fm’ est défini comme l’efficience photochimique opérationnelle du PSII sous illumination (Genty et al., 1989). Les paramètres de fluorescence peuvent être utilisés pour évaluer les changements photochimiques du PSII, le flux linéaire d’électrons et l’assimilation du CO2 in vivo (Baker, 2008).

14Fluorescence chlorophyllienne et composés métabolites foliaires. La ChlF d’une feuille verte, à température ambiante, est caractérisée par une première bande étroite ayant un maximum d’émission dans la région R du spectre autour de 685-690 nm (fluorescence rouge ou Red Fluorescence : RF) et une deuxième bande plus large avec un maximum dans le proche infrarouge (PIR) autour de 730-740 nm (fluorescence du rouge lointain ou Far Red Fluorescence : FRF) (Buschmann, 2007). Bien qu’il existe une hétérogénéité de l’émission de fluorescence de la chlorophylle due à l’existence des deux photosystèmes, la fluorescence à température ambiante provient majoritairement du PSII (Krause et al., 1991). Seule une petite partie de la fluorescence dans le PIR vient du PSI. Les pics RF et/ou FRF permettent d’estimer la concentration en composés métabolites foliaires de la plante : la chlorophylle et certains composés phénoliques (les flavonoïdes en particulier). Pour estimer ces derniers, il est utile de considérer aussi la FRF sous excitation de rayonnements UV.
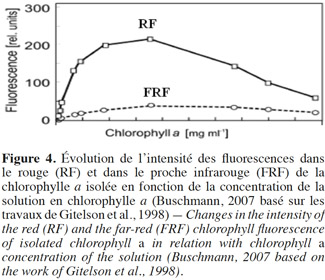
15Rapport RF/FRF et concentration en chlorophylle des feuilles. À partir d’une faible concentration en chlorophylle des feuilles, la RF et la FRF augmentent avec la teneur en chlorophylle (Figure 4). À partir d’une teneur plus élevée en chlorophylle, la FRF augmente légèrement suite à une augmentation de la concentration en chlorophylle, alors que la RF se stabilise puis diminue (Buschmann, 2007).
16Cette réduction de la RF induite par l’accroissement de la concentration en chlorophylle est due au phénomène de réabsorption, par la chlorophylle, du spectre d’émission de la fluorescence au niveau des longueurs d’onde du R. La figure 5 décrit le phénomène de réabsorption in vivo au niveau de la feuille, expliquant ainsi la différence d’allure observée entre le spectre d’émission (Figure 5a) et les spectres de détection de la ChlF (Figure 5d et 5e). La réabsorption est la conséquence du chevauchement du spectre d’émission de fluorescence dans la région du R (Figure 5b : spectre en rouge) avec le spectre d’absorption de la chlorophylle (Figure 5b : spectre en noir). Étant donné que le spectre d’absorption de la chlorophylle possède un pic dans le R (de l’ordre de 680 nm) qui diminue rapidement pour des plus grandes longueurs d’onde, la réabsorption de la FRF est faible, comparativement à la réabsorption de la RF (Buschmann, 2007).
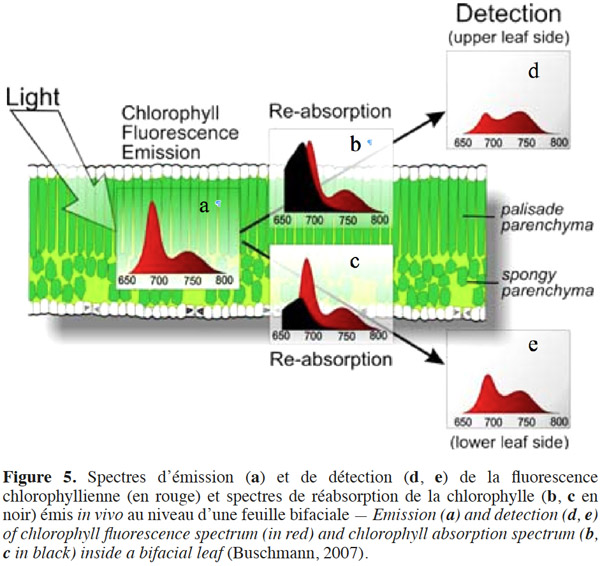
17La différence de concentration en chlorophylle entre la face supérieure et inférieure des feuilles bifaciales induit un degré de réabsorption de la RF beaucoup plus important au niveau de la face supérieure (Figure 5b : spectre en noir) que de la face inférieure (Figure 5b : spectre en noir), ce qui explique la discrimination observée au niveau des spectres de détection de la RF et de la FRF selon la face considérée de la feuille (Figure 5d et 5e) (Buschmann, 2007).
18La mesure de la fluorescence par son intensité est tributaire de facteurs externes tels que la distance, la transmission atmosphérique, la géométrie et les mouvements du couvert végétal, d’où le recours aux rapports d’émission de fluorescence ou rapports d’excitation de fluorescence (Lichtenthaler et al., 1990). La prise en considération des unités relatives permet également d’éliminer les variables de l’instrument utilisé telles que l’intensité de la lumière ou l’angle de détection (Buschmann, 2007).
19Le rapport le plus souvent utilisé dans la littérature est le rapport RF/FRF, rapport entre deux intensités de fluorescence. La diminution de ce rapport avec l’augmentation de la concentration en chlorophylle est induite par le développement de l’épaulement de la FRF et l’augmentation de la réabsorption qui affecte fortement la RF. Cette évolution du rapport en fonction de la concentration en chlorophylle a été observée et confirmée pour plusieurs espèces de plantes et sous diverses conditions (Lichtenthaler et al., 1988 ; Lichtenthaler et al., 1990 ; Gitelson et al., 1998).
20Des résultats obtenus par Gitelson et al. (1998) démontrent que 90 % de la variation du rapport RF/FRF spécifique, F685/F735, est déterminée par le changement de la concentration en chlorophylle des feuilles. Le rapport F685/F735 possède une grande sensibilité pour des teneurs en chlorophylle faibles à modérées (valeur proche de 0 à 100-150 mg·m-2). Ce rapport sature ensuite, à partir des teneurs modérées à élevées en chlorophylle (Gitelson et al., 1999) et donc sa sensibilité devient relativement faible pour des teneurs en chlorophylle supérieures à 200 mg·m-2 (Gitelson et al., 1998). Étant donné que le PSII définit le niveau de la ChlF variable et que sa contribution est plus importante au niveau du pic RF comparativement au pic FRF, le rapport RF/FRF peut être influencé par le rendement de la fluorescence variable, ce qui pourrait représenter une limitation dans l’interprétation de ce rapport. Le rapport RF/FRF est également influencé par la longueur d’onde de la source lumineuse utilisée et la température de la feuille (Agati et al., 1995). De ce fait, une standardisation de la méthode de mesure de ce rapport est nécessaire afin d’obtenir une information fiable. Selon Buschmann (2007), les valeurs des rapports F690/F740 ou encore F690/F735 dépendent essentiellement de la teneur en chlorophylle et, à un moindre degré, de l'activité photosynthétique et, dans une mesure relativement faible, des caractéristiques optiques de la feuille.
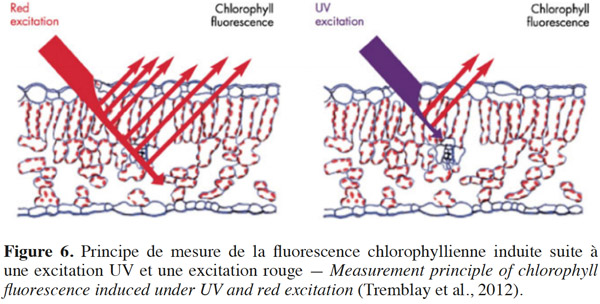
21Rapport FRF-UV/FRF-R et concentration en composés phénoliques des feuilles. Parmi les composés phénoliques, les flavonoïdes et les acides hydroxycinnamiques, majoritairement présents dans l’épiderme des feuilles, ont la propriété d’absorber les rayonnements UV et donc d’agir comme un filtre UV, protégeant ainsi le mésophylle des feuilles. Bilger et al. (1997) ont proposé l’utilisation de la transmittance épidermique comme un outil d’estimation de la teneur en composés phénoliques absorbants dans l’UV. Day et al. (1994) ont montré une corrélation négative étroite entre l’absorbance UV des extraits de feuilles et la transmittance épidermique. Les travaux de Cerovic et al. (2002) ont démontré que le rapport FRF-UV/FRF-R est proportionnel à l’absorbance des UV par les composés phénoliques présents dans l’épiderme et donc à la concentration de ces derniers (Loi de Beer -Lambert). Ce rapport de fluorescence FRF repose sur l’utilisation de deux longueurs d’onde d’excitation, l’une dans l’UV (-UV) et l’autre dans le rouge (-R). L’excitation UV (375 nm) est absorbée majoritairement par les flavonoïdes (les acides hydroxycinnamiques absorbant très peu à cette longueur d’onde), induisant ainsi une diminution de l’excitation UV qui atteint la chlorophylle du mésophylle et donc une diminution de la ChlF sous excitation UV (Figure 6). L’excitation R atteint intacte la chlorophylle du mésophylle, sans être absorbée par les composés phénoliques présents dans l’épiderme et induit une ChlF dans le PIR plus importante que celle observée suite à l’excitation UV. Cartelat et al. (2005) ont mis en évidence une relation linéaire étroite entre les flavonoïdes contenus au niveau des extraits de feuilles de blé (mesurés par absorbance) et le ratio FRF-UV/FRF-R.
2.2. Fluorescence chlorophyllienne et évaluation du statut azoté des cultures
22Utilisation de la fluorescence chlorophyllienne variable. Comme déjà mentionné, l’émission de la fluorescence est directement liée au processus photosynthétique de la plante. En particulier, les paramètres Fv/Fm et (Fm’-F’)/Fm’ fournissent une estimation de l’efficience photochimique du PSII. Étant donné que l’activité photosynthétique est reliée au statut azoté (Evans, 1989), ces paramètres de la ChlF peuvent être utilisés pour la détection d’un stress azoté. Sous l’action de stress, la photochimie est ralentie, induisant ainsi l’augmentation des rendements en fluorescence et en perte de chaleur (Henriques, 2009). Khamis et al. (1990) ont démontré que, sous forte intensité lumineuse, les apports d’azote modifient le paramètre Fv/Fm. Cependant, sous faible intensité lumineuse, le rapport Fv/Fm ne varie pas suite à une déficience en azote (Khamis et al., 1990 ; Ciompi et al., 1996). Le fluorimètre utilisé au niveau de ces deux études est le PAM (Pulse Amplitude Modulated, Walz, Allemagne) mesurant la fluorescence modulée après une période de conditionnement à l’obscurité des feuilles. La variation du ratio Fv/Fm en fonction de l’azote reflète probablement des réponses spécifiques aux conditions environnementales et à la dose d’azote pour les différentes espèces de plantes considérées (Mauromicale et al., 2006). Les paramètres de la ChlF variable sont peu spécifiques car variant selon l’activité photosynthétique qui, elle-même, est sensible à de nombreux facteurs environnementaux (notamment l’intensité lumineuse ambiante et la température). La nature dynamique de ces paramètres rend leur utilisation complexe et moins fiable pour l’évaluation du statut azoté des cultures. À l'inverse, les paramètres RF/FRF et FRF-UV/FRF-R de nature constitutive, variant directement selon la concentration en chlorophylle et en polyphénols, sont donc plus stables et peuvent s’envisager pour l’évaluation du statut azoté des cultures.
23Utilisation du rapport RF/FRF. La concentration en chlorophylle de la feuille est positivement corrélée avec sa concentration en azote, étant donné que l'azote est le constituant majeur du noyau tétrapyrrole de la chlorophylle. Selon un large consensus, l’estimation de la concentration en chlorophylle au niveau des feuilles permet d’estimer le statut en azote de la biomasse d’une culture et in fine d’ajuster la dose optimale de la fertilisation azotée en cours de saison (Blakmer et al., 1995 ; Goffart et al., 2002 ; Gianquinto et al., 2004). Le ratio RF/FRF diminue avec l’augmentation des apports en azote (Schächtl et al., 2005 ; Thoren et al., 2009).
24Les travaux de Schächtl et al. (2005) ont confirmé la potentialité de mesure du rapport RF/FRF pour la détection du statut azoté pour une culture de blé sous lumière ambiante et en plein champ. Le laser utilisé dans cette étude induit une excitation à 660 nm et mesure la fluorescence à 690 et 730 nm.
25Le rapport F690/F730 mesuré sur culture de colza (Brassica napus L.) présente une corrélation étroite (R2 = 0,98) avec la teneur en azote (Thoren et al., 2009). Dans cette étude, le Laser-N-detector (Planto GmbH, Leipzig, Allemagne) est embarqué sur le toit d’un tracteur avec une distance de 3-4 m entre le capteur et la plante.
26Les rapports FRF-R/RF-R et FRF-V/RF-V, ratios de fluorescence induite respectivement sous excitation R à 635 nm (-R) ou excitation verte à 515 nm (-V) et mesurés sur des feuilles de maïs, sont fortement influencés par les doses d’azote appliquées (Zhang et al., 2010). L’appareil utilisé au niveau de cette étude est le fluorimètre Multiplex (Force-A, Orsay, Paris, France) mesurant par télédétection rapprochée la fluorescence des feuilles à 685 nm (RF) et à 735 nm (FRF).
27Cependant, des facteurs autres que l'azote ont été identifiés comme agissant sur la photosynthèse et sur la teneur en chlorophylle. Ces facteurs, liés à la concentration en soufre par exemple (Samson et al., 2000) ou encore au régime hydrique (Gianquinto et al., 2004), montrent que les variations en chlorophylle ne sont pas exclusivement spécifiques au statut azoté de la culture. Ceci limite l’utilisation du rapport RF/FRF, relié à la concentration en chlorophylle, pour l’évaluation du statut azoté des cultures.
28Utilisation du rapport FRF-UV/FRF-R. La teneur en composés phénoliques augmente en situation de déficit en azote. Chishaki et al. (1997) rapportent une augmentation notable de la concentration en composés phénoliques, tels que l’acide p-coumarique et de l’acide férulique, au niveau des plantes de riz (Oryza sativa) suite à une déficience en azote. Lea et al. (2007) rapportent une augmentation en flavonoïdes (anthocyanines et flavonols) au niveau des feuilles d’Arabidopsis thaliana provoquée par une déficience en azote. Une comparaison d’extraits de feuilles de tomates (Lycopersicon esculentum) d’un témoin non carencé en azote avec celles en condition de carence azotée a montré une augmentation des teneurs en flavonoïdes (anthocyanidines et flavonols glycosylés) pour les plantes en situation de déficit en azote (Bongue-Bartelsman et al., 1995). Les travaux réalisés par Stewart et al. (2001) montrent qu’une déficience en azote permet d’induire une augmentation en flavonols, contrairement à la déficience phosphatée qui n’est pas capable de provoquer cette réponse. L’apport d'azote supplémentaire diminue de manière significative les concentrations de l’acide chlorogénique et de la majorité des flavonols mesurées à partir des feuilles de pomme de terre (Mittelstraß et al., 2006). L’hypothèse de la balance carbone/nutriments (Coley et al., 1985), largement acceptée par plusieurs écologistes, pourrait présenter une interprétation physiologique de l'accumulation des composés phénoliques induite sous une carence en azote (Cerovic et al., 1999). Cette hypothèse soutient que lorsque la disponibilité des ressources devient un facteur limitant, la croissance des plantes est inhibée plus que la photosynthèse et l’excès de carbone est ainsi alloué à la synthèse de composés phénoliques par stimulation de la voie de l’acide shikimique (Mercure et al., 2004). Cette situation est généralement observée pour des plantes présentant une déficience en azote (Sinclair et al., 2002). Des travaux sur Arabidopsis thaliana ont révélé que la synthèse des flavonoïdes améliore la tolérance au manque d’azote (Peng et al., 2008).
29Plusieurs études ont montré la potentialité d’utilisation du ratio FRF-UV/FRF-R pour la détection d’un stress azoté au niveau de la plante. Les résultats de Cartelat et al. (2005) ont confirmé que le ratio FRF-UV/FRF-R mesuré à partir du fluorimètre Dualex (Force-A, Orsay, Paris, France) est relié aux différents niveaux de fumure azotée. Dans cette étude, le ratio de fluorescence est corrélé négativement avec la teneur en azote au niveau des feuilles (r = -0,87). Selon Demotes-Mainard et al. (2008), le Dualex est un outil prometteur pour l’évaluation du statut azoté.
30Selon Lillo et al. (2008), différents facteurs environnementaux interagissent en influençant les concentrations en flavonoïdes dans les plantes. Parmi les facteurs (azote, température et lumière) étudiés par Løvdal et al. (2010), le déficit en azote est l’élément qui contribue le plus fortement à l'accumulation de flavonoïdes au niveau des feuilles de tomate. La déficience en soufre n’affecte pas la variation des composés phénoliques (Samson et al., 2000). Cependant, sous conditions de stress hydrique, les composés phénoliques augmentent au niveau des plantes déficientes (Estiarte et al., 1999 ; Fortier et al., 2006). Ainsi, l’accumulation des composés phénoliques peut être induite par plusieurs facteurs autres que l’azote, ce qui pourrait limiter l’utilisation du rapport FRF-UV/FRF-R dans le cadre de l’évaluation du statut azoté des cultures.
31Les indices combinant sous forme de rapport les concentrations en chlorophylle et en flavonoïdes des feuilles ont également été étudiés en relation avec le statut azoté des cultures. Ce rapport est décrit comme étant un indicateur pertinent pour l’évaluation du statut azoté des plantes dans une optique de raisonnement des apports de la fertilisation azotée (Cerovic et al., 2002 ; Cartelat et al., 2005). Le rapport [chlorophylle]/[flavonoïdes] est un meilleur indicateur du statut azoté de la culture que la chlorophylle seule car ce ratio est indépendant de la masse foliaire par unité de surface et permet d’étendre la gamme de discrimination pour les différents niveaux de fumure azotée testés en raison de la réaction inverse de la chlorophylle et des flavonoïdes vis-à-vis de l’azote (Cerovic et al., 2012 ; Agati et al., 2013). Ce rapport possède également l’avantage d'atténuer, au moins partiellement, l’hétérogénéité longitudinale dans la feuille (Cartelat et al., 2005).
32Le rapport [chlorophylle]/[flavonoïdes] peut être calculé par l’utilisation du chlorophyllomètre combiné au Dualex (Cartelat et al., 2005 ; Demotes-Mainard et al., 2008) ou bien directement à partir de la nouvelle version du Dualex. Le fluorimètre Multiplex permet également de mesurer directement, à partir des signaux de fluorescence, un indice reliant la concentration en chlorophylle à la concentration en flavonoïdes. Il s’agit d’un rapport entre deux fluorescences FRF et RF émises respectivement sous deux excitations, l’une dans l’UV et l’autre dans le R. Un autre indice a également été proposé par Agati et al. (2013) pour la mesure combinée de la chlorophylle et des flavonoïdes : il s’agit du ratio de la fluorescence FRF, (FRF-V.FRF-UV)/(FRF-R)2. Cet indice issu d’excitations sous trois longueurs d’ondes différentes (-V, -UV et -R) et calculé à partir des paramètres Multiplex a permis la discrimination entre tous les niveaux de fumure azotée testés.
3. Conclusions
33Les caractéristiques et les applications de deux approches de la ChlF décrites dans la littérature ont été examinées pour l’évaluation du statut azoté d’une culture. La première approche qui étudie la ChlF variable, associée à l’état fonctionnel de l’appareil photosynthétique, permet d’identifier des paramètres de la cinétique de fluorescence qui nécessitent une adaptation des feuilles à l’obscurité, une température définie, une intensité de rayonnement déterminée et une durée d'éclairement spécifique. De ce fait, il s’agit d’une approche assez laborieuse et consommatrice en temps à mettre en œuvre en plein champ dans une optique opérationnelle fournissant une réponse rapide sur le statut azoté de la biomasse. D’autres instruments déjà commercialisés permettent également de mesurer des paramètres de la cinétique mais sous lumière ambiante. L’étude de la cinétique de la fluorescence est la méthode de base au laboratoire, mais pour des raisons techniques elle est difficilement envisageable en application en plein champ. La nature dynamique des paramètres de la ChlF variable rend son application peu spécifique pour l’évaluation du statut azoté des cultures.
34Au lieu de miser sur cette première approche des variations rapides de la ChlF, l’analyse spectrale de la ChlF émise par une feuille nous informe sur ses propriétés chimiques telles que les concentrations en chlorophylle et en composés phénoliques, reliées aux caractéristiques structurelles de l’épiderme et du mésophylle. Cette seconde approche, de nature constitutive et donc plus stable, repose sur l’utilisation de rapport d’intensité de fluorescence, celle-ci correspondant au nombre de photons émis par unité de temps. La prise en considération des unités relatives permet d’éliminer les variables de l’instrument utilisé (intensité de la lumière, angle de détection, etc.). Le rapport entre FRF et RF, respectivement les intensités d’émission de fluorescence dans le proche infra-rouge et le rouge, qui fournit une estimation de la concentration en chlorophylle des feuilles, apparait peu sensible à la surface foliaire et à la structure de la feuille (Buschmann, 2007). Cependant, la limitation majeure de l’utilisation de ce ratio est la variation du rendement de la fluorescence plus importante au niveau de RF qu’au niveau de FRF (Tremblay et al., 2012) suite au phénomène de réabsorption de la fluorescence dans le rouge. Ainsi, l’utilisation du ratio de la fluorescence FRF induite sous excitations UV et R, permettant l’estimation de la teneur en composés phénoliques (les flavonoïdes en particulier) au niveau de la feuille, serait plus adéquate dans une optique de monitoring du statut azoté d’une culture car la variation du rendement de la fluorescence est la même pour les deux longueurs d’onde d’excitation. La ChlF induite sous UV est également décrite comme étant une signature précoce permettant la détection rapide d’une carence azotée.
35Le rapport de fluorescence qui combine la concentration en flavonoïdes et en chlorophylle au niveau de la feuille présente un intérêt potentiel pour l’évaluation du statut azoté d’une culture. La prise en compte de la chlorophylle et des flavonoïdes améliore la sensibilité de ce rapport (Cartelat et al., 2005). En effet, la dépendance inverse de la chlorophylle et des flavonoïdes vis-à-vis du statut azoté accroit la discrimination entre les traitements azotés. Ce rapport possède également l’avantage d'atténuer, au moins partiellement, l’hétérogénéité longitudinale dans la feuille (Cartelat et al., 2005). Ce ratio a été proposé comme une solution afin de diminuer l'influence de la masse foliaire par unité de surface (Cerovic et al., 2012). La mesure de la fluorescence qui combine la concentration en flavonoïdes et en chlorophylle est effectuée par pincement de la feuille (cas du Dualex) ou par télédétection rapprochée à une distance de 10 cm entre la source de lumière et la surface de mesure (cas du Multiplex). Les surfaces foliaires respectives échantillonnées sont de 19-20 mm2 et 50 cm2, ce qui pourrait constituer une limitation pour une mise en œuvre opérationnelle en application agricole. Les versions embarquées attendues de tels systèmes positionnés à distance plus grande du végétal ouvriront la porte à ces perspectives opérationnelles.
36En raison de la faible spécificité de la chlorophylle et des composés phénoliques et des flavonoïdes en particulier pour l’évaluation du statut azoté de la culture, il apparait utile de travailler avec des valeurs relatives des indicateurs par la prise en compte d’une fenêtre de référence (soit une fenêtre sans apport d’azote, soit une fenêtre sur-fertilisée) plutôt que des valeurs absolues.
Bibliographie
Agati G., Mazzinghi P., Fusi F. & Ambrosini I., 1995. The F685/F730 chlorophyll fluorescence ratio as a tool in plant physiology: response to physiological and environmental factors. J. Plant Physiol., 145(3), 228-238.
Agati G. et al., 2013. Fluorescence-based versus reflectance proximal sensing of nitrogen content in Paspalum vaginatum and Zoysia matrella turfgrasses. Eur. J. Agron., 45, 39-51.
Baker N.R., 2008. Chlorophyll fluorescence: a probe of photosynthesis in vivo. Annu. Rev. Plant Biol., 59, 89-113.
Bilger W., Veit M., Schreiber L. & Schreiber U., 1997. Measurement of leaf epidermal transmittance of UV radiation by chlorophyll fluorescence. Physiol. Plant., 101, 754-763.
Björkman O. & Demmig B., 1987. Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77 K among vascular plants of diverse origins. Planta, 170, 489-504.
Blackmer T.M. & Schepers J.S., 1995. Use of a chlorophyll meter to monitor nitrogen status and schedule fertigation for corn. J. Prod. Agric., 8(1), 56-60.
Bongue-Bartelsman M. & Phillips D.A., 1995. Nitrogen stress regulates gene expression of enzymes in the flavonoid biosynthetic pathway of tomato plant. Physiol. Biochem., 33, 539-546.
Buschmann C., 2007. Variability and application of the chlorophyll fluorescence emission ratio red/far-red of leaves. Photosynth. Res., 92(2), 261-271.
Butler W.L., 1978. Energy distribution in the photochemical apparatus of photosynthesis. Annu. Rev. Plant Physiol., 29, 345-378.
Cadet E., 2008. Détection et discrimination des carences en N, P et K par la fluorescence induite par UV chez le tournesol nain (Helianthus annuus, "Sunspot"). Mémoire : Université du Québec à Trois-Rivières (Canada).
Cartelat A. et al., 2005. Optically assessed contents of leaf polyphenolics and chlorophyll as indicators of nitrogen deficiency in wheat (Triticum aestivum L.). Field Crop Res., 91, 35-49.
Cerovic Z.G. et al., 1999. Ultraviolet-induced fluorescence for plant monitoring: present state and prospects. Agronomie, 19, 543-578.
Cerovic Z.G. et al., 2002. The use of chlorophyll fluorescence excitation spectra for the non-destructive in situ assessment of UV-absorbing compounds in leaves. Plant Cell Environ., 25(12), 1663-1676.
Cerovic Z.G., Masdoumier G., Ghozlen N.B. & Latouche G., 2012. A new optical leaf-clip meter for simultaneous non-destructive assessment of leaf chlorophyll and epidermal flavonoids. Physiol. Plant., 146(3), 251-260.
Chishaki N. & Horiguchi T., 1997. Response of secondary metabolism in plants to nutrient deficiency. Soil Sci. Plant Nutr., 43, 987-991.
Ciompi S., Gentili E., Guidi L. & Soldatini G.F., 1996. The effect of nitrogen deficiency on leaf gas exchange and chlorophyll fluorescence parameters in sunflower. Plant Sci., 118(2), 177-184.
Coley P.D., Bryant J.P. & Chapin S., 1985. Resource availability and plant antiherbivore defense. Science, 230, 895-899.
Day T., Howells B.W. & Rice W.J., 1994. Ultraviolet absorption and epidermal-transmittance spectra in foliage. Physiol. Plant., 92, 207-218.
Demotes-Mainard S., Boumaza R., Meyer S. & Cerovic Z.G., 2008. Indicators of nitrogen status for ornamental woody plants based on optical measurements of leaf epidermal polyphenol and chlorophyll contents. Sci. Hortic., 115(4), 377-385.
Denuit J.P. et al., 2002. Management of nitrogen fertilization of winter wheat and potato crops using the chlorophyll meter for crop nitrogen status assessment. Agronomie, 22(7-8), 847-853.
Estiarte M. et al., 1999. Free‐air CO2 enrichment of wheat: leaf flavonoid concentration throughout the growth cycle. Physiol. Plant., 105(3), 423-433.
Evans J.R., 1989. Photosynthesis and nitrogen relationships in leaves of C3 plants. Oecologia, 78, 9-19.
FortierE. et al., 2006. Influence of irrigation and nitrogen fertilization on broccoli polyphenolics concentration. Acta Hortic., 856, 55-62.
Genty B., Briantais J.-M. & Baker N.R., 1989. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochim. Biophys. Acta, 990, 87-92.
Gianquinto G. et al., 2004. The use of hand-held chlorophyll meters as a tool to assess the nitrogen status and to guide nitrogen fertilization of potato crop. Potato Res., 47, 35-80.
Gitelson A.A., Buschmann C. & Lichtenthaler H.K., 1998. Leaf chlorophyll fluorescence corrected for re-absorption by means of absorption and reflectance measurements. J. Plant Physiol., 152, 283-296.
Gitelson A.A., Buschmann C. & Lichtenthaler H.K., 1999. The chlorophyll fluorescence ratio F735/F700 as an accurate measure of the chlorophyll content in plants. Remote Sens. Environ., 69, 296-302.
Goffart J.-P., Olivier M., Destain J.-P. & Frankinet M., 2002. Stratégie de gestion de la fertilisation azotée de la pomme de terre de consommation. Gembloux, Belgique : Centre de Recherches agronomiques de Gembloux.
Goffart J.-P., Olivier M. & Frankinet M., 2008. Potato crop nitrogen status assessment to improve N fertilization management and efficiency: past-present-future. Potato Res., 51, 355-383.
Henriques S., 2009. Leaf chlorophyll fluorescence: background and fundamentals for plant biologists. Bot. Rev., 75, 249-270.
Huot Y. & Babin M., 2010. Overview of fluorescence protocols: theory, basic concepts, and practice. In: Suggett D.J., Prášil O. & Borowitzka M.A., eds. Chlorophyll a fluorescence in aquatic sciences: methods and applications. Dordrecht, The Netherlands: Springer, 31-74.
Khamis S., Lamaze T., Lemoine Y. & Foyer C., 1990. Adaptation of the photosynthetic apparatus in maize leaves as a result of nitrogen limitation relationships between electron transport and carbon assimilation. Plant Physiol., 94(3), 1436-1443.
Krause G.H. & Weis E., 1991. Chlorophyll fluorescence and photosynthesis. Annu. Rev. Plant Physiol. Plant Mol. Biol., 42, 313-349.
Lea U.S., Slimestad R., Smedvig P. & Lillo C., 2007. Nitrogen deficiency enhances expression of specific MYB and bHLH transcription factors and accumulation of end products in the flavonoid pathway. Planta, 225, 1245-1253.
Lichtenthaler H.K. & Rinderle U., 1988. The role of chlorophyll fluorescence in the detection of stress conditions in plants. CRC Crit. Rev. Anal. Chem., 9(1), 29-85.
Lichtenthaler H.K., Hak R. & Rinderle U., 1990. The chlorophyll fluorescence ratio F690/F730 in leaves of different chlorophyll content. Photosynth. Res., 25(3), 295-298.
Lillo C., Lea U.S. & Ruoff P., 2008. Nutrient depletion as a key factor for manipulating gene expression and product formation in different branches of the flavonoid pathway. Plant Cell Environ., 31, 587-601.
Løvdal T. et al., 2010. Synergetic effects of nitrogen depletion, temperature, and light on the content of phenolic compounds and gene expression in leaves of tomato. Phytochemistry, 71, 605-613.
Mauromicale G., Ierna A. & Marchese M., 2006. Chlorophyll fluorescence and chlorophyll content in field-grown potato as affected by nitrogen supply, genotype, and plant age. Photosynthetica, 44(1), 76-82.
Mercure S.A., Daoust B. & Samson G., 2004. Causal relationship between growth inhibition, accumulation of phenolic metabolites, and changes of UV-induced fluorescences in nitrogen-deficient barley plants. Can. J. Bot., 82(6), 815-821.
Mittelstraß K. et al., 2006. Modification of primary and secondary metabolism of potato plants by nitrogen application differentially affects resistance to Phytophthora infestans and Alternaria solani. Plant Biol., 8(5), 653-661.
Muñoz Huerta R.F. et al., 2013. A review of methods for sensing the nitrogen status in plants: advantages, disadvantages and recent advances. Sensors, 13(8), 10823-10843.
Peng L. et al., 2008. An improved HPLC method for simultaneous determination of phenolic compounds, purine alkaloids and theanine in Camellia species. J. Food Compos. Anal., 21(7), 559-563.
Samson G. et al., 2000. Nutrient stress of corn plants: early detection and discrimination using a compact multiwavelength fluorescent lidar. In: Proceedings of EARSeL-SIG-Workshop LIDAR, June 16-17, 2000, Dresden/FRG, Germany.
Schächtl J. et al., 2005. Laser induced chlorophyll fluorescence measurements for detecting the nitrogen status of wheat (Triticum aestivum L.) canopies. Precis. Agric., 6, 143-156.
Sinclair T.R. & Vadez V., 2002. Physiological traits for crop yield improvement in low N and P environments. Plant Soil, 245, 1-15.
Stewart A.J. et al., 2001. The effect of nitrogen and phosphorus deficiency on flavonol accumulation in plant tissues. Plant Cell Environ., 24(11), 1189-1197.
Thoren D. & Schmidhalter U., 2009. Nitrogen status and biomass determination of oilseed rape by laser-induced chlorophyll fluorescence. Eur. J. Agron., 30, 238-242.
Tremblay N., Fallon E. & Ziadi N., 2011. Sensing of crop nitrogen status: opportunities, tools, limitations, and supporting information requirements. Hortic. Technol., 21(3), 274-281.
Tremblay N., Wang Z. & Cerovic Z.G., 2012. Sensing crop nitrogen status with fluorescence indicators. A review. Agron. Sustain. Dev., 32(2), 451-464.
Vos J. & Bom M., 1993. Hand-held chlorophyll meter: a promising tool to assess the nitrogen status of potato foliage. Potato Res., 36, 301-308.
Zhang Y. & Tremblay N., 2010. Evaluation of the Multiplex® fluorescence sensor for the assessment of corn nitrogen status. In: Proceedings of the International Conference on Precision Agriculture, July 18-21, 2010, Denver, Colorado, USA.






