- Accueil
- Volume 17 (2013)
- numéro 2
- Caractérisation, germination et conservation des graines de Carapa procera DC. (Meliaceae), une espèce utile en santé humaine et animale
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Caractérisation, germination et conservation des graines de Carapa procera DC. (Meliaceae), une espèce utile en santé humaine et animale

Notes de la rédaction
Reçu le 28 février 2012, accepté le 18 janvier 2013
Résumé
Carapa procera DC. (Meliaceae) est une espèce très répandue dans les savanes boisées d’Afrique et en Amérique latine. C’est une plante médicinale très exploitée par la population rurale du Mali Sud. Les feuilles, fruits et graines, les écorces du tronc et des racines servent à la préparation de produits médicinaux pour la santé humaine et animale. Ces utilisations entrainent d’énormes pressions sur les peuplements de l’espèce, d’où une régénération naturelle qui varie de nulle à très faible. La physiologie des graines a été investiguée afin de développer des techniques de production de plants à partir des semences pour sa réintroduction dans les terroirs villageois. Les résultats obtenus montrent que les graines de C. procera fraichement récoltées ont une teneur en eau (rapportée au poids frais) supérieure à 50 % et une faculté germinative supérieure ou égale à 90 %. Quand les graines sont séchées dans une salle ventilée, leur teneur en eau devient inférieure à 20 % après deux semaines, entrainant ainsi une perte totale de leur capacité à germer. Les graines de C. procera sont donc récalcitrantes. Conservées dans des tonnelets contenant des copeaux de bois, 50 % des (petites) graines germent après un mois et seulement 33 % après trois mois avec une teneur en eau maintenue à 23,5 %. Pour garder la viabilité des graines de C. procera, leur teneur en eau doit être maintenue au-dessus de 35 %. L’utilisation d’un terreau de structure argilo-limoneuse permet de produire en trois mois des plants de bonne taille (hauteur ≥ 40 cm) pour la plantation au champ. Afin d’exploiter et de conserver durablement C. procera dans les zones de savane d’Afrique de l’Ouest, la domestication par l’installation de plantations dans les terroirs villageois par les communautés rurales est recommandée.
Abstract
Characterization, germination and conservation of seeds of Carapa procera DC. (Meliaceae), a useful medicinal species for human and animal health. Carapa procera DC. (Meliaceae) is a widespread species occurring in the woodlands of Africa and Latin America. It is a medicinal plant overexploited by the rural populations of southern Mali. Leaves, fruits and seeds, the bark of the trunk and the roots are used in the preparation of medicine for human and animal health. Such uses result in enormous pressures on natural stands of the species, which have great difficulty in regenerating naturally. Cultivation of C. procera was investigated through studies of its seed physiology and seedling production techniques for reintroduction into its natural habitat. Results showed that fresh seeds of C. procera had a moisture content of over 50% (based on fresh weight) and ≥ 90% germination. When seeds were dried in a ventilated room condition, their moisture content dropped below 20% after 2 weeks, resulting in a total loss of their germination capacity. Carapa procera seeds can therefore be described as recalcitrant seeds. Stored in kegs containing wood chips, 50% of (small size) seeds germinated after one month and 33% after three months, maintaining a 23.5% moisture content. This study recommends that seed moisture content should be kept at above 35% in order to maintain seed viability in storage. We found that using a substrate of silty clay in the nursery allowed a good growth of seedlings (≥ 40 cm), which could be planted out in the field within three months. In order to sustainably use and conserve C. procera in the savannah areas of West Africa, it is recommended that the species be cultivated through the establishment of plantations in its habitat by rural communities.
Table des matières
1. Introduction
1En zone sahélienne, la population rurale tire une partie importante de ses revenus de l’exploitation des produits forestiers ligneux (bois, fourrage) et non ligneux (fruits, sève, gomme, miel, etc.). L’exploitation incontrôlée des formations végétales boisées entraine la régression rapide, voire la disparition totale de certaines plantes très utiles aux communautés (GRASE, 1999 ; Sanogo et al., 2006 ; Yossi et al., 2006), alors que peu d’informations existent sur leur biologie et leur sylviculture. Parmi les principales espèces fréquemment exploitées dans le sud du Mali, figure Carapa procera qui est une plante médicinale particulièrement recherchée par les thérapeutes et herboristes (Weber et al., 2010).
2Carapa procera DC. (Meliaceae) est la principale espèce du genre Carapa présente en Afrique de l’Ouest (Guillemot, 2004). L’espèce a une distribution strictement localisée le long de quelques cours d’eau et dans des dépressions de terrains temporairement inondés. Dans ses habitats naturels, sa densité est assez restreinte avec moins de 10 pieds par hectare (Doligez et al., 1997 ; Forget et al., 1999). Plante aux multiples usages, C. procera n’est représentée aujourd’hui que par de vieux pieds dont la production fruitière est faible et irrégulière. Ces pieds se trouvent confinés dans les zones boisées d’extrême sud du Mali. Toutes les parties de l’arbre sont utilisées (Guillemot, 2004 ; Eyog-Matig et al., 2006). De sa graine, on extrait une huile dont la teneur dans l’amande est estimée à 55 % (Sanogo S. et al., 2007). L’huile extraite de la noix de C. procera entre dans la fabrication de produits cosmétiques, la production locale de savon et elle est utilisée pour le traitement de plusieurs maladies en médecine vétérinaire traditionnelle et humaine (Guèye et al., 2010 ; Weber et al., 2010). En Afrique de l’Ouest, l’huile de Carapa est souvent utilisée contre les tiques et pour soigner les plaies sur les bovins (Bah, 1993). Au Mali et au Burkina Faso, l’huile de C. procera est utilisée dans le traitement phytosanitaire du cotonnier dans le cadre du programme de production du coton biologique pour le commerce équitable (Helvetas Burkina Faso, 2006 ; Sanogo Y. et al., 2007). Par contre, dans les zones cotonnières du Mali et du Burkina Faso, l’extension incontrôlée d’exploitations agricoles contribue progressivement à la destruction des galeries forestières qui abritent encore les quelques pieds isolés de C. procera.
3D’autres travaux d’enquêtes ethnoécologiques confirment non seulement la menace de disparition de C. procera, mais également celle de beaucoup d’autres espèces ligneuses utiles aux communautés dans le sud du Mali (GRASE, 1999). Dans cette région, les arbres de C. procera sont d’âge très avancé et la régénération naturelle est absente à cause de la faible fructification et du ramassage des graines pour l’extraction d’huile. Une étude menée en Guyane française (Guillemot, 2004) a démontré que le rapport entre la production de graines de Carapa et sa régénération est généralement faible en raison d’une forte mortalité des graines et des jeunes plants issus dans le sous-bois au cours de la saison sèche. En outre, ces auteurs indiquent que l’absence de régénération naturelle de Carapa est causée par une intense consommation des graines par les rongeurs et aussi de l’infestation par les larves d’un insecte (Hipsiphylla grandella) qui se développent dans les graines.
4Les premières expérimentations menées sur les caractéristiques de C. procera ont montré que ses graines ne tolèrent pas la déshydratation et, par conséquent, cela pose un problème crucial de conservation des semences (Sanogo et al., 2006). Cependant, en matière de domestication de C. procera, peu de travaux ont été réalisés en Afrique subsaharienne.
5D’après la littérature scientifique, il ressort une insuffisance de données sur la manutention des graines et la domestication de l’espèce en dépit de ses multiples usages. C’est pourquoi, compte tenu de l’importance socio-économique de C. procera dans le sud du Mali, la présente étude sur les graines et les expérimentations de production des plants a été entreprise afin d’approfondir les connaissances sur sa biologie, sa sylviculture et de contribuer à sa protection et conservation durable. L’étude est centrée sur la caractérisation, la recherche des techniques appropriées pour la manutention et la germination des graines, et la domestication de l’espèce afin de promouvoir sa culture dans les terroirs villageois.
2. Matériel et méthodes
6Les semences utilisées pour tous les essais qui suivent ont été récoltées pendant le mois de mai durant les années 2008 et 2009 dans la forêt classée de Farako dans le sud du Mali [11° 15’ 04’’ N ; 05° 29’ 11’’ W]. Cette forêt a un relief moyennement accidenté et est constituée d’une succession de collines (Schneider, 1996). Les sols de la forêt sont de type ferrugineux tropicaux lessivés (Kouyaté et al., 2007). La formation végétale dominante est la savane boisée. Le climat est de type soudano-guinéen avec une pluviométrie annuelle variant entre 1 000 et 1 200 mm.
7Six arbres-mères distants d’au moins 100 m les uns des autres (disséminés sur environ 1 km au total) ont été sélectionnés sur la base du bon état végétatif (absence d’attaques, fût droit et couronne régulièrement développée) et de leur distribution dans une galerie de la forêt de Farako pour récolter les graines. Les capsules (fruits) mûres ont été récoltées sélectivement à l’aide d’une gaule, mélangées pour l’apprêt des semences qui ont constitué le lot initial de base pour les différentes expérimentations.
2.1. Détermination des caractéristiques des fruits et graines
8Pour la réalisation de cette étude morphologique des fruits, qui sont des capsules, et des graines, cinq groupes de 20 capsules chacun ont été prélevés au hasard sur l’ensemble des fruits récoltés sur les six arbres. Les graines ont été extraites manuellement et comptées par capsule individuelle et par groupe. Elles ont été ensuite mélangées afin de prélever un échantillon représentatif de 100 graines à l’état frais pour les mesures de dimension et de poids. La longueur et la largeur ont été mesurées à l’aide d’un pied à coulisse (modèle : Sunrise ; 15 cm de long, précision de ± 0,1 mm) et le poids a été évalué en utilisant une balance électronique (modèle : GR-202-EC, A&D Instruments LTD ; Max. 210 g, Min. 1 mg).
2.2. Influence de la dessiccation sur la capacité germinative des graines
9Pour cette expérimentation, environ 200 capsules mûres ont été utilisées. Après extraction, les graines ont été étalées dans une salle ventilée (à environ 25-27 °C) de l’Unité de Semences Forestières et Herbier (USFH) de Sikasso. L’étude s’est déroulée pendant les mois de mai à aout 2008. Durant cette période, les températures journalières variaient entre 21 et 35 °C et l’humidité relative de l’air était supérieure ou égale à 60 %. Des échantillons de graines ont été régulièrement et aléatoirement prélevés du lot des semences étalées pour suivre l’évolution de leur capacité germinative au cours du sèchage et selon la réduction de leurs teneurs en eau. Pour ce faire, des tests de germination accompagnés de la détermination de la teneur en eau des graines ont été effectués au jour 0 (semences non séchées), et après 2, 4, 7, 14 et 28 jours de sèchage suivant la méthode décrite par Pritchard et al. (2004).
10Les graines ont été semées dans des germoirs confectionnés localement en bois avec couvercle (dimensions : 50 cm de longueur, 30 cm de largeur et 15 cm de haut) et remplis pour accommoder la grosseur des graines de sable fin de fleuve stérilisé (étuvage 1 h à une température de 130 °C). À chaque date de semis, trois répétitions de 20 graines réparties dans trois germoirs ont été semées dans le sable et recouvertes d’environ 1 cm de sable. Les relevés de germination ont été effectués tous les deux jours jusqu’à la fin de l’essai prédéfinie à 60 jours, le temps nécessaire pour que toutes les graines viables puissent germer. Les semis étaient arrosés à l’eau du robinet quand cela était nécessaire. Une graine est comptée normalement germée quand la pousse de la gemmule émerge au-dessus du sable avec déjà la protrusion radiculaire dans le sable (Agyili et al., 2007 ; ISTA, 2009). Les résultats des graines normalement germées sont exprimés en pourcentage moyen des trois répétitions.
11La teneur en eau (TE) a été déterminée en utilisant un échantillon global de 30 graines qui ont été pesées en six séries de cinq graines chacune (Krishnapillay et al., 1994). Les graines de chaque série ont été pesées pour déterminer le poids frais (Pf) initial. Les graines ont ensuite été fragmentées en petits morceaux de moins de 7 mm, puis séchées à l’étuve à la température fixée à 103 ± 2 °C pour une durée de 17 ± 1 h (ISTA, 2009) afin d’estimer le poids sec (Ps). La TE du lot, rapportée à la moyenne des six répétitions, a été calculée en rapport au poids frais selon la formule (Willan, 1992 ; ISTA, 2009) : TE = 100 x (Pf - Ps)/Pf.
2.3. Influence du milieu et de la durée de conservation sur la viabilité des graines
12Les caractéristiques de germination de deux lots de semences de C. procera conçus sur la base de la grosseur des graines ont été étudiées en fonction des conditions et de la durée de conservation. Le lot I est constitué de graines dont la grosseur est supérieure à 2 cm et le lot II de celles dont la grosseur est inférieure à 2 cm. Les deux conteneurs de milieux de conservation adoptés (tonnelets en plastique et sacs en polyéthylène) ont été remplis de sciure fine et de copeaux de bois, préalablement séchés au soleil. À partir des facteurs à contrôler, huit traitements ont été adoptés :
13– T1, grosses graines conservées dans un tonnelet en plastique contenant de la sciure fine ;
14– T2, grosses graines conservées dans un tonnelet en plastique contenant des copeaux de bois ;
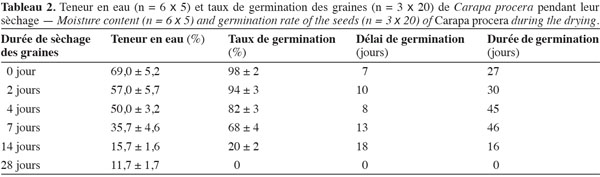
15– T3, grosses graines conservées dans un sac en polyéthylène contenant de la sciure fine ;
16– T4, grosses graines conservées dans un sac en polyéthylène contenant des copeaux de bois ;
17– T5, petites graines conservées dans un tonnelet en plastique contenant de la sciure fine ;
18– T6, petites graines conservées dans un tonnelet en plastique contenant des copeaux de bois ;
19– T7, petites graines conservées dans un sac en polyéthylène contenant de la sciure fine ;
20– T8, petites graines conservées dans un sac en polyéthylène contenant des copeaux de bois.
21L’étude s’est déroulée au cours des deuxième et troisième trimestres 2008 à l’USFH de Sikasso. Les taux de germination et les teneurs en eau des graines ont été évalués à 15, 30, 60 et 90 jours de conservation. La TE a été déterminée suivant la méthode décrite dans l’expérimentation précédente, tandis que la germination a été suivie et évaluée avec 60 graines réparties en trois répétitions de 20 graines chacune, comme précédemment décrit.
2.4. Influence du substrat de semis et de la qualité de la graine sur la germination et la croissance des plants en pépinière
22Cette étude a été menée en 2009 dans la pépinière du Programme Recherche Forestière (PRF) à Sikasso au Mali. La température journalière et la photopériode variaient entre 23 et 30 °C pendant 10 h et la nuit entre 20 et 25 °C. Les graines fraichement récoltées ont été réparties en trois lots : graines entières (lot témoin), graines décortiquées (amande extraite de la coque) et graines sectionnées (élimination de la moitié inférieure de la graine). L’extraction des coques et/ou d’une partie de la graine sont des prétraitements qui visent une accélération de la germination. Ces trois groupes de graines ont été semés sur deux types de substrats, choisis sur la base des types de sols rencontrés sur les sites de récolte des fruits. L’un était composé d’un mélange de deux tiers de terre argileuse plus un tiers de terre limoneuse prélevée sous les arbres en forêt donnant un mélange argilo-limoneux (substrat I), et l’autre de deux tiers de terre limoneuse plus un tiers de sable correspondant à un mélange limono-sableux (substrat II). La combinaison des trois groupes de graines et des deux types de substrats a permis d’adopter les six modes de production (MP) suivants :
23– MP1, graines entières semées sur le substrat I ;
24– MP2, graines entières semées sur le substrat II ;
25– MP3, graines décortiquées (amandes) semées sur le substrat I ;
26– MP4, graines décortiquées (amandes) semées sur le substrat II ;
27– MP5, graines sectionnées semées sur le substrat I ;
28– MP6, graines sectionnées semées sur le substrat II.
29Des pots en plastique avec des dimensions de 27 cm de haut sur 14 cm de diamètre ont été remplis des substrats préparés pour le semis. Ces pots ont été disposés expérimentalement en trois blocs complets aléatoires. Dans chaque bloc, 15 pots de chaque mode de production ont été installés sur une même ligne et une graine a été semée par pot. Durant l’expérimentation, l’arrosage a été effectué matin et soir. Les variables observées ont été le taux de germination des graines, la hauteur et le diamètre au collet des plants à 3 mois après le semis.
2.5. Traitement et analyse des données collectées
30À partir des données collectées, des statistiques descriptives ont été exécutées et des courbes ont été dressées pour illustrer l’évolution de la teneur en eau et les pourcentages de germination des graines et aussi, la croissance des plants en pépinière. Les données ont été analysées à partir des logiciels SPSS (version 12.0) et MINITAB (version 14). Les valeurs exprimées en pourcentage (taux de germination et teneur en eau) ont subi une transformation angulaire (Dagnelie, 19801 in Brhadda et al., 2000 ; Jaouadi et al., 2010) en vue de faire les analyses de variance et les comparaisons de moyennes afin de vérifier les effets des différents facteurs étudiés.
3. Résultats
3.1. Caractéristiques des fruits et graines
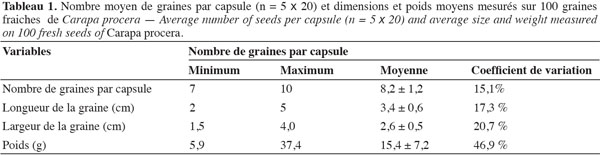
31Les fruits de C. procera sont de grosses capsules anguleuses qui sont fixées sur un long rameau fructifère (Figure 1a). Ces capsules sont de couleur verdâtre à l’état immature, mais elles prennent une coloration brune à maturité. Les graines extraites des capsules mûres sont de forme trigone et de couleur marron (Figure 1b). À partir des 100 capsules (5 échantillons de 20 capsules chacun) choisies au hasard après la récolte, 822 graines ont été extraites, donnant ainsi de 7 à 10 graines par capsule (Tableau 1). Toutes les graines extraites des capsules étaient de bonne qualité (bien formées et saines). En éclatant, les fruits de C. procera s’ouvrent en 4, 5 et/ou 6 valves et, suivant la grosseur et l’état de développement du fruit, on peut dénombrer 1 à 4 graines par valve (Figures 2a et 2b). Au stade de pleine maturité, les capsules éclatent et les graines qui en sortent présentent des exfoliations sur leurs coques (Figures 1b et 2a), ce qui signifie une amorce de leur dessiccation.


32On observe dans le tableau 1 que les graines de C. procera ont des caractéristiques physiques très variables. En moyenne, les grosses graines sont deux fois plus volumineuses que les petites graines. Les données moyennes enregistrées indiquent que les graines ont une longueur de 3,4 cm, une largeur de 2,6 cm et un poids individuel de 15,4 g, soit 15 400 g comme poids de 1 000 graines. On constate à partir des valeurs minimales et maximales que les dimensions des graines sont très hétérogènes et comme l’indiquent les coefficients de variation, cette hétérogénéité est surtout remarquable au niveau du poids avec moins de 6 g pour les plus petites graines et plus de 37 g pour les grosses.
3.2. Caractéristiques germinatives des graines au cours du sèchage
33Après extraction des capsules, les graines de C. procera fraichement préparées ont leur TE initiale très élevée. Cette teneur en eau reste supérieure ou égale à 50 %, même après quatre jours de sèchage en salle (Tableau 2). Par contre, une semaine après leur étalage dans la salle ventilée, les graines perdent environ la moitié de leur contenu hydrique. Au terme des deux premières semaines de sèchage, la TE des graines est réduite considérablement et présente des valeurs inférieures à 20 %. Les données enregistrées révèlent que lorsque les graines de C. procera ont une TE supérieure ou égale à 50 %, leur germination demeure très élevée (≥ 80 %). Le délai de germination (temps entre la date de semis et la date de la première germination) est d’une semaine pour les graines fraichement récoltées et il augmente jusqu’à deux semaines lorsque les TE sont inférieures à 35 %. De même, la durée totale de germination (temps qui sépare la date de la première germination et celle de la fin de la germination) suit le stade de dessiccation des graines. Avec des TE élevées, la durée de germination des graines de C. procera s’étale sur 4 à 6 semaines. Toutefois, quand la TE des graines diminue fortement (< 20 %), la durée de germination devient courte suite au pourrissement de la majorité (90 %) des graines après le semis (Tableau 2).
3.3. Influences des conditions de conservation sur les qualités germinatives des graines
34Avant la conservation, le tableau 3 indique que, toutes tailles confondues, les lots de graines utilisées avaient initialement en moyenne 42,8 % de TE et 85 % de taux de germination. Au départ de la conservation (0 jour), les grosses graines avaient initialement un taux de germination un peu plus élevé (90 %) que les petites graines (80 %). L’examen des figures 3 et 4 montre que, quelles que soient les conditions de conservation, la TE et le taux de germination décroissent progressivement au cours des 90 jours d’expérimentation. Après un mois de conservation, les graines gardées dans les tonnelets ont perdu moins d’eau que celles gardées dans les sacs en polyéthylène. Cette différence significative (P > 0,05) se répercute sur les taux de germination qui sont compris entre 30 et 50 % pour les graines conservées dans les tonnelets, alors qu’au niveau des sacs en polyéthylène, moins de 30 % de graines ont germé. Au même titre que le conteneur, la nature de la sciure influence aussi les caractéristiques des graines pendant la conservation. L’analyse combinatoire des paramètres conteneur et contenu montre un effet positif de meilleure conservation avec les interactions copeaux de bois et petites graines où 33 % de ces graines maintiennent leur viabilité (Figure 4) et la TE à 23,5 % après 90 jours de conservation dans le tonnelet (Figure 3). Les copeaux de bois (sciure grossière) semblent mieux conserver les graines que la sciure fine. Il a été observé au moment du déballage des graines conservées que la sciure fine contenue dans les conteneurs (tonnelet et sac) était devenue très humide. Ces observations ont montré aussi que sous l’effet de la chaleur et de la forte humidité dans les sacs et tonnelets contenant de la sciure fine, les graines conservées étaient en état de putréfaction dès le deuxième mois.
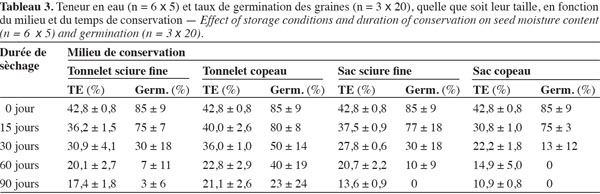
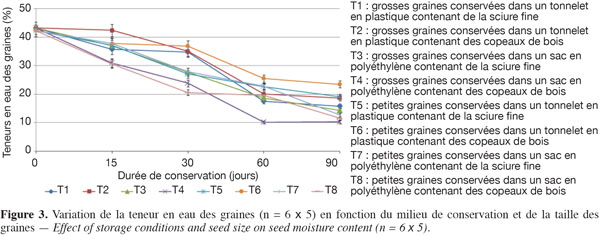
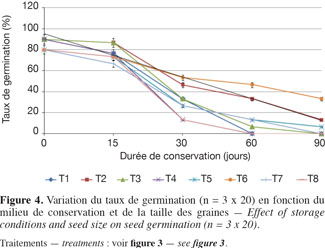
35Les figures 3 et 4 illustrent l’évolution de la TE et du taux de germination des graines au cours de leur conservation suivant les différents traitements adoptés. Après un mois de conservation, les traitements T6, T2 et T1 induisent des teneurs en eau supérieures à 30 %. Par contre, les graines des traitements T4 et T8 ont radicalement baissé leurs teneurs en eau et cela a durement affecté leur viabilité avec moins de 15 % de taux de germination. Les données du tableau 3 montrent que la teneur en eau préjudiciable à la survie des graines de C. procera se situe entre 20 et 15 %. Dans cette fourchette, les graines de l’espèce perdent totalement leur pouvoir germinatif.
36En se déshydratant, les coques des graines de C. procera se désagrègent et exposent les amandes. Il ressort de cette étude que sous l’influence de certaines conditions de conservation, les amandes oléagineuses de C. procera s’entourent de moisissures. Ce phénomène était observable au niveau des graines conservées dans les sacs en polyéthylène contenant de la sciure fine. Ce milieu peu poreux semblait accentuer la perte d’eau des graines fraiches de C. procera pendant leur conservation.
3.4. Influence de la qualité du substrat et le prétraitement des graines sur la germination et la croissance des plants en pépinière
37Les relevés de germination en fonction des substrats et du prétraitement des graines, sur sable, étaient facilités à cause de la germination hypogée des graines de C. procera (Figure 2c). Les taux de germination enregistrés en pépinière sont très élevés et se situent entre 80 et 89 % pour les graines entières et entre 62 et 78 % pour les graines sectionnées. Par contre, la germination est intermédiaire pour les graines décortiquées (Tableau 4). Ces deux derniers prétraitements n’améliorent donc pas la germination de ces graines. Par contre, ils raccourcissent le délai de germination respectivement à 13 et 15 jours par rapport à celui observé pour les graines entières (trois à quatre semaines). Quant à la durée de la germination, elle est de deux à quatre semaines en moyenne, avec une variation selon le type de substrat. Quoique le substrat limono-sableux ait réduit spécifiquement d’une semaine la durée de germination, il a cependant négativement influencé la germination des graines. En plus du taux de germination le plus élevé et en rapport aux variables mesurées (hauteur et diamètre au collet), les plants issus du mode de production MP1 (graines entières semées sur le substrat I) ont eu la plus forte croissance (53 cm de hauteur et 0,7 cm de diamètre au collet) à trois mois après le semis. Contrairement à ces plants, ceux issus du MP6 (graines sectionnées et semées sur le substrat II) ont un développement assez faible en hauteur et en diamètre au collet avec respectivement des moyennes de 28,0 et 0,3 cm pour la même durée de séjour à la pépinière. Les plants issus du MP1 font presque le double de ceux du traitement MP6 en hauteur et en diamètre, respectivement 53,3 et 0,7 cm.
4. Discussion
38Les capsules de C. procera récoltées dans la forêt de Farako sont très variables en forme et en taille. Le choix de six arbres-mères distants d’au moins 100 m les uns des autres, avec un bon état végétatif et une bonne répartition sur environ 1 km dans la forêt de Farako pour récolter les graines, a été fait pour non seulement capturer une bonne variabilité génétique de l’espèce à travers les graines récoltées, mais aussi pour masquer la variabilité génétique entre les arbres. En effet, sur le même arbre ou d’un arbre à un autre, on a pu récolter des capsules mûres avec 4 à 6 valves qui ensuite ont été mélangées pour constituer des lots. Or, cette caractéristique des capsules liée au nombre de valves pose un problème d’identification de l’espèce si on se réfère aux descriptions antérieures (Pennington et al., 19812 in Fisch et al., 1995). En effet, suite à la révision de la description botanique du genre Carapa, ces auteurs ont indiqué qu’à la maturité, les capsules de Carapa guianensis s’ouvrent en 4 valves, alors que celles de C. procera comportent 5 valves et seule cette dernière espèce serait présente en Afrique de l’Ouest. Par contre, une récente étude menée sur l’huile des espèces de Carapa en Afrique de l’Ouest (Weber et al., 2010) mentionne la présence de trois espèces (C. procera, Carapa microcarpa, Carapa velutina). Toutefois, en se référant aux bases de données des Royal Botanic Gardens à Kew (The Plant List, 2010 ; IPNI, 2011), les deux dernières espèces mentionnées par Weber et al. (2010) sont toujours considérées comme des synonymes de C. procera.
39Des observations phénologiques menées sur les sites de récolte des fruits ont montré que C. procera fleurit de janvier à mars et que les fruits murissent pendant la période allant d’avril jusqu’à la fin du mois de juin (Sanogo et al., 2006). Malgré la coïncidence de la dissémination des graines de C. procera avec le début de la saison des pluies, la régénération naturelle de l’espèce est très rare dans la zone de l’étude. Les observations menées sur les sites de récolte des fruits ont montré que l’état du sol (croute dure superficielle et sol dénudé) et l’irrégularité des pluies au début de la saison des pluies ne favorisent pas la germination des graines disséminées de C. procera.
40Le nombre moyen de 8 à 9 graines par capsule qui a été enregistré ici est largement en-deçà de certaines descriptions antérieures qui mentionnent une moyenne de 12 à 18 graines par capsule (Parkan, 1973 ; Berhaut, 1979). En revanche, les données de la présente étude sont comparables à la moyenne de 11 ± 4 graines par capsule obtenue par l’étude menée en Guyane française dans la zone tropicale humide d’Amérique du Sud (Forget et al., 2007).
41La variabilité de la taille des graines (Tableau 1) proviendrait des capsules qui sont de taille petite à grande sur un même arbre ou d’un arbre à un autre. Toutefois, des études plus ciblées sur le processus de développement des capsules de C. procera permettront de savoir si cette variabilité en forme et en taille est en rapport avec l’âge de l’arbre, la position du fruit sur le rameau fructifère et/ou les conditions du milieu (type de sol, position de l’arbre sur la berge). Déjà, il a été démontré qu’il est important de considérer les arbres-mères avec un bon génotype au stade de sélection, car comme chez Sorbus torminalis, un arbre iranien, il y a un effet significatif et positif de l’âge de l’arbre (diamètre à hauteur de poitrine) sur le taux de germination, la survie et le développement des plantules issues de ses graines (Espahbodi et al., 2007 ; Saravi et al., 2008).
42L’évaluation des caractéristiques germinatives des graines fraichement récoltées de C. procera a mis en évidence une viabilité initiale très forte (≥ 90 %). À l’image des résultats obtenus par Connor et al. (1998), cette forte viabilité est acquise avec des graines dont la TE est supérieure ou égale à 50 %.
43Le suivi du comportement des graines après leur extraction des capsules a démontré que ces dernières sont très sensibles au sèchage (Tableaux 2 et 3). La baisse de la teneur en eau des graines suite au sèchage occasionne simultanément une perte de la capacité germinative. Dès lors, on peut déduire de cette étude que les graines de C. procera sont récalcitrantes (ne supportent pas le sèchage). C’est pourquoi, la réduction de la teneur en eau à un niveau relativement faible (< 20 %) occasionne la perte de la viabilité (Tableau 2). Ce niveau de déshydratation que les graines de C. procera ne supportent pas est atteint seulement après deux semaines de sèchage à l’air libre après leur extraction. Compte tenu de cette sensibilité des graines de l’espèce au sèchage, des conditions appropriées doivent être réunies pour maintenir leur teneur en eau au-dessus de 35 % afin d’assurer leur survie. Il ressort de cette étude que les graines de C. procera ont un comportement similaire à celles de Garcinia kola dont les graines perdent leur capacité germinative dès que leur teneur en eau devient inférieure à 30 % (Agyili et al., 2007).
44L’étude sur les caractéristiques germinatives des lots de semences de C. procera a montré que la baisse du taux de germination est relativement progressive durant le stockage, quelles que soient les conditions de conservation et la taille des graines. Toutefois, à l’issue de l’étude, 33 % des graines conservées dans des tonnelets en plastique qui contenaient des copeaux de bois sont restées viables après trois mois de conservation (Figure 4). Ces semences sont restées viables suite au maintien de leur TE au-delà de 30 % pendant un mois, ce qui concorde avec les résultats des essais antérieurs (Sanogo et al., 2009). Pour la conservation des graines de C. procera, les copeaux de bois semblent le milieu le plus approprié pour maintenir la capacité germinative, contrairement à la sciure fine qui est à déconseiller. L’inadaptation de la sciure fine est due certainement à sa forte capacité de rétention d’humidité provenant des graines fraiches stockées et du taux élevé d’humidité relative de l’air (> 60 %) observé au moment des expérimentations.
45À la pépinière, un temps de production de trois mois est suffisant pour obtenir des plants de C. procera qui seront aptes à la transplantation au champ. Pour tous les traitements confondus, une hauteur moyenne de 40 cm a été obtenue à partir des plants élevés dans les pots (sachets en polyéthylène) en trois mois. Le meilleur substrat pour la production des plants de C. procera est celui constitué de deux tiers (2/3) de terre argileuse mélangé à un tiers (1/3) de terre limoneuse prélevée sous les arbres dans la forêt. Avec ce type de substrat, à structure argilo-limoneuse, les plantules accroissent de plus de 50 cm de hauteur à la pépinière après seulement une durée de production de trois mois.
46L’extraction de la coque et l’élimination de la moitié inférieure de la graine comme techniques de prétraitement n’ont amélioré ni le taux ni le délai de germination (Tableau 4). Cela, contrairement aux graines comme celles de Garcinia kola pour lesquelles la germination est importante et plus rapide avec le prétraitement de fragmentation de la graine (Asomaning et al., 2011). Au regard des résultats obtenus, il est préférable d’utiliser toujours des graines entières à l’état frais pour la production de plants de C. procera.
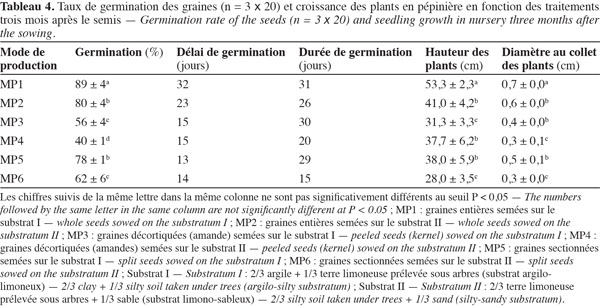
47De cette étude, il ressort que les graines de C. procera n’ont pas besoin de prétraitement avant le semis. Les graines de l’espèce ne germent plus dès que leur teneur en eau (rapportée au poids frais) devient faible (< 20 %), ce qui concorde avec les données bibliographiques qui situent la TE critique ou létale des graines de C. procera aux environs de 15 % (King et al., 19793 in Faria, 2006). Les graines de C. procera sont donc récalcitrantes, d’où la prise en compte de dispositions nécessaires pour assurer leur distribution immédiate aux utilisateurs ou leur stockage durant une très courte période (un maximum de 3 mois).
48Remerciements
49Nous remercions le Millennium Seed Bank (MSB) partnership des Royal Botanic Gardens, Kew pour le financement de cette étude et l’équipe de l’USFH de Sikasso pour l’assistance technique pendant la récolte de graines et la collecte des données.
Bibliographie
Agyili J., Sacande M., Koffi E. & Peprah T., 2007. Improving the collection and germination of West African Garcinia kola Heckel seeds. New Forests, 34, 269-279.
Asomaning J.M., Olympio N.S. & Sacande M., 2011. Desiccation sensitivity and germination of recalcitrant Garcinia kola Heckel Seeds. Res. J. Seed Sci., 4, 15-27.
Bah M.S., 1993. The importance of traditional veterinary medicine (TVM) in animal health programmes. In: Lawrence P.R., Lawrence K., Dijkman J.T. & Starkey P.H., eds. Research for development of animal traction in West Africa. Proceedings of the 4th workshop of West Africa Animal Traction Network, 9-13 July 1990, Kano, Nigeria. Addis Ababa, Ethiopia: ILCA, 33-36.
Berhaut J., 1979. Flore illustrée du Sénégal. Vol. 6. Dakar : Ministère du Développement Rural et de l’Hydraulique, Direction des Eaux et Forêts.
Brhadda N., Walali Loudyi M.D.E., Abousalim A. & Benali D., 2000. Effet de la température et de l’endosperme sur la dormance et la germination des embryons d’olivier Olea europaea L. variété Picholine marocaine. Agronomie, 20, 643-653.
Connor K.F., Kossmann Ferraz I.D., Bonner F.T. & Vozzo J.A., 1998. Effects of desiccation on the recalcitrant seeds of Carapa guianensis Aubl. and Carapa procera DC. Seed Technol., 20, 71-82.
Doligez A. & Joly H., 1997. Genetic diversity and spatial structure within a natural stand of a tropical forest tree species, Carapa procera (Meliaceae), in French Guiana. Heredity, 79, 72-82.
Espahbodi K. et al., 2007. Tree age effects on seed germination in Sorbus torminalis. Gen. Appl. Plant Physiol., 33, 107-119.
Eyog-Matig O., NDoye O., Kengue J. & Awono A., 2006. Les fruitiers forestiers comestibles du Cameroun. Cotonou : International Plant Genetic Resources Institute, IPGRI Regional Office for West and Central Africa, http://www.bioversityinternational.org/fileadmin/bioversity/publications/pdfs/1138_Les_fruitiers_forestiers_comestibles_du_Cameroun.pdf?cache=1333398266, (30/04/2013).
Faria J.M.R., 2006. Desiccation tolerance and sensitivity in Medicago truncatula and Inga vera seeds. Phd thesis: Wageningen University (The Netherlands).
Fisch S.T.V., Ferraz I.D.K. & Rodrigues W.A., 1995. Distinguishing Carapa guianensis Aubl. from Carapa procera DC. (Meliaceae) by morphology of young seedlings. Acta Amazonica, 25, 193-200.
Forget P.M., Mercier F. & Collinet F., 1999. Spatial patterns of two rodent-dispersed rain forest trees Carapa procera (Meliaceae) and Vouacapoua americana (Ceasalpiniaceae) at Paracou, French Guiana. J. Trop. Ecol., 15, 301-313.
Forget P.M. & Jansen P.A., 2007. Hunting increases dispersal limitation in the tree Carapa procera, a non timber forest product. Conserv. Biol., 21, 106-113.
GRASE, 1999. Rapport d’enquête sur les espèces forestières en voie de disparition et identification des peuplements de Raphia sudanica, Elaeis guineensis et Anthocleista kerstingii dans les cercles de Sikasso, Kadiolo, Koutiala et Yorosso. Étude commanditée et financée par l’Appui à la Recherche Forestière Participative de Sikasso, Mali.
Guèye M., Kenfack D. & Forget P.-M., 2010. Importance socioculturelle, potentialités économiques et thérapeutiques du Carapa (Meliaceae) au Sénégal. In : van der Burgt X., van der Maesen J. & Onana J.M., eds. Systématique et conservation des plantes africaines. Kew, UK : Royal Botanical Gardens, 359-367.
Guillemot N., 2004. Le Carapa, un arbre tropical aux intérêts écologiques et économiques prometteurs. Rapport de stage. Paris-Grignon : INRA, http://www.carapa.org/data/File/pdf/Rapport de stage Nicolas Guillemot.pdf, (20/12/2010).
Helvetas Burkina Faso, 2006. Programme de promotion du coton biologique au Burkina Faso. Rapport annuel 2005. Ouagadougou, http://www3.helvetas.ch/global/pdf/topic/biobaumwolle/05_Rapport_Annuel_BF_FR.pdf, (23/4/2013).
IPNI (International Plant Names Index), 2011. The International Plant Names Index, http://www.ipni.org, (22/04/13).
ISTA, 2009. Règles internationales pour les essais de semences. Bassersdorf, Suisse : Association internationale d’essais de semences (AIES).
Jaouadi W., Hamrouni L., Souayeh N. & Khouja M.L., 2010. Étude de la germination des graines d’Acacia tortilis sous différentes contraintes abiotiques. Biotechnol. Agron. Soc. Environ., 14, 643-652.
Kouyaté A.M. et al., 2007. Évaluation de la fertilité des sols à Detarium microcarpum Guill. & Perr. Tropicultura, 25, 65-69.
Krishnapillay B. & Marzalina M., 1994. Méthode statistique de détermination de la taille d’échantillon pour la mesure de la teneur en humidité des graines récalcitrantes d’arbres forestiers (Étude de cas sur Shorea leprosula et Shorea parvifolia). Informations sur les Ressources Génétiques Forestières, 21. Rome : FAO.
Parkan J., 1973. Dendrologie forestière (I et II). Projet PNUD/UNESCO-Mali-64/504. Unesco ; Mali : Institut Polytechnique Rural de Katibougou.
The Plant List, 2010. Version 1, http://www.theplantlist.org/, (01/01/2010).
Pritchard H.W., Wood C.B., Hodges S. & Vautier H.J., 2004. 100-seed test for desiccation tolerance and germination: a case study on eight tropical palm species. Seed Sci. Technol., 32, 393-403.
Sanogo S., Sanogo A.K. & Yossi H., 2006. Collecte et conservation durable des graines et d’échantillons de plantes. Rapport de recherche de la campagne 2005/2006. Bamako : 12e session de la Commission Scientifique de l’Institut d’Économie Rurale (IER).
Sanogo S. & Sacandé M., 2007. Carapa procera DC. Seed Leaflet n°136. Horsholm, Denmark: Forest & Landscape Denmark.
Sanogo S., Sanogo A.K. & Yossi H., 2009. Collecte et conservation durable des graines et d’échantillons de plantes. Rapport de recherche de la campagne 2008/2009. Bamako : 15e session de la Commission Scientifique de l’Institut d’Économie Rurale (IER).
Sanogo Y. & Favreau L., 2007. Commerce équitable et développement durable : la filière coton au Mali. Série Recherches n°4. Université du Québec Outaouais ; Centre Canadien d’Étude et de Coopération Internationale (CECI).
Saravi A.T. et al., 2008. Phenotypic correlation between selected characters of parent trees and progenies in wild service tree (Sorbus torminalis L. Crantz.). Asian J. Plant Sci., 7(6), 579-583.
Schneider P., 1996. Sauvegarde et aménagement de la forêt classée de Farako (Région de Sikasso, Mali-Sud) avec la participation et au profit des populations riveraines. Thèse : École Polytechnique Fédérale de Zurich (Suisse).
Weber N. et al., 2010. L’huile de Carapa (Carapa spp., Meliaceae) en Afrique de l’Ouest : utilisations et implications dans la conservation des peuplements naturels. Fruits, 65, 343-354.
Willan R.L., 1992. Guide de manipulation des semences forestières (dans le cas particulier des régions tropicales). Étude FAO Forêts, 20/2. Rome : FAO.
Yossi H. et al., 2006. Les haies vives au Sahel. État des connaissances et recommandations pour la recherche et le développement. Occasional Paper no. 6. Nairobi : World Agroforestry Centre (ICRAF).
Notes
Pour citer cet article
A propos de : Sidi Sanogo
Institut d’Économie Rurale (IER). Rue Mohamed V. BP 258. Bamako (Mali). E-mail : sanogohot@hotmail.com – Ghent University. Laboratory for tropical and subtropical Agriculture and Ethnobotany. Coupure Links 653. B-9000 Ghent (Belgium).
A propos de : Moctar Sacandé
Seed Conservation Department. Royal Botanical Gardens Kew. Wakehurst Place. Ardingly. West Sussex. RH17 6TN (United Kingdom).
A propos de : Patrick Van Damme
Ghent University. Laboratory for tropical and subtropical Agriculture and Ethnobotany. Coupure Links 653. B-9000 Ghent (Belgium) – Czech University of Life Sciences Prague. Faculty of tropical AgriSciences. Kamycka 129. Prague 6 - Suchdol, 165 21 (Czech Republic).
A propos de : Ibrahima NDiaye
Institut d’Économie Rurale (IER). Rue Mohamed V. BP 258. Bamako (Mali).






