- Startpagina tijdschrift
- volume 16 (2012)
- numéro 4
- Structure spatiale des arbres des savanes boisées et forêts claires soudaniennes : implication pour les enrichissements forestiers
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Structure spatiale des arbres des savanes boisées et forêts claires soudaniennes : implication pour les enrichissements forestiers

Nota's van de redactie
Reçu le 11 septembre 2011, accepté le 27 mars 2012
Résumé
L’aménagement forestier des savanes boisées et forêts claires en zone soudanienne au Bénin a eu recours, ces dernières années, à l’enrichissement en essences locales de valeur. Cependant, aucune étude préalable n’a été menée pour déterminer l’environnement local de chaque arbre, l’habileté des arbres à croître ou encore leur probabilité de survie dans un complexe forestier. Cette étude a utilisé la fonction de second ordre K de Ripley pour analyser la répartition spatiale des arbres, des grosseurs d’arbres et des essences dominantes de valeur. Les données ont été collectées sur quatre sites de dimensions variables (150 x 100 m, 150 x 100 m, 100 x 50 m et 150 x 150 m). Il ressort de l’analyse des résultats que la plupart des essences étudiées présentent une répartition spatiale en de petits agrégats au sein desquels on observe des répulsions intraspécifiques de l’ordre de 3 m et des répulsions interspécifiques de l’ordre de 4,5 m. Par ailleurs, seule une faible répulsion est observée entre classes de grosseur et suggère que la proximité des pieds adultes n’affecte pas la survie des jeunes plants. Tenant compte des comportements de répulsion, on pourrait suggérer un écartement intraspécifique minimum de 3 m et un écartement interspécifique minimum de 4,5 m dans les processus d’enrichissement des savanes boisées et forêts claires en zone soudanienne. Toutefois, les espacements suggérés peuvent ne pas être optimaux du point de vue de la croissance des espèces. Des travaux supplémentaires permettraient d’éclaircir ce point.
Abstract
Spatial distributions and interactions of trees in Sudanian woodlands: implications for forest enrichment. During the last decade, management of woodlands in the Sudanian region of Benin has been based on enrichment with valuable tree-species. Yet, no previous research has been undertaken to support enrichment design with respect to plant eye view, tree growth magnitude or survival capacity under local forest environments. To fill in this gap, Ripley’s K function was used to assess the spatial pattern of trees, diameter classes and dominant valuable species in the Sudanian zone. Data were collected in four sites of variable size (150 x 100 m, 150 x 100 m, 100 x 50 m and 150 x 150 m). Mostly, the spatial patterns of the target species revealed small-clumps. Within these small-clumps, intraspecific repulsions were observed on average at a 3 m scale, while interspecific repulsions were noticed at a 4.5 m scale. Only a weak repulsion between diameter size was also remarked, suggesting that proximity to adult trees would not affect the survival of young plants. With regard to observed repulsion scales, we would suggest using a minimum of a 3 m space between trees of the same species and a 4.5 m space between trees of different species, for enrichment plantings in Sudanian woodlands, if based on the target species. However, this suggested spacing may not be optimal with regard to plant growth. Further investigation is needed to address this aspect.
Inhoudstafel
1. Introduction
1La gestion durable des écosystèmes forestiers constitue une préoccupation à l’échelle mondiale. Dans cette optique, l’aménagement forestier des savanes boisées et forêts claires de la zone soudanienne a eu recours, ces dernières années, à l’enrichissement avec des essences forestières de valeur. Les enrichissements ou plantations en forêt consistent à introduire par plantation, dans un milieu forestier plus ou moins transformé, des espèces commerciales qui constitueront, à terme, l’essentiel de la production ; un complément de production sera éventuellement apporté par les essences de valeur préexistantes ou apparues par régénération naturelle (Dupuy, 1992). Dans certains cas, l’objectif peut aller au-delà de la production et viser la restauration d’une forêt dégradée au moyen des essences les plus sujettes à l’exploitation, ou la réintroduction et la conservation d’espèces menacées de disparition, etc. Il est admis que l’aménagement et l’enrichissement des peuplements forestiers requièrent une meilleure compréhension de l’hétérogénéité et de la structure spatiale de ces peuplements (Boyden et al., 2005). Par ailleurs, les travaux de Batista et al. (1998) ont montré que la compétition n’est pas la seule cause de mortalité : l’environnement spatial de l’arbre a également une influence considérable sur sa survie.
2En forêt naturelle, les processus écologiques engendrent des structurations spatiales qui peuvent être examinées au moyen de l’analyse statistique spatiale (Greig-Smith, 1979 ; Kikvidze et al., 2005 ; Stoll et al., 2005). Aussi, l’établissement, le développement et la composition des recrûs dans les écosystèmes naturels sont déterminés en grande partie par la structure spatiale des gros arbres et la variation des facteurs biophysiques (Duncan, 1991 ; Haase et al., 1996 ; Goreaud et al., 1999 ; Mast et al., 1999 ; Szwagrzyk et al., 2001). Cependant, aucune étude préalable aux aménagements n’a été menée pour déterminer l’environnement local des arbres dans les forêts claires et savanes boisées soudaniennes, l’habileté des arbres/espèces à croître et à se développer ou encore leur probabilité de survie dans ces massifs forestiers.
3Dans les milieux où l’eau constitue un facteur limitant comme en zone soudanienne, la compétition inter/intra spécifique entre les arbres pour l’accès à l’eau constitue une des hypothèses pouvant expliquer la structure spatiale des arbres (Walker et al., 1981 ; Eagleson et al., 1985). Théoriquement, cela peut conduire à une mortalité due à la densité chez les arbres à certains stades critiques de développement ou en relation avec les saisons sèches (Fowler, 1986). Vu l’influence de ce type de processus dynamique sur la structure spatiale des arbres, l’analyse spatiale des processus ponctuels est considérée comme une approche indirecte d’étude de la dynamique des végétations (Prentice et al., 1985 ; Skarpe, 1991 ; Couteron et al., 1997).
4Bien que les analyses des processus ponctuels univariés d’une seule marque (espèces/classe de grosseur d’arbre) ou bivariés entre différentes marques ne permettent pas d’identifier directement les facteurs qui sont à la base de la dynamique des peuplements, elles peuvent améliorer la compréhension de la compétition et de la relation spatiale entre différentes espèces et classes d’âge (Fajardo et al., 2006). De plus, de telles analyses peuvent être utilisées pour identifier des mécanismes sous-jacents et émettre des hypothèses (Legendre, 1993 ; Liebhold et al., 2002 ; Fajardo et al., 2006). Par exemple, une association spatiale positive entre deux espèces suggère leur complémentarité face aux exigences environnementales ou l’existence d’un lien de dépendance entre les deux espèces. Par contre, une association négative pourrait suggérer que l’une des espèces exclut l’autre (Dale, 1999) ou que les espèces sont différentes en termes d’utilisation des ressources, des mécanismes de dispersion et de germination ou des stratégies de reproduction (Bazzaz, 1990).
5Dans la zone soudanienne, la structure spatiale des espèces est souvent évaluée au moyen des indices de biodiversité, notamment l’indice de diversité de Shannon et de Simpson, ou encore l’équitabilité de Piélou (Fonton et al., 2004 ; Sokpon et al., 2006 ; Bognounou et al., 2009 ; Bonou et al., 2009). D’autres études ont également recours à l’indice de Blackman et à l’indice de Green (Glèlè Kakaï et al., 2009 ; Assogbadjo et al., 2010). Ces différents indices donnent une idée de la représentativité des différentes espèces au sein d’un peuplement ou de la structure spatiale globale d’un peuplement, mais ne peuvent pas informer sur le positionnement d’un arbre par rapport aux compétiteurs locaux. Ces aspects peuvent être analysés au moyen de la fonction K de Ripley (1977). Par ailleurs, la fonction de Ripley permet d’analyser la structure spatiale à différents intervalles de distance et de détecter des processus mixtes (par exemple, association à de faibles distances et répulsion à de grandes distances) (Fajardo et al., 2006).
6La présente étude a pour objectif d’analyser la structure spatiale des arbres/espèces en zone soudanienne avec les fonctions de Ripley. Ces fonctions permettent de tester deux types d’hypothèses nulles sur la nature et l’intensité de la distribution des arbres/espèces. La première repose sur l’analyse spatiale univariée et stipule qu’il n’existe aucune déviation par rapport à une distribution spatiale complètement aléatoire. La seconde, relative à l’analyse spatiale bivariée, part du principe que la distribution d’une marque (espèce, classe de grosseur d’arbres) est indépendante d’une autre marque (autre espèce, autre classe de grosseur) (Goreaud et al., 1999 ; Goreaud et al., 2003).
7Des paramètres statistiques dérivés des diverses fonctions sont utilisés pour tester des hypothèses relatives aux comportements des espèces entre elles et les grosseurs de pieds d’arbres. Il s’agit de :
81. en admettant que la ballochorie est le principal mode de dissémination dans les sites cibles, on suppose que la distribution des arbres est agrégative ;
92. en nous basant sur la théorie de Janzen qui stipule que la probabilité qu’un juvénile survive est positivement corrélée à la distance qui le sépare du pied mère (Janzen, 1970), on suppose que la distribution entre les classes de grosseur d’arbres est repulsive ;
103. de même, en supposant que les espèces dominantes soient différentes en termes d’utilisation des ressources, des mécanismes de dispersion et de germination ou des stratégies de reproduction (Bazzaz, 1990), on suppose que la distribution des sous-populations d’espèces dominantes est caractérisée par un processus répulsif.
2. Matériel et méthodes
2.1. Matériel
11La zone d’étude est composée de savanes boisées et de forêts claires du complexe forestier de Wari-Maro situé dans le district phytogéographique du Borgou sud (Adomou et al., 2006) et compris entre 1°55 et 2°25 longitude Est, 8°80 et 9°10 latitude Nord (Figure 1). Cette forêt fait partie du réseau des aires classées de la région des Monts Kouffé caractérisée par des peuplements à dominance Isoberlinia spp. (Fonton et al., 2004). Ces peuplements sont établis sur des sols ferralitiques et ferrugineux tropicaux reposant sur une roche mère de nature granito-gneissique (Agonyissa et al., 1998). Le climat est de type soudanien humide avec une saison pluvieuse et une saison sèche dont les durées sont presque égales. La pluviométrie moyenne annuelle calculée sur 30 ans, de 1980 à 2009, est de l’ordre de 1 152 mm. La température varie de 21 °C à 33 °C avec une valeur moyenne de 26,9 °C. D’après la classification phytogéographique de White (1983), la forêt de Wari-Maro se trouve dans le centre d’endémisme soudanien.
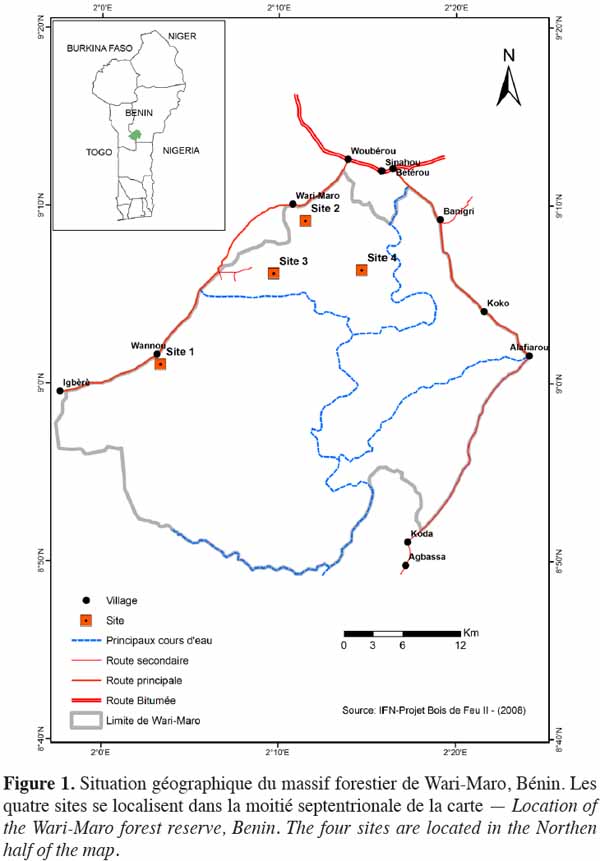
2.2. Unités d’observations et caractérisation écologique
12Quatre sites ont été identifiés après exploration de la carte d’occupation du sol (Figure 1) suivie des observations de terrain. Il s’agit du site de Wannou (site 1), du site de Wari-Maro Nord (site 2), du site de Wari-Maro sud (site 3) et du site de Sinahou (site 4). Sur chaque site, un placeau a été installé. La physionomie de ces placeaux est relativement homogène. Leurs dimensions sont de 150 m x 100 m (sites 1 et 2), 100 m x 50 m (site 3) et 150 m x 150 m (site 4). Ces dimensions sont conformes à celles recommandées par Fonton et al. (2011) pour les études d’analyse de la structure spatiale dans les écosystèmes soudaniens.
13Les mesures effectuées portent sur les arbres de diamètre (à 130 cm au-dessus du sol) supérieur ou égal à 5 cm. Il s’agit de leur localisation, du diamètre et de l’espèce. La caractérisation écologique de chaque site a été effectuée au moyen de la densité, de la surface terrière et des indices de diversité : richesse spécifique (S), indice de diversité de Shannon (H) et équitabilité de Piélou (EQ). La densité (N), toutes espèces confondues, est obtenue avec la formule :
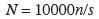
14n étant le nombre total d’arbres et s la surface (en m²) du placeau. La surface terrière (G, en m²·ha-1) est la somme de la section transversale à 130 cm au-dessus du sol de tous les arbres de diamètre supérieur à 5 cm, à l’intérieur du placeau. La richesse spécifique (S) est déterminée pour chaque site. Elle exprime le nombre total d’espèces ligneuses de diamètre supérieur à 5 cm dénombrées sur chaque placeau. L’indice de diversité de Shannon (H en bits) est obtenu par la formule :
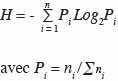
15où ni désigne le nombre d’individus d’une espèce i et la somme des ni, le nombre total d’individus sur le placeau. L’indice d’équitabilité de Piélou (EQ) est donné par la relation :
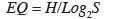
16où Log2S désigne la diversité maximale.
2.3. Modèle d’analyse spatiale
17L’hypothèse de base est que la distribution spatiale des arbres suit un processus homogène et isotrope (Goreaud et al., 1999) de densité dont la propriété de second ordre est caractérisée par une fonction K (r) telle que K (r) est l’espérance mathématique du nombre ni de voisins à une distance r d’un point quelconque du semis, soit :
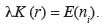
18Lorsque la distribution des semis de points suit une distribution de Poisson (hypothèse nulle),
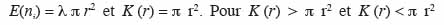
19le processus est respectivement agrégé et régulier. Pour caractériser le processus et connaissant r, il faut déterminer la valeur de K (r). Ainsi, par rapport à la définition de ce paramètre, on peut écrire, pour N semis de points sur une aire donnée de surface s (m²) et en fonction de r (en m) :
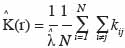
avec 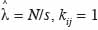
20si la distance entre les points i et j est inférieure à r et kij = 0 si non. Cette expression est biaisée pour les points situés en bordure de l’aire d’étude, d’une part, et se caractérise par une variance instable et une complexité d’interprétation, d’autre part. Dans le premier cas, on parle de l’effet de bordure. Deux méthodes sont principalement utilisées pour corriger l’effet de bordure. Il s’agit de la méthode de correction globale (Stoyan et al., 1995) et la méthode de correction locale (Ripley, 1981). La méthode de correction globale repose sur les propriétés géométriques du domaine d’étude et présente l’avantage d’être assez simple. La méthode de correction locale apparait plus robuste que la première (Kiêu et al., 1999) et repose sur la contribution de chaque point de semis situé près de la frontière. La méthode de correction locale de l’effet de bordure consiste en l’ajout d’un coefficient de pondération proportionnel au rapport entre le périmètre du cercle de rayon r autour du point et la partie de ce périmètre inclus dans le domaine d’étude, soit :
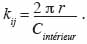
21Dans le second cas, pour stabiliser la variabilité de K (r), on a recours à la fonction modifiée L (r) de Besag (1977) qui linéarise la fonction K (r) dont l’estimateur s’écrit :
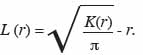
22
23Cette transformation a l’avantage de simplifier l’interprétation. En effet, celui-ci est de valeur attendue nulle pour n’importe quelle valeur de r quand l’hypothèse nulle est vraie. Pour tester la signification de la fonction L (r), 1 000 simulations de Monte Carlo ont été effectuées. Ces simulations repositionnent de manière aléatoire tous les arbres de la placette pour générer les estimations de L (r). En outre, ce processus est répété pour les r variant entre 1 et 25 m par pas de 1 m. Les limites de l’intervalle de confiance à 95 % correspondent alors aux percentiles 2,5 % et 97,5 %. L’ensemble de ces procédures a été exécuté grâce au logiciel ADE4. L’hypothèse nulle est rejetée lorsque la valeur de
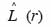
24se situe au-dessus de la limite de confiance supérieure ou en dessous de la limite inférieure et révèle respectivement une distribution agrégative ou une distribution régulière (Haase et al., 1996).
25Pour l’analyse de la répartition spatiale des classes de grosseur, trois classes de grosseur sont retenues, à savoir : les petits arbres de diamètre supérieur ou égal à 5 et inférieur à 10 cm, les arbres moyens de diamètre supérieur ou égal à 10 cm et inférieur à 35 cm et les gros arbres de diamètre supérieur ou égal à 35 cm. Les limites de 5 cm et 35 cm correspondent respectivement au diamètre des nouveaux recrûs et au diamètre minimum d’exploitabilité dans la zone d’étude.
26Pour étudier les interactions entre espèces, l’analyse a porté sur trois espèces dominantes identifiées par site. Le test de l’hypothèse nulle d’indépendance de la distribution entre classes de grosseur d’arbres, d’une part, et entre groupes d’espèces, d’autre part, est réalisé avec l’estimateur de l’intertype K12 (r) de Ripley dont la fonction modifiée est L12 (r) (Diggle, 1983). Elle s’écrit :
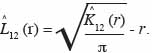
27Dans cette expression,
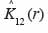
28est l’estimateur de K12 (r).
29La fonction
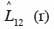
30quantifie le degré et le type d’association spatiale entre les classes de grosseur et entre les groupes d’espèces dominantes. Lorsque la valeur de
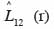
31est différente de zéro à une distance r, l’hypothèse d’indépendance des classes ou groupes d’espèces (marques) est rejetée. Comme précédemment, la signification statistique de cette différence est testée par simulations de Monte Carlo. Chaque simulation consiste à attribuer de façon aléatoire de nouvelles coordonnées aux points d’une marque tout en laissant inchangés ceux de l’autre marque (Goreaud et al., 2003). On parlera d’attraction ou de répulsion entre deux marques lorsque
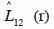
32est au-dessus ou en dessous de l’intervalle de confiance.
3. Résultats
3.1. Caractéristiques floristiques et dendrométriques des peuplements étudiés
33Les caractéristiques floristiques et dendrométriques des quatre sites étudiés sont présentées dans le tableau 1. La diversité des familles varie entre 14 et 23. La richesse spécifique varie entre 21 et 34. La diversité des familles et la richesse spécifique varient donc peu entre les quatre sites. Ce constat est le même pour les deux autres caractéristiques floristiques. En effet, l’indice de Shannon varie entre 2,50 et 3,03 bits et l’équitabilité de Piélou varie entre 0,50 et 0,64.
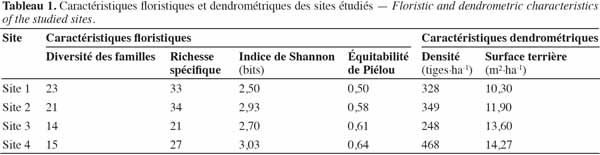
34En ce qui concerne les caractéristiques dendrométriques, la densité moyenne est de 348 tiges à l’hectare. Le site 4 se caractérise par le nombre le plus élevé de tiges à l’hectare, soit 468 tiges, tandis que le site 3 présente une densité plus faible, avec 248 tiges à l’hectare (Tableau 1). Le site 4 présente la plus grande surface terrière (14,3 m²·ha-1), tandis que la plus petite valeur a été observée au niveau du site 1 (10,3 m²·ha-1). Les trois espèces de valeur les plus abondantes sont, pour le site 1, Isoberlinia spp., Monotes kerstingii et Vitellaria paradoxa, avec une densité respective de 67, 65 et 35 tiges à l’hectare ; pour le site 2, Isoberlinia spp., Burkea africana et Lannea spp. avec une densité respective de 51, 67 et 11 tiges à l’hectare et pour le site 3, Isoberlinia spp., Anogeissus leiocarpa et V. paradoxa avec une densité de 38, 30 et 28 tiges à l’hectare, respectivement. Pour le site 4, seuls les pieds Isoberlinia spp. ont fait l’objet d’analyses en raison de leur très forte dominance avec 178 tiges à l’hectare.
3.2. Distribution spatiale des arbres par site
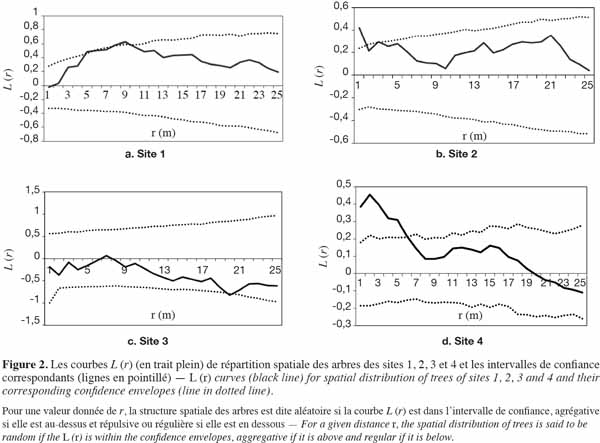
35Pour les sites 1 et 2, les analyses ont montré que les courbes L (r) restent en dehors de l’intervalle de confiance et sont au-dessus de la limite supérieure : ceci témoigne d’une hétérogénéité de la répartition spatiale des arbres à l’intérieur de chacun des deux sites. La densité locale est alors utilisée pour définir deux sous-unités homogènes par le tracé de la ligne de contour. Pour une densité moyenne de la zone d’étude de 350 arbres à l’hectare, la valeur de λ est de 0,035. On obtient alors deux zones de densité distinctes ; l’une de faible densité (λ < 0,035) et l’autre de densité relativement élevée (λ ≥ 0,035) et c’est sur cette dernière, dite zone dense, que les analyses sont effectuées.
36Comme le montre la figure 2a, la courbe L (r) de la zone dense du site 1 reste dans l’intervalle de confiance. Elle témoigne de l’homogénéité de la sous-unité considérée et du caractère aléatoire de la répartition des arbres. Il faut souligner qu’entre 5 et 10 m, la courbe sort légèrement ou se confond à la limite supérieure de l’intervalle de confiance : ceci pourrait sous-tendre la présence d’agrégats de tailles variant entre 5 et 10 m de rayon. Quant à la zone dense du site 2, on observe un pic d’agrégation à 1,5 m (Figure 2b) et la courbe ne revient dans l’intervalle de confiance qu’au-delà de 2 m : ceci traduit une attraction des individus dans un rayon de 2 m. Par contre, pour le site 3, la courbe L (r) demeure, quelle que soit la distance, dans l’intervalle de confiance et confirme l’homogénéité de la zone. Toutefois, on note une légère tendance à la régularité dans un rayon de 20 m (Figure 2c). Le site 4 présente une distribution agrégative jusqu’à 6 m et une tendance au regroupement assez marquée autour de 2 m (Figure 2d).
3.3. Structurations intraspécifiques des espèces de valeur dominantes
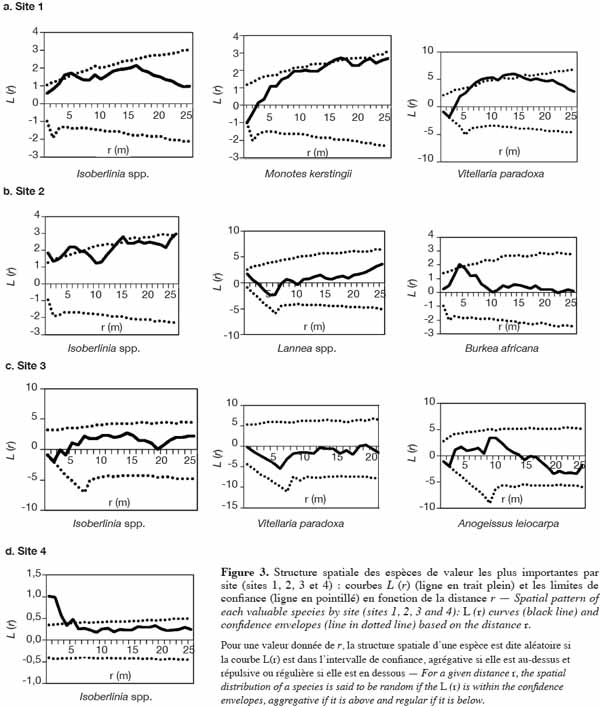
37Sur le site 1 (Figure 3a), les pieds d’Isoberlinia présentent des agrégats d’une portée de 5 m. On observe une tendance à l’agrégation dans un rayon de 16 m pour M. kerstingii. En ce qui concerne V. paradoxa, les arbres se répartissent en agrégats de 6 à 15 m de rayon. Sur le site 2, la population d’Isoberlinia spp. s’organise en agrégats de 5 à 6 m de rayon, avec une concentration dans un rayon de 16 m. Les pieds de B. africana se répartissent en agrégats de rayons de 4 à 5 m et la population de Lannea spp. se répartit, quant à elle, de façon aléatoire (Figure 3b). L’analyse de la figure 3c du site 3 montre une régularité de 3 m de portée pour Isoberlinia spp. et A. leiocarpa. Mais on note une répartition aléatoire de V. paradoxa. Pour le site 4, à forte dominance Isoberlinia spp., la taille de l’agrégation est de 5 m au plus.
3.4. Structurations interspécifiques
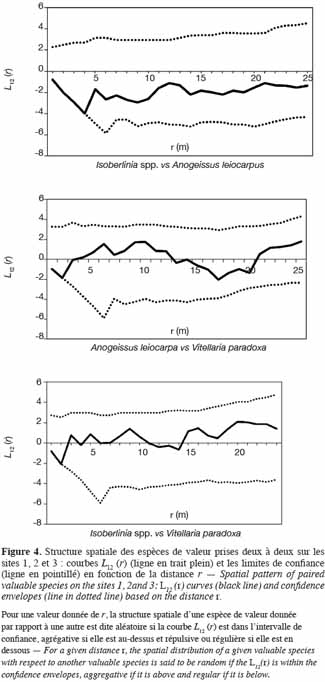
38Les paramètres de distribution entre espèces dominantes sont aussi étudiés par le biais de l’inter-type. Il ressort, sur les sites 1 et 2, une indépendance des sous-populations prises deux à deux, constituées respectivement de Isoberlinia spp. – M. kerstingii – V. paradoxa et de Isoberlinia spp. – B. africana – Lannea spp. Par contre, pour le site 3, les trois espèces de valeur dominantes (Isoberlinia spp., A. leicarpa et V. paradoxa) entretiennent des relations de mise à distance (Figure 4). Entre les espèces Isoberlinia spp. et A. leiocarpa, la répulsion est de l’ordre de 4,5 m. Mais cette répulsion est à peine de 3 m de portée entre V. paradoxa et Isoberlinia spp., d’une part, et entre V. paradoxa et A. leiocarpa, d’autre part.
3.5. Structuration inter-classes de grosseur
39En ce qui concerne la distribution spatiale des gros arbres par rapport aux petits, les courbes L12 (r) demeurent globalement dans l’intervalle de confiance, quel que soit le site (Figure 5) : ceci montre qu’il y a indépendance entre les deux cohortes et plus précisément, que les grands arbres sont distribués indépendamment des petits arbres. Il en est de même entre les arbres moyens et les petits arbres (Figure 6).
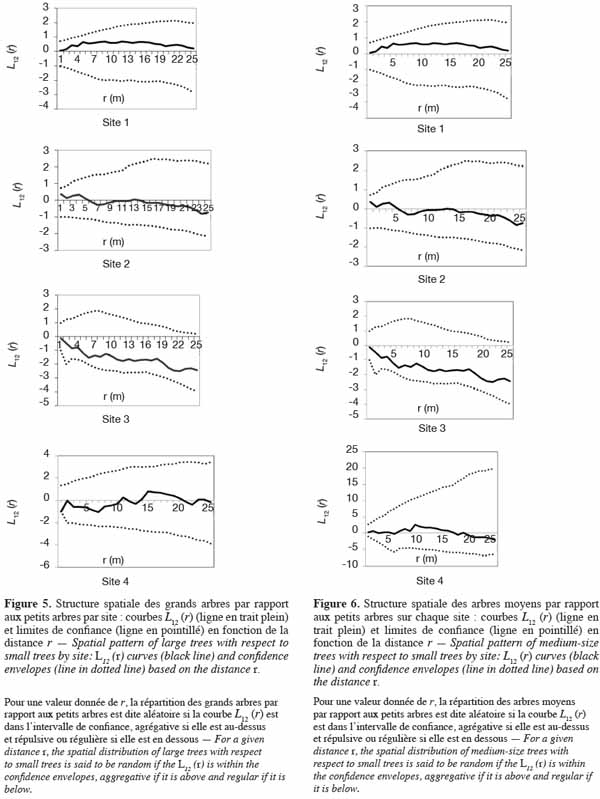
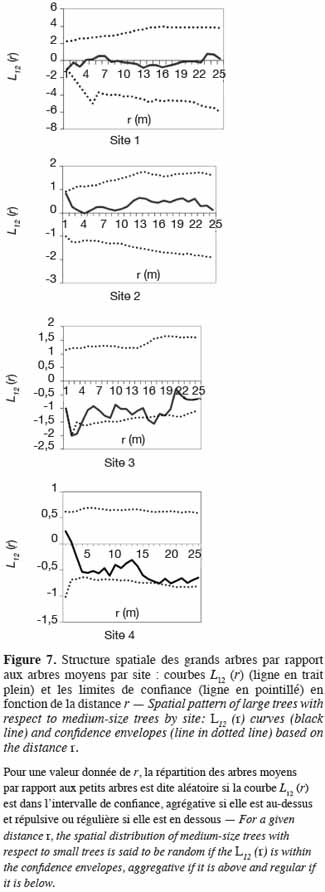
40Quant à la distribution des grands arbres et des arbres moyens, les courbes L12 (r) demeurent à l’intérieur des intervalles de confiance sur les sites 1, 2 et 4. Sur ces sites, les grands arbres sont par conséquent distribués indépendamment des arbres moyens. Par contre, sur le site 3, la courbe L12 (r) coupe légèrement la limite inférieure de l’intervalle de confiance dans un rayon de 3 m. Il y a donc une répulsion de 3 m de portée entre les grands arbres et les arbres de diamètre moyen (Figure 7).
4. Discussion et conclusion
41Les quatre sites choisis présentent une richesse spécifique comprise entre 21 et 33 espèces pour des diamètres supérieurs ou égaux à 5 cm. Les valeurs obtenues pour les indices usuels caractéristiques de ces écosystèmes sont élevées. En effet, l’indice de Shannon varie de 2,5 à 2,9 bits. Ces valeurs relativement faibles de l’indice de Shannon suggèrent une prédominance d’un petit nombre d’espèces par rapport aux autres (Shannon et al., 1949). Cela peut être lié au fait que certaines espèces observées sur les sites évoluent en peuplement et non en individus isolés (par exemple, Isoberlinia spp., Anogeissus leocarpa, Lannea barteri, etc.). Les valeurs peu élevées de l’équitabilité de Piélou (0,50 à 0,64) sont congruentes avec ces observations (Piélou, 1969). Les densités de ces formations varient entre 248 et 468 tiges à l’hectare avec une valeur moyenne de 350 tiges à l’hectare. Ces résultats sont similaires à ceux obtenus par Agonyissa et al. (2003) avec 331 à 480 tiges à l’hectare pour les savanes forestières. Les surfaces terrières sont faibles et varient entre 10,3 et 14,3 m2·ha-1 et sont conformes aux résultats préalablement obtenus dans les mêmes écosystèmes (Fonton et al., 2004 ; Sokpon et al., 2006).
42En ce qui concerne la structure spatiale des arbres, elle se caractérise par une répartition aléatoire avec des agrégats de taille atteignant 6 m. Ce qui confirme l’hypothèse (1) qui stipule que la distribution agrégative des arbres se limite à des îlots de petite taille. Ces modes de répartition des arbres sont influencés par ceux des espèces dominantes prises individuellement. En effet, les espèces abondantes telles que V. paradoxa, M. kertingii, B. africana et Isoberlinia spp. présentent en général une distribution agrégative. Ces résultats corroborent ceux de Djossa et al. (2008) qui ont observé une distribution agrégative pour V. paradoxa dans la Réserve de Biosphère de la Pendjari au Bénin. De même, Fandohan et al. (2008) ont observé une distribution en agrégats de petites tailles (bouquets) régulièrement répartis pour B. africana dans le complexe forestier de Wari-Maro. La distribution agrégative observée pour la répartition des espèces serait due, selon Collinet (1997), au mode de dissémination des espèces. En effet, Isoberlinia spp. sont des espèces ballochores qui présentent des diaspores expulsées par la plante elle-même. Ainsi, après la déhiscence, les fruits (gousses) de Isoberlinia spp., les graines mûres sont directement libérées aux pieds des semenciers. Vitellaria paradoxa, M. kertingii et B. africana sont des sarcochores qui sont des plantes dont les diaspores sont totalement ou partiellement charnues. On assiste donc à une forte concentration des semences aux pieds des sujets adultes et, par conséquent, à un nombre important de plants de ces espèces.
43De plus, la répartition en agrégats des Isoberlinia spp. et leur dominance dans les peuplements seraient dues non seulement au mode de dissémination des graines, mais également et surtout aux rejets de souches et de drageons, caractéristiques du genre (Aubréville, 1970 ; Bationo et al., 2005). Pour César (1992) et Gignoux (1994), la distribution agrégative pourrait également résulter d’une adaptation au feu, les plantules et les rejets étant moins vulnérables dans les bosquets.
44Les modes de dissémination des graines seraient à la base des interactions observées aussi bien au niveau des classes de diamètre qu’au niveau des espèces. Ils conduisent à une indépendance entre les sous-populations formées par les espèces dominantes avec des répulsions de l’ordre de 4,5 m et une indépendance entre les cohortes formées par les classes de grosseur avec une répulsion assez rare de portée inférieure à 3 m. Globalement, ces observations confirment les hypotheses (2) et (3) qui suggèrent que la distribution entre les classes de grosseurs d’arbre est aléatoire et que la distribution des sous-populations d’espèces dominantes est caractérisée par un processus répulsif.
45L’interprétation des résultats de cette étude suggère, d’une façon générale, une répartition spatiale en de petits agrégats au sein desquels on observe des répulsions intraspécifiques de l’ordre de 3 m et des répulsions interspécifiques de l’ordre de 4,5 m, exception faite des Lannea spp. pour lesquelles on observe une répartition aléatoire. Pour tenir compte des comportements de répulsion dans les processus d’enrichissement à base des essences de valeur ayant fait l’objet de cette étude (A. leiocarpa, B. africana, Isoberlinia spp., M. kerstingii et V. paradoxa), on pourrait donc suggérer l’adoption d’un écartement minimum de 3 m entre arbres de même espèce et de 4,5 m entre espèces différentes dans les savanes boisées et forêts claires en zone soudanienne. Par ailleurs, la faible répulsion notée entre classes de grosseur pourrait indiquer l’absence de relation allélopathique entre les adultes et les juvéniles et suggère que des enrichissements pourraient être effectués à proximité des pieds adultes sans que cela n’affecte la survie des jeunes plants. Toutefois, bien que résultant des différents processus analysés, les espacements suggérés ne sont peut-être pas optimaux du point de vue du taux de mortalité au jeune âge et de la croissance des espèces concernées. Des travaux supplémentaires basés sur des expérimentations permettraient d’éclaircir ces points.
Bibliographie
Adomou C.A., Sinsin B. & van der Maesen L.J.G., 2006. Phytosociological and chorological approaches to phytogeography: a meso-scale study in Benin. Syst. Geogr. Plants, 76, 155-178.
Agonyissa D. & Sinsin B., 1998. Productivité et capacité de charge des pâturages naturels du Bénin. Rev. Élev. Méd. Vét. Pays Trop., 51(3), 239-246.
Agonyissa D., Hahn-Hadjali K. & Sinsin B., 2003. Species diversity variation in Sudanian woodland in relation to grazing pressure with control in protected area and in surrounding village. In: 16th Annual Conference of the Society for Tropical Ecology, 19-22. Feb. 2003, Rostock, Germany.
Assogbadjo A.E., Glèlè Kakaï R.L., Sinsin B. & Pelz D., 2010. Structure of Anogeissus leiocarpa Guill., Perr. natural stands in relation to anthropogenic pressure within Wari-Maro Forest Reserve in Benin. Afr. J. Ecol., 48(3), 644-653.
Aubréville A., 1970. Flore du Cameroun : légumineuses Caesalpinoïdes. Paris : Museum National d’Histoire Naturelle.
Bationo A.B. et al., 2005. Régénération naturelle d’Isoberlinia doka Craib. et Stapf. dans la forêt classée du Nazinon (Burkina Faso). Cah. Étud. Rech. Fr./Agric., 14(3), 297-304.
Batista L.J. & Maguire A.D., 1998. Modelling the spatial structure of tropical forest. For. Ecol. Manage., 110, 293-314.
Bazzaz F.A., 1990. Successional environments: plant-plant interactions. In: Grace J.B. & Tilman D., eds. Perspectives on plant competition. New York, USA: American Press Inc., 239-263.
Besag J., 1977. Contribution to the discussion of Dr Ripley’s paper. J. R. Stat. Soc., B 39, 193-195.
Bognounou F. et al., 2009. Structure et composition spécifique de la végétation ligneuse de quatre sites sur un gradient latitudinal au Burkina Faso occidental. Bois For. Trop., 300, 29-44.
Bonou W. et al., 2009. Characterization of Afzelia africana Sm. habitat in the Lama forest reserve of Benin. For. Ecol. Manage., 258, 1084-1092.
Boyden S., Binkley D. & Shepperd W., 2005. Spatial and temporal patterns in structure, regeneration and mortality of an old-growth ponderosa pine forest in Colorado Front Range. For. Ecol. Manage., 219, 43-55.
César J., 1992. La production biologique des savanes de Côte d’Ivoire et son utilisation par l’homme. Thèse d’État : Institut d’Élevage et de Médecine vétérinaire des Pays tropicaux, CIRAD (France).
Collinet F., 1997. Essai de regroupement des principales espèces structurantes d’une forêt dense humide d’après l’analyse de leur répartition spatiale. Forêt de Paracou, Guyane. Thèse de doctorat : Université Claude Bernard Lyon I (France).
Couteron P. & Kokou K., 1997. Woody vegetation spatial patterns in a semi-arid savanna of Burkina Faso, West Africa. Plant Ecol., 132, 211-227.
Dale M.R.T., 1999. Spatial pattern analysis in plant ecology. New York, USA: Cambridge University Press, 326.
Diggle J.P., 1983. Statistical analysis of spatial point patterns. New York, USA: Academic Press.
Djossa B.A. et al., 2008. Land use impact on Vitellaria paradoxa C.F.Gaertn. stand structure and distribution patterns: a comparison of Biosphere Reserve of Pendjari in Atacora district in Benin. Agroforestry Syst., 72, 205-220.
Duncan R.P., 1991. Competition and coexistence of species in a mixed podocarp stand. J. Ecol., 79, 1073-1084.
Dupuy B., 1992. Les plantations à vocation de bois d’œuvre en forêt dense humide africaine. Bois For. Trop., 231, 5-15.
Eagleson P.S. & Segarra R.I., 1985. Water-limited equilibrium of savanna vegetation systems. Water Resour. Res., 21, 1483-1493.
Fajardo A., Goodburn J.M. & Graham J., 2006. Spatial patterns of regeneration in managed uneven-aged ponderosa pine/Douglas-fir forests of Western Montana, USA. For. Ecol. Manage., 223(1-3), 255-266.
Fandohan B., Glèlè Kakaï R., Sinsin B. & Pelz D., 2008. Caractérisation dendrométrique et spatiale de trois essences ligneuses médicinales dans la forêt classée de Wari-Maro au Bénin. Rev. Ivoirienne Sci. Technol., 12, 173-186.
Fonton H.N. & Sagbo P., 2004. Modélisation des distributions des paramètres dendrométriques d’une espèce ligneuse dominante en peuplement naturel. Ann. For. Sci., 61, 545-549.
Fonton N.H., Atindogbe G., Hounkonnou N.M. & Odjo Dohou R., 2011. Plot size for modelling the spatial structure of Sudanian woodland trees. Ann. For. Sci., 68(8), 1315-1321.
Fowler N., 1986. The role of competition in plant communities in arid and semi-arid regions. Ann. Rev. Ecol. Syst., 17, 89-110.
Gignoux J., 1994. Modélisation de la coexistence herbes/arbres en savane. Thèse de doctorat : Université de Paris 6 (France).
Glèlè Kakaï R. & Sinsin B., 2009. Structural description of two Isoberlinia dominated vegetation types in the Wari-Maro Forest Reserve (Benin). South Afr. J. Bot., 75, 43-51.
Goreaud F., Courbaud B. & Collinet F., 1999. Spatial structure analysis applied to modeling of forest dynamics: a few examples. In: Amaro A. & Tomé M., eds. Empirical and process based models for forest tree and stand growth simulation. Oeiras, Portugal: Novas Technologias, 155-172.
Goreaud F. & Pélissier R., 2003. Avoiding misinterpretation of biotic interactions with the intertype K12-function: population independence vs. random labelling hypotheses. J. Veg. Sci., 14(5), 681-692.
Greig-Smith P., 1979. Pattern in vegetation. J. Ecol., 67, 755-779.
Haase P., Pugnaire F.I., Clark S.C. & Incoll L.D., 1996. Spatial patterns in two-tiered semi-arid shrubland in southeastern Spain. J. Veg. Sci., 7, 527-534.
Janzen D.H., 1970. Herbivores and the number of tree species in tropical forests. Am. Nat., 104, 501-528.
Kiêu K. & Mora M., 1999. Estimating the reduce moments of a random measure. Adv. Appl. Probab. (SGSA), 31(1), 48-62.
Kikvidze Z. et al., 2005. Linking patterns and process in alpine plant communities: a global study. Ecology, 86(6), 1395-1400.
Legendre P., 1993. Spatial autocorrelation trouble or new paradigm? Ecology, 74(6), 1659-1673.
Liebhold A.M. & Gurevitch J., 2002. Integrating the statistical analysis of spatial data ecology. Ecography, 25(5), 553-557.
Mast J.N. & Veblen T.T., 1999. Tree spatial patterns and stand development along the pine-grassland ecotone in the Colorado Front Range. Can. J. For. Res., 23, 1347-1360.
Piélou E.C., 1969. An introduction to mathematical ecology. New York, USA: Wiley.
Prentice I.C. & Werger M.J.A., 1985. Clump spacing in a desert dwarf shrub community. Vegetatio, 63, 133-139.
Ripley B.D., 1977. Modeling spatial patterns. J. R. Stat. Soc., B 39, 172-212.
Ripley B.D., 1981. Spatial statistics. New York, USA: Wiley.
Shannon C.E. & Weaver W., 1949. The mathematical theory of communication. Urbana, IL, USA: University of Illinois Press.
Skarpe C., 1991. Spatial patterns and dynamics of woody vegetation in arid savanna. J. Veg. Sci., 2, 565-572.
Sokpon N., Biaou S., Ouinsavi C. & Hunhyet O., 2006. Bases techniques pour une gestion durable des forêts claires du Nord-Bénin : rotation, diamètre minimal d’exploitabilité et régénération. Bois For. Trop., 287, 45-57.
Stoll P. & Bergius E., 2005. Pattern and process: competition causes regular spacing of individuals within plant populations. J. Ecol., 93(2), 395-403.
Stoyan D., Kendall W.S. & Mecke J., 1995. Stochastic geometry and its applications. New York, USA: Wiley.
Szwagrzyk J., Szewczyk J. & Bodziarczyk J., 2001. Dynamics of seedling banks in beech forest: results of a 10-years study on germination, growth and survival. For. Ecol. Manage., 141, 237-250.
Walker B.H., Ludwig D., Holling C.S. & Peterman R.M., 1981. Stability of semi-arid savanna grazing systems. J. Ecol., 69, 473-498.
White F., 1983. The vegetation of Africa. Paris : UNESCO.
Om dit artikel te citeren:
Over : Noël Houedougbe Fonton
Université d’Abomey-Calavi. Laboratoire d’Étude et de Recherche en Statistique appliquée et Biométrie. 01 BP. 526. Cotonou (République du Bénin). E-mail : hnfonton@gmail.com
Over : Gilbert Atindogbe
Université d’Abomey-Calavi. Laboratoire d’Étude et de Recherche en Statistique appliquée et Biométrie. 01 BP. 526. Cotonou (République du Bénin).
Over : Belarmain Fandohan
Université d’Abomey Calavi. Faculté des Sciences agronomiques. Laboratoire d’Écologie appliquée. 01 BP. 526. Cotonou (République du Bénin).
Over : Philippe Lejeune
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Gestion des Ressources forestières et des Milieux naturels. B-5030 Gembloux (Belgique).
Over : Gauthier Ligot
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Gestion des Ressources forestières et des Milieux naturels. B-5030 Gembloux (Belgique).






