- Accueil
- volume 16 (2012)
- numéro 3
- Les modèles de croissance en microbiologie prévisionnelle pour la maitrise de la sécurité des aliments (synthèse bibliographique)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Les modèles de croissance en microbiologie prévisionnelle pour la maitrise de la sécurité des aliments (synthèse bibliographique)

Notes de la rédaction
Reçu le 22 février 2011, accepté le 3 juillet 2012
Résumé
La microbiologie prévisionnelle a pour but de prédire l’évolution des micro-organismes dans les aliments par des modèles mathématiques. De nombreux modèles ont été publiés et la complexité de certains d’entre eux rend leur utilisation difficile aux non-initiés. Cependant, l’utilisation de cette discipline est amenée à se généraliser dans les années à venir. Ces modèles fournissent, par exemple, des outils supplémentaires pour assurer la sécurité microbiologique des aliments, établir les flux de contamination dans une chaine alimentaire, développer et assister les systèmes d’assurance qualité. Le développement de nouveaux logiciels informatiques et de bases de données permettra aux acteurs impliqués dans la chaine alimentaire d’avoir un meilleur contrôle des dangers microbiologiques. Le but de cette synthèse est de donner une vue d’ensemble des modèles de microbiologie prévisionnelle et de leurs applications. Une première approche des modèles primaires, secondaires et tertiaires est donnée. La modélisation de la latence, les modèles intégrés et les tests de croissance sont également abordés.
Abstract
A review of growth models in predictive microbiology to ensure food safety. Predictive microbiology aims to predict the evolution of microorganisms in foods using mathematical models. Several models have been published and the complexity of some of them makes their use difficult for the uninitiated. However, the use of this discipline will become widespread in coming years. These models provide, for example, additional tools to ensure the microbiological safety of food, to establish the contamination flow in a food chain, and to develop and assist existing quality assurance systems. The development of new computer software and database will enable stakeholders in the food chain to have better control of microbiological hazards. The aim of this review is to give an overview of existing models of predictive microbiology and their applications. A first approach of the primary, secondary and tertiary models is given. The modeling of latency, integrated models and growth tests are also discussed.
Table des matières
1. Introduction
1En 2008, 5 332 foyers de toxi-infections alimentaires collectives (TIAC) ont été rapportés dans l’Union européenne (UE), causant 45 622 cas cliniques, 6 230 hospitalisations et 32 décès (European Food Safety Authority, 2010).
2Depuis une vingtaine d’années, la sécurité des denrées alimentaires doit être gérée dans un contexte international de libre échange et de mondialisation. En 1994, l’Organisation Mondiale du Commerce (OMC) a conclu un accord pour l’application des mesures sanitaires et phytosanitaires (sanitary and phytosanitary measures, SPS measures) dont les objectifs sont d’éviter les entraves au commerce international et d’instituer des règles selon lesquelles un pays peut refuser de commercialiser un produit sur son territoire s’il présente un risque pour la population. La justification du refus de commercialisation d’une denrée alimentaire doit se fonder sur une analyse de risque basée sur des normes internationales reconnues par l’OMC.
3En 2000, l’UE a édité le Livre Blanc sur la sécurité alimentaire où les principes généraux de la politique européenne en matière de sécurité alimentaire sont exposés. Dans ce texte fondateur, on insiste sur le respect des accords internationaux. Depuis lors, l’UE a remplacé son ancienne législation par un ensemble de nouveaux règlements communément appelés « le paquet hygiène ». Les différentes règlementations du paquet hygiène découlent toutes du règlement (CE) N°178/2002 établissant les principes généraux et les prescriptions générales de la législation alimentaire, appelée « General Food Law » (EU, 2002 ; EU, 2004a ; EU, 2004b ; EU, 2004c ; EU, 2004d ; EU, 2005). L’UE décide que le niveau élevé de protection de la santé, qui est la base de l'élaboration de la législation alimentaire, soit appliqué de manière non discriminatoire aux échanges tant nationaux qu'internationaux des denrées alimentaires.
4De même, le règlement (CE) N°2073/2005 concernant les critères microbiologiques applicables aux denrées alimentaires recommande des révisions des critères microbiologiques en tenant compte de l'évolution des connaissances dans les domaines de la santé publique et de la microbiologie des denrées alimentaires. Cette évolution comprend les progrès scientifiques, technologiques et méthodologiques, l'évolution des niveaux de prévalence et de contamination, l'évolution de la population de consommateurs vulnérables ainsi que les résultats éventuels d'analyses de risque.
5L’article 3 du règlement (CE) N°2073/2005 précise que « les exploitants du secteur alimentaire responsables de la fabrication du produit conduisent des études afin d'examiner si les critères sont respectés pendant toute la durée de conservation. Cette disposition s'applique notamment aux denrées alimentaires prêtes à être consommées permettant le développement de Listeria monocytogenes et susceptibles de présenter un risque pour la santé publique lié à Listeria monocytogenes ». Dans l’annexe II de ce règlement, les outils d’aide à l’évaluation de la durée de vie microbiologique d’un produit alimentaire sont cités : la détermination des caractéristiques physico-chimiques du produit alimentaire, le test de vieillissement, le test de croissance (challenge test) et la microbiologie prévisionnelle.
6L’utilisation de la microbiologie prévisionnelle peut concerner (Brul et al., 2007) :
7– les plans HACCP (Hazard Analysis - Critical Control Point, appelés également en français Analyse des Dangers - Points Critiques pour leur Maitrise) (qui comprend différentes étapes : analyse préliminaire des dangers, identification et établissement des points critiques, surveillance, actions correctives, vérification) ;
8– l’Appréciation Quantitative de Risque (AQR) (estimation de l’évolution du nombre de micro-organismes dans une chaine de production, évaluation de l’exposition à une bactérie pathogène, conséquences de cette exposition) ;
9– la détermination de la durée de vie d’un aliment, la prédiction de la croissance de micro-organismes pathogènes ou d’altérations sur un aliment déterminé ;
10– le développement d’un nouveau produit ou d’un nouveau procédé (par exemple, l’évaluation d’une nouvelle technologie de production) ;
11– la mise au point d’une nouvelle formulation d’un produit sur l’évolution des micro-organismes) ;
12– la formation du personnel (formation des personnes directement responsables de la qualité microbiologique du produit) ;
13– la planification d’expériences (définition des intervalles entre chaque échantillonnage et nombre d’échantillons à prélever).
14La première application concrète dans l’industrie agro-alimentaire est le modèle log-linéaire de destruction thermique (Bigelow, 1921 ; Esty et al., 1922). Ce modèle est cependant une simplification de phénomènes complexes et ne tient pas compte de certaines particularités des micro-organismes. Malgré cette faiblesse, ce modèle reste encore utilisé aujourd’hui. Un exemple d’application de ce modèle est la prédiction du couple temps/température adéquat pour la destruction des spores de Clostridium botulinum dans les boites de conserve.
15En 1937, Scott envisage pour la première fois le potentiel de l’utilisation de la microbiologie prédictive pour déterminer la croissance de bactéries pathogènes sur une carcasse durant sa manipulation et sa réfrigération (Scott, 1937). Il a fallu attendre la généralisation de l’électronique et de l’informatique dans les années 1960-1970 pour que cette discipline dispose d’outils performants de suivi du couple temps/température au cours du processus de fabrication et de distribution des denrées alimentaires. Mais c’est surtout au cours de ces vingt dernières années qu’un progrès considérable en modélisation a permis des avancées spectaculaires avec l’apparition de modèles plus précis et flexibles en tenant compte des conditions environnementales.
16Cette synthèse propose un aperçu de plusieurs modèles de microbiologie prévisionnelle. Le but, in fine, est de donner au lecteur une vision globale sur la manière par laquelle la microbiologie prévisionnelle peut contribuer à une meilleure maitrise de la qualité sanitaire des aliments.
2. Principes de base
17La microbiologie prévisionnelle est basée sur l’hypothèse que les réponses de populations de micro-organismes à des conditions environnementales identiques sont reproductibles. Par conséquent, il est possible, à partir d’observations disponibles sur la croissance, la survie ou l’inactivation des bactéries en fonction de facteurs environnementaux, de prédire les réponses des mêmes micro-organismes sous d’autres conditions, en suivant les facteurs environnementaux plutôt qu’en réalisant des analyses microbiologiques lourdes et couteuses.
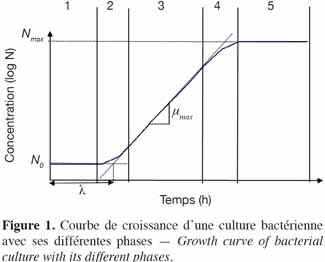
18Si les conditions sont favorables à la croissance, l’évolution de la population microbienne suit toujours le même profil. La figure 1 décrit la courbe de croissance d’une culture bactérienne et ses différentes phases :
191. la phase de latence (λ) : cette phase correspond à l’adaptation de l’inoculum (N0) à son nouvel environnement. Durant cette période, la vitesse de croissance est nulle (μ = 0),
202. la phase d’accélération : les bactéries commencent à se multiplier pour atteindre progressivement la vitesse maximum de croissance (μmax) (0 < μ < μmax),
213. la phase exponentielle : la vitesse de croissance des bactéries est maximum (μ = μmax),
224. la phase de décélération : la vitesse de croissance devient progressivement nulle (μmax > μ > 0),
235. la phase stationnaire : la vitesse de croissance est nulle (μ = 0) et la culture atteint sa densité maximale (N = Nmax) avec, parfois, une phase ultérieure de décroissance de la population.
24Des modèles primaires, secondaires et tertiaires sont utilisés pour modéliser le comportement des micro-organismes. Le modèle primaire vise à reproduire l’évolution de la concentration en micro-organismes au cours du temps dans un environnement donné. Les modèles secondaires permettent de décrire l’influence des facteurs environnementaux sur les paramètres primaires. Les modèles tertiaires utilisent des systèmes experts et des bases de données afin d’établir des relations entre les modèles primaires et secondaires (Whiting et al., 1993).
25On distingue deux types d’approche en modélisation : l’empirique et le mécaniste. Les modèles empiriques ont pour unique but le meilleur ajustement possible aux données observées sans expliquer les phénomènes provoquant la réponse observée. Le meilleur exemple d’un modèle empirique secondaire est le modèle polynomial dont les capacités d’ajustement sur un jeu de données sont excellentes, mais dont l’équation générée n’a aucune signification biologique (Luning et al., 2007). A contrario, les modèles mécanistes sont développés à partir de théories ou d’hypothèses et permettent d’expliquer la réponse à modéliser par l’action de phénomènes physiques, biologiques et/ou chimiques (Ross et al., 2003a). En microbiologie prévisionnelle, la grande majorité des modèles ne sont pas purement empiriques ou purement mécanistes, mais peuvent être considérés comme semi-mécanistes car les mécanismes de croissance ou d’inactivation gouvernant le comportement des micro-organismes ne sont pas encore tous compris et intégrés dans les modèles actuels. La relation mathématique est empirique, mais les composantes de la formule sont des paramètres ayant une signification biologique (Brul et al., 2007). Dans le futur, le développement de modèles mécanistes complexes dépendra essentiellement de la compréhension du comportement physiologique au niveau cellulaire.
3. Les modèles primaires
26Les modèles primaires décrivent la croissance d’un micro-organisme bien défini dans un contexte environnemental donné. On les distingue en modèles déterministes ou stochastiques. La plupart des modèles utilisés actuellement sont des modèles déterministes. Dans ces modèles, l’évolution du nombre de cellules d’une population microbienne peut être décrite par un ensemble de paramètres, à savoir N0, λ, μmax, Nmax. Mais certains modèles tentent également de connecter le comportement des cellules individuelles à celui de toute la population. Ceci conduit aux modèles stochastiques ou probabilistes dans lesquels les paramètres du modèle sont des variables de distributions aléatoires représentant l’ensemble de la population bactérienne. Cela signifie que les paramètres du modèle font partie d'une distribution aléatoire pouvant représenter la variabilité biologique entre les cellules individuelles d’une même population. Au moyen de modèles stochastiques appropriés, l'information acquise sur la distribution du comportement des cellules, par exemple, via les mesures de Bioscreen, peut être utilisée pour améliorer les prédictions du temps de latence de la population (Augustin et al., 2000). Ces modèles stochastiques sont très utiles lorsque la taille de l'inoculum est faible et la différence du temps de latence entre les cellules individuelles est très variable au sein de cette petite population (Guillier et al., 2005). La compréhension de la variabilité de certains paramètres à l’échelle de cellules individuelles sera certainement la prochaine étape en microbiologie prévisionnelle.
27Le premier modèle primaire de croissance qui ait été décrit en microbiologie prévisionnelle est le modèle exponentiel (Buchanan, 1918). Ce modèle très simple décrit la phase exponentielle, mais ne tient pas compte de la phase de latence ni de la phase stationnaire. Néanmoins, il peut être utilisé en première approche pour réaliser une estimation de l’évolution du nombre de bactéries suivant un scénario pessimiste, puisque l’on considère que toutes les bactéries peuvent se multiplier à une vitesse maximale. Une alternative au modèle exponentiel est l’utilisation du modèle linéaire à trois phases proposé par Buchanan et al. (1997) correspondant au modèle exponentiel avec démarrage et freinage brusque où N(t) correspondant au nombre de cellules au temps t :
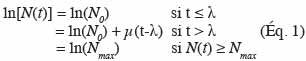
28Cependant, ce modèle ne permet pas un bon ajustement sur des données obtenues expérimentalement (Baranyi, 1997). Les modèles non linéaires, basés sur des fonctions sigmoïdes comme le modèle logistique ou de Gompertz, permettent un meilleur ajustement (Lôpez et al., 2004).
29Le modèle logistique avec délai et rupture est un des plus utilisé actuellement (Rosso et al., 1995). Il suppose qu’il n’y a pas de possibilité de croissance lors de la phase de latence et qu’il n’y a pas de transition entre la phase de latence et la phase exponentielle :
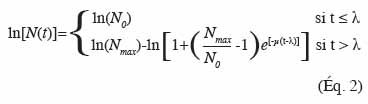
30Ce modèle a l’avantage de pouvoir être utilisé assez simplement. Un modèle de croissance a été proposé par Baranyi et al. (1993). Il est également un des plus utilisé actuellement. Ce modèle est basé sur une équation différentielle (phase exponentielle) et complété par deux fonctions d’ajustement. La première fonction d’ajustement décrit la phase de transition entre la phase de latence et la phase exponentielle. Ce processus de transition est déterminé par un paramètre additionnel représentant l’état physiologique des bactéries et est caractérisé par une augmentation graduelle d’une valeur comprise entre 0 et 1. La seconde fonction d’ajustement permet de décrire la phase d’inhibition entre la phase exponentielle et la phase stationnaire. Elle est basée sur le principe d’une diminution progressive des nutriments. Pour des raisons pratiques d’ajustement de modèle, la fonction d’inhibition a été créée sur base de la concentration maximale et d’un paramètre de courbure. Ce dernier est également la fonction de freinage du modèle logistique. Le modèle de Baranyi fut réécrit en un modèle utilisant des variables explicites (Baranyi et al., 1994) :
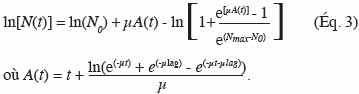
31Le modèle Baranyi est très utilisé car il donne des résultats satisfaisants lors d’ajustement de modèles sur des données de laboratoire. Le succès de ce modèle peut être expliqué en partie par la mise au point de DMFit, un logiciel gratuit d’ajustement basé sur le modèle primaire de Baranyi disponible sur http://www.combase.cc/toolbox.html.
32La figure 2 présente le modèle primaire de Baranyi ajusté à l’aide du logiciel DMFit sur des données obtenues lors d’un test de croissance concernant Listeria monocytogenes dans de la viande hachée de porc irradiée et conditionnée sous film étirable à une température de 10 °C (Delhalle et al., 2009).
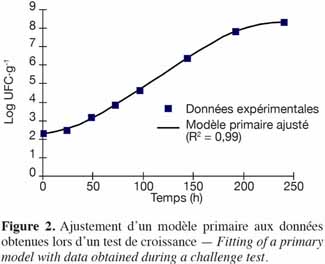
33Le coefficient de détermination (R2) a été calculé à partir des points obtenus par le modèle primaire aux mêmes temps que les points expérimentaux. La comparaison de l’ajustement de modèles primaires sur des données de laboratoire a fait l’objet de plusieurs études (Baranyi, 1997 ; Buchanan et al., 1997 ; Lôpez et al., 2004 ; Pal et al., 2008). Actuellement, il n’est pas possible de sélectionner un modèle en particulier pour représenter de manière la plus appropriée la croissance bactérienne. Les modèles les plus simples peuvent souvent être suffisants pour représenter correctement les paramètres fondamentaux de croissance. Miconnet et al. (2005) proposent une réflexion sur l’incertitude des paramètres de croissance obtenus à partir de données collectées lors de tests de croissance.
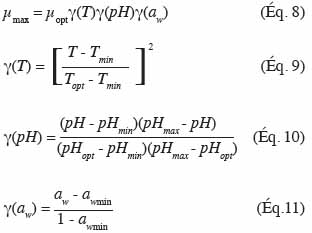
4. Les autres modèles primaires
34La plupart des modèles actuels s’intéressent uniquement au comportement d’une population bactérienne, mais d’autres modèles décrivent le comportement de cellules individuelles. Ces derniers se basent sur différents principes comme la consommation d’une substance vitale pour la croissance de la cellule dans son nouvel environnement (Baranyi et al., 1994), l’augmentation de la biomasse (Hills et al., 1994), l’apparition de molécules précédant la division (Buchanan et al., 1997) ou l’hétérogénéité entre les cellules composant une population en phase de latence (McKellar, 1997). L’idée est de représenter le comportement à un niveau microscopique (cellule individuelle) pour in fine simuler le comportement à un niveau macroscopique (population). Pour obtenir le comportement de cellules individuelles, il faut simuler les différences entre les cellules en utilisant des variables aléatoires représentées par des distributions statistiques. L’hypothèse de départ est que chaque cellule interagit avec son environnement de manière indépendante. Le développement de modèles décrivant le comportement de cellules individuelles reste encore au stade de recherche. De plus, ce genre d’approche nécessite un matériel de mesure spécifique.
5. Les modèles secondaires
5.1. Les modèles secondaires pour la vitesse de croissance
35La croissance est gouvernée par les conditions de stockage (facteurs extrinsèques) et par les caractéristiques propres au produit (facteurs intrinsèques). Ces deux types de facteurs sont repris sous le terme général de facteurs environnementaux. Dans les aliments, les facteurs environnementaux sont souvent complexes et dynamiques car ils doivent inclure l’effet combiné de facteurs extrinsèques comme la température, la composition en gaz de l’atmosphère de conditionnement et les facteurs intrinsèques comme le pH, l’activité de l’eau, la présence naturelle de certains acides et les interactions entre les groupes de micro-organismes. Les modèles secondaires permettent de décrire l’effet des conditions environnementales sur les paramètres du modèle primaire (Whiting et al., 1993).
36Dans la plupart des situations, la température est le facteur environnemental qui aura le plus d’impact sur la croissance des micro-organismes dans les aliments. Durant les étapes de transformation, de stockage et de distribution, la température des aliments peut varier considérablement et inclure des périodes d’abus de température (Likar et al., 2006). Le suivi des températures à différentes étapes de la chaine alimentaire permet d’introduire ces données dans un modèle secondaire intégrant l’effet de la température au cours du temps, afin de prédire les conséquences en termes de croissance.
37Pour être applicable, un modèle secondaire doit idéalement rencontrer une série de critères (Ross et al., 2000) :
38– la collecte des paramètres nécessaires pour le modèle doit être réalisable,
39– les paramètres à inclure doivent avoir une signification concrète,
40– les propriétés des fonctions mathématiques doivent refléter les phénomènes biologiques,
41– le modèle doit permettre des extensions ou des améliorations,
42– le modèle ne doit pas contenir plus de paramètres que nécessaire,
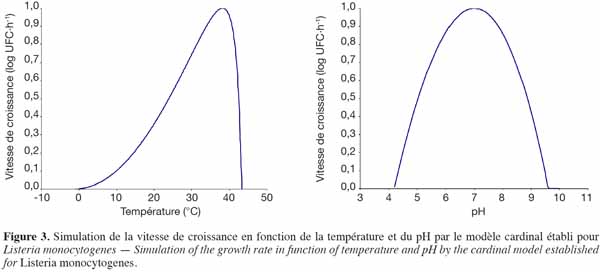
43– la gamme d’utilisation du modèle doit être suffisante.
44Ces deux derniers points concernent surtout les modèles polynomiaux, car ils comportent un grand nombre de paramètres et manquent donc de parcimonie (Corroler, 2006). Même si l’élimination des coefficients non significatifs permet d’obtenir un modèle plus parcimonieux, les différents coefficients sont difficilement interprétables. De plus, le domaine d’utilisation de ces modèles est plus restreint que l’espace multidimensionnel défini par les bornes des gammes étudiées des différents facteurs (Baranyi et al., 1996 ; Le Marc et al., 2005). Si ces modèles sont utilisés en dehors de la plage d’interpolation, alors ils peuvent conduire à des estimations aberrantes.
45Les modèles secondaires se composent le plus souvent de variables déterministes car elles sont simples à collecter. Il est également possible d’intégrer de la variabilité ou de l’incertitude pour les paramètres composant un modèle. De cette manière, les variables sont représentées dans une distribution statistique.
46Les modèles secondaires ont déjà fait l’objet de travaux de synthèse (Ross et al., 2003a). La section suivante traite du gamma concept et donne un aperçu des modèles secondaires de croissance et du temps de latence actuellement disponibles avec une discussion sur leurs utilisations pratiques.
47Le gamma concept. Le gamma concept a été introduit par Zwietering et al. (1992) et s’appuie sur deux principes :
481. tous les facteurs mesurables, ayant une influence sur le taux de croissance (µ), sont indépendants et interviennent de façon multiplicative :
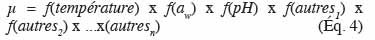
492. l’effet de chaque facteur sur la vitesse de croissance peut être représenté par une fraction du taux de croissance maximum

50où représente une fonction prenant en compte le ou les facteurs ayant une influence sur μopt, la vitesse de croissance optimale.
51Dans les conditions optimales de croissance, chaque micro-organisme a une vitesse de croissance optimale reproductible. Sous des conditions défavorables de croissance, la vitesse de croissance diminue de manière prévisible et peut être calculée à partir de la vitesse de croissance optimale comme indiqué dans l’équation n°7. L’inhibition de la croissance, produite par chaque facteur, à des conditions sous-optimales, est représentée par le facteur de croissance « gamma » ().
52Modèles de type racine carrée. Un modèle purement empirique a été proposé afin de modéliser l’effet de la température sur le taux de croissance (Ratkowsky et al., 1983). Les taux de croissance ont été transformés par une racine carrée afin de stabiliser leurs variances. Ce type de modèle ainsi que tous les modèles en découlant seront appelés des modèles de type « racine carrée ».

53où b est un paramètre constant du modèle obtenu par régression, T est la température en °C et Tmin est la température minimum de croissance qui doit être de 5 à 10 °C inférieure par rapport à la température observée (McKellar et al., 2004). Le modèle de type « racine carrée » continue à être développé pour obtenir des extensions du modèle (Wijtzes et al., 2001) :
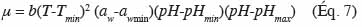
54où les paramètres b, T, Tmin ont été définis précédemment, pH et aw sont respectivement le pH et l’activité de l’eau du milieu, pHmin et aw min sont le pH et l’activité de l’eau minimaux de croissance pour le micro-organisme. D’autres extensions du modèle ont été suggérées incluant la concentration, les interactions entre le pH et la concentration en acide lactique (Ross et al., 2003b).
55Les modèles de type racine carrée peuvent également être utilisés dans le gamma concept. La vitesse de croissance optimale (opt) est la vitesse où toutes les conditions environnementales sont optimales telles que la température (Topt), le pH (pHopt), l’activité de l’eau (aw opt), etc. L’effet combiné de plusieurs facteurs environnementaux est alors déterminé par multiplication de leurs facteurs gamma respectifs (Zwietering et al., 1996):
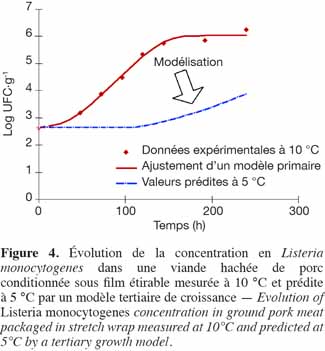
56Suivant les principes expliqués ci-dessus, un seul test de croissance avec une espèce bactérienne pathogène en condition optimale sur un produit particulier suffirait à déterminer son opt et, par conséquent, d’appliquer le modèle sous différentes conditions sous-optimales.
57Pour les bactéries d’altération présentes dans les denrées alimentaires stockées à faible température, les paramètres tels que Topt, awopt ou opt sont souvent inconnus. Dans ces conditions, il est préférable d’utiliser des modèles plus simples n’incluant pas les valeurs optimales de croissance (Gimenez et al., 2004).
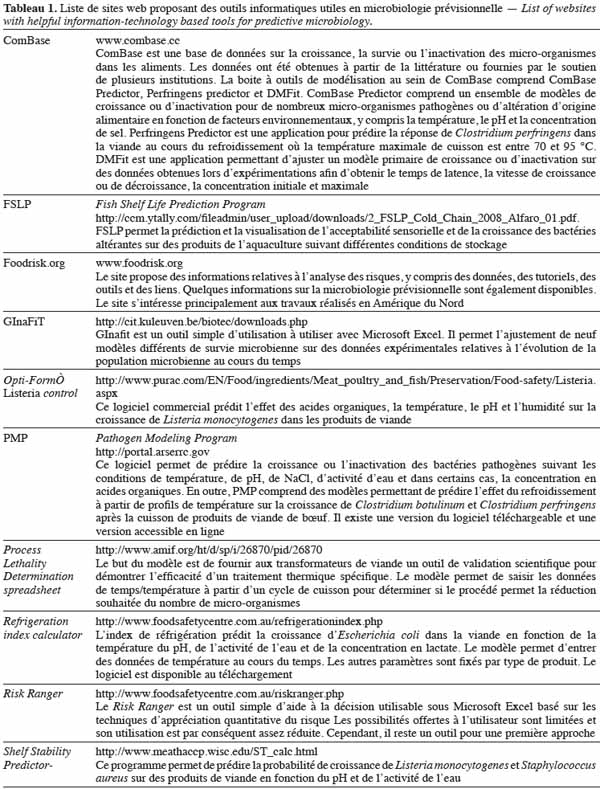
58Modèle cardinal. Les modèles cardinaux sont des modèles empiriques de plus en plus utilisés (Le Marc et al., 2002 ; Van Derlinden et al., 2008). Un paramètre cardinal a une signification biologique. Ce modèle est basé sur le même principe d’utilisation que le modèle gamma, à savoir que l’influence de chaque effet environnemental peut être intégré dans une fonction par des facteurs multiplicatifs :

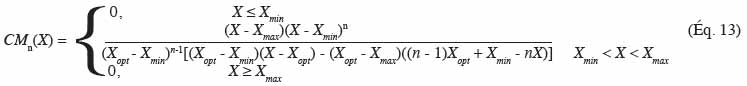
59où CM est l’acronyme de modèle cardinal, X est un facteur environnemental, Xmin est la valeur cardinale minimale de croissance, Xopt est la valeur cardinale optimale de croissance pour laquelle max atteint sa valeur optimale opt, Xmax est la valeur cardinale maximale de croissance et n est un paramètre de forme.
60Les équations 14 et 15 montrent le modèle cardinal incluant l’effet de la température, du pH, de l’activité de l’eau, de substances inhibitrices (ci) et des facteurs qualitatifs (kj) sur la vitesse de croissance optimale (Rosso et al., 1995) :
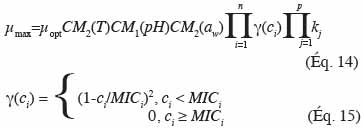
61où MICi est la concentration minimale inhibitrice du composé au-delà de laquelle aucune croissance n’est possible, toutes les autres variables ayant été définies précédemment. Les facteurs qualitatifs concernent l’effet de flores de compétition ou l’effet de la matrice alimentaire (Augustin et al., 2000).
62L’avantage du modèle cardinal est qu’il permet de représenter l’ensemble de la gamme de valeurs du paramètre X représenté dans la figure 3 pour la température et le pH. Les valeurs utilisées dans les représentations du modèle cardinal pour la température et le pH de la figure 3 proviennent de l’étude d’Ellouze et al. (2010).
63Le modèle cardinal peut également tenir compte d’un phénomène bi-phasique dans la modélisation de la vitesse de croissance en fonction de la température (Le Marc et al., 2002). Les modèles cardinaux sont de plus en plus utilisés car ils sont simples avec des paramètres facilement interprétables et mesurables, et les hypothèses sous-jacentes à ce type de modèle peuvent s’appliquer dans une large variété d’environnements différents. Cependant, il est important de tenir compte des interactions possibles entre facteurs (Le Marc et al., 2002).
64Les modèles polynomiaux. Les modèles polynomiaux, aussi appelés les modèles « bulldozers » (Luning et al., 2007), permettent de décrire la vitesse de croissance d’une bactérie en fonction de plusieurs facteurs environnementaux (Delignette-Muller et al., 1995). Ces modèles sont encore largement utilisés pour leur facilité de mise en œuvre. Un modèle incluant plus de deux facteurs s’écrit :
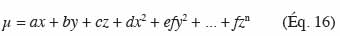
65où x, y,…z représentent les facteurs environnementaux. Les modèles polynomiaux donnent des prévisions acceptables uniquement dans le domaine où ils ont été établis. Les paramètres a, b, c… n’ont aucune signification biologique ou concrète, ils permettent juste au modèle de s’ajuster au mieux au jeu de données.
5.2. Modèle secondaire pour le temps de latence
66Plusieurs définitions ont été proposées pour le temps de latence (Swinnen et al., 2004). Parmi celles-ci, on peut définir le temps de latence de cellules individuelles comme étant le temps entre l’inoculation d’une cellule et le moment de sa division (Pirt, 1975). Au niveau d’une population, le temps de latence apparent est défini comme le temps nécessaire pour la multiplication par deux de la population (Buchanan et al., 1972). Buchanan et al. (1990) ont défini le temps de latence en calculant la dérivée seconde du modèle primaire de Gompertz, le temps auquel l’accélération de la croissance est maximale correspond au temps de latence. La définition communément admise est le temps correspondant à l'intersection entre la tangente au point d'inflexion de la phase exponentielle de la courbe de croissance et l'horizontale passant par l'ordonnée à l'origine de la courbe de croissance (Figure 1) (Brul et al., 2007).
67Le temps de latence ne dépend pas uniquement de l’environnement actuel, mais aussi de l’environnement précédent et de l’état physiologique des bactéries. De ce fait, le développement de modèles secondaires pour prédire le temps de latence est compliqué. Deux approches ont été adoptées pour modéliser le temps de latence : la première considère que le temps de latence et la vitesse de croissance doivent être modélisés séparément (Ratkowsky et al., 1982), la deuxième considère que le temps de latence est proportionnel au temps de génération des bactéries car celles-ci doivent réaliser une certaine quantité de travail pour s’adapter à leur nouvel environnement (Robinson et al., 1998). Il existe donc dans cette dernière approche une corrélation entre le temps de latence et l’inverse du taux de croissance. Pour des conditions de pré-incubations identiques, on a l’équation suivante :

68où k est une constante pour des conditions de pré-incubation données représentant une quantité de travail. Si l’on connait la valeur k, alors l’estimation du temps de latence peut être déduite de max.
69Lorsque le taux de croissance est optimal, le temps de latence est minimal. On a alors :

70En intégrant la valeur de k de l’équation 17 dans l’équation 18 :

71Dans une approche cardinale, on peut déduire l’équation suivante (Le Marc, 2001) :
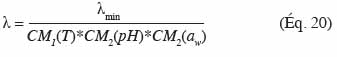
72Il apparait que le temps de latence est très variable, tandis que la constante k est assez stable et reproductible. Cette approche permet de simplifier la modélisation du temps de latence et de la vitesse de croissance par un modèle unique de croissance. Il est possible d’attribuer une distribution à la valeur k dans une approche stochastique lorsque, par exemple, la valeur k est inconnue.
6. Les modèles tertiaires
73Les modèles utilisant des systèmes experts et des bases de données pour faire le lien entre les modèles primaires et secondaires sont appelés modèles tertiaires. Un système expert est un logiciel capable de répondre à des questions, en effectuant une relation à partir de faits (base de données) et de règles connues (modèles primaires et secondaires). Les modèles tertiaires sont donc constitués d’une base de données permettant de sélectionner la matrice alimentaire et les micro-organismes d’intérêt.
74À partir de données collectées pour un micro-organisme dans une matrice alimentaire déterminée dans des conditions environnementales connues (test de croissance), un modèle tertiaire permet de prédire l’évolution de ce micro-organisme dans des conditions environnementales différentes dans la plage d’interpolation pour laquelle les données sont disponibles dans la base de données. Si le modèle est utilisé en dehors de la plage d’interpolation, l’utilisateur doit être conscient de l’incertitude sur le résultat.
75La figure 4 donne un exemple de modélisation de la croissance de Listeria monocytogenes dans de la viande hachée de porc conditionnée sous film étirable. Les données expérimentales ont été collectées à une température fixée à 10 °C. À partir de données expérimentales complétées par des données bibliographiques, le comportement de Listeria monocytogenes dans de la viande hachée de porc conditionnée sous film étirable peut être modélisé à une température de 5 °C.
76À titre d’exemple de modèle tertiaire, on peut citer Sym’Previus, PMP et SSSP. Ces logiciels comprennent une base de données et des modèles de croissance ou d'inactivation de bactéries pathogènes ou d’altération d'origine alimentaire et ne nécessitent pas d’intégrer des résultats issus d’expériences de laboratoire. Cependant, même si ces logiciels possèdent une base de données importante, il est préférable de réaliser un test de croissance en laboratoire afin de réaliser des simulations sur base de données issues directement de la denrée alimentaire d’intérêt.
77Le tableau 1 présente une synthèse des logiciels et des bases de données disponibles sur internet pour réaliser des études en microbiologie prévisionnelle.
7. La validation
78Une des étapes les plus importantes dans le développement et l’utilisation d’un modèle est de s’assurer que celui-ci est applicable en situation réelle pour des denrées alimentaires. Beaucoup de modèles ont été développés sur base d’expérimentations en milieux de culture et il est important de s’assurer de la transposition aux denrées alimentaires, ce qui correspond à un environnement très différent (flore bactérienne d’origine, structure de la matrice). Le principe est simple : il faut comparer les prédictions des modèles avec des résultats indépendants de ceux qui ont servi à établir le modèle (McKellar et al., 2004).
79La validation peut se réaliser en deux étapes (te Giffel et al., 1999) :
80– la validation mathématique, qui consiste à vérifier que les écarts entre les valeurs théoriques prévues par le modèle et les données obtenues dans les conditions qui ont servi à le construire ne sont pas excessifs,
81– la validation dans des produits, qui consiste à vérifier que les écarts entre les valeurs théoriques prévues par le modèle construit à partir des données obtenues en conditions expérimentales et les valeurs réelles obtenues sur des produits industriels contaminés naturellement ne sont pas excessifs.
82Si le modèle a été validé, il peut être utilisé pour la prévision, à condition de se limiter, pour ce qui concerne la variation des facteurs, à la gamme des valeurs comprises entre les valeurs qui ont fait l’objet de la validation. Il faut éviter l’extrapolation ou être conscient des risques qu’on prend en la pratiquant (Baranyi et al., 1996).
83Idéalement, la validation se base sur des données obtenues lors d’expériences de laboratoire réalisées dans les mêmes conditions que pour l’obtention du modèle. Cependant, l’obtention de telles données est couteuse en temps et en énergie. L’utilisation de données issues de la littérature permet également de réaliser la validation des modèles. L’utilisation de ces données est basée sur l’hypothèse que les conditions appliquées aux expériences issues de la littérature ne diffèrent pas significativement des expériences réalisées dans le cadre du développement du modèle. Les conditions d’expérience doivent être idéalement identiques telles que les conditions de pré-incubation de la souche bactérienne où la composition du milieu ne doit pas être composée de substances ayant une influence importante sur la croissance de la bactérie comme un additif de conservation. Miconnet et al. (2005) proposent une réflexion sur l’incertitude des paramètres de croissance obtenus à partir de données collectées lors de tests de croissance (challenge tests).
84On reproche souvent à la microbiologie prévisionnelle un caractère pessimiste. En effet, on considère qu’un modèle n’est valide que s’il ne sous-estime pas le risque. Mais le plus souvent, les valeurs observées sont très inférieures aux prévisions. Ainsi, les durées de conservation prédites sont très inférieures aux durées de conservation réelles, ce qui est pénalisant pour les producteurs de denrées alimentaires.
85Les modèles qui ont été publiés ces dernières années, avec leurs nombreuses qualités, ne permettent pas toujours de refléter les résultats relevés lors de la croissance ou l’inactivation des micro-organismes sur la denrée alimentaire. De plus, il est maintenant clair que des souches génétiquement proches ne se comportent pas de manières identiques (Beaufort et al., 2008). Par ailleurs, au sein d’une même population, il existe des différences de comportement entre les différents individus (Guillier et al., 2005). Ces problèmes peuvent se révéler d’une importance capitale depuis que les industriels explorent les possibilités d’utiliser des processus et des techniques de travail permettant de réaliser un produit au meilleur cout, mais également le plus proche possible des limites des conditions de destruction ou de réduction des micro-organismes. De ce fait, cela requiert une plus grande précision et une validation plus fine des modèles utilisés dans l’industrie semble nécessaire.
8. Les tests de croissance
86Le suivi d’une cinétique de croissance microbienne sur les aliments via un test de croissance est un des outils à maitriser pour collecter des paramètres pour les modèles de microbiologie prévisionnelle. Le principe général consiste à inoculer l’aliment considéré, et à mesurer l’évolution de la concentration microbienne en fonction du temps, de façon à tracer une courbe de croissance. Le dénombrement classique sur milieu gélosé est encore très courant. Cependant, cette technique se révèle longue et fastidieuse. Il existe des méthodes alternatives, mais encore peu utilisées, pour suivre la flore sur les aliments. À partir des données expérimentales, un modèle pourrait être construit pour établir un lien entre les conditions expérimentales et la croissance des souches considérées. On travaille directement à partir de l’aliment considéré et non pas sur un milieu de culture, afin de tenir compte de l’effet structure et des phénomènes de compétition entre la flore banale et la bactérie d’intérêt (Luning et al., 2007).
87La mise en place d’un tel protocole nécessite que seuls des laboratoires ayant une expertise suffisante dans le domaine puissent l’utiliser. De plus, les conditions d’expérience sont différentes lorsque l’on développe un modèle ou lorsque l’on désire utiliser un modèle pour représenter la réalité avec sa complexité (effet matrice, effet flore, variabilité entre les souches de bactéries, etc).
9. Conclusion
88Cette synthèse donne un aperçu de l’étendue des modèles de microbiologie prévisionnelle pour l’agro-alimentaire. Le nombre de modèles disponibles est en constante augmentation, avec parfois un niveau élevé de complexité. Cependant, la microbiologie prévisionnelle offre de nombreuses perspectives d’utilisation et est sur le point de se généraliser dans une démarche de maitrise des dangers microbiens dans une chaine alimentaire. Dans les prochaines années, la prévision de la durée de conservation, de la sécurité et de la qualité à partir des modèles, se développera à mesure que l’accès aux bases des modèles sera rendu plus aisé et que les modèles seront validés plus largement au niveau international.
89Bien que cette discipline arrive à maturité, de nombreux travaux doivent encore être menés. Les futures recherches s’intéresseront certainement aux comportements de cellules individuelles et non plus à une population. Les modèles intégrés doivent être développés pour modéliser tous les phénomènes engendrés lors de la croissance de bactéries sur un aliment. La mise au point de techniques simples et rapides de dénombrement des bactéries sur des denrées alimentaires au cours du temps doit encore être réalisée pour alléger le travail de laboratoire. Enfin, la validation reste une priorité puisque des modèles doivent prouver leurs capacités de prédiction pour des aliments complexes. Cette validation est nécessaire pour que cette discipline soit généralisée et employée comme méthode de routine en complément des méthodes actuelles.
90Remerciements
91Les auteurs souhaitent remercier chaleureusement Monsieur le Professeur Jean-Christophe Augustin pour la lecture du manuscrit et pour les suggestions d’améliorations. Les auteurs souhaitent également remercier la Région wallonne pour son support financier (Projet Consalim, DGO6, Convention n°5713, 2008-2011, http://www.wagralim.be/consalim.php).
Bibliographie
Augustin J.-C. & Carlier V., 2000. Mathematical modelling of the growth rate and lag time for Listeria monocytogenes. Int. J. Food Microbiol., 56(1), 29-51.
Baranyi J., 1997. Simple is good as long as it is enough. Food Microbiol., 14(2), 189-192.
Baranyi J., Mc Clure P.J., Sutherland J.P. & Roberts T.A., 1993. Modeling bacterial growth responses. J. Ind. Microbiol., 12, 190-194.
Baranyi J. & Roberts T.A., 1994. A dynamic approach to predicting bacterial growth in food. Int. J. Food Microbiol., 23(3-4), 277-294.
Baranyi J., Ross T., McMeekin T.A. & Roberts T.A., 1996. Effects of parameterization on the performance of empirical models used in 'predictive microbiology'. Food Microbiol., 13(1), 83-91.
Beaufort A., Cornu M., Bergis H. & Lardeux A.L., 2008. Technical guidance document: on shelf-life studies for Listeria monocytogenes in ready-to-eat foods. Paris : EU Community Reference Laboratory for Listeria monocytogenes.
Bigelow W., 1921. The logarithmic nature of thermal death time curves. J. Infect. Dis., 29, 528-536.
Brul S., van Gerwen S. & Zwietering M., 2007. Modelling microorganisms in foods. Cambridge, UK: Woodhead Publishing Limited.
Buchanan R.E., 1918. Life phases in a bacterial culture. J. Infect. Dis., 23, 109-125.
Buchanan R.L. & Solberg M., 1972. Interaction of sodium nitrite, oxygen and pH on growth of Staphylococcus aureus. J. Food Sci., 37, 81-85.
Buchanan R.L. & Cygnarowicz M.L., 1990. A mathematical approach toward defining and calculating the duration of the lag phase. Food Microbiol., 7(3), 237-240.
Buchanan R.L., Whiting R.C. & Damert W.C., 1997. When is simple good enough: a comparison of the Gompertz, Baranyi, and three-phase linear models for fitting bacterial growth curves. Food Microbiol., 14(4), 313-326.
Corroler L., 2006. Étude des facteurs non thermiques agissant sur la décroissance microbienne et modélisation. Thèse de doctorat : Université de Bretagne occidentale (France).
Delhalle L. et al., 2009. Development of predictive modelling tools for food business operators to comply with European food law. In: Thirteenth Conference on Food Microbiology, June 18-19, 2009, University of Liege, Liege, Belgium, 94-95.
Delignette-Muller M.L., Rosso L. & Flandrois J.P., 1995. Accuracy of microbial growth predictions with square root and polynomial models. Int. J. Food Microbiol., 27(2-3), 139-146.
Ellouze M. & Augustin J.-C., 2010. Applicability of biological time temperature integrators as quality and safety indicators for meat products. Int. J. Food Microbiol., 138(1-2), 119-129.
Esty J.R. & Meyer K.F., 1922. The heat resistance of the spores of B. botulinus and related anaerobes. J. Infect. Dis., 31, 650-663.
EU, 2002. Regulation (EC) No 178/2002 of the European Parliament and of the Council of 28 January 2002 laying down the general principles and requirements of food law, establishing the European Food Safety Authority and laying down procedures in matters of food safety. Off. J. Eur. Union, L31/1-24.
EU, 2004a. Regulation (EC) No 852/2004 of the European Parliament of 29 April 2004 on the hygiene of foodstuffs. Off. J. Eur. Union, 226/3-226/21.
EU, 2004b. Regulation (EC) No 853/2004 of the European Parliament and of the Council of 29 April 2004 laying down specific hygiene rules for food of animal origin. Off. J. Eur. Union, 001.001/1-59.
EU, 2004c. Regulation (EC) No 854/2004 of the European Parliament and of the Council of 29 April 2004 laying down specific rules for the organisation of official controls on products of animal origin intended for human consumption. Off. J. Eur. Union, L226/83-L226/127.
EU, 2004d. Regulation (EC) No 882/2004 of the European Parliament and of the Council of 29 April 2004 on official controls performed to ensure the verification of compliance with feed and food law, animal health and animal welfare rules. Off. J. Eur. Union, L165/1-L165/141.
EU, 2005. Regulation (EC) No 183/2005 of the European Parliament and of the Council of 12 January 2005 laying down requirements for feed hygiene. Off. J. Eur. Union, L35/1-L35/22.
European Food Safety Authority, 2010. The Community summary report on trends and sources of zoonoses. Zoonotic agents, antimicrobial resistance and foodborne outbreaks in the European Union in 2008. Parma, Italy: European Food Safety Authority.
Gimenez B. & Dalgaard P., 2004. Modelling and predicting the simultaneous growth of Listeria monocytogenes and spoilage micro-organisms in cold-smoked salmon. J. Appl. Microbiol., 96(1), 96-109.
Guillier L. & Augustin J.-C., 2005. Influence of stress on individual lag time distributions of Listeria monocytogenes. Appl. Environ. Microbiol., 71(6), 2940-2948.
Hills B.P. & Wright K.M., 1994. A new model for bacterial growth in heterogeneous systems. J. Theor. Biol., 168(1), 31-41.
Le Marc Y., 2001. Développement d'un modèle modulaire décrivant les effets des interactions entre les facteurs environnementaux sur les aptitudes de croissance de Listeria. Thèse de doctorat : Université de Bretagne occidentale (France).
Le Marc Y. et al., 2002. Modelling the growth kinetics of Listeria as a function of temperature, pH and organic acid concentration. Int. J. Food Microbiol., 73(2-3), 219-237.
Le Marc Y., Pin C. & Baranyi J., 2005. Methods to determine the growth domain in a multidimensional environmental space. Int. J. Food Microbiol., 100(1-3), 3-12.
Likar K. & Jevsnik M., 2006. Cold chain maintaining in food trade. Food Control, 17(2), 108-113.
Lôpez S. et al., 2004. Statistical evaluation of mathematical models for microbial growth. Int. J. Food Microbiol., 96(3), 289-300.
Luning P.A., Devlieghere F. & Verhé R., 2007. Safety in the agri-food chain. Wageningen, The Netherlands: Wageningen Academic.
McKellar R.C., 1997. A heterogeneous population model for the analysis of bacterial growth kinetics. Int. J. Food Microbiol., 36(2-3), 179-186.
McKellar R.C. & Lu X., 2004. Modelling microbial responses in food. Boca Raton, FL, USA: CRC Press.
Miconnet N. et al., 2005. Reflections on the use of robust and least-squares non-linear regression to model challenge tests conducted in/on food products. Int. J. Food Microbiol., 104(2), 161-177.
Pal A., Labuza T.P. & Diez-Gonzalez F., 2008. Comparison of primary predictive models to study the growth of Listeria monocytogenes at low temperatures in liquid cultures and selection of fastest growing ribotypes in meat and turkey product slurries. Food Microbiol., 25(3), 460-470.
Pirt S.J., 1975. Principles of microbe and cell cultivation. London, UK: John Wiley & Sons.
Ratkowsky D.A., Olley J., McMeekin T.A. & Ball A., 1982. Relationship between temperature and growth rate of bacterial cultures. J. Bacteriol., 149(1), 1-5.
Ratkowsky D.A. et al., 1983. Model for bacterial culture growth rate throughout the entire biokinetic temperature range. J. Bacteriol., 154(3), 1222-1226.
Robinson T.P., Ocio M.J., Kaloti A. & Mackey B.M., 1998. The effect of the growth environment on the lag phase of Listeria monocytogenes. Int. J. Food Microbiol., 44(1-2), 83-92.
Ross T., Baranyi J. & McMeekin T.A., 2000. Predictive microbiology and food safety. London, UK: Academic Press.
Ross T. & Dalgaard P., 2003a. Modelling microbial responses in food: secondary models. New York, USA: CRC Press.
Ross T., Ratkowsky D.A., Mellefont L.A. & McMeekin T.A., 2003b. Modelling the effects of temperature, water activity, pH and lactic acid concentration on the growth rate of Escherichia coli. Int. J. Food Microbiol., 82(1), 33-43.
Rosso L., Lobry J.R., Bajard S. & Flandrois J.P., 1995. Convenient model to describe the combined effects of temperature and pH on microbial growth. Appl. Environ. Microbiol., 61(2), 610-616.
Scott W.J., 1937. The growth of microorganisms on ox muscle, the influence of temperature. J. Counc. Sci. Ind. Res. Aust., 10, 338-350.
Swinnen I.A.M. et al., 2004. Predictive modelling of the microbial lag phase, a review. Int. J. Food Microbiol., 94(2), 137-159.
te Giffel M.C. & Zwietering M.H., 1999. Validation of predictive models describing the growth of Listeria monocytogenes. Int. J. Food Microbiol., 46(2), 135-149.
Van Derlinden E., Bernaerts K. & Van Impe J.F., 2008. Accurate estimation of cardinal growth temperatures of Escherichia coli from optimal dynamic experiments. Int. J. Food Microbiol., 128(1), 89-100.
Whiting R.C. & Buchanan R.E., 1993. Letter to the editor: a classification of models in predictive microbiology. A reply to K.R. Davey. Food Microbiol., 10, 175-177.
Wijtzes T. et al., 2001. Development and validation of a combined temperature, water activity, pH model for bacterial growth rate of Lactobacillus curvatus. Int. J. Food Microbiol., 63(1-2), 57-64.
Zwietering M.H., Wijtes T., De Wit J.C. & van't Riet K., 1992. A decision support system for prediction of the microbial spoilage in foods. J. Food Prot., 55, 973-979.
Zwietering M.H., de Wit J.C. & Notermans S., 1996. Application of predictive microbiology to estimate the number of Bacillus cereus in pasteurised milk at the point of consumption. Int. J. Food Microbiol., 30(1-2), 55-70.
Pour citer cet article
A propos de : Laurent Delhalle
Univ. Liège. Département des Sciences des Denrées alimentaires. B43bis Sart-Tilman. B-4000 Liège (Belgique). E-mail : l.delhalle@ulg.ac.be
A propos de : Georges Daube
Univ. Liège. Département des Sciences des Denrées alimentaires. B43bis Sart-Tilman. B-4000 Liège (Belgique).
A propos de : Ysabelle Adolphe
Univ. Liège. Département des Sciences des Denrées alimentaires. B43bis Sart-Tilman. B-4000 Liège (Belgique).
A propos de : Sébastien Crevecoeur
Univ. Liège. Département des Sciences des Denrées alimentaires. B43bis Sart-Tilman. B-4000 Liège (Belgique).
A propos de : Antoine Clinquart
Univ. Liège. Département des Sciences des Denrées alimentaires. B43bis Sart-Tilman. B-4000 Liège (Belgique).






