Embryogenèse précoce comparative lors des croisements entre Phaseolus coccineus L. et Phaseolus vulgaris L.
Faculté universitaire des Sciences agronomiques de Gembloux. Unité de Phytotechnie tropicale et Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : nguema.p@fsagx.ac.be
Faculté universitaire des Sciences agronomiques de Gembloux. Unité de Phytotechnie tropicale et Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Faculté universitaire des Sciences agronomiques de Gembloux. Unité de Phytotechnie tropicale et Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Reçu le 30 août 2005, accepté le 29 août 2006.
Résumé
L’hybridation interspécifique entre Phaseolus coccineus L. et Phaseolus vulgaris L. est utile pour l'amélioration génétique du haricot commun. L’utilisation du cytoplasme de P. vulgaris lors de ces hybridations aboutit généralement à un retour plus ou moins rapide à la forme maternelle dans les générations ultérieures. Lorsque P. vulgaris est pollinisateur, les croisements se soldent par des avortements d’embryons à un stade précoce de leur développement (embryons globulaire ou cordiforme). Une compétition entre l’albumen et l’embryon, d’une part, et entre le suspenseur et l’embryon, d’autre part, conduirait à des difficultés d’alimentation du jeune embryon. Des coupes histologiques fines en résine de Méthacrylate de 2-Hydroxyéthyle (HEMA) réalisées sur des embryons des génotypes de P. coccineus (NI16) et P. vulgaris (NI637 et X707), ainsi que leur combinaison génotypique (NI16 x NI637 et NI16 x X707 dans les deux sens du croisement), permettent d’expliquer partiellement ces avortements. Les observations portent sur des embryons âgés de 3 à 6 jours après pollinisation (JAP). Le développement de l'embryon (suspenseur et embryon proprement dit) est plus lent dans le cas des hybrides que chez les génotypes parentaux quel que soit le sens du croisement. Les invaginations des cellules de base du suspenseur, observées lorsque P. coccineus est parent femelle sont caractéristiques du cytoplasme de ce dernier. La dégradation (ou prolifération) de l’endothélium chez les embryons hybrides serait plutôt liée au degré atteint par le processus d’avortement de l’embryon concerné.
Abstract
Comparative early embryogenesis in crossings between Phaseolus coccineus L. and Phaseolus vulgaris L. The interspecific hybridization between Phaseolus coccineus L. and Phaseolus vulgaris L. is useful for the genetic improvement of the common bean. The use of the P. vulgaris cytoplasm for such hybridizations leads usually to a rather fast return to the maternal form in the subsequent generations. When P. vulgaris is the pollinator, crosses result in early embryo abortion (globular or heart-shaped embryos). A competition between the endosperm and the embryo, on the one hand, and between the suspensor and the embryo, on the other hand, could generate difficulties of feeding young embryos. Histological sections using the 2-Hydroxyethyl Methacrylate (HEMA) resin method on the embryos of P. coccineus (NI16) and P. vulgaris (NI637 and X707) genotypes, as well as on their genotypic combination (NI16 x NI637 and NI16 x X707 and reciprocal crosses) enable us to explain partially these abortion cases. Observations concern embryos from 3 to 6 days after pollination (DAP). Embryo development (suspensor and embryo proper) of the hybrids is slower than that of the parents whatever the crossing. Ingrowths of suspensor basal cells observed when P. coccineus is the maternal parent are characteristic of the presence of the cytoplasm of these species. Endothelium deterioration (or proliferation) in hybrid embryos would rather be related to the degree reached by the process of abortion in the embryo concerned.
1. Introduction
1L’hybridation interspécifique est souvent utilisée pour faciliter l’échange génétique chez de nombreux végétaux. Au sein du genre Phaseolus (Debouck, Smartt, 1995), le stade auquel aboutit le développement de l’embryon hybride dépend de la combinaison interspécifique ainsi que du sens du croisement (Mok et al., 1986 ; Sabja et al., 1990 ; Nguema et al., 2004). Pour améliorer la résistance du haricot commun (Phaseolus vulgaris L.) aux maladies et ravageurs, on fait appel à deux espèces donneuses du pool génique primaire : P. coccineus L. et P. polyanthus Greenm. Ces hybridations se heurtent cependant aux barrières d’incompatibilité (Baudoin, 2001) et aboutissent très régulièrement à l’avortement précoce des embryons (Geerts et al., 2002).
2Certaines structures embryonnaires jouent un rôle important dès la double fécondation jusqu’au stade cordiforme de développement de l’embryon (Lester, Kang, 1998 ; Mattys-Rochon et al., 1998 ; Devic, Guilleminot, 2001). C’est le cas du suspenseur qui, d'une part constitue un support physique pour l'embryon (Yeung, Meinke, 1993 ; Yeung et al., 1996) et, d'autre part, intervient au cours de la phase préliminaire du développement de la graine grâce à son rôle structural, de stockage et de véhicule de nutriments vers l’embryon (Harada, 1999 ; Guyon et al., 2002 ; Lopez-Almansa et al., 2004). Le suspenseur est constitué d'au moins dix cellules (Yeung et al., 1996) lorsque l'embryon atteint le stade cordiforme.
3Une étude histologique comparative des embryons de même âge, autofécondés et hybrides devrait permettre de comprendre les mécanismes d'incompatibilité impliqués.
4Ce travail vise à caractériser les changements morphologiques que l'embryon subit lors des premières étapes de la croissance. Ces observations contribueront à une meilleure connaissance du développement d’embryons zygotiques et pourraient suggérer des solutions pour contourner les dites barrières et obtenir des hybrides viables.
2. Matériel et méthodes
2.1. Matériel végétal et conditions de culture
5Les génotypes utilisés sont NI16 de P. coccineus, NI637 et X707 de P. vulgaris. Ils sont respectivement d'origine rwandaise, brésilienne et colombienne. Ils sont identifiés par leur numéro d'introduction (NI) ou leur numéro d'attente d'introduction (X) au Jardin Botanique National de Belgique.
6Les semences sont scarifiées, puis mises en pré-germination dans des boîtes de Pétri, sur papier filtre imbibé d’eau distillée. Elles passent deux à trois jours à l’obscurité dans une étuve (24 ± 1 °C). L’apparition des premiers organes radiculaires et/ou foliaires marque la levée. Les plants sont empotés dans du terreau et placés dans une chambre conditionnée, caractérisée par
7– une température jour/nuit de 24/20 °C,
8– une humidité relative de 75 % ± 20 %,
9– une photopériode jour/nuit de 12 h/12 h,
10– une irradiance de 170 µmol.m-2.s-1.
11Le substrat est composé de : 80 % de terreau Klasmann 4 spécial n°26, 15 % de tourbe, 5 % de sable du Rhin et d’engrais organique (environ 6 g/10 l de mélange). Il est régulièrement arrosé et enrichi par une solution nutritive (Otoul, Le Marchand, 1974) dès la huitième semaine après le semis.
2.2. Pollinisations
12Les génotypes de P. vulgaris (NI637 et X707) sont autogames, tandis que la pollinisation est réalisée manuellement chez le génotype NI16 de l'espèce allogame P. coccineus. Les croisements interspécifiques sont réalisés selon la méthode de Buishand (1956).
2.3. Protocole histologique
13Le protocole histologique est celui utilisé par Lecomte (1997), décrit par Ruzin (1999) et amélioré par Geerts (2001).
14Les objets sont fixés dans une solution à base de glutaraldéhyde (1,25 %) et de paraformaldéhyde (4 %). Une série de trois rinçages est ensuite effectuée dans un mélange équilibré de NaH2PO4.2H2O et Na2HPO4.2H2O. Les échantillons sont déshydratés dans un gradient croissant de concentration d’alcool éthylique (30 %, 50 %, 70 %, 90 %, 95 % et 100 %). La pré-infiltration est faite dans un mélange de résine pure (™Technovit 7100) et d’éthanol absolu (50/50). Elle est suivie de l’infiltration proprement dite, puis de l’enrobage des objets pour l'obtention des histoblocs en résine dans du Méthacrylate de 2-Hydroxyéthyle (HEMA). Enfin, des coupes de 3 à 5 µm sont effectuées à l'aide d'un microtome rotatif (Micron H360) équipé de couteaux Ralf en verre. Les coupes sériées sont réalisées dans l'axe longitudinal des ovules en vue d'observer l'embryon et le suspenseur dans toute leur longueur. Elles sont ensuite colorées au bleu de toluidine selon la procédure de Gutmann (1995) pour l’observation générale des structures.
15Les lames porte-objet sont recouvertes de lamelles à l’aide d’une à trois gouttes de l’agent de montage DPX (BDH360294H). Les coupes sont observées à l’aide d’un microscope Nikon (Model Eclipse E800). Les images, prises par une caméra vidéo couleur de type JVC 3-CCD (model KY-F58), sont saisies par le logiciel Archive Plus 4.1 utilisant le contraste Gamma.
2.4. Observations et mesures
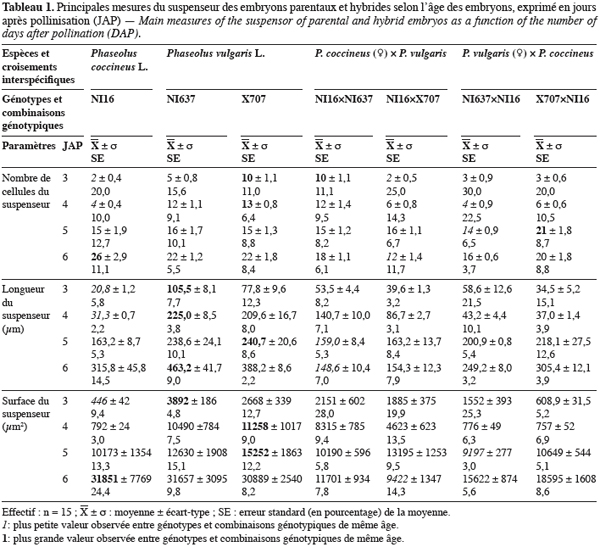
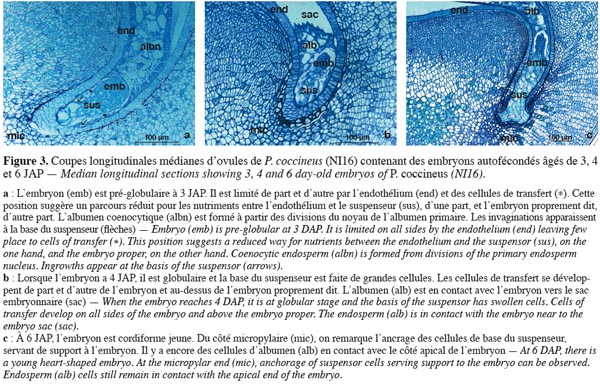
16Dans ce travail, le terme « embryon » se réfère au suspenseur et à la partie organogénétique diploïde de l'embryon dénommé « embryon proprement dit » (Esau, 1965). Le suspenseur est arbitrairement divisé en deux zones pour faciliter la description. La base du suspenseur est élargie et rattachée au tissu maternel. Sa partie supérieure, plus étroite constitue le corps du suspenseur. Les mesures portent sur des coupes longitudinales axiales et médianes d'embryons.
17Les cellules du suspenseur sont comptées. Sa longueur et sa surface sont mesurées à partir du micropyle jusqu'au point de jonction du suspenseur et de l'embryon proprement dit. La longueur de l'embryon est prise suivant l'axe longitudinal, de la base du suspenseur jusqu'à l'extrémité apicale de l'embryon, vers la chalaze. Sa largeur est prise dans sa portion la plus étendue. L'épaisseur de l'endothélium est calculée à partir de mesures faites en différents points tout autour du sac embryonnaire et de l'embryon.
18Les stades successifs de développement de l'embryon peuvent être identifiés. Il s'agit notamment des stades globulaire, cordiforme et cotylédonaire (Brady, Clutter, 1972 ; Walbot et al., 1972).
19La description des principales structures embryonnaires se rapporte notamment au stade de développement de l’embryon, la présence de cellules de l'albumen, l’intégrité de l’endothélium, l’aspect présenté par les cellules basales du suspenseur et le suspenseur lui-même.
20Pour chaque structure embryonnaire observée, cinq mesures sont prises sur trois ovules du génotype ou du croisement concerné. Le calcul des statistiques descriptives des quinze valeurs obtenues est fait à l'aide du logiciel MINITAB 14.
3. Résultats
21Le tableau 1 récapitule les paramètres mesurés sur le suspenseur des embryons âgés de 3 à 6 JAP (jours après pollinisation) issus, d'une part, d'autofécondations des génotypes de P. coccineus (NI16) et P. vulgaris (NI637 et X707) et, d'autre part, des embryons hybrides résultant des croisements réciproques P. coccineus x P. vulgaris.
22A 3 et 4 JAP, le nombre de cellules du suspenseur du génotype X707 est plus élevé par rapport aux autres génotypes et hybrides, tandis que les valeurs minimum se retrouvent chez le génotype NI16 de P. coccineus. A 5 JAP, le nombre de cellules du suspenseur est assez proche entre les génotypes parentaux et les hybrides utilisant NI16 comme parent maternel. A cet âge, le nombre minimum de cellules du suspenseur est de 14 quelle que soit l'origine de l'embryon. Entre 5 et 6 JAP, la croissance du nombre de cellules du suspenseur se poursuit, excepté dans les combinaisons génotypiques réciproques impliquant NI16 et X707. A 6 JAP, NI16 présente une valeur plus élevée pour l'ensemble des observations, soit 26 cellules.
23La longueur du suspenseur à 3 et 4 JAP est plus faible chez le génotype NI16, et plus élevée chez le génotype NI637. A 5 et 6 JAP, les génotypes de P. vulgaris (NI637 et X707) atteignent le stade cotylédonaire et la longueur de leur suspenseur est maximale. Par contre, chez les embryons issus des croisements utilisant le cytoplasme de NI16, les tailles des suspenseurs sont plus petites et demeurent inférieures à 200 µm aux mêmes âges. Dans l'ensemble, la croissance du suspenseur se poursuit chez tous les embryons parentaux lors de nos observations. Il continue à se développer dans les croisements utilisant NI16 comme pollinisateur, contrairement au cas où ce génotype est le parent maternel. Les valeurs sont plus élevées pour la taille du suspenseur et la longueur des embryons chez NI637 et X707 par rapport au génotype NI16.
24L'augmentation de la taille du suspenseur semble liée à l'évolution du nombre de cellules du suspenseur. Chez les génotypes parentaux, ces deux paramètres croissent rapidement et de façon continue. Quel que soit l'âge de l'embryon, le suspenseur des embryons hybrides se caractérise par la faiblesse de sa taille comparativement aux génotypes de P. vulgaris (NI637 et X707). A partir de 5 JAP, le suspenseur du génotype NI16 de P. coccineus devient plus grand que celui des embryons hybrides.
25La surface du suspenseur est croissante chez tous les génotypes et croisements à l'exception de NI16 x X707, où la valeur est la plus petite à 6 JAP par rapport aux différents autres embryons. Le suspenseur de NI16 devient le plus volumineux à 6 JAP. Cette grandeur reste malgré tout proche de celles des autres génotypes parentaux, de même âge. L'emprise des suspenseurs des embryons hybrides est en général inférieure de moitié à celle des embryons parentaux. Le ralentissement de la croissance de la surface du suspenseur chez les embryons hybrides peut expliquer la réduction de la zone de contact entre le suspenseur, les cellules de transfert et les parois endothéliales. Ceci pourrait entraîner une sous-alimentation de l'embryon et résulterait en l'avortement de l'embryon hybride.
26Les figures 1 et 2 montrent l'évolution de la largeur de l'embryon d'une part et la croissance de l'embryon d'autre part chez les génotypes parentaux (P. coccineus et P. vulgaris) et les hybrides réciproques résultant, âgés de 3 à 6 jours après pollinisation (JAP).
27Les embryons de P. vulgaris (NI637 et X707) évoluent plus rapidement que ceux de P. coccineus (NI16).
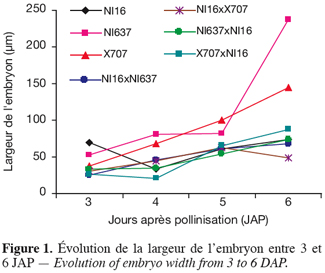
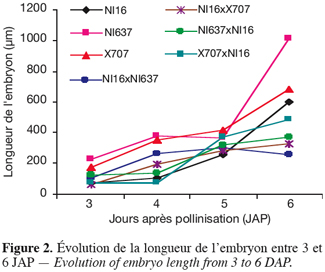
28Dès 3 JAP, les embryons de NI637 présentent une taille plus importante. Chez tous les génotypes parentaux, la courbe de croissance de la longueur de l'embryon est positive. Par contre, lors des hybridations, on observe un ralentissement à 4 JAP, notamment dans la combinaison génotypique NI16 x NI637. Ce fléchissement devient nettement visible à 5 JAP. Il s'agirait d'un moment critique dans le développement de l’embryon et durant lequel le processus d'avortement de l'embryon hybride serait déclenché. En effet, lors des hybridations interspécifiques, les principales structures embryonnaires croissent de la même manière jusqu'à 5 JAP. Au-delà de ce délai, une diminution des valeurs calculées (Tableau 1) et un amoindrissement des courbes d'évolution (Figures 1 et 2) sont remarquables. A 5 et 6 JAP, les embryons issus du croisement entre P. vulgaris (♀) et P. coccineus sont plus grands que ceux issus des croisements réciproques (Figures 1 et 2).
29L'évolution de la largeur et de la longueur des embryons se comporte de la même manière chez tous les génotypes et croisements. L'axe de la coupe n'a pas toujours permis de disposer d'une vue médiane complète de l'embryon. De ce fait, certains embryons, quoique coupés longitudinalement, ne présentent pas leur portion la plus étendue de la largeur. Cela expliquerait en particulier l'évolution en dents de scie de la largeur de l'embryon chez NI16 et NI16 x X707, ainsi que les variations importantes chez NI637.
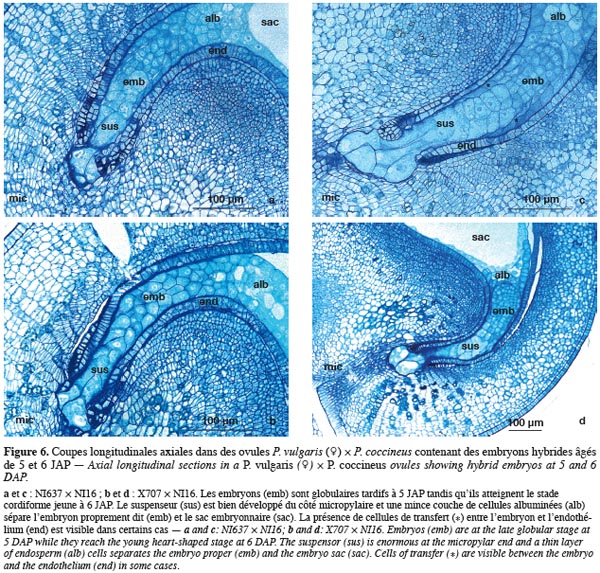
30Les figures 3 et 4 illustrent les coupes longitudinales axiales d'embryons autofécondés des génotypes de P. coccineus (NI16) et P. vulgaris (NI637 et X707), âgés de 3, 4 et 6 JAP.
31Chez Phaseolus coccineus, dès le stade proembryon, des invaginations à partir des parois cellulaires apparaissent à la base du suspenseur, traduisant la mise en place de mécanismes physiologiques spécifiques. A 3 JAP, l'embryon est pré-globulaire (Photo 3a). C'est à 4 JAP qu'il devient réellement globulaire. A la fin de ce stade, les invaginations de la base du suspenseur sont très développées. L'embryon baigne dans un albumen liquide fortement nucléé (Photo 3b). La croissance de l'embryon et surtout de l'albumen, qui reste longtemps coenocytique, est très rapide. Cela se caractérise par la présence de noyaux localisés dans le cytoplasme pariétal du sac embryonnaire. Les parois de l'endothélium sont faites de cellules allongées et aucun contact n'existe entre l'embryon proprement dit et ces parois. Les nutriments transiteraient essentiellement par la base du suspenseur qui reste bien au contact du tissu ovulaire vers le micropyle (Lecomte, 1997). La présence de cellules de transfert est cependant suspectée de part et d'autre de l'embryon. Jusqu'au terme du stade cordiforme, il y a peu de modifications dans la structure générale des cellules suspensoriales. Ces cellules sont épaisses et la plupart des invaginations deviennent moins évidentes (Photo 3c). Cela implique l’existence de nouveaux changements préliminaires à l'initiation cotylédonaire et à la maturation de l’embryon.
32Chez P. vulgaris (Geerts, 2001), tout comme chez d'autres légumineuses (Yeung, Meinke, 1993), juste après la double fécondation, la première division asymétrique du zygote s'opère suivant la polarité entre l'embryon proprement dit et la base qui évoluera en suspenseur. L'embryon est globulaire à 3 JAP (Photos 4a et 4d), le suspenseur est bien formé et la croissance de l'embryon proprement dit est continue. La limite entre le sac embryonnaire et l'embryon proprement dit est faite d'une fine couche de cellules albuminées (Photos 4b et 4e). Les cellules de transfert constituées en assise bordent l'embryon de part et d'autre, au contact de l'endothélium. Entre 3 et 6 JAP, la croissance du suspenseur est rapide. Celui-ci assure le lien physique entre le tissu ovulaire et l'embryon proprement dit. A 6 JAP, la forme effilée du suspenseur persiste chez le génotype NI637 et l'initiation cotylédonaire prend le relais. Cela est caractérisé par l'interruption de l'augmentation du nombre de cellules du suspenseur (Tableau 1) et le début de la différenciation de la couche épidermique de l'embryon. Les cellules de transfert sont visibles entre l'embryon et la paroi interne de l'endothélium (Photos 4c et 4f).
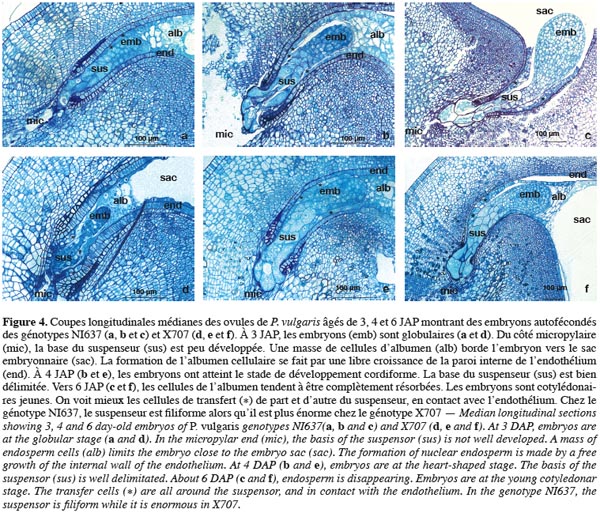
33La figure 5 montre les coupes longitudinales axiales d'embryons âgés de 3 à 6 JAP issus des croisements P. coccineus (♀) x P. vulgaris.
34Lors des hybridations interspécifiques, le nombre de cellules du suspenseur est faible à 3 JAP quel que soit le croisement. A cet âge, les embryons baignent dans de l'albumen liquide (Photos 5a et 5e). L'albumen nucléaire n'est en contact ni avec l'embryon ni avec l'endothélium. Ceci suppose une difficulté de transfert de nutriments vers l'embryon. L'albumen est cellularisé le long de la paroi endothéliale, vers la chalaze. L'observation des coupes sériées d'embryons hybrides P. coccineus x P. vulgaris révèle qu'en dépit de l'initiation des divisions cellulaires à la suite de la fécondation, le développement de l'embryon est ralenti. L'embryon est toujours sphérique, son suspenseur court ne comporte pas plus de trois cellules. A 5 JAP, l'embryon s'est développé latéralement (Photos 5c et 5g).
35A 6 JAP, ces embryons sont toujours globulaires (Figure 5). L'embryon est séparé du sac embryonnaire par une couche épaisse de cellules d'albumen fortement nucléées. La croissance de l'embryon est lente mais axiale et radiale à la fois.
36Dans la combinaison génotypique NI16 x NI637, la croissance de l'embryon est plus lente que dans tout autre combinaison. Dans le croisement NI16 x X707, les invaginations à la base du suspenseur (Photo 5h), déjà signalées chez le génotype maternel NI16, sont aussi présentes à 6 JAP. Chez tous les embryons hybrides, l'albumen persiste avec des nuances au niveau de la vacuolisation des cellules. Les cellules endothéliales persistent aussi à 6 JAP au voisinage de l'embryon. La prolifération de l'endothélium est signalée uniquement dans les ovules où le processus d'avortement est enclenché. Autour de l'embryon proprement dit, l'endothélium est fait d'une ou deux couches de cellules. Par contre, vers la chalaze, une simple couche de cellules rangées côte à côte est visible.
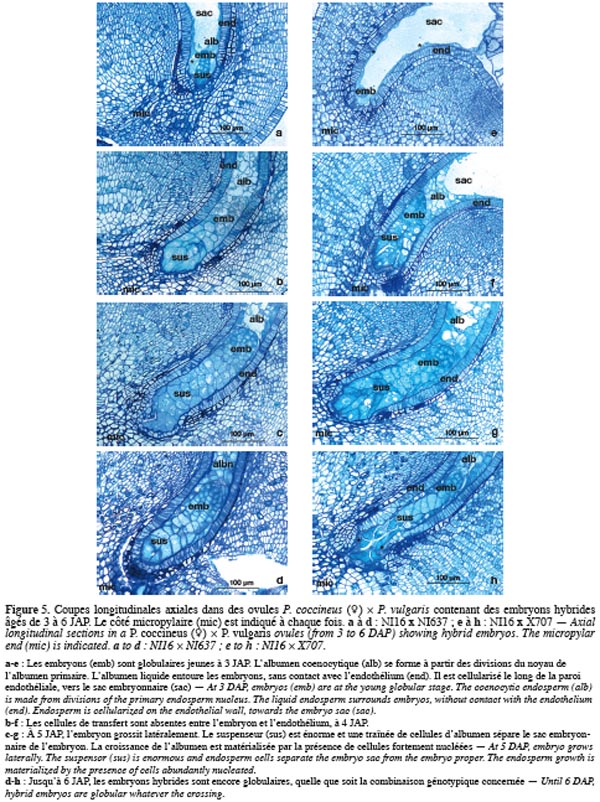
37La figure 6 présente les coupes longitudinales axiales dans les ovules de P. vulgaris (♀) x P. coccineus, contenant des embryons âgés de 5 et 6 jours après pollinisation. Les embryons sont globulaires tardifs à 5 JAP (Photos 6a et 6b) puis cordiformes jeunes à 6 JAP (Photos 6c et 6d). Ils sont bordés du côté chalazien par une assise de cellules albuminées plus ou moins épaisse, selon la combinaison génotypique. Le contact est étroit entre, d'une part, le suspenseur et le micropyle et, d'autre part, entre le suspenseur, l'embryon proprement dit et les parois endothéliales. Les cellules de transfert sont perceptibles dans certaines combinaisons génotypiques (Photo 6c).
4. Discussion
38L'embryogenèse est un stade critique de la vie des angiospermes (Harada, 1999). Elle détermine l'organisation générale de la plante suivant deux plans simultanés (plan apex-base et plan radial).
39Chez Phaseolus (Lecomte, 1997), le zygote subit d’abord une division asymétrique et transversale donnant une cellule apicale qui évoluera en embryon proprement dit et une autre cellule fondamentale qui produira l'hypophyse et le suspenseur, qui est un organe de transit impliqué dans le développement de l'embryon (Yeung, Meinke, 1993). Son rôle essentiel s'arrête assez tôt lors de l'embryogenèse. Sa taille et sa forme diffèrent entre espèces et d'un génotype à un autre. Son développement précède la différenciation de l'embryon proprement dit.
40Le futur embryon globulaire résulte des divisions des cellules centrales du proembryon, puis de la formation du procambium et du méristème de base. Vers 5 JAP, l'embryon passe du stade globulaire au stade cordiforme et l'activité mitotique augmente, favorisant l'initiation des cotylédons chez P. vulgaris. A ce dernier stade, d'autres phénomènes spécifiques interviennent pour la maturation et la déshydratation de la graine (Yeung, Clutter, 1979 ; Harada, 1999 ; Devic, Guilleminot, 2001). Les nutriments sont essentiellement alloués à ces fins plutôt qu'à la croissance des tissus embryonnaires.
41La position médiane du suspenseur, entre la base micropylaire et l'embryon proprement dit, présume une synthèse et sécrétion de substances nutritives destinées à l'alimentation du jeune embryon. Lorsque l'embryon atteint le stade cordiforme, le suspenseur est constitué d'au moins dix cellules.
42Les cellules de base du suspenseur, fortement nucléées, s'incrustent dans la paroi du tégument interne (Figures 3 et 4). Ce fait traduit l'activité intense du suspenseur, jusqu'au stade cordiforme de l'embryon. Il est probable que, chez Phaseolus, le suspenseur soit plus actif que l'embryon proprement dit pour la synthèse de l'acide ribonucléique et des protéines durant l'embryogenèse précoce (Walbot et al., 1972 ; Sussex et al., 1973 ; Yeung et al., 1996).
43Le développement de l'embryon du génotype NI16 (de P. coccineus) concorde avec la description de Yeung et Clutter (1978). La formation des invaginations à la base du suspenseur commence tôt (au stade globulaire) chez NI16. Le suspenseur a évolué fortement jusqu'au stade cordiforme. L'activité métabolique à la base du suspenseur est traduite par la présence de grandes cellules. Cela concorde avec les conclusions antérieures de Walbot et al. (1972), Sussex et al. (1973), Yeung et Clutter (1978) et Budimir (2003–2004). C'est au stade cordiforme que le suspenseur atteint sa taille maximale. Au-delà de ce stade, il régresse progressivement.
44Avant le stade cotylédonaire, la proximité entre le corps du suspenseur, les cellules de transfert et les cellules de l'albumen serait favorable à l'alimentation de l'embryon. Yeung et Clutter (1978) et Geerts (2001) situent cette phase entre 4 et 5 jours après la pollinisation. En général, le suspenseur de P. coccineus est plus volumineux que celui de P. vulgaris, conformément aux travaux de Yeung et Meinke (1993). Une colonne de cellules de tailles différentes et rangées en deux assises constitue le corps du suspenseur.
45Le développement de l'embryon est similaire chez les génotypes parentaux (P. vulgaris et P. coccineus) au-delà du stade cordiforme. La différence se situe essentiellement au niveau du délai dans lequel l'un ou l'autre embryon aboutit à un stade de développement précis.
46Les premières divisions cellulaires dans les croisements P. coccineus x P. vulgaris apparaissent dès 3 JAP. Chez ces croisements, les embryons sont globulaires à 6 JAP (Figure 5) alors qu'ils ont déjà atteint au moins le stade cordiforme chez les génotypes parentaux (Figures 3 et 4). Ce décalage est aussi observé lors des croisements entre P. polyanthus (♀) et P. vulgaris, à un âge identique (Lecomte, 1997 ; Geerts, 2001). Le développement des embryons hybrides est lent par rapport aux embryons parentaux.
47L'absence de prolifération de l'endothélium peut s'expliquer par le retard dans les mécanismes d'avortement, d'une part, et par la nature des génotypes parentaux utilisés dans les croisements, d'autre part, contrairement aux observations de Geerts (2001).
48La cause des avortements des embryons n'est pas liée ici au manque de division du noyau de l'albumen primaire. Le zygote se divise normalement mais on observe plutôt un développement anarchique de l'albumen. Il se peut que l'échange de nutriments soit plus rapide chez P. vulgaris que chez P. coccineus. Ce transfert serait encore plus lent chez leurs hybrides réciproques. Ce qui favorise un développement plus rapide des embryons de P. vulgaris. Les besoins nutritifs de l'embryon hybride P. coccineus x P. vulgaris seraient également plus élevés que dans les autres cas. Ainsi, une sous-alimentation des embryons au stade précoce de leur développement résulterait inévitablement en avortement.
49En comparant les embryons globulaires des différents génotypes et hybrides, il ressort que les cellules basales du suspenseur des génotypes parentaux sont nettement plus grandes que celles des hybrides. Pour l'ensemble des autres paramètres mesurés, les génotypes parentaux (NI16, NI637 et X707) montrent les valeurs les plus élevées. Par contre, les valeurs les plus faibles proviennent essentiellement des hybridations interspécifiques.
5. Conclusion
50Les observations faites in vivo ou lors de la culture in vitro d'embryons (Yeung, Sussex, 1979) concordent sur l'important rôle joué par le suspenseur au cours de l'embryogenèse précoce chez Phaseolus.
51Le nombre de cellules du suspenseur est supérieur ou égal à 10 au-delà de 4 JAP, chez les embryons parentaux et hybrides. Ce nombre ne traduit pas nécessairement le stade de développement de l'embryon ni l'importance de la taille du suspenseur. Cependant le volume du suspenseur en dépend. Le suspenseur de NI16 est bien plus grand que celui des génotypes de P. vulgaris et des combinaisons génotypiques observées. Durant les premières étapes du développement embryonnaire, le suspenseur est fort sollicité (Yeung, Clutter, 1979). En effet, il joue un rôle actif, à la suite des premières divisions du proembryon en zygote au regard de l'aspect pris par ses cellules basales. L'épaisseur et les invaginations observées à la base du suspenseur de NI16 traduisent des besoins élevés pour l'alimentation de l'embryon chez P. coccineus. Cette région du suspenseur participe fortement aux échanges et au transit des nutriments entre l'embryon et le tissu ovulaire (Lecomte, 1997). Lors des croisements P. coccineus x P. vulgaris, l'endothélium préserve son intégrité jusqu'à l'occurrence des irrégularités histologiques.
52Le développement des embryons de P. coccineus est lent par rapport aux embryons de P. vulgaris. Les embryons hybrides ont un développement plus lent aussi par rapport aux embryons parentaux. Cette différence est observée à 4 jours après la pollinisation.
53L'avortement de l'embryon semble plus lié à tout autre structure embryonnaire qu'au suspenseur ou à l'embryon proprement dit. Il pourrait s'agir du retard dans le développement de l'albumen observé au-delà de 5 JAP. Il est possible que les divisions de l'albumen se réduisent après 6 JAP. La majorité des avortements ont lieu à cet âge. C'est en fait le résultat d'une coordination réduite du développement simultané de l'embryon, de l'albumen et du reste du tissu maternel comme le pensent aussi plusieurs auteurs (Zenkteler, 1991 ; Geerts, 2001 , Tuyl et al., 2002). Les interactions existantes entre l'embryon et l'albumen au cours de l'embryogenèse chez les hybrides interspécifiques au sein du genre Phaseolus doivent faire l'objet de recherches approfondies. Le développement normal de l'albumen est un facteur important du déroulement des phénomènes post-zygotiques. A cette fin, il serait opportun d'entreprendre des études supplémentaires sur le développement de l'albumen lors des croisements interspécifiques et de compléter les observations histologiques similaires sur des embryons plus âgés des mêmes génotypes et croisements interspécifiques.
54Abréviations
55DAP : Days after pollination
56HEMA : Méthacrylate de 2-Hydroxyéthyle
57JAP : Jours après pollinisation
58Remerciements
59Nous remercions l'Etat gabonais dont le premier auteur bénéficie du soutien pour ses recherches. Nous exprimons également notre gratitude au Professeur Edward Charles Yeung de l'Université de Calgary (Canada) pour ses conseils pratiques ainsi qu'à Christelle Boudry de l'Unité de Zootechnie de la Faculté universitaire des Sciences agronomiques de Gembloux pour le traitement des images.
Bibliographie
Baudoin JP. (2001). Contribution des ressources phytogénétiques à la sélection variétale de légumineuses alimentaires tropicales. Biotechnol. Agron. Soc. Environ. 5 (4), p. 221–230.
Brady T., Clutter ME. (1972). Cytolocalization of ribosomal cistrons in plant polytene chromosomes. J. Cell. Biol. 53, p. 827–832.
Budimir S. (2003/2004). Developmental histology of organogenic and embryogenic tissue in Picea omorika culture. Biol. Plant. 47 (3), p. 467–470.
Buishand TJ. (1956). The crossing of beans (Phaseolus sp.). Euphytica 5, p. 41–50.
Debouck DG., Smartt J. (1995). Beans, Phaseolus spp. (Leguminosae-Papilionideae). In Smartt IJ., Simmonds NW. (eds.). Evolution of Crop plants. 2nd ed. Harlow, England: Longman, p. 287–294.
Devic M., Guilleminot J. (2001). Approches de génomique fonctionnelle appliquées à l’étude de l’embryogenèse précoce. Ecole thématique Biologie végétale. <http://www.isv.cnrs-gif.fr/ebv/devic.pdf>
Esau K. (1965). Plant Anatomy. 2nd ed. New York: J. Wiley & Sons, 767 p.
Geerts P. (2001). Study of embryo development in Phaseolus in order to obtain interspecific hybrids. Thèse doct. Sci. agron. Gembloux, Belgique : Faculté universitaire des Sciences agronomiques de Gembloux, 183 p.
Geerts P., Toussaint A., Mergeai G., Baudoin JP. (2002). Study of the early abortion in reciprocal crosses between Phaseolus vulgaris L. and Phaseolus polyanthus Greenm. Biotechnol. Agron. Soc. Environ. 6 (2), p. 109–119.
Gutmann M. (1995). Improved staining procedures for photographic documentation of phenolic deposits in semithin sections of plant tissue. J. Microsc. 179 (3), p. 277–281.
Guyon V., Baud S., Wuillème S., Jond C., Debeaujon I., Rochat C., Miquel M., Caboche M., Lepiniec L. (2002). Identification de gènes impliqués dans le contrôle de la qualité des graines chez une plante modèle, Arabidopsis thaliana. Les rencontres de l’INA. <http://www.inapg.fr/rencontre/Rina1/genetique.htm.
Harada JJ. (1999). Signaling in plant embryogenesis. Curr. Opin. Plant Biol. 2, p. 23–27.
Lecomte B. (1997). Etude du développement embryonnaire in vivo et in vitro dans le genre Phaseolus L. Thèse doct. Sci. Agron. Gembloux, Belgique : Faculté universitaire des Sciences agronomiques de Gembloux, 186 p.
Lester RN., Kang JH. (1998). Embryo and endosperm function and failure in Solanum species and hybrids. Ann. Bot. 82, p. 445–453.
Lopez-Almansa JC., Yeung EC., Gil L. (2004). Abortive seed development in Ulmus minor (Ulmaceae). Bot. J. Linn. Soc. 145, p. 455–467.
Matthys-Rochon E., Piola F., Le Deunff E., Mol R., Dumas C. (1998). In vitro development of maize immature embryos : a tool for embryogenesis analysis. J. Exp. Bot. 49 (322), p. 839–845.
Mok DWS., Mok MC., Rabakoarihanta A., Shii T. (1986). Phaseolus. Wide hybridization through embryo culture. In Bajaj YPS (ed). Biotechnology in agriculture and forestery, Crops I. Berlin : Springer-Verlag, p. 309–318.
Nguema Ndoutoumou P., Toussaint A., Baudoin JP. (2004). Etude histologique du développement d’embryons issus du croisement Phaseolus vulgaris L. x P. coccineus L. In Actes des 19e journées scientifiques du Réseau « Biotechnologies végétales : amélioration des plantes et sécurité alimentaire », 4–7 octobre 2004. Lomé, Togo : Agence universitaire de la Francophonie, p. 89–92.
Otoul E., Le Marchand G. (1974). Contribution à l'étude de l'influence de l'équilibre minéral sur la composition en aminoacides de P. vulgaris L. Bull. Rech. Agron. Gembloux 9 (1), p. 72–93.
Ruzin SE. (1999). Plant microtechnique and microscopy. New York: Oxford University Press, 322 p.
Sabja AM., Mok DWS., Mok MC. (1990). Seed and embryo growth in pod cultures of Phaseolus vulgaris and P. vulgaris x P. acutifolius. Hort. Sci. 25 (10), p. 1288–1291.
Sussex I., Clutter M., Walbot V., Brady T. (1973). Biosynthesic activity of the suspensor of Phaseolus coccineus. Caryologia 25 suppl., p. 261–272.
Tuyl JM. (van), Maas IWGM., Kibyung L., (van) Tuyl JM., Lim KB., Littlejohn G., Venter R., Lombard C. (2002). Introgression in interspecific hybrids of lily. Acta Hortic. 570, p. 213–218.
Walbot V., Brady T., Clutter M., Sussex I. (1972). Macromolecular synthesis during plant embryogeny : rates of RNA synthesis in Phaseolus coccineus embryos and suspensors. Develop. Biol. 29, p. 104–111.
Yeung EC, Clutter ME. (1978). Embryogeny of Phaseolus coccineus: Growth and microanatomy. Protoplasma 94, p. 19–40.
Yeung EC., Clutter ME. (1979). Embryogeny of Phaseolus coccineus : the ultrastructure and development of the suspensor. Can. J. Bot. 57, p. 120–136.
Yeung EC., Meinke DW. (1993). Embryogenesis in Angiosperms: Development of the suspensor. Plant Cell 5, p. 1371–1381.
Yeung EC., Rahman MH., Thorpe TA. (1996). Comparative development of zygotic and microspore-derived embryos in Brassica napus L. cv Topas. I. histodifferenciation. Int. J. Plant Sci. 157 (1), p. 27–39.
Yeung EC., Sussex IM. (1979). Embryogeny of Phaseolus coccineus: The suspensor and the growth of the embryo-proper in vitro. Z. Pflanzenphysiol. 91 S, p. 423–433.
Zenkteler M. (1991). Ovule culture and test tube fertilization. Med. Fac. Landbouw Rijksuni. Gent 56, p. 1403–1410.
