- Accueil
- Volume 11 (2007)
- numéro 2
- Possibilités d’amélioration de la principale espèce cultivée de cotonnier (Gossypium hirsutum L.) pour la résistance au nématode réniforme (Rotylenchulus reniformis Linford et Oliveira)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Possibilités d’amélioration de la principale espèce cultivée de cotonnier (Gossypium hirsutum L.) pour la résistance au nématode réniforme (Rotylenchulus reniformis Linford et Oliveira)

Notes de la rédaction
Reçu le 5 février 2007, accepté le 23 février 2007.
Résumé
La production de la principale espèce de cotonnier cultivé, Gossypium hirsutum L., est gravement menacée dans le nouveau monde par les attaques du nématode réniforme Rotylenchulus reniformis Linford et Oliveira. Ce dernier peut causer des pertes de rendement variant de 15 à 75 % selon les niveaux d’infestation et les conditions météorologiques ; ce ravageur est considéré comme une des principales menaces qui pèse sur la production de coton aux USA. L’étude passe en revue les méthodes de lutte envisageables pour limiter l’impact de ce ravageur en développant particulièrement les perspectives offertes par l’introgression de la résistance au nématode réniforme existant chez les espèces diploïdes du genre Gossypium.
Abstract
Breeding possibilities of the main cultivated cotton species (Gossypium hirsutum L.) for the resistance to reniform nematode (Rotylenchulus reniformis Linford et Oliveira). The production of the main cultivated species of cotton, Gossypium hirsutum L., is seriously threatened by attacks of the reniform nematode Rotylenchulus reniformis Linford and Oliveira. This nematode reduces total yield from 15 to 75% according to the levels of infestation and the meteorological conditions. It is becoming one of the main threats of cotton production in America. This study reviews the possible control methods to limit the impact of this parasite and develops especially the prospects offered by the introgression of the resistance to the reniform nematode existing in the diploids species of the Gossypium genus.
Table des matières
1. Introduction
1Le cotonnier est largement répandu dans les régions arides et semi-arides des zones tropicales et subtropicales du globe terrestre. Il constitue de loin la première source de fibre textile au monde (selon Berti et al., 2006 sa production assure environ 40 % de la consommation de fibre par l’industrie textile), et se situe respectivement à la 2e et à la 5e place dans les classements mondiaux des cultures productrices de protéines et d’huile végétale comestible (Courtant et al., 1991 ; Estur, 2006). La culture du cotonnier occupe environ 30 millions d’hectares dans le monde, soit 2,5 % des terre arables de la planète (Bocchino, 1999 ; Estur, 2006), ce qui la classe parmi les spéculations agricoles majeures de la planète. Plus que chez la majorité des autres espèces cultivées, les ravageurs constituent une contrainte très importante pour la production de coton. Les pertes de récolte dues aux attaques des ravageurs sont, en moyenne, de l’ordre de 20 %, malgré l’utilisation en culture cotonnière de près du quart des pesticides chimiques produits annuellement au niveau mondial (Ferron et al., 2006). Parmi les ravageurs du cotonnier, le nématode réniforme Rotylenchulus reniformis Linford et Oliveira est un des plus dommageables (Westphal, Scott, 2005). Il réduit non seulement les rendements en coton-graine mais déprécie également la qualité des fibres et des graines (Cook, Robinson, 1998). Les pertes de rendement causées par ses attaques vont de 15 à 75 % selon les niveaux d’infestation et les conditions météorologiques (Yik, Birchfield, 1984 ; Robinson, 1999).
2Nous présentons ici un état des connaissances concernant l’importance des problèmes causés à la culture du cotonnier par R. reniformis et les solutions envisageables pour réduire l’impact de cette contrainte en insistant sur les perspectives offertes par l’introgression des gènes de résistance au nématode réniforme existant chez les espèces diploïdes du genre Gossypium.
2. Présentation du genre Gossypium et des espèces de cotonnier cultivé
2.1. Origine et spéciation
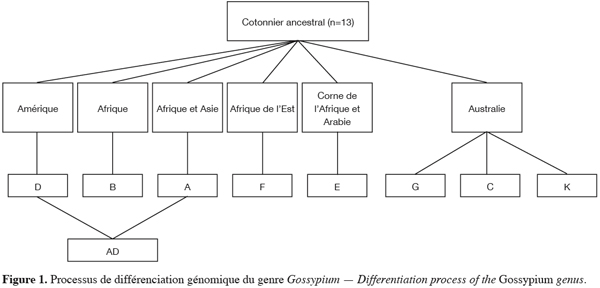
3Le genre Gossypium serait issu d’un phylum ancestral, aujourd’hui disparu, qui se serait différencié il y a plus de cent millions d’années en plusieurs groupes génomiques sous l’influence de la pression de sélection induite par la dérive des continents (Ndungo et al., 1988a ; Wendel, Cronn, 2003). Huit groupes génomiques désignés par les lettres majuscules A, B, C, D, E, F, G et K, comprenant des espèces de cotonnier diploïdes, (2n=2x=26 chromosomes) sont à ce jour reconnus. Par une hybridation naturelle entre espèces des génomes A et D suivie d’un doublement spontané du nombre de chromosomes, un groupe génomique allotétraploïde (2n=4x=52 chromosomes) désigné par le symbole (AD) est apparu il y a environ un million d’années (Wendel, Cronn, 2003). Aujourd’hui, environ 50 espèces (45 espèces diploïdes et 5 espèces allotétraploïdes) sont dénombrées dans le genre Gossypium et de nouvelles espèces continuent d’être découvertes (Wendel, Cronn, 2003). La figure 1 présente le processus de différenciation des espèces du genre Gossypium.
2.2. Nomenclature et classification
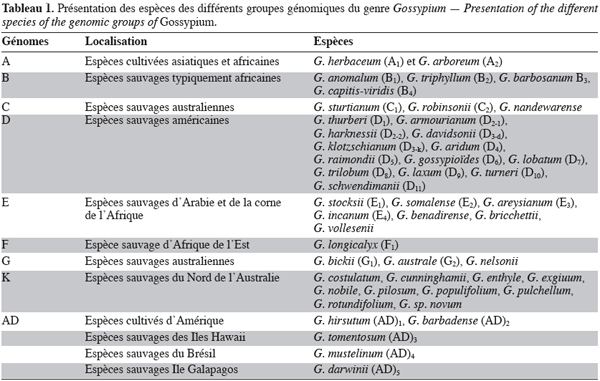
4Le tableau 1 présente les espèces des différents groupes génomiques du cotonnier et leur zone géographique de dispersion naturelle. L’ordre dans lequel ces génomes sont classés reflète des niveaux décroissants d’appariements méïotiques observés à la métaphase I chez les hybrides F1 issus du croisement entre espèces appartenant à ces génomes et les espèces du génome A (espèces cultivées asiatiques). Cet ordre suit également la répartition géographique de chaque génome, la fertilité des hybrides entre espèces et la taille des chromosomes à la métaphase I (Parry, 1982).
2.3. Domestication du cotonnier
5En raison principalement des possibilités d’utilisation textile qu’offre le revêtement pileux de leurs graines, certaines espèces de cotonnier ont été domestiquées par l’homme. Cette domestication, fort ancienne et remontant aux temps préhistoriques, s’est produite indépendamment en Afrique, en Amérique et en Asie (Kammacher, 1956 ; Parry, 1982). Parmi la cinquantaine d’espèces que compte le genre Gossypium, quatre seulement ont été domestiquées et forment le groupe des cotonniers cultivés. Ce sont deux espèces diploïdes du génome A (G. herbaceum L. et G. arboreum L. produisant le coton dit indien à fibre épaisse et courte) et deux espèces tétraploïdes du génome (AD) (G. barbadense L. produisant le coton dit égyptien à fibre longue et fine, et G. hirsutum L. produisant le coton dit Upland à fibre de caractéristiques intermédiaires). Les 46 autres espèces de cotonnier, qui sont dépourvues ou très peu pourvues de poils filables, sont impropres à tout usage textile et forment le groupe des cotonniers dits sauvages. à ce jour, G. hirsutum constitue l’espèce de cotonnier la plus exploitée au monde. Plus de 94 % de la production mondiale de coton proviennent de cette espèce (Bocchino, 1999 ; Wendel, Cronn, 2003).
2.4. Réservoirs génétiques utilisables pour l’amélioration de la principale espèce de cotonnier cultivé
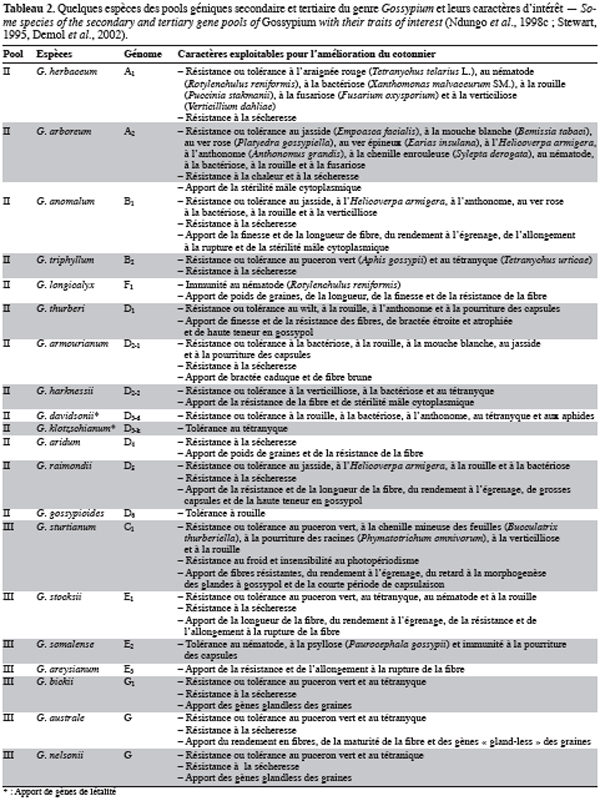
6Pour être en mesure de créer des variétés nouvelles exigées par l’évolution des besoins du marché et l’émergence éventuelle de contraintes et/ou de besoins nouveaux, il est nécessaire de disposer en permanence d’une variabilité génétique importante. Le genre Gossypium, riche de plus d’une quarantaine d’espèces sauvages, représente un réservoir important de variabilité génétique pour l’amélioration des espèces cultivées, notamment de la principale espèce de cotonnier cultivé G. hirsutum L. Cette importante variabilité est organisée en trois pools géniques (pool génique primaire, secondaire et tertiaire) selon la perméabilité génétique qui existe entre les différentes espèces du genre et la principale espèce cultivée (Ndungo et al., 1988b ; Stewart, 1995). Le tableau 2 présente les caractères d’intérêt susceptibles d’être introgressés chez les cotonniers tétraploïdes à partir de quelques espèces diploïdes appartenant aux pools géniques secondaires et tertiaires.
3. Le nématode réniforme et la culture du cotonnier
3.1. Place de R. reniformis parmi les nématodes parasites du cotonnier
7Un nombre impressionnant de nématodes se rencontre chez le cotonnier. Heureusement, tous ne sont pas dommageables. Les nématodes les plus redoutables de la culture cotonnière sont le nématode à galles Meloidogyne incognita Kofoid et White et le nématode réniforme Rotylenchulus reniformis Linford et Oliveira (Robinson, 1999 ; Robinson, Cook, 2001). Des recherches importantes ont été menées sur M. incognita conduisant au développement de variétés de cotonnier qui lui sont résistantes (Robinson, 1999 ; Koenning et al., 2004). Concernant le nématode réniforme R. reniformis, beaucoup reste à faire et les recherches les plus notables n’ont débuté qu’au cours de la dernière décennie (Koenning et al., 2004).
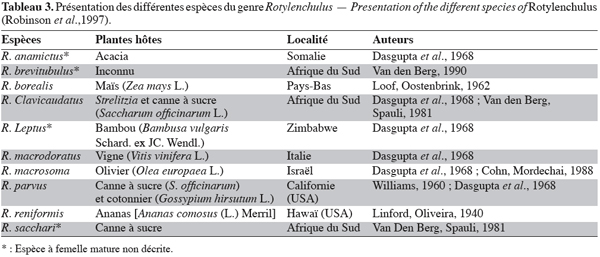
8Les nématodes réniformes appartiennent au genre Rotylenchulus. Ce sont des nématodes semi-endoparasites sédentaires apparaissant communément dans les régions tropicales, subtropicales et tempérées chaudes. Le terme « réniforme » provient de la forme en rein que prend le corps de la femelle mature après pénétration de sa partie antérieure dans la racine des plantes hôtes. On compte à ce jour, dix espèces connues de Rotylenchulus. Ces espèces, leurs types de plantes hôtes, les auteurs de leur description et les localités de leur découverte sont indiqués dans le tableau 3. Parmi toutes les espèces du genre Rotylenchulus, seule R. reniformis Linford et Oliveira est dommageable au cotonnier (Robinson et al., 1997). Aujourd’hui ce parasite est en passe de devenir le nématode le plus redoutable de la culture cotonnière (Koenning et al., 2004) dans le Nouveau Monde. La proportion des champs de coton infestés par ce nématode en Alabama est passée de 8 % à 48 % entre 1985 et 2000. Cette grande vitesse de propagation amène certains spécialistes (Koenning et al., 2004) à penser que si rien n’est fait, ce nématode sera très bientôt le problème le plus sérieux pour la culture du cotonnier aux USA.
3.2. Morphologie et distribution géographique de R. reniformis
9R. reniformis Linford et Oliveira est un ver microscopique de 0,34 à 0,52 mm de long dont la femelle parasite les racines des plantes hôte (Figure 2). C’est le nématode réniforme qui présente non seulement le plus grand nombre de plantes hôtes (Ayala, Ramirez, 1964 ; Robinson et al., 1997) mais aussi la plus large distribution géographique. On le retrouve dans d’innombrables localités des régions chaudes : en Amérique, dans les îles Caraïbes, en Afrique, en Europe du Sud (Malte et Espagne seulement), au Moyen Orient, en Inde, en Asie du Sud-Est, en Australie, dans les îles de l’Océan Indien, en Chine, au Japon, aux Philippines, dans les îles du Pacifique (Robinson et al., 1997). Cette large distribution résulte vraisemblablement de son très grand spectre de plantes hôtes (plus d’une centaine d’espèces botaniques parmi lesquelles certaines sont de grande importance économique : cotonnier, ananas, bananier, agrumes, tomate, manioc, maïs, canne à sucre, chou, haricot, de nombreuses cucurbitacées, etc.) et de sa facile adaptation aux conditions environnementales les plus défavorables. R. reniformis peut, par exemple, ralentir ses phénomènes vitaux par une stratégie de survie appelée anhydrobiose qui lui permet de survivre au moins deux ans en l'absence d’hôte dans un sol desséché (Vilardebo, Delattre, 1971 ; McSorley, 2003 ; Koenning et al., 2004, Treonis, Wall, 2005).
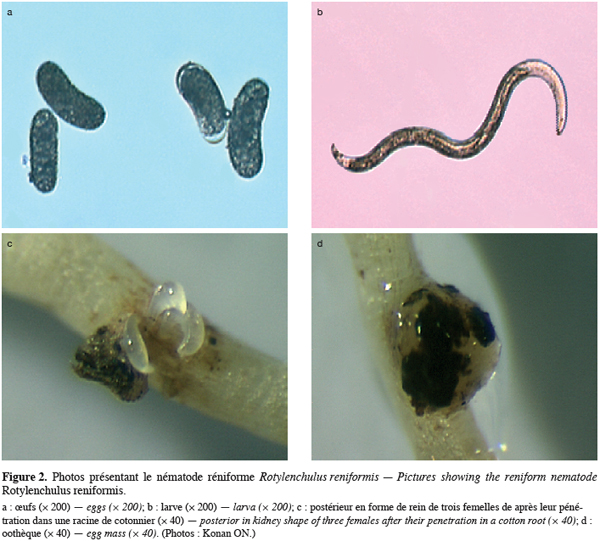
3.3. Cycle de vie et mode d’infection de R. reniformis
10R. reniformis a une température optimale de mouvement et de reproduction comprise entre 27 et 32 °C (Robinson, 1999). Son cycle de vie complet est de 24 à 29 jours dans les conditions optimales (Robinson, 1999). Ce cycle de vie est assez simple et il se décompose en six stades (Robinson, 1999) : un stade œuf, quatre stades larvaires et le stade adulte. Le nématode adulte sexuellement différencié constitue le stade infectieux. Le « sex ratio » est en général de 1:1. Seule la femelle se nourrit et donc est dommageable aux plantes. Elle est inséminée par le mâle avant même la formation des gonades femelles (Robinson, 1999). La femelle stocke le sperme reçu, dans un organe appelé spermathèque.
11La femelle attaque les racines généralement au niveau de la zone d’élongation (Birchifield, 1962). Lors de l’invasion des racines, la partie antérieure de son corps pénètre l’épiderme et le parenchyme cortical par écartement des cellules, tandis que la partie postérieure reste à l’extérieur. C’est dans cette position qu’elle restera et se nourrira durant le reste du cycle. Grâce à des sécrétions œsophagiennes elle suscite la différenciation chez l’hôte de cellules spécialisées indispensables à sa nutrition. Ces cellules forment un site trophique qui s’élargit au fil du temps en incorporant les cellules voisines (Robinson, 1999). Ce site trophique cellulaire intervient par sa dimension et son activité sur le développement et la fécondité de la femelle qui s’y nourrit. Parallèlement, la partie postérieure restée à l’extérieur de la racine grossit et prend une forme de rein qui se positionne perpendiculairement à l’axe de la racine. Environ 7 à 10 jours après la pénétration dans la racine, la femelle devient reproductive. Il s’ensuit la maturation des gonades femelles et peu après, les œufs produits sont fertilisés par le sperme préalablement stocké. La femelle commence alors à déposer les œufs formés et fertilisés dans une matrice gélatineuse appelée oothèque (Robinson, 1999). Cette matrice provient de la vulve et est produite par les glandes vaginales (Robinson et al., 1997). Le nombre d’œufs par oothèque peut varier de 60 à 200 (Robinson, 1999).
12Les attaques de R. reniformis entraînent au niveau des racines des plantes infestées, une hypertrophie et un disfonctionnement de l’endoderme et des couches cellulaires du péricycle entourant le cylindre vasculaire et en conséquence, un blocage des vaisseaux d’acheminement d’eau et de nutriments (Cohn, 1973 ; Robinson, 1999). Les attaques de ce nématode se soldent généralement par un développement moindre de la plante, par des décolorations du feuillage, par une faible production en capsules, graines et fibres avec une réduction du « seed index » et de la valeur micronaire, conséquence de l’action phytotoxique d’une toxine sécrétée et injectée dans les tissus par le nématode (Vilardebo, Delattre, 1971 ; Cook, Robinson, 1998). Cette altération de l’état physiologique de la plante rend celle-ci plus réceptive à Fusarium oxysporum f. vasinfectum, champignon responsable de la fusariose du cotonnier (Neal, 1954 ; Vilardebo, Delattre, 1971 ; Robinson, 1999 ; Davis et al., 2006). Les pertes de rendement dues à R. reniformis varient de 15 à 75 % selon les niveaux d’infestation et les conditions météorologiques (Birchifield, Jones, 1961 ; Yik, Birchifield, 1984 ; Robinson, 1999).
4. Méthodes de lutte contre R. reniformis en culture cotonnière
4.1. Méthodes culturales
13Les plantes non-hôtes de Rotylenchulus reniformis peuvent, théoriquement, être utilisées en rotation pour gérer les populations du nématode. Aux USA, les plantes généralement utilisées dans ce cadre sont le sorgho, le maïs et le soja (Davis et al., 2003 ; Westphal, Scott , 2005). En pratique, cependant, on se heurte à un manque d’efficacité de ces mesures à cause du remarquable potentiel de survie de ce nématode même en l’absence de plantes hôtes. De plus, le fait d’être résistantes à R. reniformis n’empêche pas les plantes non-hôtes d’être sensibles à d’autres parasites pathogènes du cotonnier et de permettre le développement prolifique de ces derniers. L’élimination précoce des adventices pourrait aussi participer au contrôle de R. reniformis (Robinson, 1999) car plusieurs mauvaises herbes communes supportent une reproduction prolifique de ce nématode (Carter et al., 1995). Un labour profond est également souvent préconisé pour permettre aux racines de pénétrer profondément dans le sol afin de compenser certains des effets délétères de R. reniformis sur l’absorption d’eau et des nutriments (Robinson, 1999).
4.2. Lutte biologique
14Certains antagonistes du sol tels que les bactéries et les champignons prédateurs peuvent être utilisés comme agents de lutte biologique contre les nématodes (Ritter, 1985 ; Robinson, 1999). Ce type de pratique présente cependant la difficulté de maintenir un auxiliaire dans un sol qui ne lui convient pas toujours. Cette méthode de lutte est donc très loin d’être appliquée à grande échelle.
4.3. Lutte chimique
15Les principaux pesticides couramment utilisés pour lutter contre les nématodes phytophages sont la chloropicrine, le bromure de méthyle, le dichloropropène, le dibromoéthane, l’isothiocyanate de méthyle et l’aldicarbe (Bernhard et al., 1985). Les nématicides favorisent l’installation de la culture en détruisant le nématode ou en retardant fortement le début des attaques. Ils peuvent cependant être très polluants et dangereux pour l’environnement. De plus, il n’est pas toujours conseillé de renouveler leur application pour allonger la protection de la culture du fait de leur phytotoxicité ou de la toxicité de leurs résidus (Bernhard et al., 1985). Le vide biologique créé par les applications de nématicides et les résidus qu’ils libèrent dans les milieux ont amené certains pays à en restreindre l’emploi. Ces produits sont, en outre, coûteux et ne sont pas toujours efficaces. Par exemple, injectés à la surface du sol, leur efficacité est réduite sur les parasites localisés en profondeur (Ritter, 1985).
4.4. Recours à la résistance génétique
16L’utilisation de variétés de cotonnier résistantes représente le moyen à la fois le plus efficace, le plus économique et le plus respectueux de l’environnement (Castagnone-Serono, 2002 ; Niks, Rubiales, 2002) pour lutter contre R. reniformis. Malheureusement, malgré des recherches intensives, aucun cultivar de cotonnier upland (moderne ou primitif) présentant un haut niveau de résistance au nématode réniforme n’a encore pu être identifié (Cook et al., 1997 ; Koenning et al., 2004 ; Robinson et al., 2005 ; Westphal, Scott, 2005 ; Weaver et al., 2007). Les seules sources de résistance découvertes à ce jour concernent les espèces diploïdes G. longicalyx (F1), G. stocksii (E1), G. somalense (E2), G. arboreum (A2) et G. herbaceum (A1) et, dans une moindre mesure, l’espèce tétraploïde G. barbadense (AD)2. Parmi ces espèces, G. longicalyx est celle qui présente le plus haut niveau de résistance (Yik, Birchifield, 1984). La résistance de cette espèce à R. reniformis est tellement élevée qu’elle s’apparenterait à l’immunité (Yik, Birchfield, 1984). Elle a été utilisée par A. Bell (US Department of Agriculture) pour créer les hybrides trispécifiques HLA [(G. hirsutum x G. longicalyx)2 x G. armourianum] et HHL [(G. hirsutum x G. herbaceum)2 x G. longicalyx] qu’il a ensuite rétrocroisés pendant plusieurs générations avec des variétés de G. hirsutum (Robinson et al., 2005). Les autres espèces faisant actuellement l’objet de recherches aux USA en vue d’introgresser leur résistance au nématode réniforme chez le cotonnier upland sont G. arboreum et G. barbadense (Nichols et al., 2005).
17La résistance des plantes aux nématodes se définit comme l’aptitude de la plante à réduire ou à empêcher la reproduction du nématode (Castagnone-Serono, 2002). Elle se manifeste généralement par une réaction d’hypersensibilité qui empêche l’installation et/ou la reproduction du nématode (Castagnone-Serono, 2002). Cela se traduit par la mort des cellules pénétrées par les nématodes et la mise en place de barrières liégeuses et des nécroses s’opposant à la pénétration dans de nouvelles cellules (Carter, 1981 ; Ritter, 1985 ; Robinson et al., 1997 ; Robinson, 1999 ; Castagnone-Serono, 2002).
18Une autre forme de résistance assez commune est l’induction de la formation de mâles. Chez beaucoup de nématodes phytophages, le déterminisme du sexe est, pour une grande part, d’ordre épigénétique ; la qualité de la nutrition ou l’état physiologique de l’hôte conditionne le sexe des larves qui l’ont envahi, ces dernières pouvant même disparaître (Ritter, 1985). Chez les cotonniers résistants au nématode Meloidogyne incognita, il a été observé que des aldéhydes terpénoïdes toxiques (gossypol) s’accumulaient plus rapidement autour de la tête des nématodes que dans les cotonniers sensibles (Veech, Mc Clure, 1977 ; Veech, 1978 ; Robinson, 1999). Chez l’espèce sauvage de cotonnier G. longicalyx résistant à R. reniformis, il y a pénétration du nématode dans la racine mais la reproduction est fortement réduite avec une faible production d’œufs par oothèque (Agudelo et al., 2005). La plante réagit à l’attaque en opposant une réaction d’hypersensibilité ; une barrière physique est mise en place par une lignification des cellules de la zone de pénétration du nématode. Puis apparaît une lyse et une nécrose des cellules à l’endroit susceptible d’héberger le site trophique du nématode, l’empêchant ainsi de se nourrir (Agudelo et al., 2005).
19D’un point de vue génétique, deux principaux types de résistances génétiques sont connus chez les plantes : la résistance monogénique (appelée aussi résistance spécifique ou verticale) et la résistance polygénique (appelée aussi résistance partielle, quantitative, horizontale ou non-spécifique). Les interactions plante-nématode suivent très souvent le modèle « gene-for-gene » (c’est-à-dire à un gène d’avirulence chez le nématode correspond un gène de résistance chez la plante) comme par exemple le gène H1 de résistance de la pomme de terre contre le nématode Globodera rostochiensis Behrens (Castagnone-Serono, 2002). Le pathogène produit de petites molécules appelées éliciteurs (grâce au gène d’avirulence) qui sont reconnus par des récepteurs spécifiques (provenant du gène de résistance) dans la plante résistante (McDonald, Linde, 2002). Cette reconnaissance des éliciteurs déclenche chez la plante le mécanisme de défense (Lindhout, 2002 ; McDonald, Linde, 2002). Théoriquement, la résistance monogénique dans laquelle intervient un seul gène, est une forme moins durable de résistance et s’effondre facilement si une seule mutation ou un seul changement allélique intervient au niveau du gène d’avirulence du pathogène (Lindhout, 2002 ; McDonald, Linde, 2002 ; Niks, Rubiales, 2002 ; Parlevliet, 2002 ; Pink, 2002). Les pathogènes les plus aptes à briser la résistance génétique sont ceux qui possèdent un système de reproduction mixte et un haut potentiel de flux de gènes (McDonald, Linde, 2002). La reproduction sexuelle permet plusieurs nouvelles recombinaisons alléliques pouvant engendrer une combinaison capable de briser la résistance génétique de la plante ; la reproduction asexuelle permet la reproduction conforme (comme par clonage) de la souche virulente produite ; et le flux de gènes qui est un processus par lequel des allèles particuliers sont échangés parmi des populations géographiquement séparées, assure la large dispersion des souches virulentes produites (McDonald, Linde, 2002). La résistance polygénique s’oppose, par contre, de manière plus durable aux attaques du parasite. Plus la résistance est génétiquement complexe, plus il est difficile pour le pathogène d’évoluer vers une forme pouvant la briser (Stuthman, 2002). Dans la pratique, cependant, il arrive que la résistance monogénique se révèle très durable (Parlevliet, 2002). La plupart du temps les résistances contre les nématodes parasites sont de longue durée à cause de la biologie des nématodes qui sont, en général, des organismes sédentaires du sol avec une faible évolution génomique due à une capacité réduite de dissémination, de mutation et de flux de gène (Castagnone-Serono, 2002). Par exemple, le gène H1 de résistance de Solanum tuberosum L. contre G. rostochiensis a été introduit et largement utilisé depuis plus de 30 ans et aucune population virulente de nématodes vis-à-vis de ce gène n’a encore été observée (Castagnone-Serono, 2002).
20Par ailleurs, Urwin et al. (2000) ont montré que l’expression transgénique de la cystéine inhibitrice de protéinase, la cystatine Oc-ID86 (une variante de la cystéine Oc-I des grains de riz) permettait de contrôler le développement de plusieurs nématodes dont R. reniformis chez Arabidopsis thaliana (L.) Heynh. en réduisant leur densité et leur fécondité. L’introgression par génie génétique chez le cotonnier de la séquence de gènes induisant la synthèse de cette cystéine constitue une voie possible pour développer des cotonniers transgéniques résistants au nématode réniforme.
5. Voies d’exploitation possibles des espèces de cotonnier diploïdes pour l’amélioration de la résistance de G. hirsutum au nématode réniforme
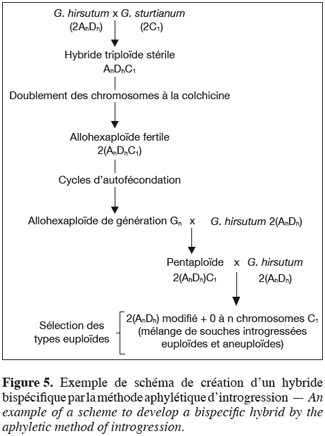
21Trois grands schémas de croisements sont potentiellement utilisables pour exploiter la variabilité des espèces diploïdes au profit de la principale espèce de cotonnier cultivé. Les deux premiers, appelés méthodes paraphylétique et pseudophylétique d’introgression (Figures 3 et 4), consistent à créer un hybride trispécifique où les deux sous-génomes constitutifs du tétraploïde cultivé (Ah et Dh) sont confrontés à deux génomes diploïdes. Seules les espèces diploïdes ayant une bonne affinité pour l’un ou l’autre des sous-génomes du tétraploïde peuvent être utilisées. Le troisième schéma, appelé méthode aphylétique d’introgression (Figure 5), consiste en l’exploitation directe d’hybrides bispécifiques et permet d’accéder à la majorité des compartiments du genre Gossypium (Hau, 1981 ; Ndungo et al. 1988b ; Stewart, 1995 ; Mergeai, 2006).


22Les hybrides trispécifiques s’obtiennent en passant par un hybride intermédiaire qui peut être allotétraploïde ou allohexaploïde. La création d’hybrides trispécifiques permet théoriquement de transférer simultanément à G. hirsutum des caractères des deux espèces diploïdes qui lui sont associées. Aucun contrôle ne peut cependant être exercé sur la nature de ces échanges de matériel génétique. L’hybride triple obtenu est toujours fortement déséquilibré et présente une très faible fertilité. Le retour à une forme plus fertile exige généralement la réalisation de plusieurs générations de rétrocroisements avec l’espèce cultivée. Une fois un certain niveau de fertilité rétabli, l’application de schémas de sélection cumulative longs et coûteux est souvent nécessaire afin de briser les linkats existant chez ce type de matériels entre caractères intéressants et rédhibitoires.
23L’exploitation des hybrides bispécifiques passe par la création d’allohexaploïdes à partir desquels le retour au nombre chromosomique normal de G. hirsutum s’obtient en réalisant deux rétrocroisements successifs avec le parent cultivé. L’améliorateur peut en théorie intervenir au niveau de deux étapes de ce schéma d'introgression pour augmenter l’intensité des échanges de matériel génétique. Il s'agit du stade hexaploïde et du stade des lignées d'addition.
24Pour les espèces phylétiquement les plus proches de G. hirsutum, la multiplication des générations en autofécondation au stade hexaploïde induit des échanges intergénomiques excessifs qui ont pour effet de déséquilibrer l’hybride et de provoquer la stérilité de ce dernier, souvent dès la deuxième génération en autofécondation. Dans le cas des espèces diploïdes moins proches des sous-génomes constitutifs de G. hirsutum, l’intensité des recombinaisons intergénomiques au stade hexaploïde varie en fonction de leur distance phylétique vis-à-vis des génomes A et D. Des travaux préliminaires menés à Gembloux laissent penser que pour tout croisement interspécifique, il doit exister un nombre idéal de générations d’hexaploïdes qu’il faut atteindre afin de profiter de manière optimale des remaniements géniques qui accompagnent chaque autofécondation successive (Mergeai, 2006). Aucune étude approfondie n’a encore été réalisée en vue de préciser ce nombre pour les différents génomes du genre Gossypium. Les aneuploïdes obtenus par rétrocroisement ou autofécondation de pentaploïdes sont, comme l’hexaploïde, le siège de translocations, de substitutions et de remaniements divers. L’idée du cumul d’échanges intergénomiques au cours de générations successives est en théorie applicable aux aneuploïdes ; la très faible fertilité des types d’addition multiple où plusieurs chromosomes surnuméraires s’ajoutent au stock normal et leur tendance naturelle à retourner au type euploïde limitent cependant la mise en œuvre de ce principe aux seules lignées monosomiques d’addition. Chez les souches aneuploïdes issues de pentaploïdes, les appariements hétérologues sont d’autant plus nombreux que la plante contient un nombre plus réduit de chromosomes surnuméraires (Mergeai et al., 1994). Les races monosomiques d’addition constituent donc un matériel très intéressant pour réaliser des transferts de gènes entre les chromosomes de l’espèce cultivée et un chromosome de l’espèce sauvage, l’état d’addition du chromosome de l’espèce donneuse pouvant être maintenu autant de générations que nécessaire pour l’obtention de la recombinaison désirée.
25Parmi les espèces potentiellement donneuses du caractère de résistance à R. reniformis, G. longicalyx est l’espèce la plus intéressante à cause de sa plus grande résistance et de la bonne affinité d’appariement chromosomique de son génome vis-à-vis du sous génome Ah de G. hirsutum (Phillips, Strickland, 1966 ; Ndungo et al., 1988b). Etant donné la méconnaissance actuelle du déterminisme génétique qui sous-tend ce mécanisme de résistance, confronter tous les chromosomes de cette espèce diploïde sauvage avec ceux de G. hirsutum dans un hybride trispécifique paraît être l’approche la plus prometteuse pour l’exploitation et la compréhension de la résistance de G. longicalyx. Les croisements directs entre diploïdes, tel qu’employés dans la méthode paraphylétique, étant plus difficiles qu’entre tétraploïdes et diploïdes, la méthode pseudophylétique d’introgression se prêterait mieux à la création de cet hybride triple. Encore faudrait-il que l’espèce diploïde à utiliser comme espèce pont appartienne au génome D car le sous-génome Dh du cotonnier cultivé a très peu d’affinité avec les autres génomes. L’exploitation du matériel créé devra nécessairement passer par l’utilisation des nouveaux outils de la cytogénétique et de la biologie moléculaire (hybridation in situ, emploi de marqueurs moléculaires de l’ADN) qui permettent une amélioration sensible de l’exploitation des hybrides interspécifiques de cotonnier par une meilleure quantification des échanges de matériel génétique qui se produisent, l’identification du matériel chromosomique introgressé et le choix des individus les plus intéressants en cours de sélection (Jr, 1995 ; Ahoton et al., 2003).
26Le marqueur moléculaire est un locus dont le génotype renseigne sur le génotype d’un ou de plusieurs locus voisins (Santoni et al., 2000) et sert, pour l’améliorateur, de repère pour suivre la transmission du gène d’intérêt d’une génération à l’autre (Boichard et al., 1998). Il existe actuellement une grande diversité de marqueurs moléculaires. On peut citer entre autres, les marqueurs RAPD (Randomly Amplified Polymorphic DNA), SSR (Simple Sequence Repeats), ISSR (Inter Simple Sequence Repeats), AFLP (Amplified Fragment Length Polymorphism), RFLP (Restriction Fragment Length Polymorphism), EST (Expressed Sequence Tags) (Santoni et al., 2000). De tous ces marqueurs, les microsatellites (SSR) avec leur multi-allélisme, leur codominance et l’existence de cartes de liaison génétique SSR chez le cotonnier, sont particulièrement bien adaptés pour assister le travail d’amélioration du cotonnier par hybridation interspécifique (Lu et al., 1996 ; Pejiic et al., 1998 ; Liu et al., 2000a ; Liu et al., 2000b, Saha et al., 2003 ; Nguyen et al., 2004). La technique d’hybridation in situ, en permettant l’identification des chromosomes ou fragments de chromosomes parentaux chez les hybrides interspécifiques, permet à l’améliorateur de déterminer la présence de recombinaisons entre les génomes impliqués dans les croisements et de suivre effectivement l’introgression du matériel génétique de l’espèce donneuse du caractère d’intérêt (Jiang, Gill, 1994 ; Humphreys et al., 1995 ; D’Hont et al., 1996). L’emploi de ces techniques modernes pour assister le travail de sélection permet de diriger efficacement les recombinaisons en supprimant une grande part du rôle du hasard dans l’obtention de résultats ; il en résulte un gain de temps et une meilleure utilisation de la variabilité.
6. Conclusion
27La recherche d’une solution génétique à l’immense défi que pose le nématode réniforme à la durabilité de la culture du cotonnier dans le Nouveau Monde est, a priori, la voie la plus prometteuse en termes de rentabilité financière des exploitations agricoles et d’impact sur l’environnement. L’exploitation de l’énorme réservoir de variabilité génétique que constituent les espèces diploïdes de cotonnier est une alternative prometteuse pour atteindre cette solution. Parmi les espèces diploïdes, G. longicalyx est certainement celle qui présente le plus d’intérêt compte tenu de son très haut niveau de résistance et de la bonne affinité d’appariement de ses chromosomes vis-à-vis de ceux du sous-génome Ah de G. hirsutum. Aujourd’hui, le généticien du cotonnier dispose d’outils et de techniques variés et pointus pour développer de façon plus rapide et plus efficace des variétés améliorées à partir d’hybrides interspécifiques. Les marqueurs moléculaires de l’ADN et la cytogénétique moléculaire permettent de suivre de manière beaucoup plus efficace que par le passé l’introgression du matériel génétique des espèces donneuses de caractères d’intérêt et d’accélérer la sélection de plantes introgressées génétiquement équilibrées. Les exemples d’introgression réussie et durable de résistance à des nématodes chez d’autres plantes (Castagnone-Serono, 2002), renforcent l’espoir dans le développement prochain d’un cotonnier résistant au nématode réniforme dans le cadre de programmes d’amélioration interspécifique du cotonnier. Actuellement des recherches sont en cours à l’Unité de Phytotechnie tropicale et d’Horticulture de la Faculté universitaire des Sciences agronomiques de Gembloux (Belgique), en vue du développement par hybridation interspécifique de cotonniers génétiquement équilibrés, agronomiquement compétitifs et résistants à R. reniformis.
Bibliographie
Agudelo P., Robbins R., Stewart JM., Bell AA., Robinson AF. (2005). Histological observations of Rotylenchulus reniformis on Gossypium longicalyx and interspecific cotton hybrids. J. Nematol. 37, p. 444–447.
Ahoton L., Lacape JM., Baudoin JP., Mergeai G. (2003). Introduction of australian diploïd cotton genetic variation into Upland cotton. Crop. Sci. 43, p. 1999–2005.
Ayala A., Ramirez CT. (1964). Host-range, distribution and bibliography of the reniform nematode, Rotylenchulus reniformis, with special reference to Puerto Rico. J. Agric. Univ. Puerto Rico 48 (2), p. 140–161.
Bernhard R., Bouquet A., Massese CSL. (1985). Diversité des problèmes nématologiques en vergers et en vignobles, solutions chimiques et génétique. C.R. Acad. Agri. Fr. 71 (7), p. 705–718.
Berti F., Hofs JL., Zagbaï HS., Lebailly P. (2006). Le coton dans le monde, place du coton africain et principaux enjeux. Biotechnol. Agron. Soc. Environ. 10 (4), p. 271–280.
Birchifield W. (1962). Host-parasite relations of Rotylenchulus reniformis on Gossypium hirsutum. Phytopathology 52, p. 562–865.
Birchifield W., Jones JE. (1961). Distribution of the reniform nematode in relation to crop failure of cotton in Louisiana. Plant Dis. Rep. 45, p. 671–673.
Bocchino F. (1999). Les modifications du panorama cotonnier entre 1949 et 1999. Coton Dév., Hors série (septembre), p. 8–13.
Boichard D., Le Roy P., Levéziel H., Elsen JM. (1998). Utilisation des marqueurs moléculaires en génétique animale. INRA Prod. Anim. 11, p. 67–80.
Carter CH., McGawley EC., Russin JS. (1995). Reproduction of Rotylenchulus reniformis on weed species common to Lousiana soybean fields. J. Nématol. 27, p. 494–495.
Carter WW. (1981). Resistance and resistant reaction of Gossypium arboreum to reniform nematode, Rotylenchulus reniformis. J. Nématol. 13, p. 368–374.
Castagnone-Sereno P. (2002). Genetic variability of nematodes: threat to the durability of plant resistant genes? Euphytica 124, p. 193–199.
Cohn E. (1973). Histology of the feeding site of Rotylenchulus reniformis. Nematologica 19, p. 455–458.
Cohn E., Mordechai M. (1988). Morphology and parasitism of the mature female of Rotylenchulus macrosomus. Rev. Nématol. 11, p. 385–389.
Cook CG., Robinson AF. (1998). Reniform nematode and silverleaf whitefly influence on lint yield, fiber quality and seed quality of cotton. In Dugger P., Richter D. Proceedings of beltwide cotton conferences. Memphis, TN, USA: National Cotton Council, p. 171–172.
Cook CG., Robinson AF., Namken LN. (1997). Tolerance to Rotylenchulus reniformis and resistance to Meloidogyne incognita Race 3 in high-yielding breeding lines of upland cotton. J. Nematol. 29 (3), p. 322–328.
Courtant JJ., Estur G., Raymond H., Raymond G. (1991). Le coton en Afrique de l’Ouest et du centre : situation et perspective (2e ed.). Paris : Ministère de la Coopération et du Développement, 353 p.
Dasgupta DR., Raski DJ., Sher SA. (1968). A revision of the genus Rotylenchulus Linford and Oliveira 1940 (Nematoda: Tylenchidae). Proc. Helminthological Soc. Washington 35, p. 169–172.
Davis RF., Koenning SR., Kemerait RC., Cummings TD., Shurley WD. (2003). Rotylenchulus reniformis management in cotton with crop rotation. J. Nematol. 35 (1), p. 58–64.
Davis RM., Colyer PD., Rothrock CS., Kochman JK. (2006). Fusarium wilt of cotton: population, diversity and implications for management. Plant Dis. 90 (6), p. 692–703.
Demol J., Baudoin JP., Louant BP., Maréchal R., Mergeai G., Otoul E. (2002). Amélioration des plantes. Application aux principales espèces cultivées en régions tropicales. Gembloux, Belgique : Presses agronomiques de Gembloux, 581 p.
D’Hont A., Grivet L., Feldman P., Rao S., Berding N., Glaszmann JC. (1996). Characterisation of the double genome structure of modern sugarcane cultivars (Saccharum spp.) by molecular cytogenetics. Mol. Gen. Genet. 250, p. 405–413.
Estur G. (2006). Le marché mondial du coton : évolution et perspectives. Cah. Agric. 15 (1), p. 9–16.
Ferron P., Deguine JP., Mouté JEM. (2006). Evolution de la protection phytosanitaire du cotonnier : un cas d’école. Cah. Agric. 15 (1), p. 128–134.
Hau B. (1981). Lignées d’addition sur l’espèce Gossypium hirsutum L. : utilisation de l’hybridation interspécifique et de la méthode des lignées d’addition pour l’amélioration du cotonnier. Coton Fibre Trop. 36 (3), p. 247–258.
Humphreys MW., Thomas HM., Morgan WG., Meredith MR., Harper JA., Thomas H. Zwierzykowski Z., Gheshiere M. (1995). Discriminating the ancestral progenitors of hexaploid Festuca arundinacea using genomic in situ hybridization. Heredity 75, p. 171–174.
Jiang J., Gill BS. (1994). Nonisotopic in situ hybridization and plant genome mapping: the first 10 years. Genome 37, p. 717–725.
Jr WRM. (1995). Use of molecular markers in cotton breeding. In Constable GA, Forrester NW (eds). Challenging the future: proceedings of the world cotton research conference-1, Brisbane, 14-17 February 1994. Melbourne, Australia: CSIRO, p. 303–308.
Kammacher P. (1956). Les possibilités actuelles d’application de l’hybridation interspécifique à l’amélioration du cotonnier en milieu africain. Coton Fibre Trop. 11, p. 101–136.
Koenning SR., Kirkpatrick TL., Starr JL., Wrather JA., Walker NR., Mueller JD. (2004). Plant-parasitic nematodes attacking cotton in the United States: Old and emerging production challenges. Plant Dis. 88, p. 100–113.
Lindhout P. (2002). The perspectives of polygenic resistance in breeding for durable disease resistance. Euphytica 124, p. 217–226.
Linford MB., Oliveira JM. (1940). Rotylenchulus reniformis, nov. gen., n. sp., nematode parasite of roots. Proc. Helminthological Soc. Washington 7, p. 35–42.
Liu S., Cantrell RG., McCarty JC., Jr Stewart JMcD. (2000a). Plant genetic resources. Simple sequence repeat-based assessment of genetic diversity in cotton race stock accessions. Crop Sci. 40, p. 1459–1469.
Liu S., Saha S., Stelly D., Burr B., Cantrell RG. (2000b). Chromosomal assignment of microsatellite loci in cotton. Am. Genet. Assoc. 91, p. 326–332.
Lu J., Knox MR., Ambrose MJ., Brown JKM., Ellis THN. (1996). Comparative analysis of genetic diversity in pea assessed by RFLP and PCR-based methods. Theor. Appl. Genet. 93, p. 1103–1111.
Loof P., Oostenbrink M. (1962). Rotylenchulus borealis n. sp. with a key to the species of Rotylenchulus. Nematologica 7, p. 83–90.
McDonald BA., Linde C. (2002). The population genetics of plant pathogens and breeding strategies for durable resistance. Euphytica 124, p. 163–180.
McSorley R. (2003). Adaptation of nematodes to environnemental extremes. Fla. Entomol. 86 (2), p. 138–142.
Mergeai G. (2006). Introgressions interspécifiques chez le cotonnier. Cah. Agric. 15, p. 135–143.
Mergeai G., Ndungo V., Folo A., Delhove G., Hofs JL., Baudoin JP. (1994). Choix d'une nouvelle variété pour les zones cotonnières méridionales du Zaïre. Résultats des essais variétaux préliminaires. Bull. Rech. Agron. Gembloux 29, p. 423–447.
Ndungo V., Demol J., Maréchal R. (1988a). L’amélioration du cotonnier Gossypium hirsutum L. par hybridation interspécifique : 1. Phylogénie et spéciation du genre Gossypium. Bull. Rech. Agron. Gembloux. 23 (1), p. 27–49.
Ndungo V., Demol J., Maréchal R. (1988b). L’amélioration du cotonnier Gossypium hirsutum L. par hybridation interspécifique : 2. Méthodologies pour l’exploitation de la diversité du genre Gossypium. Bull. Rech. Agron. Gembloux 23 (2), p. 171–204.
Ndungo V., Demol J., Maréchal R. (1988c). L’amélioration du cotonnier Gossypium hirsutum L. par hybridation interspécifique : 3. Application et résultats obtenus. Bull.Rech. Agron. Gembloux 23 (3), p. 283–316.
Neal DC. (1954). The reniform nematode and its relationship to the incidence of Fusarium wilt of cotton at Baton Rouge, Louisiana. Phytopathology 44, p. 447–450.
Nguyen TB., Giband M., Risterucci AM., Lacape JM. (2004). Wide coverage of the tetraploid cotton genome using newly developed microsatellite markers. Theor. Appl. Genet. 109, p. 167–175.
Nichols B., Chee P., Robinson AF., Roberts P., Stelly D., Weaver D., Cantrell R. (2005). Breeding cotton for resistance to nematodes. Report of the June 9, 2005 meeting in Memphis, Tennessee. [online]. Available <http://creatures.ifas.ufl.edu/nematode/r_reniformis.htm>, consulted on 14/10/06.
Niks RE., Rubiales D. (2002). Potentially durable resistance mechanisms in plants to specialised fungal pathogens. Euphytica 124, p. 201–216.
Parlevliet JE. (2002). Durability of resistance against fungal, bacterial and viral pathogens; present situation. Euphytica 124, p. 147–156.
Parry G. (1982). Le cotonnier et ses produits. Paris : Maisonneuve et Larose, 502 p.
Pejic I., Ajmone-Marsan P., Moragane M., Kozumplick V., Castiglioni P., Taramino G., Motto M. (1998). Comparative analysis of genetic similarity among maize inbred lines detected by RFLPs, RAPDs, SSRs and AFLPS. Theor. Appl. Genet. 97, p. 1248–1255.
Pink DAC. (2002). Strategies using genes for non-durable disease resistance. Euphytica 124 p. 227–236.
Phillips LL., Strickland MA. (1966). The cytology of a hybrid between Gossypium hirsutum and G. longicalyx. Can. J. Genet. Cytol. 8, p. 91–95.
Ritter M. (1985). Connaissances nouvelles sur la biologie des nématodes ; conséquences pratiques. C. R. Acad. Agri. France. 71 (7), p. 691–704.
Robinson AF., Inserra RN., Caswell-Chen EP., Vovlas N., Troccoli A. (1997). Rotylenchulus species: identification, distribution, host ranges and crop plant resistance. Nematropica 27 (2), p. 127–157.
Robinson AF. (1999). Cotton Nematodes. In Smith WC. (ed). Cotton: origin, history, technology and production. Wiley J. & Sons, p. 595–615.
Robinson AF., Cook CG. (2001). Root-knot and reniform reproduction on kenaf and sunn hemp compared with that on nematode resistant and susceptible cotton. Ind. Crops Prod. 13 (3), p. 249–264.
Robinson AF., Bell AA., Stelly DM., Dighe ND., Menz MA. (2005). Introgression of resistance to Rotylenchulus reniformis into Gossypium hirsutum from G. longicalyx. J. Nematol. 37, p. 391.
Saha S., Karaca M., Jenkins JN., Zipf AE., Reddy OUK., Kantety RV. (2003). Simple sequence repeats as useful resources to study transcribed genes of cotton. Euphytica 130, p. 355–364.
Santoni S., Faivre-Rampant P., Prado E., Prat D. (2000). Marqueurs moléculaires pour l’analyse des ressources génétiques et l’amélioration des plantes. Cah. Agric. 9, p. 311–327.
Stewart JM. (1995). Potential for crop improvement with exotic germplasm and genetic engineering. In Constable GA, Forrester NW (eds). Challenging the future: proceedings of the world cotton research conference-1, Brisbane, 14-17 February 1994. Melbourne, Australia: CSIRO, p. 313–327.
Stuthman DD. (2002). Contribution of durable disease resistance to sustainable agriculture. Euphytica 124, p. 253–258.
Treonis AM., Wall DH. (2005) Soil nematodes and desiccation survival in the extreme arid environment of the antarctic dry valleys. Integr. Comp. Biol. 45, p. 741–750.
Urwin PE., Levesley A., McPherson MJ., Atkinson HJ. (2000). Transgenic resistance to the nematode Rotylenchulus reniformis conferred by A. thaliana plants expressing proteinase inhibitors. Mol. Breed. 6, p. 257–264.
Van den Berg E. (1990). Two new and one known species of the Tylenchoidea (Nemata) from southern Africa. Phytophylactica 22, p. 23–34.
Van Den Berg E., Spauli VW. (1981). Rotylenchulus species found associated with sugar cane in South Africa with a description of R. sacchari sp. n. (Nematoda: Rotylenchulinae). Phytophylactica 13, p. 43–47.
Veech JA., McClure MS. (1977). Termpenoid aldehydes in cotton roots susceptible and resistant to the root knot nematode, Meloidogyne incognita. J. Nematol. 9, p. 222–229.
Veech JA. (1978). An apparent relationship between methoxy-substitued terpenoid aldehydes and the resistance of cotton to Meloidogyne incognita. Nematologica 24, p. 81–87.
Vilardebo A., Delattre R. (1971). Aperçu sur quelques nématoses des cultures tropicales. Les nematoses du contonnier. Paris : Association de Coordination Technique Agricole (ACTA), p. 519–530.
Weaver DB., Lawrence KS., van Santen E. (2007). Reniform Nematode Resistance in Upland Cotton Germplasm. Crop Sci. 47, p. 19–24.
Wendel JF., Cronn RC. (2003). Polyploidy and the evolutionary history of cotton. Adv. Agron. 78, p. 139–186.
Westphal A., Scott AW. (2005). Implementation of soybean in cotton cropping sequences for management of reniform nematode in South Texas. Crop. Sci. 45, p. 233–239.
Yik CP., Birchfield W. (1984). Resistant germplasm in Gossypium species and related plants to Rotylenchulus reniformis. J. Nematol. 16, p. 146–153.
Pour citer cet article
A propos de : N’Guessan Olivier Konan
Faculté universitaire des Sciences agronomiques de Gembloux. Unité de Phytotechnie tropicale et d’Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : konan.n@fsagx.ac.be – nguessanolivier@yahoo.fr
A propos de : Guy Mergeai
Faculté universitaire des Sciences agronomiques de Gembloux. Unité de Phytotechnie tropicale et d’Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






