- Portada
- Volume 15 (2011)
- numéro 2
- Activité anti-androgénique de Leptadenia hastata (Pers.) Decne : effet compétitif des extraits aqueux de la plante et du propionate de testostérone sur des rats impubères castrés
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Activité anti-androgénique de Leptadenia hastata (Pers.) Decne : effet compétitif des extraits aqueux de la plante et du propionate de testostérone sur des rats impubères castrés

Notes de la rédaction
Reçu le 23 janvier 2010, accepté le 16 novembre 2010
Résumé
L'activité anti-androgénique et l'évaluation de la compétitivité entre les extraits aqueux de Leptadenia hastata et le propionate de testostérone (PT) ont été étudiés sur des rats Wistar impubères castrés. Il a été, dans un premier groupe, administré uniquement aux rats 0,04 ; 0,4 ; 4 ; 40 ; 400 et 1 000 µg.kg-1 de PT, puis dans un second groupe, il a été administré aux rats ces mêmes doses de PT simultanément avec la dose de 200 mg.kg-1 de L. hastata. Les différents traitements ont montré une augmentation significative (p < 0,05) du poids des organes androgéno-dépendants et du niveau de la testostérone plasmatique. À faibles doses de PT, la dose de 200 mg.kg-1 de L. hastata inhibe l'effet de la PT et à fortes doses, cet effet est potentialisé. En conclusion, l'effet anti-androgénique de l'extrait de L. hastata s'exprime lorsque les doses de PT sont faibles.
Abstract
Anti-androgenic activity of Leptadenia hastata (Pers.) Decne: competitive effect of the aqueous extracts of the plant and the testosterone propionate on castrated immature rats. The anti-androgenic activity and the evaluation of competitiveness between the extracts of Leptadenia hastata and the testosterone propionate (TP) were studied on Wistar immature castrated rats. The first group received only 0.04; 0.4; 4; 40; 400 and 1,000 µg.kg-1 of TP and the second group received simultaneously these different doses of TP and 200 mg.kg-1 of L. hastata. The various treatments showed a significant increase (p < 0.05) of the weight of androgeno-dependent organs and the level of plasmatic testosterone. At low dosis of TP, the dosis of 200 mg.kg-1 of L. hastata inhibited TP effects, whereas at high doses of TP L. hastata extracts potentiated TP effects. In conclusion, the anti-androgenic effect of the extract of L. hastata is expressed when the TP amounts are weak.
Tabla de contenidos
1. Introduction
1Dans la région du nord du Burkina Faso, grande zone d'élevage, pousse tout au long de l'année Leptadenia hastata (Pers.) Decne, une liane vivace de la famille des Asclepediaceae. Sur la base d'enquêtes ethnobotaniques et de certains entretiens avec les tradipraticiens, il est ressorti que la consommation des tiges feuillées de L. hastata aurait des effets anti-fertilisants sur les ânes, les chameaux et les chevaux. Dans d'autres régions du Burkina Faso, la consommation de L. hastata aurait également des effets néfastes sur la fécondité des espèces ovines et bovines. Certaines ressources documentaires font ressortir les effets anti-fertilisants de la plante dans des pays comme le Sénégal, le Niger et le Mali (Berhaut, 1979 ; Ake-Assi, 1992 ; Arbonnier, 2000).
2L. hastata a fait l'objet de plusieurs études qui ont démontré son action anti-inflammatoire (Nikiema et al., 2001), son effet inhibiteur sur certaines cellules tumorales (Aquino et al., 1996) et son effet trypanocide (Bizimana et al., 2006). Cependant jusqu'à nos jours, aucune étude n'a montré les effets des extraits de L. hastata sur la fonction de reproduction.
3Le but de cette étude est dans un premier temps de montrer les effets anti-androgéniques de L. hastata et ensuite, de mettre en évidence la compétition entre différentes doses de propionate de testostérone (PT) et la dose de 200 mg.kg-1 de L. hastata. La dose de 200 mg.kg-1 est celle à partir de laquelle les effets anti-androgéniques se manifestent. Il s'agira, dans cette étude, d'évaluer sur des rats impubères castrés l'effet de différentes doses de PT combinées ou non à la dose de 200 mg.kg-1 de L. hastata sur les organes androgéno-dépendants et le niveau de testostérone plasmatique.
2. Matériel et méthodes
2.1. Mode de récolte et préparation des extraits
4Les tiges feuillées de L. hastata ont été récoltées pendant les mois de mars et avril 2008 à Kamboinsè, localité située à 25 km au nord de Ouagadougou (Burkina Faso). L'identification a été effectuée au Laboratoire de Botanique de l'Université de Ouagadougou où se trouve un spécimen authentifié. Les feuilles sont lavées à grande eau puis séchées sous ventilation artificielle à l'abri du soleil et de la poussière. Une fois séchées, les feuilles sont réduites en poudre et scellées dans des sachets hermétiques. Cent-cinquante grammes du broyat sont mis à macérer dans 500 ml d'eau distillée. La macération est faite pendant 24 h sous agitation magnétique, à l'abri de la lumière en recouvrant les béchers de papier aluminium. Le macéré est ensuite recueilli et centrifugé. Le surnageant est filtré, congelé et lyophilisé. Après 72 h de lyophilisation, on obtient une poudre avec un rendement de 24,6 %. Le lyophilisat est conservé dans un dessiccateur pour éviter toute humidification.
2.2. Le produit chimique
5Le produit chimique utilisé est le propionate de testostérone (pureté : 97 %) de Sigma Chemical Co. (St. Louis, MO, USA) et de Aldrich Chemical Co.
2.3. Modèle animal
6Pour les expérimentations, ce sont des rats mâles impubères de race Wistar provenant de l'élevage Charles Rivers (France) qui ont été utilisés. À l'animalerie, les rats ont librement accès à l'eau et à la nourriture et sont soumis chaque jour à 12 h d'obscurité et 12 h de lumière. La température moyenne dans l'animalerie est de 22 ± 3 °C, l'humidité relative de 55 %. Les rats sont castrés à 21 jours d'âge sous anesthésie générale à la kétamine + xylasine. Les différents traitements ont commencé 7 jours après les castrations pour permettre une récupération complète des rats.
2.4. Méthodologie
7Les essais se sont déroulés sur deux groupes, un groupe recevant des doses croissantes de PT (0,04 ; 0,4 ; 4 ; 40 ; 400 et 1 000 µg.kg-1) et un groupe recevant simultanément les mêmes doses croissantes de PT et une dose fixe de L. hastata (200 mg.kg-1). Chaque groupe est constitué de 6 lots de 6 rats impubères castrés. Avant la constitution des lots, un allotement a été fait pour réduire la différence de poids moyen entre lots.
8L'administration des extraits aqueux de L. hastata a duré 10 jours consécutifs et s'est faite par voie orale à l'aide de seringues pour gavage œsophagien. L'administration de propionate de testostérone s'est faite par voie intrapéritonéale. Les différentes doses de L. hastata et la dose de propionate de testostérone sont préparées extemporanément et sont administrées par kg de poids corporel. La solution mère de propionate de testostérone est d'abord préparée dans de l'alcool à 95 % avant d'être diluée dans l'huile d'arachide (la concentration finale en alcool est de 2,5 %).
2.5. Évaluation pondérale des organes androgéno-dépendants et des glandes surrénales
9Vingt-quatre heures après le dernier traitement, les rats ont été anesthésiés à l'aide du mélange kétamine + xylasine (1/10 ; 9/10) et le sang a été prélevé par ponction cardiaque. Les glandes androgéno-dépendantes [vésicules séminales, prostate, glandes coagulantes, glande de Cowper, LABC (les muscles élévateurs de l'anus et bulbocarverneux)] ont été soigneusement prélevés et pesés. Les glandes surrénales ont été également prélevées et pesées.
2.6. Évaluation du niveau de testostérone plasmatique
10La testostérone a été dosée par méthode radio-immunologique. L'hormone de l'échantillon est tout d'abord extraite par un solvant avant d'être mise en compétition avec de l'hormone marquée au tritium pour se lier à un anticorps anti-testostérone. Lorsque l'équilibre est atteint, les complexes hormone-anticorps sont immuno-précipités puis séparés par centrifugation. Pour déterminer la concentration de l'échantillon en testostérone, une gamme étalon a été utilisée. Les points de gamme ont été dosés en triplicate et les échantillons en duplicate. Des échantillons contrôles inclus dans chaque dosage ont permis de suivre la répétabilité intra-dosage et la reproductibilité inter-dosage. La limite de détection du niveau de testostérone plasmatique était de 10 pg.ml-1 (Belanger et al., 1980).
2.7. Analyses statistiques
11Les données ont été analysées en utilisant le logiciel SYSTAT version 10. Les résultats sont exprimés sous la forme de moyenne ± erreur standard (n = 6). L'analyse de variance (ANOVA I) appliquée aux résultats obtenus a permis d'apprécier les effets des différents traitements et doses de produits avec comme niveau de signification 5 %. Le test LSD a été utilisé pour faire les comparaisons entre les moyennes. Les différents graphiques ont été tracés avec le logiciel SIGMA PLOT for Windows Version 10.0.
3. Résultats
3.1. Effet des traitements sur l'évolution du poids des glandes androgéno-dépendantes
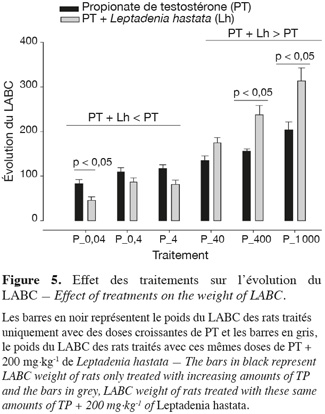
12Au niveau de chaque groupe, les différents traitements entrainent de manière dose-dépendante une augmentation significative (p < 0,05) du poids des différents organes androgéno-dépendants.
13Au niveau intergroupe, la dose de 200 mg.kg-1 de L. hastata combinée aux doses de 0,04 ; 0,4 et 4 µg.kg-1 de PT montre une baisse non significative (p > 0,05) du poids des organes androgéno-dépendants en comparaison avec celle des rats traités uniquement avec ces mêmes doses de PT.
14Lorsque la dose de 200 mg.kg-1 de L. hastata est combinée aux doses de 40, 400 et 1 000 µg.kg-1 de PT, on observe une potentialisation par une augmentation du poids des organes androgéno-dépendants en comparaison des rats traités uniquement avec ces mêmes doses de PT.
15La variation intergroupe du poids des vésicules séminales, de la prostate, des glandes coagulantes, des glandes de Cowper et du LABC n'est pas significative (p > 0,05) pour les doses de 0,04 ; 0,4 ; 40 ; 400 et 1 000 mg.kg-1 (Figures 1, 2, 3, 4 et 5).
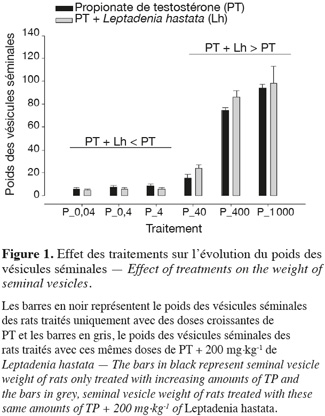
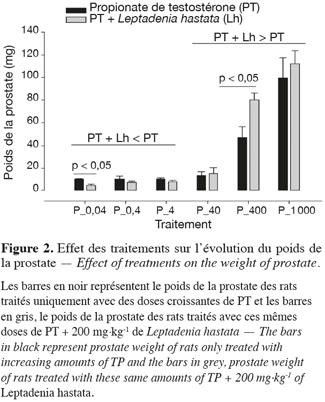
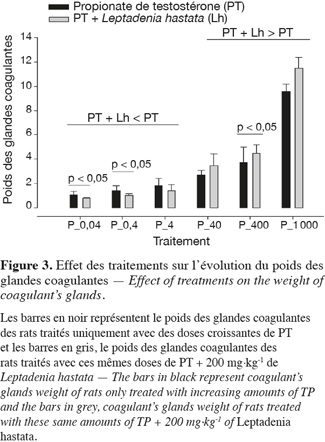
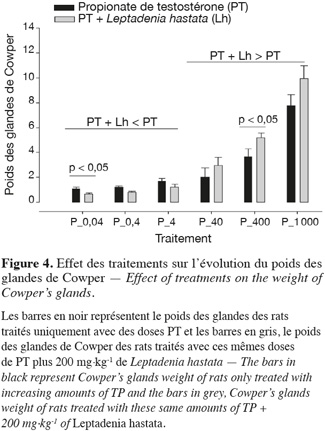
3.2. Effet des traitements sur l'évolution du poids des glandes surrénales
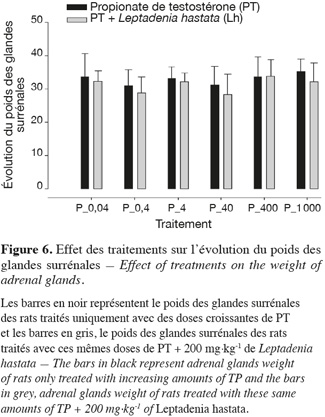
16Au niveau de chaque groupe, les différents traitements n'ont aucune influence sur le poids des glandes surrénales. Que ce soit les différentes doses de PT administrées seules ou combinées à 200 g.kg-1 de L. hastata, le poids des glandes surrénales ne montre pas de variation significative (p > 0,05) entre les deux types de traitements.
17Au niveau intergroupe, le poids des glandes surrénales des rats traités avec les différentes doses de PT combinées à 200 mg.kg-1 de L. hastata, bien que non significative (p > 0,05), est en baisse comparativement à ceux des rats traités uniquement avec les différentes doses de PT (Figure 6).
3.3. Effet des traitements sur le niveau de testostérone plasmatique
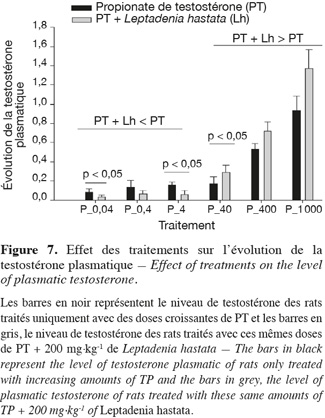
18Au niveau de chaque groupe, les différents traitements entrainent de manière dose-dépendante une augmentation significative (p < 0,05) du taux de testostérone plasmatique.
19Au niveau intergroupe, la combinaison de 0,04 ; 0,4 ; 4 µg.kg-1 de PT à 200 mg.kg-1 de L. hastata entraine une baisse du taux de testostérone plasmatique comparativement à celui des rats traités uniquement avec ces mêmes doses de PT. Par contre, la combinaison de 40, 400 et 1 000 µg.kg-1 de PT à 200 mg.kg-1 de L. hastata entraine une augmentation du taux de testostérone plasmatique comparativement à celui des rats traités uniquement avec ces mêmes doses de PT.
20La variation intergroupe est significative (p < 0,05) aux doses de 0,04 ; 4 ; 40 µg.kg-1 de PT (Figure 7).
4. Discussion
21Plus de 80 % de la population des pays en voie de développement utilisent les plantes médicinales pour leurs problèmes de santé. Malgré cette importante utilisation, très peu de travaux scientifiques sont entrepris pour vérifier l'innocuité et l'efficacité des remèdes issus de ces plantes (Hilaly et al., 2004).
22Dans cette étude, les extraits aqueux des tiges feuillées de L. hastata ont été testés sur des rats impubères castrés pour d'abord évaluer leur effet anti-androgénique et ensuite, mettre en évidence la compétition entre différentes doses de propionate de testostérone (PT) et la dose de 200 mg.kg-1 de L. hastata.
23Le poids des organes androgéno-dépendants (vésicules séminales, prostate, glandes de Cowper, glandes coagulantes, le muscle élévateur de l'anus et le muscle bulbocaverneux) et le niveau de testostérone plasmatique ont été utilisés pour évaluer la compétition entre les extraits aqueux de L. hastata et le PT (Vinggaard et al., 2002 ; Vinggaard et al., 2005). Le test de Hershberger qui permet de détecter les antagonistes des récepteurs androgéniques sur des rats immatures castrés a permis de mettre en évidence cette compétition (Gray et al., 2004 ; Owens et al., 2006).
24La testostérone est produite par les testicules et accessoirement, par les glandes surrénales. Cette sécrétion surrénaléenne est accrue en situation pathologique ou lorsque les testicules sont supprimés par castration (Forest , 1997 ; Chandra et al., 2007). Dans le cas de notre étude, la présence de la testostérone est donc due à une production surrénaléenne précisément de la zone réticulée du cortex surrénal (Bélanger et al., 1992 ; Nakamura et al., 2009).
25Les tests de toxicité générale aigüe réalisés par Tamboura et al. (2004) ont montré que les extraits aqueux des tiges feuillées de L. hastata étaient non toxiques.
26Les différents résultats ont montré que les fortes doses de PT sont potentialisées par la dose de 200 mg.kg-1 de L. hastata. Lorsque les doses sont faibles, l'effet anti-androgénique des extraits aqueux de L. hastata s'exprime par une diminution de l'effet du PT. Les extraits aqueux de L. hastata contiendraient des substances anti-androgéniques non stéroïdiennes qui inhiberaient l'effet du PT à faible dose. Quarante µg.kg-1 de PT est la dose maximale en deçà de laquelle l'effet antagoniste des extraits aqueux de L. hastata apparait. Au-delà, la dose de 200 mg.kg-1 de L. hastata potentialise l'effet du PT. Les substances anti-androgéniques contenues dans les extraits aqueux de L. hastata pourraient être des antagonistes des récepteurs androgéniques, inhibant ou réduisant ainsi l'effet du PT. Les anti-androgènes se lient aux récepteurs androgéniques, empêchant ainsi leur reconnaissance par les androgènes (Cook et al., 1993 ; O'Connor et al., 1998 ; Lambright et al., 2000).
27Les substances contenues dans les extraits aqueux des tiges feuillées de L. hastata pourraient également être des phytoestrogènes qui sont des molécules d'origine végétale diverse qui, par leur homologie structurale avec le 17 ß-estradiol, peuvent avoir des actions modulatrices des œstrogènes par des effets oestrogéniques ou anti-oestrogéniques (Rochira et al., 2001 ; Diel et al., 2002 ; Sampaio et al., 2009). Les effets observés pourraient aussi s'expliquer par une action au niveau de l'aromatase, enzyme qui permet de convertir les androgènes comme la testostérone en œstrogène (Carreau et al., 1999 ; Carreau et al., 2007). La présence d'stradiol dans les extraits de L. hastata entrainerait au niveau de l'axe hypothalamo-hypophysaire un ralentissement du générateur de pulses hypothalamiques et donc la libération de la LH (Meikle et al., 1986 ; Reed et al., 1987). Lorsque les doses de PT sont faibles, la présence d'estradiol dans les extraits pourrait donc entrainer une baisse de la production de LH, donc de la testostérone plasmatique par un rétrocontrôle négatif. La testostérone inhibe préférentiellement la sécrétion de LH, alors que les œstrogènes, dont l'action frénatrice globale est plus marquée que celle de la testostérone (Cameron et al., 1991), inhibe de façon identique la LH et la FSH. L'action des œstrogènes pourrait être inhibée par les fortes doses de testostérone entrainant donc une potentialisation, ce qui s'observe lorsque les doses de PT sont fortes. Cet argumentaire n'est cependant pas plausible à partir du moment où les tests ont porté sur des rats castrés, ce qui ferait disparaitre le rétrocontrôle et entrainerait une augmentation marquée de la LH. Or, la LH agit préférentiellement sur les cellules de Leydig situées autour et entre les tubes séminifères du testicule (Meikle et al., 1990 ; Kamischke et al., 1998) et dont le principal rôle est la production des androgènes (Schulze, 1984). L'une des explications qui pourrait donc être envisagée est la voie de la production surrénalienne. La production surrénalienne de la testostérone est sous contrôle de l'ACTH régulée par le cortisol. Il serait souhaitable de rechercher l'interaction qui pourrait exister entre les œstrogènes et la sécrétion de l'ACTH au niveau hypophysaire. Cependant, pour une meilleure compréhension de l'identification du site de l'interaction au niveau du récepteur de la testostérone, un test de compétition entre la testostérone radiomarquée et l'extrait de la plante serait nécessaire (Scippo et al., 2004) ou encore, un test in vitro sur des cellules équipées d'un gène rapporteur codant par exemple pour la luciférase (Willemsen et al., 2004).
5. Conclusion
28En conclusion, cette étude met en évidence l'effet anti-androgénique des extraits aqueux des tiges feuillées de L. hastata, ce qui confirme l'inquiétude des éleveurs quant à la baisse de la fertilité des animaux après la consommation de cette plante. La dose de 40 µg.kg-1 de propionate de testostérone est la dose maximale en deçà de laquelle l'effet anti-androgénique des extraits de L. hastata se manifeste. Au delà, les doses de PT sont hors gamme et masquent l'effet des extraits de L. hastata. Que ce soit des anti-androgènes non stéroïdiens ou des phytoestrogènes contenus dans les extraits de L. hastata, ces substances font l'objet de nouvelles approches thérapeutiques pour lutter contre les cancers de la prostate et du sein, les maladies cardiovasculaires, l'ostéoporose et les bouffées de chaleur chez les femmes ménopausées (Richardson et al., 2000 ; Boik, 2001 ; Diel et al., 2001 ; Schmidt et al., 2005).
29Remerciements
30Nous remercions l'AUF (Agence Universitaire de la Francophonie) de nous avoir fait bénéficier de la bourse post-doctorale qui a permis de faire un séjour à l'UMR/PRC, INRA à Tours, où ont été effectués les différents tests. Nous sommes très redevables à équipe Neurobiologie et Maîtrise des Fonctions saisonnières qui a mis tous les moyens à notre disposition pour la réalisation de ces tests.
Bibliographie
Ake-Assi Y.A., 1992. Contribution au recensement des espèces végétales utilisées traditionnellement sur le plan zootechnique et vétérinaire en Afrique de l'Ouest. Thèse de doctorat : Faculté des Sciences vétérinaires, Université Claude Bernard (Lyon).
Aquino R. et al., 1996. New polyoxypregnane ester derivates from Leptadenia hastata. J. Nat. Prod., 59(6), 555-564.
Arbonnier M., 2000. Arbres, arbustes et lianes des zones sèches d'Afrique de l'Ouest. Montpellier, France : CIRAD ; Paris : MNHN ; UICN.
Belanger A., Caron S. & Picard V., 1980. Simultaneous radioimmuno-assay of progestins, androgens and estrogens in rat testis. J. Steroid Biochem., 13, 185-190.
Bélanger B. et al., 1992. Adrenal steroidogenesis in the guinea pig: effects of androgens. Steroids, 57(2), 76-81.
Berhaut J., 1979. Flore illustrée du Sénégal. Dakar : Gouvernement du Sénégal, Ministère du Développement rural, Direction des Eaux et Forêts.
Bizimana N. et al., 2006. Evaluation of medicinal plants from Mali for their in vitro and in vivo trypanocidal activity. J. Ethnopharmacol., 103, 350-356.
Boik J., 2001. Natural compounds in cancer therapy. Princeton, MN, USA : Oregon Medical Press, 25.
Cameron J.L. et al., 1991. Slowing of pulsatile luteinizing hormone secretion in men after forty-eight hours of fasting. J. Clin. Endocrinol. Metab., 73, 35-41.
Carreau S., Genissel C., Bilinska B. & Levallet J., 1999. Sources of estrogen in the testis and reproductive tract of the male. Int. J. Androl., 22, 211-223.
Carreau S. et al., 2007. Estrogens and male reproduction: a new concept. Braz. J. Med. Biol. Res., 40, 761-768.
Chandra A.K. et al., 2007. Chromium induced testicular impairment in relation to adrenocortical activities in adult albino rats. Reprod. Toxicol., 24(3-4), 388-396.
Cook J.C., Mullin L.S., Frame S.R. & Biegel L.B., 1993. Investigation of a mechanism for Leydig cell tumorigenesis by linuron in rats. Toxicol. Appl. Pharmacol., 119, 195-204.
Diel P., Olff S., Schmidt S. & Michna H., 2001. Molecular identification of potential selective estrogen receptor modulator (SERM) like properties of phytoestrogens in the human breast cancer cell line MCF-7. Planta Med., 67, 510-514.
Diel P., Schmidt S. & Vollmer G., 2002. In vivo test systems for the quantitative and qualitative analysis of the biological activity of phytoestrogens. J. Chromatogr. B., 777, 191-202.
Forest M.G., 1997. La puberté surrénalienne. Andrologie, 7(2), 165-186.
Gray L.E. Jr. et al., 2004. Use of the laboratory rat as a model in endocrine disruptor screening and testing. ILAR J., 45, 425-437.
Hilaly J.E., Israili Z.H. & Lyoussi B., 2004. Acute and chronic toxicological studies of Ajuga iva in experimental animals. J. Ethnopharmacol., 91, 43-50.
Kamischke A. et al., 1998. Testosterone levels in men with chronic obstructive pulmonary disease with or without glucocorticoid therapy. Eur. Respir. J., 11, 41-45.
Lambright C. et al., 2000. Cellular and molecular mechanisms of action of linuron: an antiandrogenic herbicide that produces reproductive malformations in male rats. Toxicol. Sci., 56, 389-399.
Meikle A.W., Bishop D., Stringham J. & West D., 1986. Quantitating genetic and nongenetic factors that determine plasma sex steroid variation in normal twins. Metabolism, 35, 1090-1095.
Meikle A.W., Stringham J.D., Woordward D.M. & MCmurry M., 1990. Effects of a fat-containing meal on sex hormones in men. Metabolism, 39, 943-946.
Nakamura Y. et al., 2009. Type 5 17beta-hydroxysteroid dehydrogenase (AKR1C3) contributes to testosterone production in the adrenal reticularis. J. Clin. Endocrinol. Metab., 94(6), 2192-2198.
Nikiéma J.B. et al., 2001. Effects of antiinflammatory triterpenes isolated from Leptadenia hastata latex on keratinocyte proliferation. Phytother Res., 15(2), 131-134.
O'Connor J.C. et al., 1998. An ongoing validation of a Tier I screening battery for detecting endocrine-active compounds (EACs). Toxicol. Sci., 46, 45-60.
Owens W. et al., 2006. The OECD program to validate the rat Hershberger bioassay to screen compounds for in vivo androgen and antiandrogen responses. Phase 1: use of a potent agonist and a potent antagonist to test the standardized protocol. Environ. Health Perspect., 114, 1259-1265.
Reed M.J. et al., 1987. Dietary lipids: an additional regulator of plasma levels of sex hormone binding globulin. J. Clin. Endocrinol. Metab., 64, 1083-1085.
Richardson M.A. et al., 2000. Complementary/alternative medicine use in a comprehensive cancer center and the implications for oncology. J. Clin. Oncol., 18, 2505-2514.
Rochira V. et al., 2001. Congenital estrogen deficiency: in search of the estrogen role in human male reproduction. Mol. Cell. Endocrinol., 178, 107-115.
Sampaio M.D. et al., 2009. Isoflavone regulates vascular endothelial growth factor expression in urinary tract of castrated rats. Maturitas, 62(3), 317-320.
Schmidt S., Michna H. & Diel P., 2005. Combinatory effects of phytoestrogens and 17beta-estradiol on proliferation and apoptosis in MCF-7 breast cancer cells. J. Steroid Biochem. Mol. Biol., 94, 445-449.
Schulze C., 1984. Sertoli cells and Leydig cells in man. Adv. Anat. Embryol. Cell. Biol., 88, 1-104.
Scippo M.L. et al., 2004. Recombinant human estrogen, androgen and progesterone receptors for detection of potential endocrine disruptors. Anal. Bioanal. Chem., 378, 664-669.
Tamboura H.H. et al., 2004. Ecological distribution, morphological characteristics and acute toxicity of aqueous extracts of Holarrhena floribunda (G.Don) Durand & Schinz, Leptadenia hastata (Pers.) Decne and Cassia sieberiana (DC.) used by veterinary healers in Burkina Faso. Afr. J. Trad. Complementary Altern. Med., 2, 11-22.
Vinggaard A.M. et al., 2002. Antiandrogenic effects in vitro and in vivo of the fungicide prochloraz. Toxicol. Sci., 69, 344-353.
Vinggaard A.M. et al., 2005. Antiandrogenic effects in short-term in vivo studies of the fungicide fenarimol. Toxicology, 207, 21-34.
Willemsen P. et al., 2004. Use of reporter cell lines for detection of endocrine disruptor activities. Anal. Bioanal. Chem., 378, 655-663.
Para citar este artículo
Acerca de: Balé Bayala
Université de Ouagadougou. Unité de Formation et de Recherche en Science de la Vie et de la Terre. Laboratoire de Physiologie animale. BF-01 BP 848 Ouagadougou 01 (Burkina Faso). E-mail : bayala_bale71@hotmail.com
Acerca de: Maria Teresa Rubio-Pellicer
Institut National de la Recherche Agronomique (INRA). Unité Mixte de Recherche (UMR). Physiologie de la Reproduction et des Comportements (PRC). Centre de Tours. F-37380 Nouzilly (France).
Acerca de: Moussa Zongo
Université de Ouagadougou. Unité de Formation et de Recherche en Science de la Vie et de la Terre. Laboratoire de Physiologie animale. BF-01 BP 848 Ouagadougou 01 (Burkina Faso).
Acerca de: Benoit Malpaux
Institut National de la Recherche Agronomique (INRA). Unité Mixte de Recherche (UMR). Physiologie de la Reproduction et des Comportements (PRC). Centre de Tours. F-37380 Nouzilly (France).
Acerca de: Laya Sawadogo
Université de Ouagadougou. Unité de Formation et de Recherche en Science de la Vie et de la Terre. Laboratoire de Physiologie animale. BF-01 BP 848 Ouagadougou 01 (Burkina Faso).






