Les oligosaccharides pectiques : production et applications possibles
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Chimie biologique industrielle. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : ammcombo@student.ulg.ac.be – comboagnan@yahoo.fr
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Chimie biologique industrielle. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Chimie biologique industrielle. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
reçu le 25 janvier 2010, accepté le 1 juin 2010
Résumé
Les oligosaccharides pectiques ou POS sont des fragments de composition complexe issus de la dégradation chimique, physique ou enzymatique de la pectine. Du fait de l'intérêt de leurs propriétés biologiques, les oligosaccharides pectiques font l'objet de nombreuses études et trouvent aujourd'hui des applications dans des domaines aussi différents que la médecine, l'agriculture et l'industrie agro-alimentaire. Cet écrit présente la structure des pectines ainsi que les différents modes de production des POS en insistant particulièrement sur les différentes enzymes microbiennes permettant de les obtenir et sur les applications possibles de ces POS.
Abstract
Pectic oligosaccharides: production and potential applications. Pectic oligosaccharides (POS) are complex fragments coming from the chemical, physical or enzymatic degradation of pectin. Many studies have been focused on pectic oligosaccharides because of the interest of their biological properties, and POS have many applications in various fields such as medicine, agriculture and agri-food industry. This paper presents the structure of pectins, the different ways of POS production with particular emphasis on the various microbial enzymes used to obtain them and the possible applications of these POS.
1. Introduction
1Les pectines sont des substances d'origine végétale. Ce sont des polysaccharides complexes que l'on retrouve principalement dans la lamelle moyenne et la paroi primaire des plantes supérieures (Alkorta et al., 1998 ; Blanco et al., 1999). Elles jouent un rôle important dans l'adhésion et le maintien des cellules des tissus végétaux en formant un ciment rattachant les cellules les unes aux autres (Iwasaki et al., 1998). Les pectines sont constituées essentiellement par des résidus d'acide galacturonique (GalA) liés entre eux par des liaisons α-(1-4), partiellement acétylés ou estérifiés par des groupes méthyles (Daas et al., 1999 ; Bonnin et al., 2002a). Ces substances ont fait l'objet de nombreuses recherches portant notamment sur leurs fonctions au sein de la paroi végétale, leur structure chimique et leur caractérisation en tant qu'additifs. Toutes ces recherches ont conduit au développement de nombreuses applications dans des domaines aussi différents que l'industrie cosmétique, plastique et pharmaceutique, mais l'utilisation la plus importante se situe dans l'industrie alimentaire où les pectines sont essentiellement utilisées comme agents de texture, gélifiants, stabilisants et épaississants (Thakur et al., 1997 ; Mesbahi et al., 2005). Les pectines ont également fait l'objet d'une attention particulière de la part des nutritionnistes. Elles sont en effet utilisées comme des fibres alimentaires et exercent des effets physiologiques sur le tractus intestinal en réduisant le temps du transit et l'absorption du glucose (Olano-Martin et al., 2002). Aujourd'hui, la consommation journalière de pectines dans un régime alimentaire occidental se situe entre 4 et 5 g. Quant à la consommation annuelle mondiale de pectine extraite industriellement, elle est estimée à 45 millions de kg (Willats et al., 2006). Différents procédés de transformation des pectines ont été mis au point pour augmenter leurs potentialités en tant que molécules bioactives. À l'heure actuelle, un domaine relativement nouveau de la recherche se concentre sur les propriétés fonctionnelles des oligosaccharides. L'intérêt majeur de ces nouveaux oligosaccharides réside dans leur diversité de structure qui offre un large spectre de propriétés et d'applications. L'utilisation des pectines dans le développement d'oligosaccharides à effet prébiotique et pharmaceutique constitue un nouveau domaine émergent. Pour cela, un grand intérêt est porté aux oligosaccharides pectiques (POS) en raison de leurs potentialités d'utilisation comme nouvelle génération de prébiotiques. Certaines des qualités attribuées à ces oligosaccharides sont la protection contre le cancer du colon, une action antibactérienne, la répression de l'accumulation de lipide dans le foie, l'inhibition de l'adhésion des bactéries aux cellules épithéliales et la stimulation de la croissance des bifidobactéries et d'Eubacterium rectale (Manderson et al., 2005 ; Qiang et al., 2009).
2Nous présentons dans ce travail un état des connaissances sur les pectines, sur la production des oligosaccharides pectiques (POS) tout en insistant sur la voie enzymatique de leur obtention et sur les applications possibles de ces POS.
2. Description des pectines et des sources
3Le terme « pectines » fait référence à un ensemble de polysaccharides complexes qui entrent dans la composition des parois cellulaires de la plupart des végétaux supérieurs (Daas et al., 1999).
4Les pectines sont abondantes dans les fruits et les légumes (Tableau 1) et évoluent avec la maturation des tissus. Bien qu'elles puissent être extraites d'un grand nombre de végétaux, les principales sources industrielles de pectines sont les marcs de pomme et les écorces de citron et d'orange. Les pectines représentent environ 0,5 à 4 % du poids frais du matériel végétal (Kashyap et al., 2001), avec une masse moléculaire variant de 10 à 400 KDa suivant leur origine (Sakai et al., 1993). Les pectines présentent des propriétés physico-chimiques spécifiques du fait de leur caractère polyélectrolyte. Ce caractère leur confère la capacité de s'associer entre elles et de former des gels en présence de cations divalents tels que le calcium (Fang et al., 2008). Généralement, les pectines sont caractérisées par leur degré de méthylation (DM) défini comme étant le pourcentage de groupements carboxyles estérifiés par le méthanol (Levigne et al., 2002). Contrairement à l'acétylestérification, la méthylestérification est en proportion considérable dans les pectines natives (Tho et al., 2006). Ainsi, en fonction du DM, on distingue :
5– les pectines HM (hautement méthylées) : ce sont les pectines dont le degré d'estérification est supérieur à 50 %,
6– les pectines LM (faiblement méthylées) : ce sont les pectines dont le degré d'estérification est inférieur à 50 %.
7Le DM est un paramètre important qui influe sur le processus et le mécanisme d'association des pectines dans la formation des gels. Les pectines HM forment des gels en présence de sucres neutres ou en milieu acide, alors que les LM forment des gels en présence de calcium. Mis à part le DM, le pH, la concentration en sucre ou acide, la présence de chaines latérales, le degré de polymérisation (DP) et la température jouent également un rôle important dans la formation d'un gel (Capel et al., 2006 ; Guillotin et al., 2007). Ces propriétés font que les pectines sont d'une importance considérable pour les industries alimentaire, pharmaceutique, biotechnologique et les industries de traitement de polluants (Willats et al., 2006 ; Fang et al., 2008).
3. Structure moléculaire des pectines
8Les pectines sont des hétéropolysaccharides caractérisés par une forte teneur en acide galacturonique (GalA), monomères liés entre eux par des liaisons α-(1-4) et partiellement acétylés ou estérifiés par des groupements méthyles. Elles sont composées de différents polysaccharides associés : les homogalacturonanes, les xylogalacturonanes, les rhamnogalacturonanes, les arabinanes, les galactanes et les arabinogalactanes. Cette association permet de décrire les pectines comme étant constituées essentiellement de trois domaines distincts, à savoir l'homogalacturonane et les rhamnogalacturonanes I et II (RG-I et RG-II) (Perrone et al., 2002).
3.1. Homogalacturonane
9Les homogalacturonanes (Figure 1) représentent 57 à 69 % de la pectine (Jackson et al., 2007). Ce sont des polymères linéaires constitués uniquement d'acides D-galacturoniques reliés entre eux par des liaisons α-(1-4) et dont les fonctions carboxyliques et alcools peuvent être estérifiées respectivement par du méthanol en position C6 et par l'acide acétique en position C2 ou C3. Elles forment la zone lisse des pectines. La méthylestérification des régions homogalacturonanes détermine dans une large mesure l'application industrielle des pectines et leur capacité d'interaction (Ralet et al., 2005). En effet, de nombreuses propriétés et fonctions biologiques des pectines sont déterminées par une interaction ionique entre régions homogalacturonanes (Ridley et al., 2001).
3.2. Rhamnogalacturonane type I
10Le RG-I est une famille de polysaccharides pectiques qui représente 7 à 14 % de la pectine et environ 20 à 80 % des rhamnoses du RG-I sont substitués (Ridley et al., 2001 ; Jackson et al., 2007). Le RG-I d'un degré de polymérisation (DP) d'environ 1 000 est constitué d'une alternance d'unités rhamnosiques et d'unités galacturoniques [→ 4)-α-D-GalA-(1→2)-α-L-Rha-(1→]. Comme dans l'homogalacturonane, certains résidus d'acide galacturonique de RG-I sont acétylés (Dumville et al., 2000 ; Perrone et al., 2002). Différents substituants polysaccharidiques neutres sont capables de se greffer à ce squelette osidique au niveau du carbone C4 du L-rhamnose (Figure 2). Parmi ces substituants, on peut citer le L-arabinose, le D-galactose, les arabinanes, les galactanes ou les arabinogalactanes (Bonnin et al., 2002a). Chez certains végétaux (betterave, épinard, etc.), les chaines latérales peuvent être substituées par des acides phénoliques (acide férulique ou coumarique) estérifiant les fonctions alcools en position 6 des résidus de galactose ou en position 2 des résidus d'arabinose (Bonnin et al., 2002b).
3.3. Rhamnogalacturonane type II
11Le RG-II est un galacturonane substitué qui représente 10 à 11 % de la pectine et dont la structure complexe est très conservée au sein des espèces végétales (Jackson et al., 2007). Avec un DP d'environ 60 (Dumville et al., 2000), le RG-II comprend au moins huit résidus d'acides galacturoniques liés en 1-4 constituant la chaine principale, sur laquelle sont greffés quatre complexes glycosidiques différents (Figure 3). Ces complexes glycosidiques sont composés d'arabinofuranose, d'arabinopyranose, de glucopyranose, de fucopyranose, d'apiofuranose et de galactopyranose et d'autres sucres inhabituels tels que le Dha : acide 3-déoxy-D-lyxo-heptulosarique, le Kdo : acide 3-déoxy-D-manno-octulosonique et l'acide acérique. Il contient également des sucres méthylés rarement observés comme le 2-O-méthylxylose et le 2-O-méthylfucose (Ridley et al., 2001). Le RG-II se présente principalement sous la forme d'un dimère dans la paroi cellulaire des plantes par l'établissement de liaison covalente de diester de bore. Cette liaison est formée entre le OH-2 et le OH-3 des résidus β-D-apiofuranose de chaque sous-unité monomérique de RG-II. En outre, il a été montré que seul le résidu apiofuranose de chaque chaine latérale A participe à cette dimérisation (Ishii et al., 1999 ; Ridley et al., 2001).

4. Production des oligosaccharides pectiques
12Les oligosaccharides pectiques sont des fragments pectiques de compositions complexes dérivés de la pectine. Plusieurs modes de production des oligosaccharides pectiques sont envisageables. Il peut s'agir de traitements chimiques utilisant des acides dilués ou concentrés (acide chlorhydrique, acide sulfurique, acide trifluoroacétique, acide formique ou acide nitrique) chauffés entre 50 et 90 °C (Courtois, 2009). Certains traitements physiques peuvent également être utilisés : thermique, micro-ondes, irradiation γ et ultrasonication (Barreteau et al., 2006 ; Courtois, 2009). Par exemple, le traitement de polysaccharides par irradiation micro-ondes pour obtenir des oligosaccharides entraine une diminution des temps de réaction, de bons rendements et une diminution des réactions secondaires. L'irradiation γ induit principalement la formation de radicaux hydroxyles libres qui catalysent la dépolymérisation du polysaccharide (Courtois, 2009). Cependant, lorsque le processus de dégradation est associé à une température de plus de 100 °C, des quantités résiduelles de protéines ou de peptides présents dans l'échantillon peuvent provoquer des réactions de Maillard, par conséquent des molécules indésirables et potentiellement toxiques peuvent se former (Courtois, 2009). Enfin, les traitements enzymatiques permettent, contrairement aux deux types de méthodes précédentes, des coupures plus spécifiques des chaines pectiques. L'utilisation d'enzymes permet de cibler le site de réaction et d'opérer dans des conditions douces qui limitent les réactions secondaires (comme la caramélisation). Ces enzymes appartiennent au groupe des hydrolases ou lyases et sont spécifiques des liaisons glycosidiques ; toutefois, la présence de substituants sur les unités osidiques peut inhiber le clivage du polymère. Les enzymes impliquées dans la dégradation des pectines sont nombreuses du fait de la nature complexe du polysaccharide.
4.1. Les enzymes pectinolytiques
13Les enzymes pectinolytiques ou pectinases sont un groupe hétérogène d'enzymes qui hydrolysent les substances pectiques et qui sont largement distribuées dans les plantes supérieures et dans les micro-organismes. Cette famille d'enzymes est capable d'attaquer une variété de liaisons chimiques des pectines. Le terme « enzyme pectinolytique » ne concerne que les enzymes qui agissent sur la partie galacturonique des substances pectiques (Figure 4) et les enzymes capables de dégrader les chaines latérales ne sont pas classées parmi les enzymes pectolytiques. La plupart des préparations commerciales de pectinases sont d'origine fongique. Aspergillus niger est la source fongique la plus communément utilisée pour la production industrielle d'enzymes pectinolytiques (Jayani et al., 2005).
14Les enzymes pectinolytiques sont classées selon la nature du substrat (pectine, acide pectique, oligogalacturonate), le mécanisme de dégradation (trans-élimination ou hydrolyse) et le type de clivage (endo ou exo) (Favela-Torres et al., 2006). Ces enzymes peuvent être divisées en deux grands groupes : les pectinestérases (PE) ou pectine-méthylestérases (PME) et les dépolymérases (polygalacturonases et lyases).
15Pectinestérases (PE) ou pectine-méthylestérases (PME). Les PE catalysent l'hydrolyse des liaisons esters méthyliques des pectines HM, entrainant la libération de méthanol et la formation d'acide polygalacturonique. L'activité de la PE peut être suivie soit par le dosage du méthanol libéré, soit par la détermination de l'augmentation du nombre de carboxyles libres ou encore en utilisant un régulateur de pH. En effet, l'ionisation du groupe carboxyle produit un proton dans le milieu, ce qui cause une variation du pH (Jayani et al., 2005). Les PE sont présentes dans de nombreux végétaux supérieurs et elles peuvent être extraites de divers fruits tels que la banane, l'orange, la tomate, la papaye et la pomme (Denès et al., 2000). Mais elles peuvent être aussi produites par des champignons, des bactéries et des levures. Les PE des végétaux, très spécifiques des esters méthyliques des acides pectiques, sont mieux connues que celles d'origine fongique et bactérienne. Leur pH optimum est compris entre 7 et 8, alors que les PE fongiques et bactériennes sont plus actives à pH 4-5. Les PE hydrolysent seulement les groupes esters adjacents à un groupe carboxyle libre et enlèvent ainsi les groupes méthyles de la chaine les uns après les autres dans une direction donnée (Sakai et al., 1993). Beaucoup de travaux ont été menés sur les propriétés physico-chimiques et cinétiques des PE, cependant leur mode d'action n'est toujours pas bien élucidé. Selon Jayani et al. (2005), le mécanisme d'attaque des PE varie en fonction de l'origine. Ainsi, les PE fongiques agissent au hasard suivant un mécanisme « multi-chaine » par lequel l'enzyme forme un complexe enzyme-substrat, se dissocie après la réaction et s'associe à nouveau avec une autre molécule du substrat pour enlever les groupes méthyles. En revanche, les PE des végétaux tendent à agir à l'extrémité non réductrice ou à côté d'un groupe carboxyle libre le long de la molécule par un mécanisme « unichaine » où le substrat est progressivement déméthylé jusqu'à ce que l'enzyme atteigne l'extrémité de la chaine ou un résidu qui bloque sa progression pour se dissocier du complexe enzyme-substrat (Cameron et al., 2008). Un troisième mode d'action a été évoqué : il s'agit d'un mécanisme d'attaque multiple qui est un mécanisme intermédiaire aux deux premiers. Dans ce cas, l'enzyme catalyse la transformation d'un nombre moyen de résidus pour chaque complexe enzyme-substrat formé (Denès et al., 2000 ; Cameron et al., 2008).
16La PE est inhibée par l'augmentation du nombre des carboxyles libres le long des chaines polygalacturoniques progressivement déméthylées. Cette inhibition est due à la répulsion exercée par la charge négative des carboxyles ionisés. La présence de cations (Ca²+, Na+) pourrait contrecarrer cette inhibition. Cette inhibition des PE serait également due aux chaines latérales des sucres neutres dans la molécule de pectine (Sakai et al., 1993).
17Dépolymérases. Les dépolymérases sont des hydrolases (polygalacturonases et lyases) qui possèdent des activités endo- ou exo-galacturonases. Les dépolymérases peuvent être subdivisées, en fonction du substrat et du mécanisme de clivage des liaisons glycosidiques, en quatre catégories différentes : les polygalacturonases (PG), les polyméthylgalacturonases (PMG), les polygalacturonate lyases (PGL) et les polyméthylgalacturonate lyases (PMGL). Les PG et PMG agissent respectivement sur les pectates et les pectines par un mécanisme d'hydrolyse, tandis que les PGL et PMGL agissent respectivement par β-élimination sur les pectates et les pectines (Alkorta et al., 1998). Suivant leur mode d'attaque, la réaction peut se faire soit de manière aléatoire, soit à l'extrémité de la chaine, ce qui permet de distinguer les endo- et les exo-dépolymérases (Jayani et al., 2005).
18Les polygalacturonases (PG). Les PG sont des enzymes pectolytiques qui catalysent l'hydrolyse des liaisons glycosidiques α-(1-4) des pectines acides (acide polygalacturonique). Ces enzymes sont spécifiques des substances pectiques non ou partiellement estérifiées par du méthanol. Elles sont les plus étudiées parmi la famille des enzymes pectolytiques. Les PG impliquées dans l'hydrolyse des substances pectiques sont des endo-PG (EC 3.2.1.15) et des exo-PG (EC 3.2.1.67) (Jayani et al., 2005). Deux méthodes ont été développées pour déterminer l'activité des PG et des PMG. On apprécie cette activité en mesurant la diminution de viscosité ou l'augmentation du pouvoir réducteur du substrat (acide pectique ou pectine). La comparaison des mesures de viscosité et de pouvoir réducteur au cours de la dépolymérisation des pectines et des acides pectiques permet de faire la part des activités « endo » et « exo ». Ainsi, avec une endo-PG, la viscosité diminue de moitié quand seulement 2 à 3% des liaisons glycosidiques sont rompues. Avec une exo-PG, le même abaissement de la viscosité n'est observé qu'après rupture de 20% des liaisons glycosidiques (Sakai et al., 1993 ; Jayani et al., 2005).
19Les endo-PG sont produites par divers micro-organismes tels que des bactéries, des levures et des moisissures. Elles sont aussi présentes chez certains végétaux et surtout dans les fruits. En général, l'action des endo-PG libère des mono-, di- et tri-acides galacturoniques par un mécanisme d'attaque multiple à chaine unique ou par un mécanisme d'attaque « multi-chaine », dans lequel les mono-, di- et trimères s'accumulent seulement après hydrolyse des produits initiaux de dépolymérisation. Pour les pectines HM, l'hydrolyse n'a lieu qu'au niveau des résidus d'acide galacturoniques non méthylés. Toutefois, lorsque le DM augmente, la vitesse d'hydrolyse de l'enzyme diminue (Sakai et al., 1993). Les exo-PG sont moins fréquentes. Elles sont produites par des moisissures et quelques bactéries. On distingue deux types : les exo-PG fongiques avec comme produit final l'acide galacturonique et les exo-PG bactériennes qui produisent principalement l'acide digalacturonique.
20Les PG isolées des différentes sources microbiennes diffèrent nettement entre elles par leurs propriétés physico-chimiques et leur mode d'action (Tableau 2).
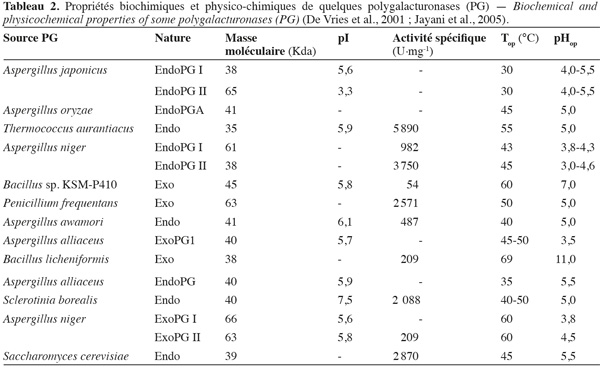
21Les lyases ou transéliminases. Les lyases dégradent la pectine, les oligomères et les polymères d'acide galacturonique. Ce sont des enzymes qui rompent la liaison glycosidique C-O par un mécanisme de β-élimination. Leur action dépolymérisante entraine la libération d'uronides insaturés et d'oligomères de petite taille. La méthode la plus commode pour suivre l'activité des lyases est la mesure de l'augmentation de l'absorbance à 235 nm due à la double liaison produite à l'extrémité non réductrice des composés insaturés. De plus, les méthodes de détermination de l'activité des PG peuvent également être utilisées pour les lyases. Les lyases sont classées en différents types sur base de leur mode d'action et en fonction du substrat sur lequel elles agissent (Tableau 3).
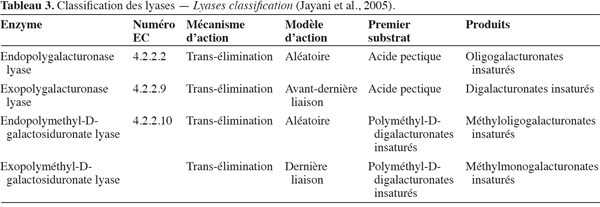
22Comme pour les PG, selon que la réaction enzymatique se fait au hasard ou à l'extrémité de la chaine, on distingue les endo- et les exo-lyases. Les réactions catalysées par les lyases sont illustrées à la figure 4.
23Les PGL sont produites par plusieurs bactéries et quelques moisissures pathogènes, avec les endo-PGL plus abondantes que les exo-PGL. Les PMGL sont produites par Aspergillus japonicus, Penicillium paxilli et Pichia pinus. La plupart des lyases sont d'origine microbienne. Les lyases bactériennes constituent le plus grand groupe d'enzymes pectolytiques. Les PGL sont activées par les ions Ca²+ et, dans certains cas, par d'autres ions divalents tels que Mg²+, Co²+ et Sr²+. Elles sont, par contre, inhibées par l'agent chélateur EDTA. Les PMGL sont par contre actives en l'absence d'ions Ca²+, mais la présence de Ca²+ ou celle d'autres cations les stimule. Les PMGL sont les seules dépolymérases capables de dégrader les pectines HM sans action préalable d'autres enzymes (Jayani et al., 2005).
4.2. Autres enzymes intervenant dans la dégradation des substances pectiques
24L'amélioration des connaissances sur les différences structurales entre la chaine principale des régions « lisses » et « hérissées » de la pectine a permis de découvrir de nouvelles enzymes impliquées dans la dégradation des chaines latérales des substances pectiques (De Vries et al., 2001). Ces enzymes purifiées ont également acquis une importance en tant qu'outils analytiques dans les études structurales en raison de leur grande spécificité. Une série d'enzymes, toutes hautement spécifiques pour la région « hérissée » de la pectine, a été purifiée et caractérisée. Parmi ces enzymes, il y a lieu de citer les rhamnogalacturonases, les arabinanases et les galactanases (Mutter et al., 1998).
25Rhamnogalacturonases. La rhamnogalacturonase isolée à partir d'Aspergillus aculeatus est spécifique du squelette rhamnogalacturonique au niveau de départ des zones « hérissées » où il existe une alternance d'unités rhamnoses et galacturoniques. Deux endo-rhamnogalacturonases (RhgA, RGase A) et deux exo-rhamnogalacturonases (RG-rhamnohydrolase, RG-galacturonohydrolase) ont été isolées chez cette moisissure. Ces enzymes sont freinées dans leur action par la présence de groupements acétyles (De Vries et al., 2001).
26Les produits libérés par cette enzyme sont des oligomères linéaires composés d'une alternance de rhamnose et d'acide galacturonique (4 à 6 résidus) avec des résidus galactoses connectés à certains ou à tous les résidus rhamnose (Schols et al., 1995).
27Arabinanases. Les arabinanases sont des enzymes capables d'hydrolyser les arabinanes, mais aussi les chaines latérales d'arabinose présentes dans les arabinoxylanes et les arabinogalactanes.
28Dans la nature, différents micro-organismes secrètent des endo-arabinanases (EC 3.2.1.99) et des arabinofuranosidases (EC 3.2.1.55) pour la dégradation des polysaccharides contenant l'arabinose. Cependant, la plupart des préparations enzymatiques commerciales contenant des activités arabinanases sont obtenues à partir de moisissures, comme par exemple Aspergillus niger. Cette moisissure secrète deux arabinofuranosidases (AbfA et AbfB) et une endo-arabinanase. L'arabinofuranosidase de type A agit seulement sur les petites chaines de résidus arabinose liés par des liaisons α-(1-5), tandis que le type B hydrolyse les liaisons α-(1-5), α-(1-3) et α-(1-2) des résidus arabinoses. À la différence de certaines arabinofuranosidases, l'arabinofuranohydrolase d'Aspergillus awamori est incapable de libérer l'arabinose de la pectine, mais est fortement spécifique des résidus d'arabinose liés au xylane (Gielkens et al., 1999). L'endo-arabinanase agit au hasard sur les liaisons α-(1-5) des polysaccharides d'arabinane qui sont présents dans les chaines latérales de la pectine. Cette enzyme augmente fortement l'efficacité de la dégradation des arabinanes et influence l'action des arabinofuranosidases. Jusqu'ici, seulement une exoarabinanase a été purifiée d'Aspergillus. Cette enzyme libère principalement de l'arabinobiose et peu d'arabinotriose (De Vries et al., 2001).
29Galactanase. Les galactanases sont impliquées dans la dégradation des polysaccharides des plantes en général et des pectines en particulier. Deux types de chaines arabinogalactanes sont présents dans la pectine. Le type I se compose d'unités galactose liées par des liaisons β-(1-4), alors que le type II contient des résidus galactose liés par des liaisons β-(1-3) qui peuvent être substitués avec des résidus galactose en β-(1-6). De plus, les deux types d'arabinogalactanes peuvent être substitués avec une chaine d'arabinofuranose en α-(1-3). Parallèlement aux deux types d'arabinogalactanes, il existe deux types de galactanases : les endo-β-1,4-galactanases et les exo-β-1,3-galactanases. La différence entre ces enzymes réside dans leur capacité à hydrolyser les liaisons β-(1-3), β-(1-4) ou β-(1-6) entre les résidus de galactose. Les endo-β-1,4-galactanases sont actives sur les galactanes et les arabinogalactanes de type I, libérant ainsi des galacto-oligosaccharides. Les endo-β-1,4-galactanases bactériennes libèrent principalement du galactotriose et du galactotétraose, bien que certaines libèrent aussi du galactobiose (De Vries et al., 2002). Les exo-β-1,3-galactanases sont actives sur les arabinogalactanes de type II où elles hydrolysent spécifiquement les liaisons β-(1-3) (De Vries et al., 2001).
5. Applications potentielles des fragments pectiques
30Différents oligosaccharides non digestibles (NDO) sont produits et utilisés dans le monde aujourd'hui, dont bien sûr les fructooligosaccharides (FOS). Leurs effets prébiotiques sont souvent mis en évidence et de là, certains effets favorables pour la santé. Les POS présentent un potentiel de développement de nouveaux prébiotiques sur le marché européen. Cependant, à côté de leurs effets fonctionnels, ils sont aussi connus pour présenter d'autres propriétés biologiques intéressantes, pour les végétaux notamment. De là, leur ouverture dans la formulation de nouveaux produits phytopharmaceutiques plus respectueux de l'environnement.
5.1. Effet prébiotique des fragments pectiques
31L'une des caractéristiques les plus importantes des POS comme ingrédients alimentaires est leur capacité à stimuler la croissance des bifidobactéries intestinales. Par exemple, l'utilisation des POS comme source de carbone entraine une augmentation du nombre de bifidobactéries, de Lactobacillus et d'Eubacterium rectale (Olano-Martin et al., 2002 ; Manderson et al., 2005). Les oligosaccharides de faible poids moléculaire (2-4 résidus) sont bifidogènes, toutefois ils ne sont pas aussi sélectifs que les FOS (Rastall et al., 2002). De plus, le DM joue un rôle important dans les propriétés de fermentation des fragments pectiques. Il a été montré que les POS faiblement méthylés sont de meilleurs substrats pour la croissance des bactéries que ceux hautement méthylés (Dongowski et al., 2002 ; Olano-Martin et al., 2002). Les perspectives d'utilisation des hydrolysats de pectine dans les préparations pour nourrissons ont montré que ces derniers étaient bien tolérés et présentaient des changements bénéfiques pour la microflore intestinale comme l'abaissement du pH fécal (Fanaro et al., 2005). Ainsi, les oligosaccharides pectiques peuvent être intéressants pour imiter les effets bénéfiques des oligosaccharides du lait humain en combinaison avec d'autres prébiotiques.
5.2. Utilisation des fragments pectiques dans le domaine de la santé
32Un grand nombre d'études in vivo et in vitro a été mené sur l'effet des NDO. Bien que certains des effets ne soient pas clairement démontrés, certaines données indiquent des effets cliniquement significatifs qui justifient l'ensemble des travaux actuels (Swennen et al., 2006). Par exemple, les NDO sont connus pour avoir des effets sur le métabolisme bactérien, la croissance des bactéries dans le colon, la diminution du risque de cancer, la modulation du système immunitaire, la diminution du cholestérol (Mussatto et al., 2007 ; Qiang et al., 2009). Les fragments pectiques font partie des NDO et peuvent présenter des effets santé. Ainsi, il a été rapporté que les fragments pectiques pouvaient inhiber l'adhésion des bactéries aux cellules épithéliales et ainsi être utilisés comme des agents thérapeutiques. Par exemple, l'acide digalacturonique empêche l'adhésion d'Escherichia coli sur les cellules uroépithéliales in vitro (Hotchkiss et al., 2003). Olano-Martin et al. (2003) ont montré que les POS exerçaient un rôle protecteur en inhibant les shiga-toxines sécrétées par Escherichia coli O157:H7. Par ailleurs, certains effets anti-cancérigènes ont été rapportés. Les pectines et les POS sont capables d'induire une mort par apoptose des cellules d'adénocarcinome HT-29 du colon (Olano-Martin et al., 2003). Des essais réalisés sur des lignées de cellules myéloïdes (Chauhan et al., 2005) et sur des cellules cancéreuses de la prostate (Jackson et al., 2007) ont montré les mêmes effets. En outre, certains dérivés de la pectine ont été utilisés pour la préparation de vaccins, mais aussi en tant que vecteurs dans l'administration de produits pharmaceutiques (Souto-Maior et al., 2010).
5.3. Application des fragments pectiques dans le domaine agricole
33Dans le domaine agricole, les POS peuvent induire des réponses biologiques chez certaines plantes (molécules élicitrices). Les oligogalacturonides (OGA) sont impliqués dans les réactions de défense, la croissance et le développement des végétaux (Messiaen et al., 1994 ; Baldan et al., 2003). Ainsi, les essais réalisés sur des pousses de célosie (Celosia argentea L.) par Suzuki et al. (2002) ont montré que leur croissance était améliorée en présence d'acide polygalacturonique de DP 8. Des OGA de DP supérieur à huit stimulent la croissance des cellules de carotte en suspension (Daucus carota), mais aussi la croissance de plants de tomate (Lycopersicum esculentum) (Van Cutsem et al., 2008).
34Il a été également rapporté que les OGA sont capables d'induire la floraison sur des explants de tabac. Ils stimulent aussi la différenciation cellulaire du péricycle et favorisent la maturation des tomates et d'autres fruits. Les OGA inhibent cependant l'élongation de la tige du pois (Marfa et al., 1991 ; Dumville et al., 2000 ; Ridley et al., 2001 ; Baldan et al., 2003). La plupart des réponses biologiques sont obtenues avec des OGA de DP variant de 10 à 16, dont le plus actif est de l'ordre de 12 (Messiaen et al., 1994 ; Ridley et al., 2001 ; Baldan et al., 2003). Plusieurs travaux indiquent cependant que les OGA autres que ceux de DP 10 à 16 peuvent être biologiquement actifs. Par exemple, les OGA de DP 2 provoquent l'inhibition des protéases dans les plants de tomate. De plus, les DP 2 et 3 insaturés à l'extrémité non réductrice sont actifs. Les OGA de DP 2 à 6 induisent la biosynthèse de l'éthylène dans les plants de tomate, le pentasaccharide (DP 5) étant le plus actif. Au cours de la maturation de la tomate, le triacide galacturonique (DP 3) inhibe la production de l'endopolygalacturonase (Ridley et al., 2001).
6. Conclusion
35Utilisées depuis longtemps comme agents de texture, gélifiants, stabilisants et épaississants, les pectines sont une source d'ingrédients pour des aliments santé. Les progrès réalisés dans la connaissance des enzymes de clivage des pectines ont mené au développement d'oligosaccharides non digestibles : les fragments pectiques (oligosaccharides acides dérivés de pectines).
36Ces biopolymères émergents trouvent des applications dans des domaines divers, alimentaires ou non alimentaires. Leurs principales applications comprennent la fonction élicitrice des plantes, la protection contre le cancer du colon, la stimulation de la croissance de bactéries bénéfiques dans le colon (prébiotiques), l'inhibition de l'adhésion des bactéries aux cellules épithéliales, mais aussi l'induction d'une mort par apoptose des cellules d'adénocarcinome du colon. Pour exploiter les fragments pectiques, il est nécessaire d'obtenir des molécules pures en grande quantité. Des stratégies sont continuellement en cours afin de développer des méthodes de production compétitives sur le marché.
Bibliographie
Alkorta I., Garbisu C., Liama M.J. & Serra J.L., 1998. Industrial applications of pectic enzymes: a review. Process. Biochem., 33(1), 21-28.
Baldan B., Bertoldo A., Navazio L. & Mariani P., 2003. Oligogalacturonide-induced changes in the developmental pattern of Daucus carota L. somatic embryos. Plant Sci., 165, 337-348.
Barreteau H., Delattre C. & Michaud P., 2006. Production of oligosaccharides as promising new food additive generation. Food Technol. Biotechnol., 44(3), 323-333.
Blanco P., Sieiro C. & Villa G.T., 1999. Production of pectic enzymes in yeasts. FEMS Microbiol. Lett., 175, 1-9.
Bonnin E., Dolo E., Le Goff A. & Thibault J.F., 2002a. Characterisation of pectin subunits released by an optimised combination of enzymes. Carbohydr. Res., 337, 1687-1696.
Bonnin E. et al., 2002b. Release of ferulic acid from agroindustrial by-products by the cell wall-degrading enzymes produced by Aspergillus niger I-1472. Enzyme Microb. Technol., 31, 1000-1005.
Cameron R.G., Luzio G.A., Goodner K. & Williams M.A.K., 2008. Demethylation of a model homogalacturonan with a salt-independent pectin methylesterase from citrus: I. Effect of pH on demethylated block size, block number and enzyme mode of action. Carbohydr. Polym., 71, 287-299.
Capel F. et al., 2006. Calcium and acid induced gelation of (amidated) low methoxyl pectin. Food Hydrocolloids, 20, 901-907.
Chauhan D. et al., 2005. A novel carbohydrate-based therapeutic GCS-100 overcomes bortezomib resistance and enhances dexamethasone-induced apoptosis in multiple myeloma cells. Cancer Res., 65(18), 8350-8358.
Courtois J., 2009. Oligosaccharides from land plants and algae: production and applications in therapeutics and biotechnology. Curr. Opin. Microbiol., 12, 261-273.
Daas P.J.H. et al., 1999. Investigation of the non-esterified galacturonic acid distribution in pectin with endo-polygalacturonase. Carbohydr. Res., 318, 135-145.
Denès J.M. et al., 2000. Different action patterns for apple pectin methylesterase at pH 7.0 and 4.5. Carbohydr. Res., 327, 385-393.
De Vries R.P. & Visser J., 2001. Aspergillus enzymes involved in degradation of plant cell wall polysaccharides. Microbiol. Mol. Biol. Rev., 65, 497-522.
De Vries R.P. et al., 2002. The β-1,4-endogalactanase A gene from Aspergillus niger is specifically induced on arabinose and galacturonic acid and plays an important role in the degradation of pectic hairy regions. Eur. J. Biochem., 269, 4985-4993.
Dongwski G., Lorenz A. & Proll J., 2002. The degree of methylation influences the degradation of pectin in the intestinal tract of rats and in vitro. J. Nutr., 132, 1935-1944.
Dumville J.C. & Fry S.C., 2000. Uronic acid-containing oligosaccharins: their biosynthesis, degradation and signalling roles in non-diseased plant tissues. Plant Physiol. Biochem., 38(1/2), 125-140.
Fanaro S. et al., 2005. Acidic oligosaccharides from pectin hydrolysate as new component for infant formulae: effect on intestinal flora, stool characteristics, and pH. J. Pediatr. Gastroenterol. Nutr., 41(2), 186-190.
Fang Y. et al., 2008. Binding behavior of calcium to polyuronates: comparison of pectin with alginate. Carbohydr Polym., 72, 334-341.
Favela-Torres E., Volke-Sepùlveda T. & Vniegra-Gonzalez G., 2006. Production of hydrolytic depolymerising pectinases. Food Technol. Biotechnol., 44(2), 221-227.
Gielkens M. et al., 1999. The abfB gene encoding the major α-L-arabinofuranosidase of Aspergillus nidulans: nucleotide sequence, regulation and construction of a disrupted strain. Microbiology, 145, 735-741.
Guillotin S.E. et al., 2007. Rapid HPLC method to screen pectins for heterogeneity in methyl-esterification and amidation. Food Hydrocolloids, 21, 85-91.
Hotchkiss A.T. et al., 2003. Pectic oligosaccharides as prebiotics. ACS Symp. Ser., 849, 54-62.
Ishii T. et al., 1999. The plant cell wall polysaccharide rhamnogalacturonan II self-assembles into a covalently cross-linked dimmer. J. Biol. Chem., 274(19), 13098-13104.
Iwasaki K., Inoue M. & Matsubara Y., 1998. Continuous hydrolysis of pectate by immobilized endo-polygalacturonase in a continuously stirred tank reactor. Biosci. Biotechnol. Biochem., 62, 262-272.
Jackson C.L. et al., 2007. Pectin induces apoptosis in human prostate cancer cells: correlation of apoptotic function with pectin structure. Glycobiology, 17(8), 805-819.
Jayani R.S., Saxena S. & Gupta R., 2005. Microbial pectinolytic enzymes: a review. Process Biochem., 40, 2931-2944.
Kashyap D.R., Vohra P.K., Chopra S. & Tewari R., 2001. Applications of pectinases in the commercial sector: a review. Bioresour. Technol., 77, 215-227.
Levigne S. et al., 2002. Determination of the degrees of methylation and acetylation of pectin using a C18 column and internal standards. Food Hydrocolloids, 16, 547-550.
Manderson K. et al., 2005. In vitro determination of the prebiotic properties of oligosaccharides derived from an orange juice manufacture by-product stream. Appl. Environ. Microbiol., 71(12), 8383-8389.
Marfà V. et al., 1991. Oligogalacturonides are able to induce flowers to form on tabacco explants. Plant J., 1(2), 217-225.
Mesbahi G., Jamalian J. & Farahnaky A., 2005. A comparative study on functional properties of beet and citrus pectins in food systems. Food Hydrocolloids, 19, 731-738.
Messiaen J. & Van Cutsem P., 1994. Pectic signal transduction in carrot cells: membrane, cytosolic nuclear responses induced by oligogalacturonides. Plant Cell Physiol., 35, 677-689.
Mussatto S.I. & Mancilha I.M., 2007. Non-digestible oligosaccharides: a review. Carbohydr. Polym., 68, 587-597.
Mutter M. et al., 1998. Rhamnogalacturonan α-D-galactopyranosyluronohydrolase: an enzyme that specifically removes the terminal non reducing galacturonosyl residue in rhamnogalacturonan regions of pectin. Plant Physiol., 117, 153-163.
Olano-Martin E., Gibson G.R. & Rastall R.A., 2002. Comparison of the in vitro bifidogenic properties of pectins and pectic-oligosaccharides. J. Appl. Microbiol., 93, 505-511.
Olano-Martin E., Williams M.R., Gibson G.R. & Rastall R.A., 2003. Pectins and pectic-oligosaccharides inhibit Escherichia coli O157:H7 shiga toxin as directed towards the human colonic cell line HT29. FEMS Microbiol. Lett., 218, 101-105.
Perrone P. et al., 2002. Patterns of methyl and O-acetyl esterification in spinach pectins: new complexity. Phytochemistry, 60, 67-77.
Qiang X., Yonglie C. & Qianbing W., 2009. Health benefit application of functional oligosaccharides. Carbohydr. Polym., 77, 435-441.
Ralet M.-C. et al., 2005. Mapping sugar beet pectin acetylation pattern. Phytochemistry, 66(15), 1832-1843.
Rastall R.A. & Maitin V., 2002. Prebiotics and synbiotics: towards the next generation. Curr. Opin. Biotechnol., 13, 490-496.
Ridley B.L., O'Neill M.A. & Mohnen D., 2001. Pectins: structure, biosynthesis, and oligogalacturonide-related signaling. Phytochemistry, 57, 929-967.
Sakai T., Sakamoto T., Hallaert J. & Vandamme E.J., 1993. Pectin, pectinase and protopectinase: production, properties and applications. Adv. Appl. Microbiol., 39, 213-279.
Schols H.A., Bakx E.J., Schipper D. & Voragen A.G.J., 1995. A xylogalacturonan subunit present in the modified hairy regions of apple pectin. Carbohydr. Res., 279, 265-279.
Souto-Maior J.F.A., Reis A.V., Pedreiro L.N & Cavalcanti O.A., 2010. Phosphated crosslinked pectin as a potential excipient for specific drug delivery: preparation and physicochemical characterization. Polym. Int., 59, 127-135.
Suzuki T. et al., 2002. Preparation and isolation of oligogalacturonic acids and their effects in cockscomb (Celosia argentea L.) seedlings. J. Plant Growth Regul., 21, 209-215.
Swennen K., Courtin C.M. & Delcour J.A., 2006. Non-digestible oligosaccharides with prebiotic properties. Food Sci. Nutr., 46, 459-471.
Thakur B.R., Singh R.K. & Handa A.K., 1997. Chemistry and uses of pectin: a review. Crit. Rev. Food Sci. Nutr., 37(1), 47-73.
Tho I., Kjonilsen A.-L., Knudsen K.D. & Nyström B., 2006. Effect of solvent composition on the association behaviour of pectin in methanol-water mixtures. Eur. Polym. J., 42, 1164-1172.
Van Cutsem P. & Pino Cabrera J.C., 2008. Composition comprising oligogalacturonans and polycationic saccharides. WO 2008/065151 A1.
Willats W.G.T., Knox J.P. & Mikkelsen J.D., 2006. Pectin: new insights into an old polymer are starting to gel. Trends Food Sci. Technol., 17, 97-104.
