- Startpagina tijdschrift
- Volume 11 (2007)
- numéro 2
- Effet du nitrate d’ammonium sur le développement et l’activité des enzymes anti-oxydantes du fraisier (Fragaria x ananassa L.) micropropagé
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Effet du nitrate d’ammonium sur le développement et l’activité des enzymes anti-oxydantes du fraisier (Fragaria x ananassa L.) micropropagé

Nota's van de redactie
Reçu le 7 février 2005, accepté le 12 octobre 2006.
Résumé
L’ajout de nitrate d’ammonium (NH4NO3) aux doses de 500, 1000 et 1500 mg.l-1 au milieu de prolifération améliore la vigueur et diminue la chlorose des microboutures de fraisier observée sur le milieu témoin préconisé par Boxus ne contenant que de l’azote nitrique à la dose de 1250 mg.l-1. Les analyses réalisées sur deux variétés « Chandler » et « Sweet Charlee » respectivement sensible et tolérante à la chlorose d’origine nutritionnelle, ont montré que NH4NO3 confère aux microboutures une situation nutritionnelle générant moins de stress. Une plus grande teneur en protéines solubles et l’amélioration de l’activité enzymatique des CAT (Catalase) et POD (Peroxydase) constituent les changements métaboliques particuliers qui ont été observés chez les deux variétés cultivées en présence d’ammonium. Une telle situation leur était plus favorable puisqu’elles ont montré une moindre peroxydation de leurs lipides membranaires suite à une meilleure activité des enzymes anti-oxydantes.
Abstract
Effect of ammonium nitrate on the development and anti-oxydant enzymes activity of strawberry (Fragaria x ananassa L.) propagated in vitro. The addition of ammonium nitrate (NH4NO3) at different concentrations (500, 1000 and 1500 mg.l-1) to the in vitro multiplication medium improved significantly the vigor and reversed the leaf chlorosis affecting the strawberry shoots when cultivated on Boxus standard medium, which only contains nitrate as source of nitrogen. The analysis performed with both susceptible « Chandler » and more tolerant « Sweet Charlee » varieties showed that NH4NO3 would confer a more favorable and less stressful nutritional situation to the vitroshoots. Higher quantity of total soluble proteins and improvement of CAT and POD enzymatic activities in both varieties are the single changes observed in the metabolism of the shoots cultivated in presence of ammonium nitrate. This situation allowed those shoots to protect their membrane lipids against peroxydation due to a better activity of their anti-oxidant enzymes.
Inhoudstafel
1. Introduction
1En culture in vitro, les microboutures se développent sur des milieux nutritifs artificiels. Les corrélations physiologiques y sont réduites et les tissus sont privés de certains mécanismes régulateurs de la plante entière, ce qui les rend sensibles à la variation de la composition chimique du milieu y compris à celle des ions minéraux. Cette sensibilité se traduit, entre autres, par l’expression de symptômes de carence ou de toxicité (Margara, 1982).
2Parmi les éléments minéraux, l’azote joue un rôle très important par sa disponibilité et sa formulation chimique. En effet, la présence de l’une des deux formes oxydée (ion nitrate NO3-) ou réduite (ion ammonium NH4+) ou des deux formes simultanément, affecte le développement, la morphogenèse, la structure anatomique, la composition chimique des tissus, la machinerie cellulaire et moléculaire des microplantules (Lewis, Chadwick, 1983 ; Vieitez et al., 1985 ; Cramer, Lewis, 1993 ; George, 1993).
3Tout déséquilibre entre les deux formes d’azote peut soumettre la plante à une situation de stress nutritionnel responsable de changements de la balance hormonale interne. Le métabolisme de la microbouture, sa croissance et son développement peuvent être affectés par la genèse de formes actives de l’oxygène (FAOx) (Scandalios, 1993 ; Gossett et al., 1994 ; Taylor et al., 2004) telles que l’ion superoxide O2-, la forme singulière de l’oxygène O2-, le peroxyde d’hydrogène (H2O2) ou les radicaux hydroxydes OH- (Zarrouk, 1999). L’accumulation des FAOx altère les composants cellulaires, provoquant ainsi soit une inhibition directe des enzymes, soit des réactions d’oxydation des protéines ou de peroxydation des lipides membranaires (Mittler, 2002 ; Taylor et al., 2004). Des dommages oxydatifs de l’ADN et de l’ARN ont également été signalés (Becana et al., 1998 ; Taylor et al., 2004). Pour faire face à ces dommages, la plante peut utiliser ses systèmes de défense anti-oxydante de type enzymatique (SOD, CAT, POD, APX, etc.) et non enzymatique (ASC, GSH, vitamine E, caroténoïdes, flavonoïdes, etc.) (Foyer et al., 1994a, 1994b).
4En micropropagation du fraiser, on recourt souvent au milieu breveté par Boxus (1974) ne contenant que de l’azote nitrique. Dans ce milieu, certaines variétés telles que « Chandler » expriment des symptômes de chlorose qui affectent le comportement des microboutures (Chakroun, 2004). L’addition de nitrate d’ammonium au milieu de culture améliore l’aspect, la vigueur et la multiplication des microboutures, ce qui témoigne d’une meilleure situation nutritionnelle où l’ion ammonium paraît jouer un rôle essentiel (Chakroun, 2004).
5Afin d’expliquer ces différences morphologiques favorables au développement des microboutures, nous avons émis l’hypothèse qu’elles étaient liées au stress oxydatif et avons procédé à l’analyse de l’activité de certaines enzymes anti-oxydantes en rapport avec la quantité de nitrate d’ammonium ajoutée au milieu de culture préconisé par Boxus (1974).
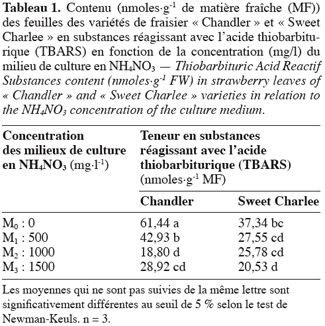
2. Matériel et méthodes
2.1. Matériel végétal, conditions de culture et prélèvement des échantillons
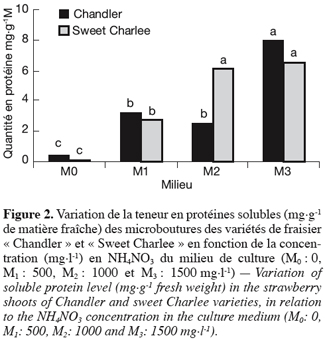
6Deux variétés de fraisier « Chandler » et « Sweet Charlee » sont préalablement établies in vitro à partir d’apex méristématiques et multipliées pendant quatre cycles selon le procédé décrit par Boxus (1974). Sur base de résultats préliminaires obtenus antérieurement concernant l’ajout de nitrate d’ammonium (NH4NO3) à ce milieu qui ne contient que la forme nitrique NO3- [KNO3 et Ca(NO3)2] à la concentration totale de 1250 mg.l-1, ce sel est testé aux concentrations de 500, 1000 et 1500 mg.l-1.
7Après quatre subcultures supplémentaires de trois semaines chacune sur les nouveaux milieux de prolifération enrichis en NH4NO3, un minimum de 700 mg de feuilles fraîches est prélevé de chaque bocal à raison de 3 répétitions (1 bocal = 1 répétition) par traitement, puis fixé dans l’azote liquide pour servir aux analyses biochimiques envisagées.
8Les microboutures sont élevées dans une chambre de culture programmée pour une photopériode de 16 h, à une intensité lumineuse de l’ordre de 3–4 klx assurée par des tubes fluorescents (Sylvania Gros Lux) et à une température de 25 ± 2 °C.
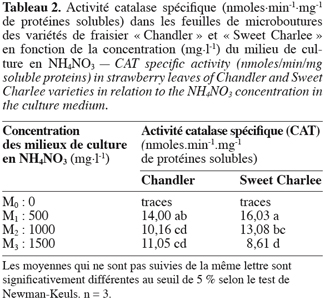
2.2. Dosage des substances réagissant avec l’acide thiobarbiturique (TBARS)
9Le dosage des substances de type aldéhyde réagissant avec l’acide thiobarbiturique (TBA) et notamment le dialdéhyde malonique (MDA) est effectué selon la méthode de Draper et Hadley (1990).
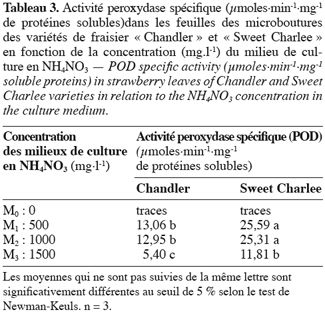
10Pour cela, 500 mg de feuilles sont homogénéisées dans l’acide trichloroacétique (TCA) 0,1 % puis incubées pendant 30 min dans un mélange TBA (0,5 %)/TCA (20 %) à 95 °C. L’absorbance est mesurée à 532 nm. La quantité de TBARS est calculée sur la base du coefficient d’extinction molaire = 155 mM-1.cm-1.
2.3. Analyse de l’activité des enzymes anti-oxydantes : catalase et peroxydase
11Extraction des enzymes. Deux cents milligrammes de feuilles sont broyées dans l’azote liquide et homogénéisées dans un tampon Tris-HCl (pH 8,0), en présence de polyvinylpyrrolidone (PVP) 10 % (p/p). Après centrifugation, le surnageant est utilisé pour la détermination de la teneur en protéines solubles totales ainsi que l’activité de la catalase (CAT, EC 1.11.1.6) et de la peroxydase (POD, EC 1.11.1.7).
12Dosage des protéines solubles totales. Les protéines solubles sont dosées selon la méthode de Bradford (1976) en utilisant le réactif préparé par Biorad (bleu de Coomassie + éthanol + acide phosphorique). La teneur en protéines (mg.g-1 poids frais) est déterminée par référence à une gamme étalon préparée à partir d’une solution de BSA (Bovin Serum Albumin) à 0,4 mg.ml-1.
13Mesure de l’activité enzymatique. L’activité CAT est mesurée selon la méthode d’Aebi (1984) en suivant la diminution de l’absorbance du milieu réactionnel (tampon phosphate + extrait enzymatique) à 240 nm pendant 2 min, après addition de H2O2. La quantité de CAT est calculée sur la base du coefficient d’extinction molaire = 40 mM-1.cm-1.
14L’activité POD est mesurée selon la méthode Ranieri et al. (2000) en suivant l’augmentation de l’absorbance du milieu réactionnel (acétate de sodium + dianisidine + extrait enzymatique) à 460 nm pendant 2 min, après addition du peroxyde d’hydrogène. La quantité de POD est calculée sur la base du coefficient d’extinction molaire = 11,3 mM-1.cm-1. Les analyses sont faites à l’aide d’un spectrophotomètre SECOMAM ADVANCED 2.
15Electrophorèse en gel de polyacrylamide et révélation des enzymes antioxydantes. Des gels de polyacrylamide de 1 mm d’épaisseur sont utilisés pour les systèmes enzymatiques étudiés (CAT et POD). La migration est faite à 4 °C sous ampérage constant de 20 mA à l’aide d’un générateur Consort-E532.
16Pour les isoformes CAT (achromatiques), le gel est incubé dans une solution de H2O2 30 %. La révélation est faite à l’air libre dans une solution de ferricyanate de potassium 0,5 % et de chlorure ferreux 0,5 %.
17Pour la POD, le gel est incubé dans un tampon Na-acétate 0,1M additionné de gaïacol 1 %. La révélation est faite à l’air libre dans une solution contenant du 3-amino 9-éthyl carbazole, du N.N-diméthylformamide, du tampon Na-acétate 0,01M, du H2O2 et du CaCl2 0,1M.
2.4. Analyse statistique
18L’analyse des données est faite par la méthode ANOVA utilisant le logiciel STATISTICA (version 5). L’ensemble des mesures a fait l’objet d’une analyse de la variance à deux facteurs par le test de Fisher-Snedecor au seuil de risque de 5 %. Elle est complétée par des comparaisons multiples des moyennes par le test de Newman–Keuls au seuil de 5 % (Dagnelie, 1986).
3. Résultats
3.1. Aspects des microboutures
19Pour les deux variétés testées, la présence du nitrate d’ammonium dans le milieu de culture améliore l’aspect des microboutures en réduisant la chlorose observée avec le milieu témoin (0 mg.l-1 NH4NO3) et permet ainsi l’obtention de pousses dont la vigueur apparente s’accroît avec l’augmentation de la concentration en ce sel, tel qu’illustré par des microboutures de la variété sensible « Chandler » (Figure 1). Il faut cependant noter que l’excès de vigueur conféré par la concentration de 1500 mg.l-1 s’accompagne d’une réduction du taux de prolifération par rapport aux concentrations de 500 et 1000 mg.l-1 (Chakroun, 2004).

3.2. Peroxydation des lipides membranaires
20Les valeurs enregistrées (Tableau 1) pour les teneurs en substances (dont le MDA) réagissant avec l’acide thiobarbiturique (TBARS), indiquent que celles-ci diminuent avec l’addition de NH4NO3 dans le milieu témoin. En effet, le contenu des feuilles en ces substances est le plus élevé chez les deux variétés en l’absence de ce sel. Ce contenu diminue avec l’augmentation de la concentration en nitrate d’ammonium.
21En comparant les deux variétés, nous remarquons que « Sweet Charlee » accumule moins de ces substances dans ses feuilles que « Chandler ». La faible valeur observée pour « Chandler » reste pour le moment inexplicable.
3.3. Teneur en protéines solubles
22Les dosages protéiniques (Figure 2) montrent qu’indépendamment de la variété utilisée, l’ajout de NH4NO3 au milieu témoin entraîne une amélioration conséquente du contenu en protéines solubles totales des microboutures.
23Pour la variété « Sweet Charlee », ce contenu est élevé de 19 fois à la dose de 500 mg.l-1 et à 38 fois et plus respectivement aux doses de 1000 et 1500 mg.l-1.
24Concernant la variété « Chandler », cette amélioration atteint 7 fois à 500 mg.l-1 et 17 fois à 1500 mg.l-1 alors que le résultat est moins certain pour 1000 mg.l-1.
3.4. Activité des enzymes antioxydantes
25Le tableau 2 montre que l’ajout de NH4NO3 au milieu témoin se traduit par l’apparition d’une activité CAT mesurable chez les deux variétés de fraisier. L’activité maximale est observée en présence de 500 mg.l-1 de NH4NO3.
26La mise en évidence qualitative effectuée sur gel de polyacrylamide (Figure 3) illustre l’apparition des bandes achromatiques caractéristiques de l’activité CAT dans les extraits de microboutures cultivées sur milieu enrichi en NH4NO3. Cette activité n’est pas détectable en l’absence de nitrate d’ammonium.
27Le tableau 3 montre que l’activité POD n’est également détectable qu’en présence de NH4NO3. L’activité chute toutefois de plus de la moitié de sa valeur lorsque la quantité de ce sel passe de 500 mg.l-1 à 1500 mg.l-1 dans le milieu de culture. Par rapport à la CAT, la supériorité de l’activité POD chez la variété « Sweet Charlee » est plus évidente.
28L’analyse du profil électrophorétique de cette activité peroxydasique (Figure 4) montre que l’addition de nitrate d’ammonium dans le milieu de culture induit l’apparition d’isoformes anodiques (indiquées par une flèche) non détectables en l’absence de nitrate d’ammonium.
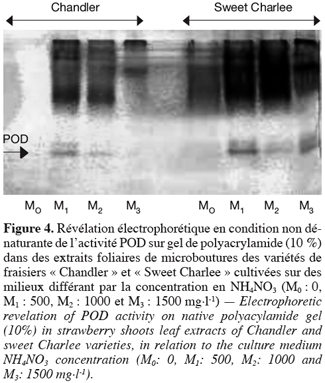
4. Discussion
29La présente étude montre que l’apport de nitrate d’ammonium au milieu de culture conçu par Boxus (1974) aux doses testées de 500, 1000 et 1500 mg.l-1, améliore la vigueur et réduit la chlorose foliaire des microboutures de fraisier de façon remarquable par rapport au témoin. Ceci est dû, selon Zimmerman (1981) et Hunter et al. (1984) à la présence de l’ion ammonium avec l’ion nitrate dans le milieu de culture.
30Le dosage des substances (dont le MDA) réagissant avec l’acide thiobarbiturique, au niveau des feuilles des microboutures cultivées en présence de ces concentrations en NH4NO3 et du témoin (sans nitrate d’ammonium) montre que, sur ce dernier, le fraisier accumule beaucoup plus de ces substances, dénotant une forte peroxydation des lipides membranaires. Cette forte peroxydation est due à une grande dismutation des O2-, une des formes actives de l’oxygène (Baisak et al., 1994 ; Sairam, Srivastava, 2002). La diminution de la peroxydation des lipides suite à l’addition de nitrate d’ammonium traduit, selon Xue et al. (2001), une diminution des effets oxydatifs des FAOx. Ceci constitue une preuve que la plante a bien profité du nitrate d’ammonium pour éviter ou réduire les dégâts occasionnés par l’accumulation des FAOx.
31Le dosage des protéines solubles montre que l’addition du nitrate d’ammonium dans le milieu de culture induit une élévation très importante des quantités de celles-ci dans les microboutures de fraisier. Ceci est dû à la présence de l’ion NH4+ qui, associé à l’ion NO3, (Mohantly, Fletcher, 1980 ; Volk et al. 1992) améliore l’absorption de l’azote et augmente consécutivement le contenu en protéines des plantules (Chaillou et al., 1986, 1991 ; Chaillou, Lamaze, 1997). Cette augmentation est accompagnée par une meilleure expression des enzymes antioxydantes (CAT et POD), qui ne sont pas détectables en l’absence de NH4NO3. En présence de ce dernier, le passage de 500 à 1500 mg.l-1 se traduit par une diminution simultanée de l’activité de ces enzymes et de la peroxydation des lipides membranaires. La plante se trouve ainsi dans des conditions nutritionnelles moins stressantes par rapport au témoin et donc moins favorables à la genèse des FAOx (Xue et al., 2001 ; Shalata et al., 2002).
5. Conclusion
32En l’absence de nitrate d’ammonium dans le milieu de Boxus (1974), les microboutures de fraisier expriment des symptômes de chlorose et de faible vigueur plus ou moins marqués selon la variété. Ces symptômes se traduisent par une importante peroxydation des lipides membranaires associée à une activité non détectable des enzymes antioxydantes (CAT et POD) chez les deux variétés étudiées.
33L’apport de nitrate d’ammonium aux doses de 500 à 1500 mg.l-1 met la plante dans des conditions de culture moins stressantes qui se traduisent par une moindre chlorose et une meilleure vigueur résultant d’une diminution de la peroxydation lipidique avec une meilleure expression de l’activité des enzymes antioxydantes. Sur base de ces résultats, il conviendrait maintenant de déterminer la corrélation précise entre la dose de NH4NO3, les FAOx et l’activité enzymatique et d’analyser l’interaction du rapport NH4+/ NO3- avec les cytokinines qui influencent le taux de multiplication in vitro.
34Abréviations
35CAT : catalase
36POD : peroxydase
37FAOx : formes actives de l’oxygène
38TBARS : substances réactives à l’acide thio-barbiturique
39MDA : radical libre de mono-déshydroascorbate
40SOD : superoxide dismutase
41APX : ascorbate réductase
42ASC : acide ascorbique
43GSH : glutathion réduit
Bibliographie
Aebi H. (1984). Catalase in vitro. Methods Enzymol. 105, p. 121–126.
Baisak R., Rana D., Acharya PBB., Kar M. (1994). Alteration in activities of active oxygen scarvenging enzymes of wheat leaves subjected to water stress. Cell Physiol. 35, p. 489–459.
Becana M., Moran JF., Iturbe-Ormaetxe I. (1998). Iron-dependent oxygen free radical generation in plants subjected to environmental stress: toxicity and antioxidant protection. Plant Soil 201, p. 137–147.
Boxus P. (1974). The production of strawberry plants by in vitro micropropagation. J. Hort. Sci. 49, p. 209–210.
Bradford M. (1976). A rapid and sensitive method for the quantification of microgram quantities of protein utilising the principal of protein-dye binding. Anal. Biochem. 72, p. 248–254.
Chaillou S., Morot-Gaudry JF., Salsac L., Lesaint C., Jolivet E. (1986). Compared effects of NO3- and NH4+ on growth and metabolism of French bean. Physiol. Vég. 24, p. 679–687.
Chaillou S., Vessey JK., Morot-Gaudry JF., Raper CD., Henry LT., Boutin JP. (1991). Expression of characteristics of ammonium nutrition as affected by pH of the root medium. J. Exp. Bot. 42, p. 189–196.
Chaillou S., Lamaze T. (1997). Assimilation de l’azote chez les plantes. Jean-Francois Morot-Gaudry (ed). p. 67–83.
Chakroun A. (2004). Incidences de la concentration en nitrate d’ammonium (NH4NO3) du milieu de culture sur le comportement morphologique et métabolique du fraisier (Fragaria x ananassa. Duch) micropropagé. Mastère en Sci. Agron. Institut national agronomique de Tunis, Tunisie, 96 p.
Cramer MD., Lewis OAM. (1993). The influence of NO3- and NH4+ nutrition on the carbon and nitrogen partitioning characteristics of wheat (Triticum aestivum L.) and maize (Zea mays L.) plants. Plant Soil 154, p. 289–300.
Dagnelie P. (1986). Théorie et méthodes statistiques. Applications agronomiques. Vol. 2. Gembloux, Belgique : Presses agronomiques de Gembloux, p. 463.
Draper HH., Hadley M. (1990). Malondialdehyde determination as index of lipid peroxidation. Methods Enzymol. 186, p. 421–431.
Foyer CH., Descourvières P., Kunert KJ. (1994a). Protection against oxygen radicals: an important defence mechanism studied in transgenic plants. Plant Cell. Env. 17, p. 507–523.
Foyer CH., Lelandais M., Kunert KJ. (1994b). Photooxidant stress in plants. Physiol. Plant. 92, p. 696–717.
George EF. (1993). Plant Propagation by tissue culture: Part I: the technology. Edington, UK.: Exegetics Ltd, p. 273–291.
Gossett DR., Millhollon EP., Lucas MC. (1994). Antioxydant response to NaCl stress in salt-tolerant and salt-sensitive cultivars of cotton. Crop Sci. 34, p. 706–714.
Hunter SA., Hannon M., Foxe MJ., Hennerty MJ. (1984). Factors affecting the in vitro production of strawberry (Fragaria x ananassa Duch) Meristems (cv. Cambridge Favourite). J. Life Sci. R. Dubl. Soc. 5, p. 13–19.
Lewis OAM., Chadwick S. (1983). An 15N investigation into nitrogen assimilation in hydroponically-grown barley (Hordeum vulgare L. cv. Clipper) in response to nitrate, ammonium and mixed nitrate and ammonium nutrition. New Phytol. 95, p. 635–646.
Margara J. (1982). Bases de la multiplication végétative. Les méristèmes et l’organogenèse. Paris, France : INRA, 262 p.
Mittler R. (2002). Oxidative stress, antioxidants and stress tolerance. Plant Sci. 7, p. 405–410.
Mohantly B., Fletcher JS. (1980). Ammonium influence on nitrogen assimilating enzymes and protein accumulation in suspension cultures of Paul’s Scarlet rose. Physiol. Plant. 48, p. 453–459.
Ranieri A., Castagna A., Soldatini GF. (2000). Differential stimulation of ascorbate peroxidase isoforms by ozone exposure in sunflower plants. J. Plant Physiol. 56, p. 266–271.
Sairam RK., Srivastava GC. (2002). Changes in antioxidant activity in sub-cellular fraction of tolerant and susceptible wheat genotypes in response to long term salt stress. Plant Sci. 162, p. 897–904.
Scandalios JG. (1993). Oxygen stress and superoxyde dimutase. Plant Physiol. 101, p. 7–12.
Shalata A., Mittova V., Volokita M., Guy M., Tal M. (2002). Response of the cultivated tomato and its wild salt-tolerant relative Lycopersicon pennellii to salt-dependent oxidative stress: the root antioxidative system. Physiol. Plant. 112, p. 487–494.
Taylor NL., Day DA., Millar H. (2004). Targets of stress-induced oxidative damage in plant mitochondria and their impact on cell carbon/nitrogen metabolism. J. Exp. Bot. 394, p. 1–10.
Vieitez AM., Ballester A., San-José MC., Vieitez E. (1985). Anatomical and chemical studies of vitrified shoots of chestnut regenerated in vitro. Physiol. Plant. 65, p. 77–184.
Volk RJ., Chaillou S., Mariotti A., Morot-Gaudy JF. (1992). Benefical effects of concurrent ammonium and nitrate nutrition on growth of Phaseolus vulgaris: a 15N study. Plant Physiol. Biochem. 30, p. 487–493.
Xue T., Hartikaienen H., Piironen V. (2001). Antioxidative and growth-promoting effect of selenium on senescing lettuce. Plant Oil 237, p. 55–61.
Zarrouk M. (1999). Stress oxydatif chez les végétaux. Thèse, Fac. univ. Sci. Tunis II. Tunisie, 45 p.
Zimmerman RH. (1981). Micropropagation of fruit plants. Acta Hort. 120, p. 217–222.
Om dit artikel te citeren:
Over : Ahlem Chakroun
Institut national agronomique de Tunisie. Avenue Charles Nicole, 43. 1082 Tunis (Tunisie).
Over : Ahmed Jemmali
Institut national agronomique de Tunisie. Avenue Charles Nicole, 43. 1082 Tunis (Tunisie). E-mail : jemmali_a@yahoo.com
Over : Karim Ben Hamed
Institut national de la Recherche scientifique et de la Technologie. Laboratoire d’Adaptation des Plantes aux Stress abiotiques. BP95, Hammam-Lif 2050 (Tunisie).
Over : Chadly Abdelli
Institut national de la Recherche scientifique et de la Technologie. Laboratoire d’Adaptation des Plantes aux Stress abiotiques. BP95, Hammam-Lif 2050 (Tunisie).
Over : Philippe Druart
Centre wallon de Recherches agronomiques. Département Biotechnologie. Chaussée de Charleroi, 234. B-5030 Gembloux (Belgique).






