- Home
- Volume 14 (2010)
- numéro 4
- Production d'arômes de type lactone par des levures
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Production d'arômes de type lactone par des levures

Editor's Notes
Reçu le 7 septembre 2009, accepté le 2 mars 2010
Résumé
Les lactones sont des composés aromatiques présents dans une grande variété d'aliments et de boissons. Leur extraction à partir de produits naturels est très couteuse et leur obtention par synthèse chimique répond de moins en moins aux demandes des consommateurs. Une solution alternative s'est imposée : la production de lactones par voie biotechnologique. Il est possible d'utiliser des cellules microbiennes et des enzymes pour biotransformer ou bioconvertir des acides gras en lactones. Différentes études et des brevets ont été réalisés sur ce sujet. Dans la majorité des cas, ce sont des levures qui constituent l'agent biologique utilisé. Les principales lactones concernées sont les γ- et δ-décalactones, γ-octalactone et γ-dodécalactone. Cet article décrit les lactones et leur production par des levures, une attention particulière sera consacrée à la γ-décalactone.
Abstract
Production of aroma lactones by yeasts. Lactones are widely distributed in foods and beverages as aroma compounds. Their extraction from natural products is very expensive. Most of them can also be obtained in a chemical way, which is not well perceived by consumers. As an alternative, biotechnology proposes to use whole cells or enzymes to produce lactones by biotransformation or bioconversion of fatty acids. Different studies and patents have been conducted on that matter. In most cases, yeasts are the biological agent used. The main concerned lactones are γ- and δ-decalactones, γ-octalactone and γ-dodecalactone. This article describes lactones and their production by yeasts; particular attention will be devoted to the γ-decalactone.
Table of content
1. Introduction
1Les arômes de type lactone sont des molécules très intéressantes pour l'industrie alimentaire grâce à leur caractère généralement fruité très prononcé. Ils sont largement présents dans une grande variété d'aliments et de boissons. Le beurre, par exemple, renferme 26 lactones différentes. Certains fruits comme la pêche, l'abricot, la papaye, la fraise renferment une dizaine de lactones (Dufossé et al., 1994). Elles sont également présentes dans différentes boissons comme le thé, le café et le vin (Maga, 1976).
2Les lactones sont des esters particuliers comportant un cycle bi-oxygéné, résultant de la cyclisation ou lactonisation d'acides hydroxylés. Les γ- ou δ-lactones représentent les deux structures les plus fréquemment identifiées. Elles sont respectivement aussi appelées 4-olides et 5-olides et résultent de la cyclisation des acides hydroxylés en position 4 ou 5. Les lactones dont le nombre d'atomes de carbone est compris entre 4 (butyrolactone) et 12 (dodécalactone) (Tableau 1) sont des composés volatiles. La diversité des lactones est liée aux substituants présents sur les cycles et sur la chaine latérale, au nombre de doubles liaisons et à la configuration spatiale des molécules (formes énantiomériques R et S).

3La production microbienne de lactones implique la biotransformation d'acides gras. Parmi ceux-ci, l'acide ricinoléique est le plus abondant et le plus facilement disponible, car il représente autour de 90 % de l'huile de ricin. La biotransformation d'acide ricinoléique, d'huile de ricin ou de ricinoléate de méthyle mènent à la formation de γ-décalactone.
4Cet article traite de la production de lactones par des levures, particulièrement la γ-décalactone.
2. Propriétés sensorielles des lactones
5D'un point de vue organoleptique, les lactones se caractérisent par une odeur généralement plaisante, fruitée. Les caractéristiques aromatiques des lactones sont influencées par la forme du cycle, la longueur de la chaine latérale, la présence de doubles liaisons, la présence de substituants sur le cycle ou sur la chaine (Dufossé et al., 1994). Les γ-lactones ont un pouvoir aromatisant plus élevé que les δ-lactones, par exemple : dans l'eau, les seuils de perception de la γ-octalactone et de la γ-décalactone sont respectivement 50 et 9 fois plus faibles que ceux de la δ-octalactone et de la δ-décalactone (Engel et al., 1988). Le tableau 1 présente les γ- et δ-lactones et leurs flaveurs.
6Les concentrations en lactones dans les aliments sont faibles, mais leur potentiel aromatique est élevé. À titre d'exemple, la concentration de la γ-décalactone dans la pêche à maturité peut atteindre 650 ppb, tandis que son seuil de perception gustatif est de 88 ppb dans ce fruit (Maga, 1976).
3. Production de lactones par des levures
3.1. Production de lactones à partir d'acides hydroxylés
7La possibilité de produire des lactones par biotransformation d'acides gras a été découverte par Okui et al. (1963a ; 1963b). Ils ont montré que la levure Candida tropicalis dégrade l'acide ricinoléique en acides en C16, C14, C12, γ-décalactone et acide 2-hydroxy-octanoïque.
8Depuis cette observation, les biotechnologues ont consacré leurs efforts à l'utilisation des souches de levures capables de produire des quantités élevées de lactones (Page et al., 1989 ; Cabella et al., 1991 ; Cheetham et al., 1993 ; Spinnler et al., 1994 ; Gatfield et al., 1995 ; Ambid et al., 1999 ; Farbood et al., 1999 ; Rabenhorst et al., 2000).
3.2. Production de γ-décalactone
9Le cas le plus exploité à l'échelle industrielle est la biotransformation de l'acide ricinoléique en γ-décalactone. L'utilisation du génie microbiologique pour produire la γ-décalactone présente deux avantages : diminuer le prix à environ 100 € par kg (12 000 $ par kg en 1986) et permettre une production annuelle de plusieurs tonnes (Gatfield, 1999).
10La levure Sporidiobolus salmonicolor est connue depuis 1972 pour sa capacité à produire la γ-décalactone (Tahara et al., 1972 ; 1973). La production a été optimisée en utilisant de l'huile de ricin comme substrat (Lee et al., 1994) et en travaillant en fermentation fed-batch (Lee et al., 1995). Plus récemment, l'ajout de l'agent réducteur (dithiothréitol) a encore amélioré la production de γ-décalactone par Spridiobolus ruinenii en utilisant l'acide ricinoléique comme substrat. La production de γ-décalactone en présence de 1 g.l-1 de dithiothréitol (220 mg.l-1) est quatre fois plus importante que pour le témoin (Wang et al., 2000).
11Différentes souches de Yarrowia lipolytica sont aussi très efficaces pour la production de γ-décalactone, la concentration en lactone pouvant atteindre 12,3 g.l-1 (Rabenhorst et al., 2002). D'autres micro-organismes réalisent la même réaction mais avec des rendements beaucoup plus faibles comme Monilia fructicola (Wink et al., 1988), Sporobolomyces odorus et Rhodotorula glutinis (Cheetam et al., 1988), Aspergillus niger, Pichia etchellsii ou Cladosporium sauveolens (Cardillo et al., 1989). Les quantités obtenues par ces micro-organismes sont inférieures au g.l-1.
12L'acidification à un pH bas et le chauffage sont des étapes nécessaires pour déplacer l'équilibre qui existe entre la forme ouverte (l'acide 4-hydroxydécanoïque) et la forme cyclisée et pour avoir une lactonisation complète (Spinnler et al., 1994 ; Dufossé et al., 1998).
3.3. Production de γ-décalactone par immobilisation de cellules
13L'optimisation de la production de γ-décalactone par S. salmonicolor a donné lieu à plusieurs études et a conduit à la mise au point d'un procédé utilisant des cellules immobilisées (Lee et al., 1998). L'utilisation de cellules immobilisées au sein d'une matrice dans un tel procédé pose théoriquement des problèmes de transfert de matière (substrat, oxygène, métabolites), toutefois cette stratégie permet de protéger les cellules et dans certains cas d'augmenter la production de γ-décalactone. L'immobilisation des cellules par inclusion est la méthode la plus répandue. Le principe de l'inclusion est de retenir les cellules dans la matrice d'un polymère ou dans des microcapsules. L'alginate de calcium est le polymère le plus fréquemment utilisé pour l'immobilisation par inclusion non seulement grâce à ses propriétés de gélification, mais aussi pour sa non-toxicité. Dans cette étude, l'utilisation des cellules immobilisées dans l'alginate de sodium a permis d'améliorer la production de γ-décalactone (131,8 mg.l-1) par rapport à la production par des cellules libres (107,5 mg.l-1).
14D'autres polymères ont été testés pour immobiliser les levures comme le kapa-carrageenan, le chitosan, l'agarose, mais avec moins de succès (Lee et al., 1998). Les hautes températures pendant la gélification du kapa-carrageenan, de l'agarose et la toxicité du chitosan ont un effet négatif vis-à-vis de la levure testée, l'immobilisation de S. salmonicolor dans ces trois matrices s'avère inadéquate. L'immobilisation des cellules par l'alginate de calcium a amélioré la production de γ-décalactone par comparaison avec les cellules libres (Lee et al., 1998). Lee et al. (1999) ont montré l'incidence de différents paramètres comme le temps de préculture, le pH du milieu et la concentration en alginate sur le niveau de production de γ-décalactone par des cellules de S. salmonicolor immobilisées. Ils ont observé que le temps de préculture et la concentration en alginate n'affectent pas la production de γ-décalactone. Cependant, l'utilisation des cellules immobilisées a montré une meilleure tolérance aux perturbations du pH. Les résultats obtenus montrent que la production de γ-décalactone, en utilisant des cellules immobilisées dans un milieu ajusté à différents pH, se situe entre 75 et 114,7 mg.l-1 après quatre jours de culture.
4. Les facteurs influençant la production de lactones
15Les facteurs influençant la production de lactones sont principalement la souche microbienne utilisée, la température, le pH, la composition du milieu et la technologie de fermentation employée. Dufossé et al. (1998) ont étudié différentes souches de Sporidiobolus et ont montré que :
16– S. salmonicolor consomme peu de substrat précurseur et semble orienter son métabolisme vers la production de γ-décalactone,
17– S. ruinenii consomme l'acide gras précurseur, produit la γ-décalactone et l'acide 4-hydroxydécanoïque,
18– S. johnsonii consomme l'acide gras précurseur, mais avec une production de γ-décalactone très faible,
19– S. pararoseus consomme l'acide gras précurseur, mais ne produit pas de γ-décalactone.
20Les conditions de culture influencent fortement la production de lactones et plus particulièrement, le pH et la température (Lee et al., 1992 ; Alchihab et al., 2009). Ces auteurs ont montré pour plusieurs levures que la culture à un pH ou à une température défavorables limite l'accessibilité au substrat carboné, diminue la croissance cellulaire et la production de la lactone. Ainsi, la production de γ-décalactone par la levure psychrophile Rhodotorula aurantiaca se caractérise par une production optimale à 12 °C et à un pH de 6,8 (Alchihab et al., 2009). La production optimale de γ-décalactone par Y. lipolytica se fait à 27 °C et à un pH maintenu à 6 (Waché et al., 2000 ; Escamilla García et al., 2007a).
21Les milieux de production de lactone contiennent généralement des sels minéraux (KH2PO4, MgSO4, FeSO4, CaCl2) (Feron et al., 1996). En plus de ces divers éléments, des surfactants (principalement le Tween 80) (Souchon et al., 1998 ; Waché et al., 2000 ; Aguedo et al., 2004 ; Gomes et al., 2007) ou des acides aminés (Lee et al., 1998) sont utilisés dans la production de lactones.
22La source de carbone et sa concentration influencent fortement la production de lactones. La plupart des processus microbiologiques emploient l'huile de ricin, le ricinoléate de méthyle ou l'acide ricinoléique (principal acide gras de l'huile de ricin) pour la production de lactones.
23L'ajout de divers acides gras constitutifs de l'huile de ricin, l'acide palmitique, stéarique, oléique ou linoléique, réduit la production de γ-décalactone par Sporobolomyces odorus. Par contre, l'ajout de l'acide ricinoléique au milieu augmente la production (Lin et al., 1996). Endrizzi et al. (1993) observent que la levure Pichia guilliermondii produit de la γ-décalactone dans un milieu de culture contenant du ricinoléate de méthyle et pas dans un milieu contenant de l'oléate ou du linoléate de méthyle. Okamoto et al. (2002) ont mis en évidence que pendant la culture de Piptoporus soloniensis en présence des acides 12-hydroxystéarique et ricinoléique, cette levure oriente son métabolisme vers la production de γ-décalactone, alors qu'en présence d'acide palmitique, stéarique, oléique, elle l'oriente vers la production de γ-octalactone. Ils pensent que la présence du groupement hydroxyle sur la position 12 des acides 12-hydroxystéarique et ricinoléique, augmente la production de γ-décalactone.
24Diverses études ont montré que la source de carbone utilisée et sa concentration constituent le facteur limitant dans la production de lactones. Selon Alchihab et al. (2009), la production de γ-décalactone par Rhodotorula aurantiaca n'est pas proportionnelle à la concentration en huile de ricin. Il en est de même pour la production de cette lactone par Pichia guilliermondii à partir de ricinoléate de méthyle (Endrizzi et al., 1993). Lin et al. (1996) ont observé que l'augmentation de la concentration en acide ricinoléique diminue la croissance et la production de la lactone par Sporobolomyces odorus. Cette diminution est attribuée à une diminution de la viabilité cellulaire dans le milieu. D'autres résultats indiquent une production de γ-décalactone proportionnelle à la concentration de l'acide ricinoléique ajouté (Dufossé et al., 1998).
25Pour éviter l'inhibition initiale de la levure par une forte concentration de substrat, la technologie du fed-batch (Lee et al., 1999) et l'immobilisation des cellules par inclusion (Lee et al., 1998) semblent être des stratégies adéquates.
26Dans les procédés aérobies de culture des micro-organismes, l'oxygène est le co-substrat indispensable. Mais les conditions de transfert d'oxygène dépendent de plusieurs facteurs comme la température, la pression, la composition du milieu de culture, le débit d'air, la viscosité du milieu, l'aération, la vitesse d'agitation et la configuration du réacteur (Puthli et al., 2005). En milieu émulsionné, il faut aussi prendre en compte que l'oxygène est plus soluble dans la phase organique que dans l'eau (Gomes et al., 2007). D'autre part, l'oxygène intervient dans la régénération des cofacteurs de la β-oxydation peroxysomale tel que le NAD+ qui conduit à la production des arômes (Aguedo et al., 2005 ; Gomes et al., 2007). Selon Aguedo et al. (2005), l'augmentation du KLa de 26 à 123 par h (par augmentation de l'aération et de l'agitation) empêche l'épuisement de l'oxygène pendant la production de γ-décalactone par Y. lipolytica et améliore la production de 3-hydroxy-γ-décalactone, de déc-2-én-4-olide et de déc-3-én-4-olide. Par contre, une nouvelle augmentation jusqu'à 162 par h diminue la concentration en lactones.
27Escamillla García et al. (2007a) ont observé en modifiant le pH et l'aération que l'accumulation de 3-hydroxy-γ-décalactone est fortement dépendante des conditions environnementales, mais aucune corrélation directe n'a été observée entre l'accumulation de cette lactone et le KLa. En raison de la position centrale de la 3-hydroxy-γ-décalactone dans la voie de la production des lactones, l'effet de diverses conditions environnementales (l'aération, le pH, la concentration en substrat et en oxygène dissous) sur sa production a été étudié (Escamilla García et al., 2009). Il a été observé une accumulation importante à faible aération, à pH 3 et 4,5 et à 15 g.l-1 du substrat. Puisque l'oxygène joue un rôle important, son effet a été évalué en testant différentes concentrations et au pH qui était le plus favorable au métabolisme (4,5) : la meilleure production a été obtenue à 5 % et à 30 % d'oxygène.
5. Voie métabolique impliquée dans la biotransformation de l'acide ricinoléique en γ-décalactone
28La β-oxydation peroxysomale est la voie de dégradation principale des acides gras chez les levures (Pagot et al., 1996). L'acide ricinoléique, préalablement activé en acyl-CoA, subit plusieurs cycles de β-oxydation (Figure 1). Chaque cycle comprend quatre étapes principales : une déshydrogénation, une hydratation, une deuxième déshydrogénation et enfin une rupture de liaison entre les carbones α et β, ce qui mène à la formation de l'acide 4-hydroxydécanoïque. Cet acide se transforme en γ-décalactone par cyclisation (Okui et al., 1963b).
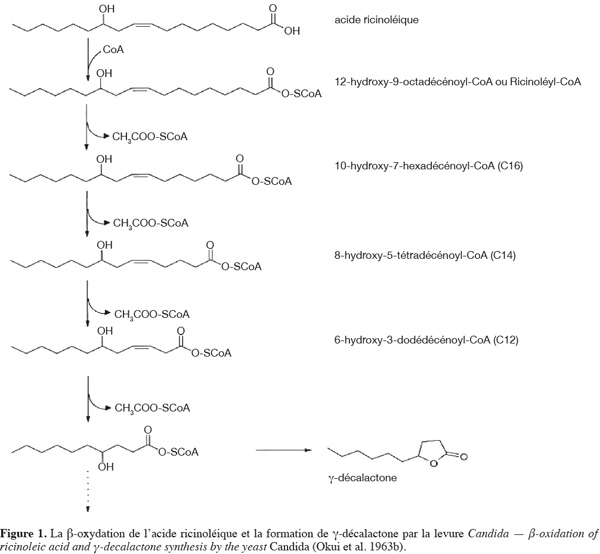
29Les acyl-CoA oxydases, qui catalysent la première étape de la β-oxydation peroxysomale, jouent un rôle important dans la dégradation des acides gras et dans la production de lactones chez la levure (Nicaud et al., 1998). Des études génétiques réalisées chez les levures ont mis en évidence plusieurs gènes codant pour des acyl-CoA oxydases. Chez Saccharomyces cerevisiae, un seul gène (pox1) a été isolé (Dmochowska et al., 1990). En revanche, chez Candida maltosa, deux gènes codant pour l'acyl-CoA oxydase (pox2 et pox4) ont été mis en évidence (Masuda et al., 1995). Trois gènes (pox2, pox4 et pox5) ont été trouvés chez Candida tropicalis (Okazaki et al., 1986 ; 1987 ; Murray et al., 1987).
30Chez Y. lipolytica, l'isolement des gènes codant pour l'acyl-CoA oxydase a été réalisé par Le Clainche (1997). Cette équipe a pu déterminer la séquence complète de cinq gènes (pox1 à pox5) codant pour les enzymes aox1 à aox5. Ces séquences ont été déposées à l'EMBL avec les numéros d'accession AJ001299 à AJ001303. Un 6e gène a été identifié lors du séquençage du génome de Y. lipolytica (Dujon et al., 2004). Y. lipolytica a donc une famille multigénique composée de six gènes. Ces gènes présentent 63 % d'identité entre eux et 42 % avec les gènes pox d'autres levures (Wang et al., 1999). L'étude fonctionnelle de ces acyl-CoA oxydases chez Y. lipolytica a été réalisée par disruption génétique. Des souches de Y. lipolytica mono- ou multi-disruptées ont été construites. L'activité totale de l'acyl-CoA oxydase a été mesurée en fonction du temps d'induction et de la longueur de chaine du substrat. Une délétion simple n'affecte pas la croissance des levures mais modifie le spectre de longueur de chaine de l'activité acyl-CoA oxydase. Ils ont démontré qu'il existe une sélectivité de longueur de chaine pour pox2 et pox3, chaines longues et chaines courtes respectivement. En revanche, pox5 est active quelle que soit la longueur de la chaine (Nicaud et al., 1998 ; Wang et al., 1998; Wang et al., 1999a ; 1999b).
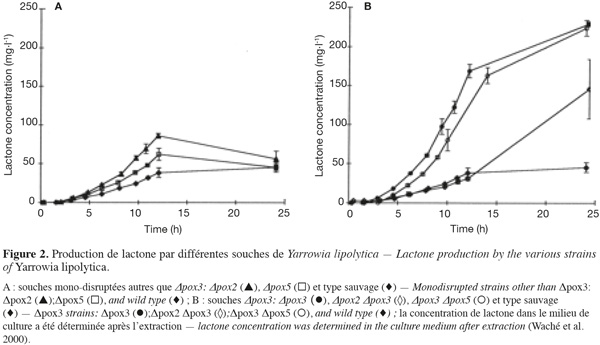
31L'analyse du rôle des acyl-CoA oxydases dans la biotransformation de l'acide ricinoléique en γ-lactone a été réalisée par Waché et al. (2000). Ils ont suivi la production et la dégradation de la lactone produite par des souches de Y. lipolytica mono- et multi-disruptées pour les gènes pox. Une souche délétée pour le gène pox1 (∆pox1) présente une activité acyl-CoA oxydase totale supérieure et une production de γ-décalactone inférieure à la souche sauvage. Ces auteurs ont montré que les souches mono-disruptées produisent des niveaux de lactone similaires à ceux de la souche sauvage (50 mg.l-1), excepté la souche délétée de pox3 (220 mg.l-1 en 24 h) (Figure 2). De même, pour les souches multi-disruptées, seule la souche ∆pox3 présente des vitesses de production plus élevées. La souche ∆pox2 ∆pox3 produit environ 150 mg.l-1. La production et la consommation de la lactone par le triple mutant ∆pox2 ∆pox3 ∆pox5 sont faibles, alors que le quadruple disruptant ∆pox2 ∆pox3 ∆pox4 ∆pox5 ne produit ni ne consomme la lactone. Ces résultats montrent que les souches contenant la délétion pox3, codant pour l'acyl-CoA oxydase spécifique des chaines courtes, dégradent plus lentement l'acide 4-hydroxydécanoïque, ce qui permet à l'acide de cycliser et de former la lactone.
32La levure Y. lipolytica transforme le ricinoléate de méthyle en γ-décalactone, mais la concentration mesurée dans le milieu est faible à cause de l'accumulation d'autres lactones (3-hydroxy-γ-décalactone, déc-2-én-4-olide et déc-3-én-4-olide) et de la consommation de γ-décalactone. Différentes études ont été réalisées dans le but d'améliorer la production de γ-décalactone et de diminuer sa consommation par Y. lipolytica (Waché et al., 2001 ; 2002). Ces auteurs ont construit des souches ne présentant pas d'activité acyl-CoA oxydase spécifique des acides gras à courte chaine. Groguenin et al. (2004) ont montré que l'enzyme Aox4p contribue à la dégradation de la γ-décalactone par Y. lipolytica. Ils ont construit une souche délétée pour le gène pox4, les résultats montrent que cette souche n'est pas capable de dégrader la γ-décalactone, elle produit dix fois plus de γ-décalactone que la souche sauvage. Une étude factorielle plus poussée propose une évaluation de l'effet des différents pox sur la production de γ-décalactone : l'activité de l'acyl-CoA oxydase est corrélée avec la croissance cellulaire et ne l'est pas avec la production de la lactone, toutefois une corrélation inverse entre l'activité acyl-CoA oxydase sur les acides gras à courte chaine et l'accumulation de la lactone a été mise en évidence (Escamilla García et al., 2007b).
6. Chiralité des lactones
33Les γ-lactones à 5 atomes de carbone et plus, et les δ-lactones à 6 atomes de carbone et plus possèdent au moins un carbone asymétrique. Par conséquent, elles peuvent exister sous les deux formes énantiomériques R et S (Dufossé et al., 1994). Les propriétés des deux formes énantiomériques peuvent être très différentes selon la lactone.
34Mosandl et al. (1989) ont étudié l'effet de la chiralité sur les propriétés organoleptiques des lactones, sur la note aromatique et son intensité. Ils ont synthétisé des énantiomères purs de γ-lactones et ont montré que les formes R des γ-lactones possèdent des seuils de perception plus faibles que leurs homologues S. Il faut savoir que la forme R de la γ-décalactone est prédominante dans la nature, ce qui permet d'ailleurs de distinguer différentes sources du composé.
35La biotransformation de l'acide oléique en γ-décalactone et γ-dodécalactone par Sporobolomyces odorus a été étudiée par Haffner et al. (1996). Les résultats montrent que la levure produit la R-γ-décalactone et un mélange racémique de γ-dodécalactone. Sporidiobolus salmonicolor produit la R-γ-décalactone à 99 % (Dufossé et al., 1997). Tandis que la levure psychrophile Rhodotorula aurantiaca produit la R-γ-décalactone à 99,6 % (Alchihab et al., 2009).
7. Dégradation des lactones
36Les lactones sont généralement produites à la fin de la phase exponentielle et au début de la phase stationnaire de la culture. Mais certains micro-organismes sont capables de former des molécules aromatiques et de les utiliser ensuite comme source de carbone, ce qui mène à une baisse de la concentration dans le milieu. Candida intermedia et Y. lipolytica sont capables de dégrader la γ-décalactone ainsi que l'acide 4-hydroxydécanoïque (Fuganti et al., 1993 ; Endrizzi et al., 1995).
37Différentes voies métaboliques peuvent être impliquées dans la dégradation des lactones par les micro-organismes (Fuganti et al., 1991 ; Endrizzi et al., 1996). Lors de la biotransformation du ricinoléate de méthyle par Y. lipolytica, la dégradation de l'acide 4-hydroxydécanoïque consisterait en une oxydation suivie d'une hydratation aboutissant à l'acide 3,4-dihydro-décanoïque qui se cycliserait ensuite en 3-hydroxy-γ-décalactone. Cette dernière lactone est le précurseur d'autres lactones. L'élimination d'une molécule d'eau de la 3-hydroxy-γ-décalactone donnera lieu à la formation de déc-2-én-4-olide et déc-3-én-4-olide (Figure 3) (Waché et al., 2001). Des études réalisées sur la dégradation des lactones par des cellules animales ont montré qu'une γ-lactonase ouvre le cycle, convertissant la lactone en l'anion de l'acide hydroxylé correspondant, qui peut par la suite subir des décarboxylations successives en acétyl-CoA via la β-oxydation peroxisomale (Adams et al., 1998). Une autre voie de dégradation pourrait être l'ω-oxydation de l'extrémité de la chaine carbonée latérale.
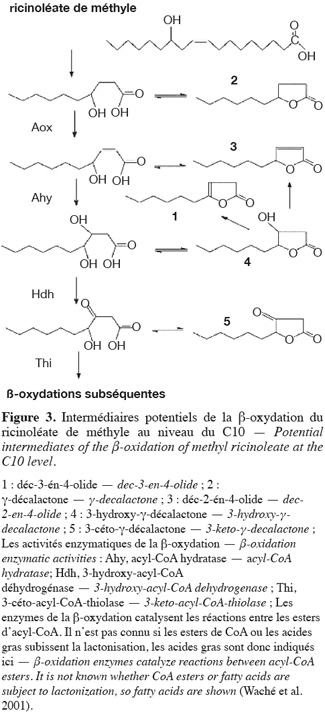
38La dégradation des lactones peut dépendre des conditions environnementales comme l'aération, l'agitation, le pH, le transfert d'oxygène et de l'activité enzymatique de la souche (Waché et al., 2001 ; Aguedo et al., 2005 ; Escamilla García et al., 2007a ; 2009).
8. Toxicité des lactones
39De nombreuses lactones naturelles ont une activité biologique de type anti-microbien, anti-fongique ou anti-inflammatoire. Les propriétés antimicrobiennes de quelques lactones ont été rapportées, par exemple, la 2-décéno-δ-lactone à une concentration de 100 mg.l-1 inhibe la croissance de bactéries (Nago et al., 1993). Endrizzi-Joran (1994) a montré, en milieu solide contenant du glucose comme source de carbone, que la γ-décalactone inhibe la croissance de plusieurs espèces de levures incapables de produire ce composé. Ce même phénomène a été également rapporté par Feron et al. (1996), auteurs selon lesquels la concentration compatible avec une croissance des cellules est comprise entre 100 et 200 mg.l-1. La γ-décalactone est aussi toxique pour les cellules de Sporobolomyces odorus. Des cinétiques de croissance de la levure sur un milieu à base de vinasse contenant 50 mg.l-1 ou 250 mg.l-1 de lactone ont été réalisées : la concentration de 50 mg.l-1 n'affectait pas la croissance de la levure pendant les 50 premières heures de culture. Au-delà de ce temps, une diminution de la croissance était observée. En revanche, en présence de 250 mg.l-1 de lactone, la croissance du micro-organisme était significativement inférieure dès le départ (Ambid et al., 1999). La 6-pentyl-α-pyrone est aussi toxique pour Trichoderma viride (Bonnarme et al., 1997).
40Aguedo et al. (2002) ont étudié l'effet de quatre lactones (γ-butyrolactone, γ-décalactone, δ-décalactone et γ-dodécalactone) sur la croissance de Y. lipolytica ; la γ-dodécalactone s'est avérée la plus inhibitrice, devant la γ-décalactone, la δ-décalactone, tandis que la γ-butyrolactone ne montre aucun effet sur sa croissance. La longueur de la chaine latérale est probablement impliquée dans l'inhibition de la croissance de Y. lipolytica. Ces auteurs (Aguedo et al., 2003) ont également montré que la γ-décalactone interagit fortement avec des phospholipides membranaires modèles et qu'elle conduit chez Y. lipolytica à une augmentation de la fluidité des membranes et à une diminution de l'activité H+-ATPase, enzyme membranaire essentielle au maintien de la viabilité cellulaire. L'effet de γ-décalactone et de l'acide 4-hydroxydécanoïque sur la croissance de la levure psychrophile Rhodotorula aurantiaca a été étudié par Alchihab et al. (2010a). Ces auteurs ont montré que la γ-décalactone est un facteur limitant pour sa production.
41Plusieurs techniques ont été utilisées pour l'extraction des lactones en continu, notamment pour éviter les problèmes de toxicité vis-à-vis des micro-organismes producteurs. C'est par exemple le piégeage de la γ-décalactone produite par Sporidiobolus en utilisant différentes phases huileuses comme l'huile d'olive, la tributyrine et la paraffine (Dufossé et al., 1999). Ces mêmes auteurs ont aussi piégé la γ-décalactone produite par Sporidiobolus salmonicolor à l'aide de β-cyclodextrine.
42L'adsorption sur du charbon actif et des résines hydrophobes présente différents avantages (Souchon et al., 1996 ; 1998 ; Dufossé et al., 1999) :
43– il n'est pas nécessaire de chauffer les produits aromatiques, par conséquent leur dégradation thermique est évitée,
44– l'adsorption de l'eau sur le support est minime,
45– la surface de support n'est pas chimiquement réactive avec les produits organiques.
46Souchon et al. (1996) ont étudié l'adsorption de produits aromatiques (acétate d'éthyle, 2,5-diméthylpyrazine, 1-octen-3-ol et γ-décalactone) sur du charbon actif et sur des polymères hydrophobes (Porapak Q, Chromosorb 105 et Amberlite XAD-4). En travaillant en fermentation extractive pour produire la γ-décalactone à partir de S. salmonicolor, Souchon et al. (1998) ont utilisé 30 g.l-1 de charbon actif et 20 g.l-1 de polymères. Ils ont montré que le ricinoléate de méthyle à la concentration de 1 g.l-1 permettait la meilleure adsorption sur le Porapak Q, par contre à une concentration de 50 g.l-1 de ricinoléate de méthyle, c'est le charbon actif qui est le plus efficace car il piège la lactone. L'ajout de la gomme tragacanth au milieu de culture semble être une stratégie adéquate pour améliorer la production de γ-décalactone et réduire sa toxicité à l'égard de la cellule (Alchihab et al., 2010a).
47Une technique d'extraction de γ-décalactone de milieu de culture a été proposée par Alchihab et al. (2010b) en utilisant des résines Macronet (MN-102, MN-100 et MN-202) (Purolite, France). Les résultats obtenus montrent que la résine MN-202 est plus efficace que les deux autres. Les pourcentages d'adsorption de γ-décalactone sur les trois résines (MN-102, MN-100 et MN-202) sont 75, 81 et 85 % respectivement, alors que le pourcentage de désorption est autour de 70 %.
9. Conclusion
48La production d'arômes par voie microbiologique présente de nombreux avantages : label naturel, potentialités de production importante, cout moindre par rapport à l'extraction d'origine végétale.
49Cette étude fait le point sur la production de lactones (molécules à notes fruitées) par des levures capables de biotransformer des acides gras. Les substrats valorisables, les souches utilisées, les rendements de production obtenus ont fait que ce type de procédé a abouti à des développements industriels. Des améliorations peuvent toutefois encore être apportées et les études en cours devraient y contribuer.
50L'étape de récupération des molécules d'intérêt mérite encore des investigations pour mettre au point une technologie intégrée efficace dans un contexte général de développement durable.
51Remerciements
52Mohamed Alchihab et les autres auteurs remercient le gouvernement de Syrie pour le soutien financier.
Bibliographie
Adams T.B. et al., 1998. The FEMA GRAS assessment of lactones used as flavour ingredients. Food Chem. Toxicol., 36, 249-278.
Aguedo M. et al., 2002. Interaction of odorous lactones with phospholipids: implications in toxicity towards producing yeast cells. Biotechnol. Lett., 24, 1975-1979.
Aguedo M., Beney L., Waché Y. & Belin J.M., 2003. Mechanisms underlying the toxicity of lactone aroma compounds towards the producing yeast cells. J. Appl. Microbiol., 94(2), 258-265.
Aguedo M. et al., 2004. Impact of surfactants on the biotransformation of methyl ricinoleate into γ-decalactone by Yarrowia lipolytica. J. Mol. Catal. B: Enzym., 29(1-6), 31-36.
Aguedo M. et al., 2005. Decalactone production by Yarrowia lipolytica under increased O2 transfer rates. Biotechnol. Lett., 27(20), 1617-1621.
Alchihab M. et al., 2009a. Production of γ-decalactone by a psychrophilic and a mesophilic strain of the yeast Rhodotorula aurantiaca. Appl. Biochem. Biotechnol., 158(1), 41-50.
Alchihab M. et al., 2009b. The use of Macronet resins to recover γ-decalactone produced by Rhodotorula aurantiaca from the culture broth. J. Ind. Microbiol. Biotechnol., 37(2), 167-172.
Alchihab M. et al., 2010. The utilization of gum tragacanth to improve the growth of Rhodotorula aurantiaca and the production of γ-decalactone in large scale. Appl. Biochem. Biotechnol., 162(1), 233-241.
Ambid C., Carle S. & De Billerbeck G., 1999. Method for producing and extracting aromatic compounds. WO patent 9954432.
Bonnarme P. et al., 1997. Production of 6-pentyl-α-pyrone by Trichoderma sp. from vegetal oils. J. Biotechnol., 56(2), 143-150.
Cabella P. et al., 1991. Process for the microbiological production of the gamma- and delta-lactones. EP patent 0412880.
Cardillo R. et al., 1989. Process for the microbiological production of gamma-decalactone (R) and gamma-octalactone (R). Patent EP 356291.
Cheetham P.S.J., Maume K.A. & De Rooji J.F.M., 1988. Production of lactones. Patent EP 0258993.
Cheetham P.S.J., Maume K.A. & De Rooij J.F.M., 1993. Method of producing gamma hydroxydecanoic acid or its lactone by feeding a ricinoleic acid source to Sporobolomyces odorus or Rhodotorula glutinis. US Patent 5.219.742.
Dmochowska A., Dignard D., Maleszka R. & Thomas D.Y., 1990. Structure and transcriptional control of the Saccharomyces cerevisiae POX1 gene encoding acyl-coenyme A oxidase. Gene, 88(2), 247-252.
Dufossé L. et al., 1994. Importances des lactones dans les arômes alimentaires : structure, distribution, propriétés sensorielles et biosynthèse. Sc. Aliments, 14, 17-50.
Dufossé L. et al., 1997. Chirality of the γ-lactones produced by Sporidiobolus salmonicolor. Chirality, 9(7), 667-671.
Dufossé L. et al., 1998. Production of γ-decalactone and 4-hydroxy-decanoic acid in the genus Sporidiobolus. J. Ferment. Bioeng., 86(2), 169-173.
Dufossé L. et al., 1999. In situ detoxification of the fermentation medium during γ-decalactone production with the yeast Sporidiobolus salmonicolor. Biotechnol. Prog., 15(1), 135-139.
Dujon B. et al., 2004. Genome evolution in yeasts. Nature, 430, 35-44.
Endrizzi-Joran A., 1994. Biotransformation de ricinoléate de méthyle en γ-décalactone par des levures. Thèse de doctorat : Université de Bourgogne-ENSBANA, Dijon (France).
Endrizzi A., Awade A.C. & Belin J.M., 1993. Presumptive involvement of methyl ricinoleate β-oxidation in the production of γ-decalactone by the yeast Pichia guilliermondia. FEMS Microbiol. Lett., 114, 153-160.
Endrizzi A. & Belin J.M., 1995. Bioconversion of methyl ricinoleate to 4-hydroxy-decanoic acid and to γ-decalactone by yeasts of the genus Candida. J. Basic Microbiol., 35, 285-292.
Endrizzi A. et al., 1996. Production of lactones and peroxisomal beta-oxidation in yeasts. Crit. Rev. Biotechnol., 16(4), 301-329.
Engel K.H. et al., 1988. Investigation of volatile constituents in nectarines. 1. Analytical and sensory characterization of aroma components in some nectarine cultivars. J. Agric. Food Chem., 36(3), 549-553.
Escamilla García E., Belin J.M. & Waché Y., 2007a. Use of a Doehlert factorial design to investigate the effects of pH and aeration on the accumulation of lactones by Yarrowia lipolytica. J. Appl. Microbiol., 103(5), 1508-1515.
Escamilla García E., Nicaud J.M., Belin J.M. & Waché Y., 2007b. Effect of acyl-CoA oxidase activity on the accumulation of γ-decalactone by the yeast Yarrowia lipolytica: a factorial approach. Biotechnol. J., 2(10), 1280-1285.
Escamilla García E. et al., 2009. Production of 3-hydroxy-γ-decalactone, the precursor of two decenolides with flavouring properties, by the yeast Yarrowia lipolytica. J. Mol. Catal. B: Enzym., 57, 22-26.
Farbood M. et al., 1999. Process for preparing saturated lactones, products produced therefrom and organoleptic uses of said products. EP patent 0952226.
Feron G. et al., 1996. Production, identification, and toxicity of γ-decalactone and 4-hydroxydecanoic acid from Sporidiobolus spp. Appl. Environ. Microbiol., 62(8), 2826-2831.
Fuganti C., Grasseli P. & Massimo B., 1991. Biogeneration of aroma: gamma and delta lactones from C-6 to C-10. NATO ASI Ser., 207, 1-17.
Fuganti C., Servi S., Barbeni M. & Cabella P., 1993. New avenues in natural products: strategies in the biogeneration of flavors. In: Attar-ur-Rahman, ed. Studies in natural products chemistry. Amsterdam, The Netherlands: Elsevier Science Publishers, 295-345.
Gatfield I., 1995. Gamma decalactone preparation with high stereo-specificity. DE patent 4401388.
Gatfield I., 1999. Biotechnological production of natural flavor materials. In: Teranishi R., Wick E. & Hornstein I., eds. Flavor chemistry, thirty years of progress. New York, USA: Kluwer Academic, Plenum Publishers, 211-227.
Gomes N., Aguedo M., Teixeira J. & Belo I., 2007. Oxygen mass transfer in a biphasic medium: influence on the biotransformation of methyl ricinoleate into γ-decalactone by the yeast Yarrowia lipolytica. Biochem. Eng. J., 35(3), 380-386.
Groguenin A. et al., 2004. Genetic engineering of the β-oxidation pathway in the yeast Yarrowia lipolytica. J. Mol. Catal. B: Enzym., 28(2-3), 75-79.
Haffner T. & Tressl R., 1996. Biosynthesis of (R)-γ-decanolactone in the yeast Sporobolomyces odorus. J. Agric. Food Chem., 44(5), 1218-1223.
Le Clainche A., 1997. Maîtrise de la production de γ-lactone par la levure Yarrowia lipolytica : mise en évidence de l'existence d'une famille multigénitique d'acyl-CoA oxydases. Paris-Grignon, France : Institut National Agronomique.
Lee S.L., Chou C.C. & Wu C.M., 1992. Effect of some factors on the volatile flavor production by Sporobolomyces odorus. J. Chin. Agric. Chem. Soc., 30, 471-483.
Lee S.L. & Chou C.C., 1994. Growth and production of γ-decalactone and cis-6-dodecen-4-olide by Sporobolomyces odorus in the presence of fatty acids and oils. J. Ferment. Bioeng., 78, 114-116.
Lee S.L., Lin S.J. & Chou C.C., 1995. Growth of and production of γ-decalactone by Sporobolomyces odorus in jar fermentors as affected by pH, aeration and fed-batch technique. J. Ferment Bioeng., 80(2), 195-199.
Lee S.L., Cheng H.Y., Chen W.C. & Chou C.C., 1998. Production of gamma-decalactone from ricinoleic acid by immobilized cells of Sporidiobolus salmonicolor. Process Biochem., 33(4), 453-459.
Lee S.L., Cheng H.Y., Chen W.C. & Chou C.C., 1999. Effect of physical factors on the production of γ-decalactone by immobilized cells of Sporidiobolus salmonicolor. Process Biochem., 34(8), 845-850.
Lin S.J., Lee S.L. & Chou C.C., 1996. Effects of various fatty acid components of castor oil on the growth and production of γ-decalactone by Sporobolomyces odorus. J. Ferment. Bioeng., 82(1), 42-45.
Maga J.A., 1976. Lactones in foods. Crit. Rev. Food Sci. Nutrit., 8(1), 1-56.
Masuda Y., Park S.M., Ohta A. & Takagi M., 1995. Cloning and characterization of the POX2 gene in Candida maltosa. Gene, 167(1-2), 157-161.
Mosandl A. & Günther C., 1989. Stereoisomeric flavor compounds. 20. Structure and properties of gamma-lactone enantiomers. J. Agric. Food Chem., 37(2), 413-418.
Murray W.W. & Rachubinski R.A., 1987. The primary structure of a peroxisomal fatty acyl-CoA oxidase from the yeast Candida tropicalis pk233. Gene, 51(2-3), 119-128.
Nago H., Matsumoto M. & Nakai S., 1993. 2-Deceno-δ-lactone producing fungi, strains of Fusarium solani, isolated by using medium containing decano-δ-lactone as the sole carbon source. Biosci. Biotechnol. Biochem., 57(12), 2107-2110.
Nicaud J.M. et al., 1998. Yarrowia lipolytica, a yeast model for the genetic studies of hydroxy fatty acids biotransformation into lactones. J. Mol. Catal. B: Enzym., 5(1-4), 175-181.
Okamoto K. et al., 2002. Production of γ-lactones by the brown-rot basidiomycete Piptoporus soloniensis. J. Biosci. Bioeng., 94(2), 182-185.
Okazaki K. et al., 1986. Two acyl-coenzyme A oxidases in peroxisomes of the yeast Candida tropicalis: primary structures deduced from genomic DNA sequence. Proc. Natl Acad. Sci. USA., 83(5), 1232-1236.
Okazaki K. et al., 1987. Peroxysomal acyl-coenzyme A oxidase multigene family of the yeast Candida tropicalis; nucleotide sequence of a third gene and its protein product. Gene, 58(1), 37-44.
Okui S., Uchiyama M. & Mizugaki M., 1963a. Metabolism of hydroxy fatty acids: metabolic conversion of ricinoleic acid by a certain microorganism to 8-D-(+)-hydroxy tetra-cis-5-enoic acid. J. Biochem., 53(4), 265-270.
Okui S., Uchiyama M. & Mizugaki M., 1963b. Metabolism of hydroxy fatty acids: intermediates of the oxidative breakdown of ricinoleic acid by genus Candida. J. Biochem., 54(6), 536-540.
Page G.V. & Eilerman R.G., 1989. Process for the preparation of gamma and delta lactones. WO patent 8912104.
Pagot Y. & Belin J.M., 1996. Fatty acid cellular metabolism and lactone production by the yeast Pichia guilliermondii. Appl. Microbiol. Biotechnol., 45(3), 349-354.
Puthli M.S., Rathod V.K. & Pandit A.B., 2005. Gaz-liquid mass transfer studies with triple impeller system on a laboratory scale bioreactor. Biochem. Eng. J., 23(1), 25.
Rabenhorst J. & Gatfield I., 2000. Process for the production of gamma decalactone. WO patent 0024920.
Rabenhorst J. & Gatfield I., 2002. Method of producing γ-decalactone using Yarrowia lipolytica strain. HR 145 (DSM 12397) US 6451565 B1.
Souchon I., Rojas J.A. & Voilley A., 1996. Trapping of aromatic compounds by adsorption on hydrophobic sorbents. Sep. Sci. Technol., 31(18), 2473-2491.
Souchon I., Spinnler H.E., Dufossé L. & Voilley A., 1998. Trapping of γ-decalactone by adsorption on hydrophobic sorbents: application to the bioconversion of methyl ricinoleate by the yeast Sporidiobolus salmonicolor. Biotechnol. Tech., 12(2), 109-113.
Spinnler H.E. et al., 1994. Production of γ-decalactone by bioconversion. French Patent No. 2705971.
Tahara S. et al., 1972. Gamma decalactone: one of constituents of volatiles in cultured broth of Sporobolomyces odorus. Agric. Biol. Chem., 36, 2585-2587.
Tahara S., Fujiwara K. & Mizutani J., 1973. Neutral constituents of volatiles in cultured broth of Sporobolomyces odorus. Agric. Biol. Chem., 37(12), 2855-2861.
Waché Y. et al., 2002. Optimization of Yarrowia lipolytica's β-oxidation pathway for γ-decalactone production. J. Mol. Catal. B: Enzym., 19-20, 347-351.
Waché Y. et al., 2001. Role of β-oxidation enzymes in γ-decalactone production by the yeast Yarrowia lipolytica. Appl. Environ. Microbiol., 67(12), 5700-5704.
Waché Y. et al., 2000. Involvement of acyl-CoA oxydase isozymes in biotransformation of methyl ricinoleate into γ-decalactone by Yarrowia lipolytica. Appl. Environ. Microbiol., 66(3), 1233-1236.
Wang X.D. et al., 2000. Addition of reducing agent dithiothreitol improves 4-decanolide synthesis by the genus Sporidiobolus. J. Biosci. Bioeng., 90(3), 338-340.
Wang H. et al., 1998. Cloning and characterization of the peroxisomal acyl-CoA oxydase ACO3 gene from the alkane-utilizing yeast Yarrowia lipolytica. Yeast, 14(15), 1373-1386.
Wang H. et al., 1999a. Cloning, sequencing, and characterization of five genes coding for acyl-CoA oxidase isozymes in the yeast Yarrowia lipolytica. Cell Biochem. Biophys., 31(2), 165-174.
Wang H. et al., 1999b. Evaluation of acyl coenzyme A oxidase (Aox) isozyme function in the n-alkane-assimilating yeast Yarrowia lipolytica. J. Bacteriol., 181(17), 5140-5148.
Wink J., Voelskow H., Grabley S. & Deger H.M., 1988. Pfirsich aroma, verfahren zur herstellung und seine verwendung. Patent EP 286950.
To cite this article
About: Mohamed Alchihab
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle (CWBI). Unité de Bio-Industries. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : mohamed_souria@yahoo.fr
About: Jacqueline Destain
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle (CWBI). Unité de Bio-Industries. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: Mario Aguedo
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Chimie générale et organique. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: Philippe Thonart
Univ. Liège - Gembloux Agro-Bio Tech. Centre Wallon de Biologie Industrielle (CWBI). Unité de Bio-Industries. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






