- Startpagina tijdschrift
- Volume 14 (2010)
- numéro 4
- Étude de la germination des graines d'Acacia tortilis sous différentes contraintes abiotiques
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Étude de la germination des graines d'Acacia tortilis sous différentes contraintes abiotiques

Nota's van de redactie
Reçu le 22 septembre 2009, accepté le 30 mars 2010
Résumé
Étant donné la menace de régression des peuplements d'acacia en Tunisie, nous avons analysé, en guise d'étude préliminaire, le comportement germinatif de l'espèce dans le but d'envisager ultérieurement un programme de conservation et de réhabilitation. Dans ce cadre et afin d'optimiser la germination des graines d'acacia et d'éliminer l'obstacle de l'inhibition tégumentaire, nous avons dans un premier temps testé différents prétraitements physiques (scarification, eau bouillante) et chimique (acide sulfurique) et sous différentes températures. De ce fait, nous avons pu déterminer les conditions optimales de germination, puis nous avons exploité ces résultats dans le but d'évaluer l'aptitude à la germination de l'espèce sous différentes contraintes osmotiques. À cet effet, nous avons soumis les graines à différentes concentrations de NaCl (0 à 22 g.l-1) et de PEG (0 à -8 bars). Les paramètres relatifs à la capacité et la cinétique de germination ont été déterminés et analysés. Ainsi, l'immersion des graines dans l'acide sulfurique concentré pendant une heure a permis d'améliorer le taux et la vitesse de germination. L'étude de l'effet de la température sur la germination a montré qu'une température de 25 °C permet d'améliorer le taux et le temps moyen de germination. Le comportement germinatif de l'espèce en conditions de stress osmotique a mis en évidence un effet traitement (concentration en PEG6000) hautement significatif sur le taux et le temps moyen de germination et a révélé que cette espèce ne supporte pas beaucoup la sècheresse (inhibition totale de la germination à -8 bars). L'étude de l'effet de la salinité sur la germination a montré un effet concentration en sel hautement significatif sur le taux et le temps moyen de germination et révélé une bonne tolérance de l'espèce à la salinité puisqu'elle réussit à germer dans des concentrations élevées de sel (à 22 g.l-1, le taux de germination est égal à 21 %). La présente étude montre ainsi que la capacité germinative de l'Acacia tortilis vis-à-vis des contraintes environnementales est assurément suffisante pour envisager l'utilisation de cette espèce en reboisement et d'élargir par conséquent son aire de répartition.
Abstract
Study of Acacia tortilis seed germination under different abiotic constraints. Since Tunisian acacia populations are threatened by regression, we analyzed as a preliminary study the germination behavior of the species in order to plan subsequently for a preservation and rehabilitation program. In this context and to optimize acacia seed germination and to overcome and remove the obstacle of tegumentary inhibition, we have in a first attempt tested several physical (scarification, boiled water) and chemical (sulfuric acid) pretreatments under different temperatures. Thus, we could determine the optimal germination conditions that have been used afterwards for evaluating the germination capacity of the species under different osmotic constraints. Several concentrations of NaCl (0 to 22 g.l-1) and PEG (0 to -8 bars) were applied on seeds. Parameters related to germination capacity and kinetic were assessed and analyzed. Thus, soaking seeds in concentrated sulfuric acid for one hour allowed us to improve the germination rate and its speed. When studying the effect of the temperature on the germination process, we showed that 25°C could improve the rate and average time of germination. Under osmotic stress, we found a highly significant treatment effect (PEG concentrations) on the germination rate and average time of germination, and the species did not display a high drought tolerance behavior (since germination is totally inhibited under -8 bars). Moreover, the study of the effect of salt stress on germination revealed a highly significant effect of NaCl concentrations on the germination rate and average time of germination, and a good level of salt tolerance since it succeeded to germinate under high salt concentrations (21% of germination rate under 22 g.l-1NaCl). In conclusion, our study clearly showed that germination capacity of Acacia tortilis under the environmental constraints and factors is sufficiently assured to consider this species for a reforestation program and to extend consequently its area of distribution.
Inhoudstafel
1. Introduction
1Dans les zones arides et désertiques de la Tunisie on assiste, au cours des dernières décennies, à un recul rapide de la couverture végétale naturelle associé à une érosion de la diversité biologique (Le Houerou, 1959 ; 1969 ; Floret et al., 1982 ; Direction Générale des Forêts, 1995 ; 2005 ; 2006). Cette dégradation du couvert végétal, imputée principalement aux conditions environnementales stressantes, au défrichement et au surpâturage, se traduit par des effets de plus en plus néfastes sur les plans économique et écologique (désertification). Pour mieux lutter contre ce phénomène, il faut chercher les solutions qui permettent d'améliorer le couvert végétal et résoudre les problèmes de régénération de certaines essences forestières en zones arides, particulièrement l'acacia qui connait en Afrique du Nord une régression et un déclin inquiétants (Kennenni et al., 1990).
2Acacia tortilis (Forsk.) Hayne ssp. raddiana (Savi) Brenan est un arbre des régions arides et semi-arides, présent au Nord et au Sud du Sahara, il se développe entre les isohyètes 50 et 1 000 mm (Danthu et al., 2003). Arbre à usages multiples, il est une des espèces majeures dans la zone sahélienne (Danthu et al., 2003). Le peuplement d'A. tortilis, en Tunisie aride surtout, est décrit comme une futaie irrégulière, relativement âgé et caractérisé par l'abondance de grands individus et par la déficience des jeunes pousses. Ce déséquilibre est dû au problème de régénération naturelle (faibles densité et durée de viabilité des graines dans le sol, prédation des graines par les insectes et les herbivores), à l'action anthropique et à la sècheresse (Ernst et al., 1989 ; Skoglund, 1992 ; Hauser, 1994 ; Zaafouri et al., 1996 ; Ward et al., 1997 ; Wiegand et al., 1999 ; Barnes, 2001). Dans les situations où la dégradation du couvert végétal a atteint le seuil d'irréversibilité et où la régénération naturelle ne peut conduire, même à moyen terme, à la restauration de ce couvert (Floret, 1981 ; Novikoff, 1983), le recours aux techniques dites de réhabilitation devient une nécessité impérieuse. En Tunisie aride, l'adoption de cette technique par le biais de la réintroduction volontaire d'espèces autochtones est, par ailleurs, justifiée par les résultats peu encourageants de la réaffectation par introduction d'espèces exotiques (Zaafouri, 1993). L'étude des exigences germinatives des espèces utilisables dans la réhabilitation permet de raisonner le choix du matériel végétal le mieux adapté à la mise en œuvre de cette technique (Bell et al., 1992). Les travaux antérieurs relatifs à la dynamique de la végétation en Tunisie steppique ont, en effet, mis l'accent sur l'intérêt des solutions qui doivent être recherchées pour résoudre les problèmes posés par la germination des semences (PNUD/FAO, 1979 ; Floret et al., 1982 ; Ben Dali, 1987). De plus, en zone aride, où les caractéristiques de la germination sont fortement impliquées dans la sélection pour l'adaptation des végétaux aux conditions du milieu (Jordan et al., 1989 ; Koller, 1995), on peut admettre que la première phase critique de la réhabilitation est celle relative à la germination des espèces à réintroduire. Pour ces raisons, ce travail a été consacré à l'étude des propriétés germinatives des semences d'une légumineuse autochtone pérenne, Acacia tortilis ssp. raddiana var. ‘raddiana’.
3Ce travail a pour objectif l'étude de l'effet des principales contraintes environnementales affectant la germination des semences (Côme, 1970 ; Ungar, 1995), notamment la sècheresse et la salinité (Ennabli, 1995 ; Hachicha, 2007) qui entravent les essais de restauration des espèces forestières menacées. Dans ce contexte, nous nous sommes penchés sur l'étude de la germination en conditions de stress salin, hydrique et thermique afin de mieux maitriser ainsi les premiers problèmes rencontrés lors des essais de reboisement. Notre travail évalue la capacité germinative des graines en conditions de contraintes hydrique et saline simulées respectivement par les molécules PEG6000 et NaCl et sous l'effet de différentes températures. Il tente enfin de déterminer si la réponse aux contraintes osmotiques appliquées au stade de la germination constitue un indicateur précoce fiable du comportement de la plante adulte. Néanmoins, s'agissant d'une légumineuse connue par son fort taux de graines dures (Behaeghe et al., 1962 ; Clatworthy, 1984 ; Vora, 1989), des prétraitements destinés à lever d'éventuelles inhibitions tégumentaires ont été appliqués aux semences d'A. tortilis, qui présente de faibles pourcentages de germination (Loth et al., 2005), d'autant plus que ce problème constitue un obstacle au pépiniériste qui vise à produire des plants massivement via une synchronisation et homogénéisation de la germination (Roussel, 1995).
2. Matériel et méthodes
2.1. Présentation d'Acacia tortilis (Forsk.) Hayne ssp. raddiana (Savi) Brenan var. ‘raddiana’
4A. tortilis se présente généralement sous forme d'arbre et peut avoir parfois l'aspect d'un arbuste de 5 à 12 m de haut. Cette espèce, très typique, est facile à reconnaitre grâce à la présence de longues épines droites et d'épines plus petites et crochues agencées par paires. Sa silhouette en forme de parasol est définie par sa cime aplatie et étalée, mais parfois également arrondie. En général, les feuilles sont plus petites que chez de nombreuses autres espèces d'acacia et ont 2 à 6 paires de pétioles secondaires. Chaque pétiole porte 5 à 12 paires de folioles linéaires de 1 mm de large et 3 mm de long. Les fleurs, de couleur blanchâtre ou blanc jaunâtre et odorantes, sont groupées en capitules globuleux. Le fruit est une gousse indéhiscente qui est contournée ou enroulée en spirale de 12 cm de longueur. L'enracinement pivotant de cette plante peut avoir jusqu'à 8 m de long. En Tunisie, la forêt claire d'A. tortilis occupe une superficie de 30 000 ha environ dans la région de Bled Talah et Bou Hedma. Les semences d'A. tortilis raddiana utilisées dans nos expérimentations ont été récoltées au mois d'aout 2005, dans le parc national de Bou Hedma. Les graines ont été ensuite triées soigneusement pour éliminer celles infectées et trouées par les insectes et dont les dégâts sont souvent énormes, bien que difficilement quantifiables.
2.2. Protocole expérimental
5Effet du prétraitement sur la germination. Afin de déterminer les conditions optimales de germination (à utiliser lors des essais de stress), nous avons, dans un premier temps, effectué des essais préliminaires utilisant différents prétraitements.
6Les téguments des graines d'A. tortilis raddiana ont une structure anatomique typique des légumineuses qui se traduit par une forte inhibition tégumentaire de la germination. Cela implique qu'une scarification naturelle ou artificielle du tégument est nécessaire pour permettre l'imbibition et la germination des graines.
7Pour lever l'inhibition tégumentaire des graines, trois prétraitements ont été réalisés en comparaison avec le témoin : le premier consiste à tremper les graines dans l'eau bouillante (100 °C durant 1 h) et à laisser refroidir, le second procédé est l'immersion des graines dans l'acide sulfurique concentré (H2SO4 à 96 %) pendant une heure, le troisième procédé est celui de la scarification manuelle à l'aide de papier abrasif (Roussel, 1984 ; Danthu et al., 1992 ; Ndour, 1997).
8Après ces prétraitements, les graines ont été lavées à l'eau distillée pendant 15 min, puis traitées avec un fongicide (Benlate) pendant 1 h et enfin rincées avec l'eau distillée. Les graines ont été mises à germer à l'obscurité, car la germination est indifférente à la lumière (Danthu et al., 2003), dans des boites de Petri en plastique sur du papier filtre avec cinq répétitions par traitement, à raison de 20 graines par boite dans trois incubateurs à trois températures différentes (20, 25 et 30 °C) pour l'étude en parallèle de l'influence du facteur thermique.
9La durée du test a été fixée à la période de germination qui s'est étalée sur 30 jours, le comptage des graines germées et dont la radicule a percé les téguments a été effectué tous les deux jours.
10Effet de la salinité sur la germination. Nous avons procédé aux essais de germination sous contraintes salines en utilisant les conditions optimales de germination déterminées à partir des essais de prétraitement précédents. Pour ce faire, les graines ont été d'abord immergées dans l'acide sulfurique pendant 1 h, puis lavées à l'eau distillée pendant 15 min, ensuite traitées avec un fongicide (Benlate) pendant 1 h et enfin rincées avec l'eau distillée. Les graines sont mises à germer dans des boites de Petri remplies de perlite et arrosées quotidiennement avec de l'eau distillée contenant différentes concentrations de NaCl (0, 3, 6, 9, 12, 15, 16, 17, 18, 19, 20, 21 et 22 g.l-1) et disposées à l'obscurité et à la température optimale de germination identifiée par les tests précédents (25 °C) (Danthu et al., 1992, 1996 ; Ndour, 1997). La durée du test a été fixée à la période de germination qui s'est étalée sur 30 jours, le comptage des graines germées a été réalisé quotidiennement.
11Effet du stress osmotique sur la germination. Le protocole de levée d'inhibition tégumentaire et de désinfection des graines est le même que le précédent. Les essais de germination ont été réalisés sous différents niveaux de potentiels hydriques par l'utilisation de PEG ayant une masse molaire de 6 000, du fait qu'il constitue un agent relativement stable, inerte, non ionique mais bien soluble dans l'eau et non toxique, même à de fortes concentrations, à l'obscurité et à la température idéale de germination (25 °C) tout en maintenant un potentiel hydrique stable et uniforme durant toute la période expérimentale (Hohl et al., 1991 ; Lu et al., 1998). En effet, les molécules de PEG6000 sont suffisamment petites pour influencer le potentiel osmotique et assez larges pour ne pas être absorbées par les plantes (Carpita et al., 1979) et constituent ainsi un moyen plus efficace pour simuler une contrainte hydrique que les solutions à faible masse molaire de leur osmoticum et dont les solutés s'infiltrent dans la cellule (Verslues et al., 1998). Ainsi, des solutions de PEG6000 de concentrations croissantes et induisant des potentiels hydriques également croissants (conformément à l'équation établie par Michel et al., 1973) ont été utilisées pour induire les différents niveaux de stress osmotique testés. Les valeurs du potentiel hydrique testées sont 0, -2, -4, -6, -8 et -10 bars. La durée du test a été fixée à la période de germination qui s'est étalée sur 30 jours, le comptage des graines germées est fait quotidiennement.
12D'après Michel et al. (1973), l'équation reliant les différents paramètres est la suivante, avec Ψh : potentiel hydrique (en bar) ; T : température d'incubation en °C ; C : concentration de PEG6000 (g.l-1) :
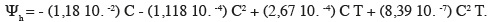
2.3. Analyse des données
13Chaque traitement a été réalisé avec cinq répétitions à raison de 20 graines par boite. Les données relatives à chaque essai ont fait l'objet d'une analyse de variance à un facteur de classification à l'aide du programme SAS puis, si nécessaire, un classement des moyennes a été effectué à l'aide du test de Newman-Keuls. Il s'agit, selon les cas, de l'effet prétraitement (à savoir : eau bouillante, scarification manuelle et acide sulfurique par comparaison au témoin), de l'effet température (3 valeurs de température : 20, 25 et 30 °C), de l'effet concentration en NaCl (13 concentrations : 0, 3, 6, 9, 12, 15, 16, 17, 18, 19, 20, 21 et 22 g.l-1 NaCl) et de l'effet concentration en PEG = potentiel osmotique (0, -2, -4, -6, -8 et -10 bars).
14Nous avons auparavant testé l'égalité des variances en recourant au test de Hartley. Ce test a été non significatif (rejet de l'égalité des variances), ce qui nous a incité à recourir à la transformation angulaire (Y = 2ArcSin√X) des taux de germination dont les valeurs transformées ont été soumises à l'ANOVA.
3. Résultats
3.1. Effet de la température et de la scarification sur la germination
15Influence de la température et de la scarification sur la capacité germinative et le temps moyen de germination de l'Acacia tortilis. La figure 1, illustrant les variations des taux et temps moyens de germination en fonction des différents prétraitements de scarification et différentes températures durant un mois, montre que la scarification à l'acide sulfurique permet d'avoir un démarrage plus rapide de la germination et des taux de germination plus élevés (> 80 % vs 16 à 73 %), comparativement avec les autres prétraitements testés à savoir la scarification mécanique (papier abrasif) ou à l'eau bouillante. Le meilleur temps moyen de germination est noté pour le prétraitement à l'acide sulfurique : 4,83 jours (Tableau 1). Ces résultats sont confirmés par l'analyse de la variance qui a révélé un effet prétraitement très hautement significatif sur les taux de germination et les temps moyens de germination. Ils montrent également qu'il existe un effet significatif de la température sur le taux de germination (p < 0,05).
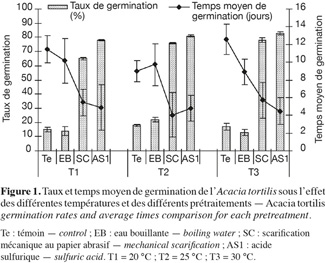
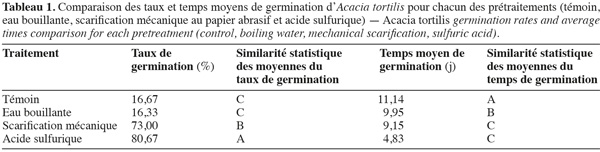
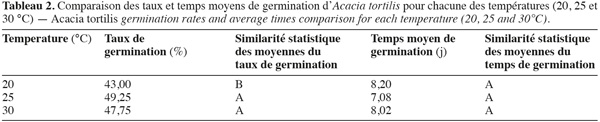
16Les résultats de la comparaison des taux et temps moyens de germination des graines d'A. tortilis sous différentes températures, tous prétraitements confondus, à l'aide du test de Newman-Keuls sont consignés dans le tableau 2. Ce dernier montre que les deux températures 25 et 30 °C ont le même niveau de signification concernant le taux de germination, mais diffèrent significativement de la température 20 °C. En revanche, elles ne diffèrent pas significativement en ce qui concerne le temps moyen de germination.
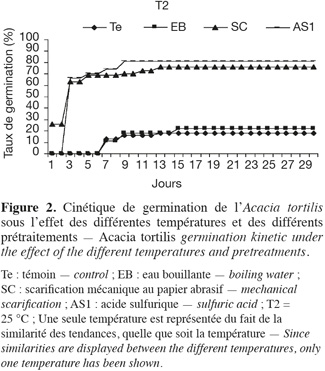
17Influence de la température et de la scarification sur la cinétique de germination. La figure 2 montre la cinétique de germination des graines pour chacun des prétraitements et des températures testées. Ces courbes représentent les taux de germination cumulés pour une période de 30 jours. On peut conclure que sous toutes les températures, l'acide sulfurique a un effet remarquable sur le démarrage des graines et la vitesse de germination.
18Ainsi, suite aux résultats obtenus par ces différents prétraitements, nous choisirons dans nos prochains essais de stress salin et hydrique l'application d'un prétraitement à l'acide sulfurique et une température de germination de 25 °C.
3.2. Effet de la salinité sur la germination
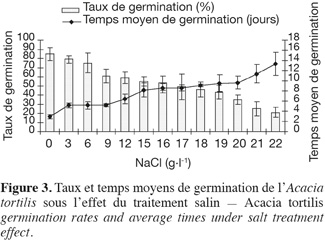
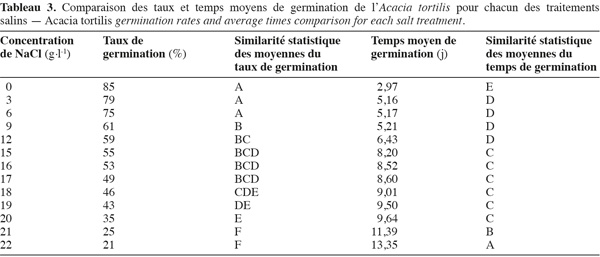
19Influence du NaCl sur le taux et le temps moyen de germination. L'examen de la figure 3, illustrant l'évolution des taux et temps moyens de germination en fonction des concentrations croissantes de NaCl, montre que l'augmentation du stress salin entraine une réduction non seulement des taux de germination mais aussi du temps moyen de germination. A. tortilis n'est affectée significativement par le NaCl qu'à partir de 9 g.l-1 (60 % de taux de germination) et continue à germer même à des concentrations élevées de NaCl (50 % de germination à 18 g.l-1 de NaCl) (voir les similarités des moyennes issues du test de Newman-Keuls, présentées dans le tableau 3).
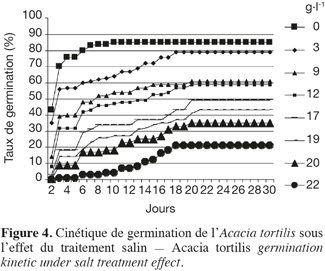
20Influence du NaCl sur la cinétique de germination. La cinétique de la germination des graines sous l'effet des concentrations croissantes de NaCl (Figure 4) décrit une forme sigmoïdale comprenant trois phases. L'analyse de cette cinétique montre généralement une première phase de latence, due à l'imbibition des graines, une deuxième phase exponentielle où l'on assiste à une accélération de la germination et enfin une troisième phase caractérisée par un palier indiquant un arrêt de germination. Chez le témoin, la phase de latence est très courte et ne dure que 2 jours ; la phase exponentielle de germination dure 5 jours avant d'atteindre la phase stationnaire où la germination s'arrête après un maximum de germination. Au fur et à mesure que la salinité augmente, l'allure de cette courbe est modifiée dans le sens d'un étirement, se traduisant par un retard et un ralentissement de la vitesse de germination. C'est ainsi que pour 22 g.l-1 de NaCl, le temps de latence et la phase exponentielle durent respectivement 6 et 14 jours.
3.3. Effet du stress hydrique sur la germination
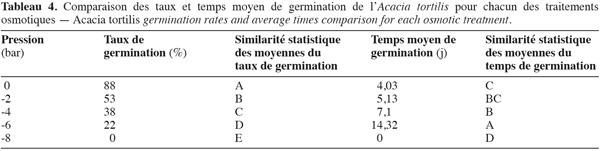
21Influence du stress hydrique sur le taux et le temps moyen de germination. La capacité germinative des graines d'A. tortilis est considérablement affectée et réduite par le stress hydrique (Figure 5). Le temps moyen de germination s'allonge en fonction de l'intensité du stress hydrique. Afin d'opérer un classement des potentiels osmotiques, une comparaison des taux et des temps moyens de germination a été réalisée à l'aide du test de Newman-Keuls (Tableau 4). On constate que dès l'application de -2 bars, la capacité germinative est significativement réduite. De plus, le potentiel osmotique de -8 bars correspond au point au-delà duquel l'espèce n'arrive pas à extraire l'eau et la capacité germinative s'annule, alors que le temps moyen de germination dure 14 jours pour -6 bars. Il s'avère ainsi que l'A. tortilis est sensible au stress osmotique en phase germinative.
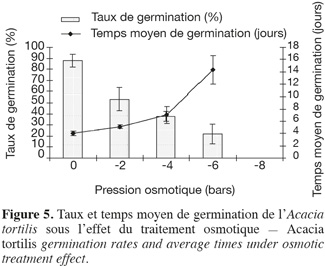
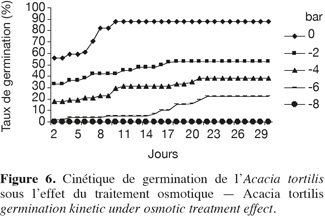
22Influence du stress hydrique sur la cinétique de germination. La cinétique de germination en conditions de stress osmotique est présentée par la figure 6, elle reflète la sensibilité de l'espèce au stress hydrique. Sur milieu témoin, comme nous l'avons remarqué précédemment, les courbes de cinétique de germination affichent trois phases : latence, accélération de façon exponentielle et enfin palier correspondant à un arrêt de germination, après avoir atteint la capacité germinative maximale. L'effet dépressif du déficit hydrique sur la germination se manifeste au cours de l'une ou de l'ensemble de ces trois phases, selon le degré d'abaissement du potentiel hydrique. L'effet se traduit par un ralentissement de la vitesse de germination visible dès le traitement -2 bars et qui s'accentue par la suite.
4. Discussion
23L'Acacia tortilis ssp. raddiana var. ‘raddiana’ constitue un élément capital dans son groupement d'origine au sud tunisien et dans l'équilibre et le maintien de nombreux écosystèmes arides et désertiques. L'introduction de cette espèce dans les programmes de reboisement offre une solution de reforestation durable dans les zones arides et semi-arides mais aussi dans celles affectées par la salinité [environ 1,5 million d'hectares, soit 10 % de la superficie totale (Hachicha, 2007)] et permettrait par conséquent des exploitations diversifiées. Néanmoins, la réussite des phases de germination et de croissance de cette espèce passe inéluctablement par une bonne connaissance de ses caractéristiques germinatives et de développement ainsi que de son comportement vis-à-vis des conditions du milieu.
24Les graines d'A. tortilis étudiées présentent des comportements variés vis-à-vis du facteur thermique et du prétraitement au moment de leur germination, les résultats obtenus mettent en évidence le rôle capital de l'acide sulfurique pour lever l'inhibition tégumentaire des graines. En effet, l'immersion des semences pendant 1 h dans l'acide sulfurique pur permet d'obtenir le plus fort taux de germination et une diminution du temps moyen de germination. L'efficacité de l'acide sulfurique pour lever l'inhibition tégumentaire d'autres espèces prairiales et pastorales avait été démontrée par plusieurs auteurs (Behaeghe et al. , 1962 ; Clatworthy, 1984 ; Grouzis, 1987 ; Vora, 1989). Toutefois, une immersion prolongée des graines dans l'acide peut endommager l'embryon et réduire les performances germinatives. La durée optimale de trempage parait être en rapport avec la dureté des téguments (Neffati, 1994). D'autre part, nos résultats corroborent ceux de Neffati et al. (1997) qui ont signalé que les légumineuses des zones arides sont capables de germer sous une large gamme de températures. Nous confirmons également les conclusions de Teketay (1996) qui indiquent que la majorité des légumineuses des zones sèches germent à des températures comprises entre 15 et 40 °C.
25Concernant le comportement des semences d'A. tortilis vis-à-vis de la salinité, notre étude montre qu'elles sont particulièrement tolérantes et qu'elles sont capables de germer après un traitement allant jusqu'à 22 g.l-1 NaCl et probablement à une concentration encore plus élevée. Effectivement, d'après Ndour et al. (1998), la germination de l'espèce A. tortilis ne s'annule que pour des concentrations en sel proches de celles de l'eau de mer (35 g.l-1). Ainsi, les valeurs limites affichées par A. tortilis sont nettement supérieures à celles publiées par Totey et al. (1987) pour Acacia auriculiformis A.Cunn. ex Benth. (dont la germination est réduite dès que la concentration saline atteint 4,6 g.l-1 NaCl), par Kayani et al. (1990) pour le jojoba (réduction de 50 % de la capacité germinative à 5 g.l-1 NaCl) et par Cavalcante et al. (1995) pour Leucaena leucocephala (Lam.) de Wit. Le retard de germination engendré par les concentrations croissantes du milieu en NaCl résulterait d'une difficulté d'hydratation des graines par suite d'un potentiel osmotique élevé et peut être expliqué par le temps nécessaire à la graine pour mettre en place des mécanismes lui permettant d'ajuster sa pression osmotique interne (Ben Miled et al., 1986 ; Smaoui et al., 1986). On peut remarquer une relation entre la tolérance à la salinité au moment de la germination et l'écologie de chaque espèce. Dans ce sens, Neffati (1994) signale que la connaissance de la tolérance de la salinité au moment de la germination est une information utile mais non suffisante pour expliquer la distribution des espèces et leur développement dans les milieux salés. Nos résultats corroborent aussi ceux de Ndour et al. (1998) et de Danthu et al. (2003) qui montrent que l'A. tortilis raddiana est parmi les espèces africaines d'acacia dont la germination est la moins perturbée par la salinité. Donc cette aptitude et capacité à germer en conditions salines représente une caractéristique importante pour la réhabilitation et le reboisement de l'espèce, mais est aussi intéressante à exploiter pour valoriser les sols marginalisés et concernés par la salinisation.
26Les résultats relatifs à l'effet du stress hydrique sur la germination montrent que les semences d'A. tortilis sont moyennement tolérantes au stress hydrique. La valeur limite du potentiel pour laquelle la quasi-totalité des graines ne germe plus se situe à -8 bars. Plus la pression osmotique est élevée, plus le taux de germination diminue et le temps moyen de germination augmente. Dans ce contexte, Singh et al. (1991) ont montré que les graines de nombreuses espèces d'acacia utilisées en Inde ne germent pas dès que le potentiel hydrique atteint -9 ou -12 bars. La germination d'A. tortilis et d'Acacia karroo Hayne est nulle pour une pression de -8 bars (Choinski et al., 1991). Celles d'Atriplex vesicaria Heward et Atriplex nummularia Lindl. s'annulent lorsque la pression atteint respectivement -2 et -4 bars (Sharma, 1973). De même, selon Sy (1995) qui a travaillé sur différentes légumineuses sahéliennes, aucune graine ne germe pour un potentiel hydrique inférieur à -14,4 bars. Nos résultats ne confirment pas les valeurs obtenues par Grouzis et al. (1986) sur diverses espèces sahéliennes. Ndour et al. (1998) montrent que la germination de l'A. tortilis raddiana est possible sous de plus fortes contraintes hydriques (-21 bars) que celles mesurées pour d'autres espèces d'acacia. Cette étude a permis de constater que cette espèce d'acacia est peu exigeante en eau en phase germinative, mais ceci ne signifie pas nécessairement que les espèces tolérantes au stress hydrique au cours de la germination sont celles qui sont les plus adaptées à la sècheresse au stade adulte (Mc Ginnies, 1960).
27En effet, bien qu'elle représente l'un des facteurs importants dans l'établissement des espèces (Mc William et al., 1970 ; Boydston, 1989), la tolérance au stress hydrique au moment de la germination constitue, selon les conditions qui suivent cette première phase du cycle végétatif, soit un avantage soit un inconvénient (Grouzis, 1987). Les résultats de recherche relatifs à l'effet du stress hydrique sur la germination montrent qu'il est difficile de relier la tolérance aux contraintes hydriques, au moment de la germination, à l'écologie de l'espèce même (Le Floc'h et al., 1989). Ce résultat, également noté par Grouzis (1987) pour certaines espèces sahéliennes, permet de dire que la résistance au déficit hydrique en phase germinative n'est pas le critère prédominant de la répartition écologique des taxons. Ndour et al. (1998) affirment que l'aptitude à germer en conditions de stress hydrique ou saline n'est pas obligatoirement représentative de l'écologie de la plante adulte, rejoignant ainsi Sharma (1973) et Sy et al. (2001).
28Nos résultats permettent de supposer que d'après l'analyse de la tolérance au stress osmotique, les graines d'A. tortilis ne devraient pas avoir de grandes difficultés à germer en régions arides ou semi-arides.
29Ainsi, en conclusion, nous pouvons dire d'après notre étude, qu'à partir du moment où les graines sont libérées de leur dormance (que cela soit par traitement artificiel ou naturel), celles-ci sont capables de germer dans une vaste gamme de températures et un large éventail de stress salin et hydrique. Cependant, les mesures et techniques de restauration à entreprendre restent encore à définir par le biais d'études à long terme tenant compte de la dynamique de développement de l'espèce à partir du stock préalable de semences viables contenues dans le sol et par l'introduction de nouvelles semences, voire des plantules, pour améliorer le processus de régénération de l'espèce.
Bibliographie
Barnes M.E., 2001. Seed predation, germination and seedling establishment of Acacia erioloba in northern Botswana. J. Arid Environ., 49(3), 541-554.
Behaeghe T. & Blouard R., 1962. Amélioration des semences et sélection des plantes prairiales au Congo, au Rwanda et au Burundi. Bull. Inf. INEAC, 11(6), 307-338.
Bell D.T. & Bellairs S.M., 1992. Effects of temperature on the germination of selected Australian native species used in the rehabilitation of bauxite mining disturbance in Western Australia. Seed Sci. Technol., 20, 47-55.
Ben Dali F., 1987. Dynamique de la végétation et mobilité du sable en Jeffara tunisienne. Thèse de doctorat : Université des Sciences et Techniques du Languedoc, Montpellier (France).
Ben Miled D., Boussaid M. & Abdelkefi A., 1986. Tolérance au sel d'espèces annuelles du genre Medicago au cours de germination. In : Colloque sur les végétaux en milieu aride, 8-10 septembre 1986, Djerba, Tunisie.
Boydston R.A., 1989. Germination and emergence of longspine sandbur (Cenchrus longispinus). Weed Sci., 37, 63-67.
Carpita N., Sabularse D., Monfezinos D. & Delmer D.P., 1979. Determination of the pore size of cell walls of living plant cells. Science, 205, 1144-1147.
Cavalcante A.M.B. & Perez S.C.J.G.A., 1995. Efeitos dos estresses hidrico e salino sobre a germinaçao de sementes de Leucaena leucocephala (Lam.) de Wit. Pesq. Agropec. Bras., 30, 281-289.
Choinski J.S. & Tuohy J.M., 1991. Effect of water potential and temperature on the germination of four species of African savanna trees. Ann. Bot., 8, 227-233.
Clatworthy J.N., 1984. Recherche sur le pâturage au Zimbabwe. Recherche sur l'amélioration des pâturages en Afrique orientale et australe. In: Comptes-rendus d'un atelier tenu du 17 au 21 septembre 1984 à Harara, Zimbabwe. Ottawa : Centre de Recherche pour le Développement International (CRDI), 25-61.
Côme D., 1970. Les obstacles à la germination. Paris : Masson & Cie.
Danthu P., Roussel J., Dia M. & Sarr A., 1992. Effect of pretreatement on the germination of Acacia Senegal seeds. Seed Sci. Technol., 20, 111-117.
Danthu P., Gaye A., Roussel J. & Sarr A., 1996. Long-term conservation of seed pretreated by sulfuric acid. In: Innovations in tropical tree seed technology. Humlebaek, Denmark: Danida Forest Seed Centre, 37-44.
Danthu P., Roussel J. & Neffati M., 2003. La graine et la germination d'Acacia raddiana. In : Grouzis M. & Le Floc'h E., eds. Un arbre au désert Acacia raddiana. Paris : IRD, 265-283.
Direction Générale des Forêts, 1995. Direction du premier inventaire forestier national. Tunis : Direction Générale des Forêts.
Direction Générale des Forêts, 2005. Deuxième inventaire forestier et pastoral national. Tunis : Direction Générale des Forêts.
Direction Générale des Forêts, 2006. Projet Inventaire des forêts par télédétection. Stratégie nationale de développement forestier et pastoral. Tunis : Direction Générale des Forêts .
Ennabli N., 1995. L'irrigation en Tunisie. Tunis : INAT-DGREF, 278-304.
Ernst W.H.O., Tolsma D.J. & Decelle J.E., 1989. Predation of seeds of Acacia tortilis by insects. Oikos, 54, 294-300.
Floret C., 1981. The effects of protection on steppic vegetation in the Mediterranean arid zone of southern Tunisia. Vegetation, 46, 117-119.
Floret C. & Pontanier R., 1982. L'aridité en Tunisie présaharienne. Travaux et documents de l'ORSTOM, n°150. Paris : ORSTOM.
Grouzis M., 1987. Structure, productivité et dynamique des systèmes écologiques sahéliens (Mare d'oursi, Burkina Faso). Thèse d'État : Université de Paris Sud, Centre d'Orsay (France).
Grouzis M., Legrand E. & Pale F., 1986. Germination des semences des régions semi-arides du Sahel. In : Actes du colloque Les végétaux en milieu aride, 8-10 septembre 1986, Djerba, Tunisie, 534-552.
Hachicha M., 2007. Les sols salés et leur mise en valeur en Tunisie. Sècheresse, 18, 45-50.
Hauser T.P., 1994. Germination, predation and dispersal of Acacia albida seeds. Oikos, 71, 421-426.
Hohl M. & Peter S., 1991. Water relations of growing maize coleoptiles. Comparison between mannitol and polyethylene glycol 6000 as external osmotica for adjusting turgor pressure. Plant Physiol., 95, 716-722.
Jordan G.L & Haferkamps M.R., 1989. Temperature responses and calculate heat units for germination of several range grasses and shrubs. J. Range Manage., 42, 41-45.
Kayani S.A., Naqvi H.H. & Ting P., 1990. Salinity effects on germination and mobilisation of reserves in jojoba seeds. Crop Sci., 30, 704-708.
Kennenni L. & van der Maarel E., 1990. Population ecology of Acacia tortilis in the semi-arid region of the Sudan. J. Veg. Sci., 1(3), 419-424.
Koller D., 1995. The regulation of germination in seeds (review). Bull. Res. Counc. Israel, 5D, 85-108.
Le Floc'h E., Schoenenbereger A., Nabli M.A. & Valdeyron G., 1989. Biologie et écologie des principaux taxons. In : Nabli M.A., ed. Essai de synthèse sur la végétation et la phyto-écologie tunisienne : I. Éléments de botanique et de phytoécologie. Tunis : Faculté des Sciences, 51-193.
Le Houerou H.N., 1959. Recherches écologiques et floristiques sur la végétation de la Tunisie méridionale. II : La Flore. Alger : Université d'Alger, Institut des recherches sahariennes.
Le Houerou H.N., 1969. La végétation de la Tunisie steppique avec référence au Maroc, à l'Algérie et à la Libye. Ann. INRAT, 42(5).
Loth P.E., De Boer W.F., Heitkönig I.M.A. & Prins H.H.T., 2005. Germination strategy of the East African savanna tree Acacia tortilis. J. Trop. Ecol., 21(5), 509-517.
Lu Z. & Neumann P.M., 1998. Water-stressed maize, barley and rice seedlings show species diversity in mechanisms of leaf growth inhibition. J. Exp. Bot., 49, 1945-1952.
Mc ginnies W.J., 1960. Effects of moisture stress and temperature on germination of six range grasses. Agron. J., 52, 159-162.
Mc william J.R., Clements R.J. & Dowling P.M., 1970. Some factors influencing the germination and early seedling development of pasture plants. Aust. J. Agric. Res., 21, 19-32.
Michel B.E. & Kaufman R.M., 1973. The osmotic potential of polyethylene glycol 6000. Plant. Physiol., 51, 914-916.
Ndour P., 1997. Comportement de quelques espèces du genre Acacia en condition de stress hydrique et salin simulé. DEA : Biologie végétale, Université Cheikh Anta Diop, Dakar (Sénégal).
Ndour P. & Danthu P., 1998. Effet des contraintes hydriques et salines sur la germination de quelques acacias africains. In : Campa C., Grignon C., Gueye M. & Hamon S., eds. Colloques et séminaires : l'acacia au Sénégal. Paris : Orstom, 105-122.
Neffati M., 1994. Caractérisation morpho-biologique de certaines espèces végétales nord africaines : implication pour l'amélioration pastorale. Thèse de doctorat : Université de Gand (Belgique).
Neffati M. & Akrimi M., 1997. Études des caractéristiques germinatives des semences de quelques légumineuses spontanées de la Tunisie steppique. Rev. Rég. Arides, NS, 272-287.
Novikoff G., 1983. Essais de lutte contre l'érosion éolienne dans les parcours à Rhanterium suaveolens de la Jeffara et leur application. In : Actes du séminaire Institut des Régions Arides (I.R.A.)/UNESCO sur les problèmes de l'érosion éolienne dans les zones pré-désertiques, 21-26 novembre 1983, Djerba, Tunisie, 105-111.
PNUD-FAO, 1979. Recherche et développement des parcours du centre-sud tunisien. Synthèse des travaux réalisés au cours du projet et recommandation. Rapport technique. Rome: PNUD-FAO.
Roussel J., 1984. Germination des semences forestières : utilisation de l'acide sulfurique en traitement des principales espèces sahéliennes, soudano-sahéliennes et exotiques. Fiche technique n°3. Dakar : Centre national de recherches forestières.
Roussel J., 1995. Pépinières et plantations forestières en Afrique tropicale sèche. Dakar : ISRA-Cirad.
Sharma M.L., 1973. Simulation of drought and its effect on germination of five pasture species. Agron. J., 65, 982-987.
Singh C., Khajuria H.N., Singh A. & Sharma F., 1991. Acacias for arid regions. Acta Bot. Indica, 19, 29-32.
Skoglund J., 1992. The role of seed banks in vegetation dynamics and restoration of dry tropical ecosystems. J. Veg. Sci., 3(3), 357-360.
Smaoui A. & Chérif A., 1986. Effet de la salinité sur la germination des graines de cotonnier. In : Colloque sur les végétaux en milieux arides, 8-10 septembre 1986, Djerba, Tunisie.
Sy A., 1995. Étude de trente quatre légumineuses herbacées du Sénégal : germination des graines et caractérisation de leurs micro-organismes symbiotiques. DEA : Biologie végétale, Université Cheikh Anta Diop, Dakar (Sénégal).
Sy A., Grouzis M. & Danthu P., 2001. Seed germination of seven Sahelian leguminous species. J. Arid Environ., 49, 875-882.
Teketay D., 1996. Germination ecology of twelve indigenous and eight exotic multipurpose leguminous species from Ethiopia. Forest Ecol. Manage., 80, 209-223.
Totey N.G. et al., 1987. Afforestation of salt affected wasteland. Screening of forest tree species of Madhya Pradesh for salt tolerance. Indian Forester, 113, 805-815.
Ungar I.A., 1995. Seed germination and seed-bank ecology of halophytes. In: Kigel J. & Galili G., eds. Seed development and germination. New York, USA: Marcel & Dekker Inc.
Verslues P.E., Ober E.S. & Sharp R.E., 1998. Root growth and oxygen relations at low water potentials. Impact of oxygen availability in polyethylene glycol solutions. Plant Physiol., 116, 1403-1412.
Vora R.S., 1989. Seed germination characteristics of selected native plants of the Low Rio Grande Valley, Texas. J. Range Manage., 42(1), 36-40.
Ward D. & Rohner C., 1997. Anthropogenic causes of high mortality and low recruitment in three Acacia tree species in the Negev desert, Israel. Biodivers. Conserv., 6, 877-893.
Wiegand K., Jeltsch F. & Ward D., 1999. Analysis of the population dynamics of Acacia trees in the Negev desert, Israel with a spatially-explicit computer simulation model. Ecol. Modell., 117, 203-224.
Zaafouri M.S., 1993. Contraintes du milieu et réponses de quelques espèces arbustives exotiques introduites en Tunisie présaharienne. Thèse de doctorat : Université de Droit, d'Économie et des Sciences, Aix-Marseille (France).
Zaafouri M.S., Zouaghi M., Akrimi N. & Jedder H., 1996. La forêt steppe à Acacia tortilis ssp. raddiana var. raddiana de la Tunisie aride : dynamique et évolution. In : Séminaire international, Acquis scientifiques et perspectives pour un développement durable des zones arides, 1996, Djerba, Tunisie, 285-271.
Om dit artikel te citeren:
Over : Wahbi Jaouadi
Institut National de Recherches en Génie rural, Eaux et Forêts. Laboratoire d’Écologie et d’Amélioration sylvo-pastorale. P.B. 10. Rue Hédi Karray. TU-2080 Ariana (Tunisie).
Over : Lamia Hamrouni
Institut National de Recherches en Génie rural, Eaux et Forêts. Laboratoire d’Écologie et d’Amélioration sylvo-pastorale. P.B. 10. Rue Hédi Karray. TU-2080 Ariana (Tunisie). E-mail: hamrounilam@yahoo.fr
Over : Naoufel Souayeh
Institut Supérieur des Sciences Biologiques et Appliquées de Tunis. Rue Zouheir Essafi, 2010. TU-1007 Tunis (Tunisie).
Over : Mohamed Larbi Khouja
Institut National de Recherches en Génie rural, Eaux et Forêts. Laboratoire d’Écologie et d’Amélioration sylvo-pastorale. P.B. 10. Rue Hédi Karray. TU-2080 Ariana (Tunisie).






