- Accueil
- Volume 14 (2010)
- numéro spécial 2
- Synthèse de molécules d'intérêt biologique. Contribution à la synthèse des bastadines
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Synthèse de molécules d'intérêt biologique. Contribution à la synthèse des bastadines

Résumé
Les métabolites constituent un domaine biochimique dont l'intérêt est en constante progression. En effet, ces molécules sont biologiquement actives et utilisées dans les traitements thérapeutiques. Ce travail s'intéresse à la synthèse chimique de macromolécules à partir de métabolites synthétisés par voie enzymatique. La mise au point de cultures d'Erwinia herbicola a permis de réaliser la synthèse de métabolites : L-dopa et dopamine. Via un schéma réactionnel chimique à partir de dopamine, nous nous sommes intéressés à la synthèse des bastadines (bis-diaryléthers) en phase hétérogène. Cette famille de molécules d'origine naturelle est produite par des éponges marines et possède des propriétés anti-angiogéniques et antimicrobiennes. La synthèse chimique complète des bastadines développée à ce jour par Couladouros et al. (2005) en phase homogène nécessite beaucoup d'étapes avec un rendement global de synthèse extrêmement faible (moins de 1 %). Le travail décrit ici a pour but de mettre au point et de réaliser une partie du schéma original de synthèse de cette molécule, en phase hétérogène, à partir de la dopamine. En effet, le fragment de gauche de la bastadine peut être réalisé via une réaction de couplage en milieu basique entre la dopamine modifiée sur support solide et un sel de diaryliodonium.
Abstract
Synthesis of molecules of biological interest. Contribution to the synthesis of bastadins. The metabolites are a biochemical area whose interest is in constant progression. Indeed, these molecules are biologically active and are used in therapeutic treatments. This work focuses on the solid phase synthesis of macromolecules from metabolites synthesized by an enzyme. The development of Erwinia herbicola cultures has achieved the synthesis of metabolites: L-dopa and dopamine. From a medical point of view, these molecules have a particular interest since they act as neurotransmitters in human nerve cells. Through a chemical reaction scheme from dopamine, we are interested in solid phase synthesis of a macromolecule like bastadin (bis-diarylethers). This molecule of natural origin is produced by marine sponge, and has anti-angiogenic and antimicrobial properties. A complete scheme of chemical synthesis of bastadines was developed by Couladouros et al. (2005) in homogeneous phase, but it requires a lot of steps with an overall yield of synthesis extremely low (less than 1%). This work aims to develop and implement a part of original scheme for the synthesis of this molecule in heterogeneous phase from dopamine. Indeed the fragment left of the bastadine can be achieved via a coupling reaction in basic medium between dopamine modified on solid support and a diaryliodonium salt.
Table des matières
1. Introduction
1Les métabolites constituent un domaine biochimique dont l'intérêt est en constante progression. En effet, ces molécules sont biologiquement actives et sont utilisées dans les traitements thérapeutiques. Ce travail s'intéresse à la synthèse chimique de macromolécules à partir de métabolites synthétisés par voie enzymatique, les bastadines.
2L'intérêt croissant pour les molécules de bastadine réside dans le fait que, outre des activités anti-angiogéniques et antimicrobiennes (toxicité pour les micro-organismes gram+), ces molécules peuvent résoudre certains problèmes intervenant dans la contraction musculaire (Kazlauskas et al., 1981 ; Pordesimo et al., 1990 ; Mack et al., 1994 ; Franklin et al., 1996).
3Ces composés naturels sont isolés d'éponges marines, principalement issus de Ianthella basta de la famille Verongida, située dans l'Océan Indien et Pacifique, dans des zones proches des sites riches en corail.
4Elles présentent toutes un squelette organique typique (Figure 1) : ce sont des bis-diaryléthers macrocycliques constitués par l'assemblage de deux fragments (gauche et droit) constitués de dopamine modifiée et de tyrosines hautement bromées.
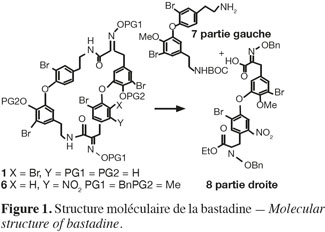
5La présence de deux liens amides et de deux liens diaryléthers confère à cette molécule une « bonne » stabilité face à la dégradation chimique. Les différents types de bastadines (e.a. Couladouros et al., 2005) sont fonction du degré de bromation, de leur position et de la présence ou non d'une double liaison.
6À l'heure actuelle, la plupart des voies de synthèse en phase homogène comportent un grand nombre d'étapes (de 4 à plus de 30), ce qui a pour conséquence de limiter le rendement global à quelques pourcents (e.a. Couladouros et al., 2005). La production en phase solide permettrait d'augmenter ce rendement global de par la simplification des étapes de purification (récupération du produit par simple filtration). Cependant, une étude complète doit être faite sur le type de résine, les conditions d'accrochage, de décrochage ainsi que de la stabilité du lien résine-molécule dans les différents milieux réactionnels.
2. Matériel et méthodes
7Trifluoromethane-sulfonic acid (TfOH), CHF3O3S, pureté : 99 %, de chez Acros organics. 3-chloroperbenzoic acid (mCPBA), tech. Ca, pureté : 70-75 % de chez Alfa Aesar. Allyl chloroformate C4H5ClO2, pureté : 97 % de chez Fluka. Merck. Iodobenzène, p. synthèse, 99 %, Merck, Benzène, p.a. Acros, dimethylsulfate, p. synthèse, Merck, résine : 2-Chlorotrityl (100-300 mesh, 1,9 mmol Cl.g-1), Chemika.
8Les solvants pour HPLC : eau/acétronitrile ont une qualité pour HPLC (far UV). Solvant pour la synthèse : Acétonitrile, extra dry, sur tamis moléculaire, de chez Acros Organic, Acétone, p.a. 99,8 %, de chez Merck, Diethyl ether, p.a. 99,5 % Riedel de Haën, Dichlorométhane, p.a. 99,8 % sur tamis moléculaire.
2.1. Matériel
9Les mesures de spectrophotométrie ont été réalisées avec un Shimadzu UV mini 1240.
10Les mesures d'infrarouge ont été réalisées sur un FTIR-8400 S, Shimadzu avec le logiciel : IRsolution.
11Les chromatogrammes des composés ont été réalisés sur HPLC : Waters 2695 XE, Separations Module – Alliance avec un injecteur automatique, un détecteur Waters 996 à barrettes de diodes (PDA : 190-800 nm, lampe à arc au deutérium, résolution spectrale : 1,2 nm par photodiode sur un total de 512 diodes, précision en longueur d'onde : 1 nm), un logiciel d'acquisition et de traitement des données : Empower II.
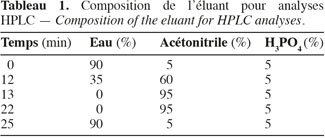
12Les colonnes utilisées pour la quantification sont : μ-Bondapak© C18 10 μm (3,9 x 150 mm), Symmetry Columns© C18 5 μm (3,9 x 150 mm) de chez Waters, en mode gradient H2O/CH3CN/ H3PO4 (0.3 M) (Tableau 1) et pour la pureté optique : Chiralcel OD-RH© (250 mm x 4,6 mm x 10 µm), provenant de chez Daicel, en mode isochratique : H2O/CH3CN (60 : 40 v/v).
13Les mesures en RMN 1H et 13C ont été réalisées à l'Université de Mons dans le Service de Chimie organique sur un Bruker Avance 500 (aimant de 11,75 T et sonde de spectroscopie haute résolution thermostatisable de 5 mm, 500 MHz, MeOD, pureté : 99,7 %).
2.2. Méthodes
14La bioproduction de la L-dopa requiert trois phases, explicitées ci-dessous.
15– Phase 1 : la pré-culture du micro-organisme, Erwinia herbicola, ATCC 21434, Enterobacter agglomerans. Il est cultivé en boite de Petri contenant un milieu gélosé (5 g.l-1 d'extrait de levure et 10 g.l-1 de peptone).
16Une petite quantité de micro-organismes est prélevée stérilement de la boite de Petri et est introduite dans un tube à essai contenant 10 ml de milieu de culture (composition identique à celui des boites de Petri, excepté l'ajout de gélose).
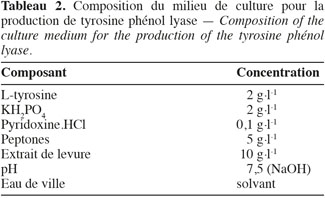
17– Phase 2 : enrichissement cellulaire. Dix ml de la solution de la première phase sont introduits dans 100 ml de milieu d'enrichissement cellulaire (Tableau 2), le tout placé à 30 °C sur une table à mouvement elliptique pendant 24 h.
18– Phase 3 : production de L-dopa. La biomasse humide est récupérée par centrifugation (6 000 t.min-1, 20 min) de la solution (phase 2) et est remise en suspension avec une solution tampon (pH 8), puis transférée dans le milieu de production (pyruvate de sodium 25 g.l-1 et chlorure d'ammonium 50 g.l-1). Un ajout de HCl permet de stopper la culture.
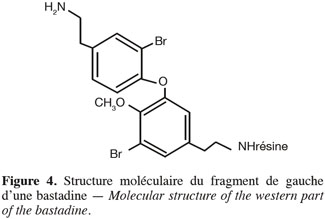
19Protocole de synthèse du diphenyliodonium triflate. Ajouter le mCPBA (0,26 mmol) et l'iodobenzène (0,23 mmol) dissous dans 1 ml de CH2Cl2, dans une fiole fermée. Ajouter ensuite le benzène (0,26 mmol) et refroidir la solution à 0 °C. Addition gouttes à gouttes de TfOH (40-60 µl, 0,46-0,69 mmol). Agiter le mélange à température ambiante pendant 22 h. Évaporer le solvant sous flux d'azote. Ajouter 1 ml de diéthyl éther et mélanger la solution à température ambiante. Mettre au congélateur pendant au moins 30 min avant de filtrer le solide. Laver le solide avec du diéthyl éther et le sécher dans un dessiccateur sur silicagel.
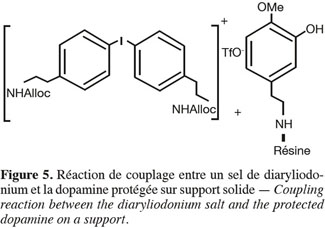
20Protocole de synthèse du bromure de diphenyliodonium. Mélanger pendant 24 h à température ambiante : 25 ml H2SO4 (98 %), 2 g de I2 en poudre, 6 g de I2O5. Refroidir au bain de glace et ajouter 100 ml d'acide acétique glacial sans dépasser 20 °C. Retirer du bain et poursuivre l'agitation pendant 15 min à température ambiante. Laisser reposer 1 h et séparer la liqueur surnageante par décantation. Reprendre l'agitation en ajoutant 100 ml d'acide acétique glacial. Ajouter la phényl-2-éthylamine (0,083 mol) protégée à température ambiante. Agiter pendant 2 h à température ambiante. Filtrer la solution pour éliminer le précipité insoluble et ajouter 6 g de NaBr dans 120 ml d'eau distillée et déminéralisée. Agiter pendant 1 h à température ambiante, ce qui permet la précipitation du sel (+ mettre au congélateur pour assurer la précipitation complète). Filtrer les cristaux et laver avec acide acétique glacial puis 20 ml eau. Les cristaux sont séchés dans un dessiccateur sur silicagel.
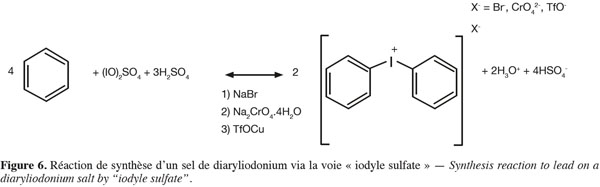
21Protection de synthèse de la phényl-2-éthylamine/ 2-(4-chlorophenyl)éthylamine/ tyramine. Ajouter 1,957 mmol de phényl-2-éthylamine ou 2-(4-chlorophenyl)éthylamine ou tyramine, dans de l'acétone (20 ml). Ajouter ensuite au mélange 0,364 g de carbonate de potassium et l'allylchloroformate (0,27 ml). Agiter le tout pendant 48 h à température ambiante, le précipité se forme et est récupéré par filtration sous vide.
22Méthylation de la dopamine. Peser 0,0025 mol de dopamine (383 mg), y ajouter 300 µl éthanol et 0,5 ml de NaOH 2N (NaOH/éthanol : 5/3 en volume). Refroidir la solution aux environs de 5 °C. Ajouter goutte à goutte le diméthylsulfate 0,25 ml (0,0026 M). Mettre dans un vial de 4 ml fermé à reflux sur une plaque chauffante pendant 2 h à 80 °C. Évaporer le solvant avec un flux d'azote sec. Reprendre le résidu avec 1 ml diethylether. Placer le vial au frigo afin d'améliorer la précipitation. Filtrer sur Büchner. Laver le précipité avec du diethylether anhydre.
23Accrochage de la dopamine protégée sur la résine. La résine 2-chlorotrityl est gonflée au dichlorométhane sec. Placer la dopamine méthylée (2-4 eq.) dans tétrahydrofurane THF (10 ml par gramme de résine). Dans un réacteur, placer la dopamine en contact avec la résine (rapport DCM/DMF : 1/3). Agiter pendant 6 h. Filtrer la résine. Lavage de la résine 3 fois avec un mélange DCM/MeOH/DIEA (17 :2 :1), 3 fois au DCM, 3 fois au méthanol. Sécher la résine sous vide (KOH).
3. Résultats et discussion
24Les recherches réalisées antérieurement dans le Service de Chimie et Biochimie appliquées de l'Université de Mons (Hantson et al., 2007) ont démontré la possibilité de réaliser la synthèse organique du motif de la structure diaryléther grâce à un couplage entre un sel de diaryliodonium et des structures dérivées des dérivés du phénol (type tyrosine et DIT). Dans le cas de la 3,5- diiotyrosine, la présence des atomes d'iode sur le noyau aromatique accroissait le rendement de la réaction.
25De plus, le sel de diaryliodonium forme un lien diaryléther avec cette entité moléculaire dans une structure de type para et non ortho, comme rencontré dans les bastadines. Cette configuration spatiale plus encombrée de l'iodonium et l'absence d'halogènes sur le noyau aromatique, montrent que l'adaptation n'est pas immédiate. Toutefois, il apparait que la philosophie de synthèse serait positive au développement des bastadines.
26Nous avons donc décidé de montrer la possibilité de synthétiser une partie du squelette des bastadines sur phase solide, notamment à partir de dopamine, avec comme base de référence les synthèses à partir de tyrosine. La biosynthèse de la L-dopa, comme précurseur de synthèse des bastadines, a été étudiée et réalisée.
27L'intérêt de ce travail est de réaliser cette étude de synthèse en phase hétérogène, dans le but de faciliter la séparation des intermédiaires de réaction par rapport à une synthèse homogène. De plus, les composés n'ayant pas réagi avec le support peuvent être recyclés, ce qui laisse entrevoir des possibilités de fonctionnement automatique et continu de la production industrielle à petite ou moyenne échelle. Enfin, la possibilité de limiter le nombre d'étapes de réaction, de manière à augmenter le rendement, est une qualité de la synthèse sur phase solide.
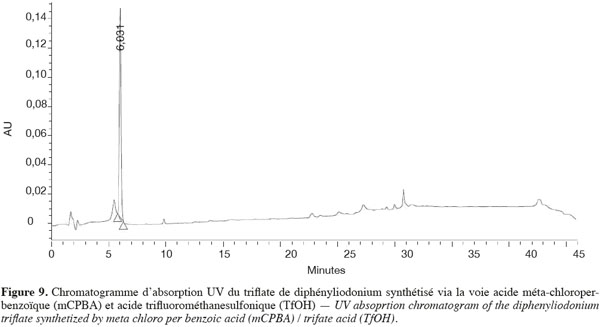
3.1. Production enzymatique de la L-dopa
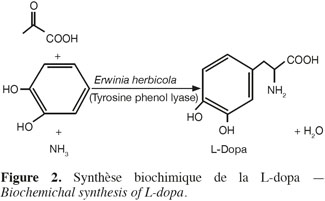
28Il a été établi (Kumagai et al., 1970 ; Yamada et al., 1972) que pour synthétiser la L-dopa par voie biologique à partir de cathécol (Figure 2), il est nécessaire d'utiliser une enzyme : la tyrosine phénol lyase (TPL). Le choix d'une voie de production biologique s'explique par le besoin d'obtenir une forme stéréospécifique de la L-dopa.
29La mise au point de cultures d'Erwinia herbicola a permis de réaliser la synthèse de métabolites : L-dopa et dopamine.
30Afin d'évaluer le temps optimum de culture pour l'obtention d'une biomasse riche en enzyme TPL optimale, une courbe de croissance relative à l'enrichissement cellulaire en enzyme a été réalisée. Plusieurs sets de production ont été stoppés après un temps différent, la biomasse humide (masse des micro-organismes et des enzymes encapsulées) est alors récupérée et pesée. Lorsque le poids de celle-ci ne varie plus entre deux pesées, les cultures peuvent être considérées comme ayant atteint la phase stationnaire et elles sont stoppées. Les résultats (Figure 3), ainsi que des mesures de densité optique par spectrophotométrie (565 nm), permettent de conclure que les cultures atteignent la phase stationnaire approximativement après 20 h de culture d'enrichissement et donnent un poids de 1,2 g ± 0,2 g de biomasse humide.
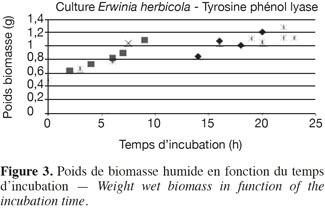
31Quelques facteurs ont, ensuite, été étudiés afin d'optimiser le fonctionnement de l'enzyme pour la production de L-tyrosine, tels que : en l'absence de pyridoxal phosphate (co-enzyme : PLP), l'enzyme ne présente aucune activité, la présence d'ions K+ et NH4+ permet d'obtenir une activité maximale de l'enzyme et des concentrations élevées de catéchol désactivent l'enzyme.
32Pour la production de la L-dopa, le milieu optimisé (Tableau 3) a été incubé pendant 24 h. Une acidification (HCl 2N, pH = 2,5) a ensuite permis de solubiliser la L-dopa (1,65 g.l-1 Merck) et de stopper l'activité biologique de la souche E. herbicola.

33La productivité de la synthèse enzymatique ainsi que la stéréospécificité ont été calculées et vérifiées via des analyses en HPLC. Les résultats obtenus ont montré que la concentration inhibitrice en catéchol pour l'enzyme TPL est de l'ordre de 10 g.l-1 avec une productivité moyenne d'environ 0,02 g de L-dopa/ (h.g de biomasse humide). Les analyses de pureté optique (HPLC chirale) ont démontré la présence d'un seul composé, la L-dopa, la stéréospécificité de la réaction a ainsi pu être démontrée. La L-dopa obtenue est engagée dans la suite de la synthèse.
3.2. Synthèse du fragment gauche de la bastadine
34La rétrosynthèse en phase hétérogène de la structure de gauche (Figure 4) de la bastadine à partir de L-dopa ou dopamine comprend plusieurs étapes qui sont dans l'ordre chronologique de synthèse : la protection de différentes fonctions chimiques (hydroxyle, amine), l'accrochage sur un support solide, la déprotection sélective d'une fonction hydroxyle, le couplage avec formation d'un lien diaryléther, la bromation de la molécule, la déprotection de différentes fonctions chimiques, le clivage entre le produit et le support solide. Le fait d'effectuer la bromation de la molécule après la formation du lien diaryléther permet de simplifier la structure de l'agent de couplage.
35La mise en œuvre de la réaction en phase hétérogène permettant le lien diaryléther a été étudiée, via le couplage avec un sel de diaryliodonium (agent de couplage) (Figure 5) et la dopamine modifiée sur support solide (résine Bromo Wang, Chlorotrityl, etc.). L'originalité et la difficulté de cette synthèse étant de rester en phase solide afin de diminuer les étapes de purification.
36Synthèse de l'agent de couplage. La réaction générale de synthèse d'un sel de diaryliodonium peut s'effectuer via deux voies différentes. Soit via la formation d'un iodyl suflate (Figure 6), soit via une voie oxydative avec de l'acide méthylchloroperbenzoique mCPBA en présence d'acide triflique TfOH (Bielawski et al., 2007 ; Marshall et al., 1959) (Figure 7).
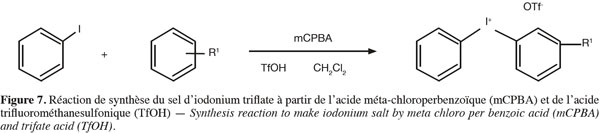
37Cette dernière réaction a l'avantage de permettre la synthèse d'un sel asymétrique suivant les groupements ajoutés au benzène, assez rapidement et facilement. Cependant l'ajout de groupement, nécessaire pour obtenir la structure de l'agent de couplage voulue, abaisse nettement le rendement de réaction et doit donc étre étudié.
38Lors des essais, des molécules ayant un ou plusieurs groupements fonctionnels (hydroxyle, amine) ont été utilisées. La protection des groupements a été effectuée via l'ajout d'allylchloroformate (Kumagai et al., 1970) : protection dite « alloc ». Les essais de protection ont été réalisés à partir de la 2-(4-chlorophenyl)éthylamine, molécule possédant une fonction amine, ainsi que la phényl-2-éthylamine. Le rendement de protection est de 80 %. La protection de la fonction amine a été mise en évidence grâce à un test colorimétrique (test Chloranil©).
39L'influence, sur la formation de l'agent de couplage, de l'ajout de groupement fonctionnel sur le benzène a été démontrée en utilisant successivement l'anisole, p-anisaldéhyde et le benzaldéhyde comme réactifs de départ. Le rendement de réaction est assez élevé à partir du benzène, mais diminue lorsque des groupements fonctionnels sont introduits sur la molécule (Tableau 4). Le faible rendement sur la benzaldéhyde pourrait s'expliquer par une réaction de réarrangement conduisant à la formation d'un ester et non de la structure voulue.

40Caractérisation de l'agent de couplage. Différentes techniques ont permis de confirmer et de calculer le rendement en sel synthétisé dans le précipité obtenu lors de la réaction.
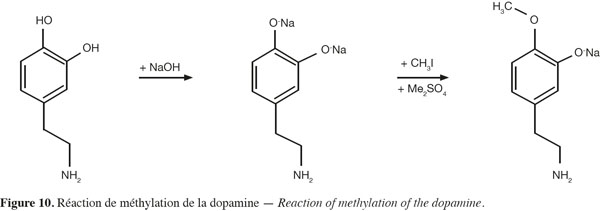
41Analyses par infrarouge : l'analyse par infrarouge (IR), en phase solide (pastilles de KBr), a été utilisée. En phase liquide, la concentration en sel synthétisé est trop faible et seul le spectre du solvant (méthanol) est observé.
42Le tableau 5 reprend les conditions réactionnelles de synthèse du triflate de diaryliodonium.

43La comparaison des spectres IR des sels synthétisés (Figure 8), du sel acheté commercialement et des réactifs utilisés démontrent que la structure synthétisée est similaire à celle du triflate de diaryliodonium voulu. Un large pic observé vers 1 200 cm-1 correspond à la bande de vibration du triflate (TfO-). Les spectres des deux sels de diphényliodonium triflate et bromide synthétisés via l'iodyle sulfate ont également été comparés aux spectres précédents, mais ne sont pas ressemblants. La voie de synthèse via l'iodyle sulfate n'est pas concluante.
44Analyses HPLC. Les sels de diphényliodonium triflate synthétisés par la voie « mCPBA/TfOH » et les sels triflate et bromure synthétisés par la voie « iodyle sulfate » ont été analysés par HPLC. La synthèse par mCPBA est celle qui a conduit à un chromatogramme peu chargé. En effet, un seul pic à 5,966 min correspondant à l'agent de couplage a été décelé, ceci a été confirmé par le spectre d'absorption UV (Figure 9).
45Pour confirmer la structure du sel obtenu d'une façon complète, une autre technique d'analyse a été exploitée, la résonnance magnétique nucléaire.
46Analyses par résonnance magnétique nucléaire 1H et 13C. Les molécules analysées sont les sels de diaryliodonium obtenus à partir de la p-anisaldéhyde via la voie « iodyle sulfate » et la molécule de 2-(4 chlorophenyl)éthylamine protégée.
47Pour les sels de diaryliodonium synthétisés à partir de la p-anisaldéhyde, les spectres de RMN du proton obtenus sont très chargés et difficilement interprétables. En effet, les nombreux pics obtenus sous-entendent que la synthèse mise en œuvre via l'iodyle sulfate n'a pas conduit à un produit pur.
48Les spectres indiquent la présence de plusieurs pics vers 7-8 ppm justifiant la présence des protons aromatiques mais aucun pic n'est visible dans la zone où on devrait identifier les protons aldéhydiques (vers 9-10 ppm) des sels synthétisés à partir de p-anisaldéhyde. La synthèse de ce sel de diaryliodonium via l'iodyle sulfate n'a donc pas abouti aux structures voulues.
49Pour la molécule de 2-(4 chlorophenyl)éthylamine protégée, les zones où l'on retrouve les signaux RMN semblent correctes. Cependant, la complexité de la molécule au niveau de sa symétrie et de la position des molécules rend l'analyse détaillée du spectre difficile.
50Pour les sels de diaryliodonium synthétisés à partir du benzène, les spectres des triflates de diphenyliodonium synthétisés via la voie mCPBA/TfOH sont tous identiques au spectre du sel pur, ceci confirme donc que la structure synthétisée correspond à celle attendue. Les spectres RMN, des sels de diphényliodonium (triflate et bromure) synthétisés via l'iodyle sulfate n'indiquent aucun signal, à part celui des protons du méthanol et de l'eau.
51Toutes ces analyses nous permettent de conclure que la synthèse du triflate de diaryliodonium via la réaction d'oxydation de l'iodobenzène avec l'acide méta-perchlorobenzoïque, donne de bons rendements (45 %) et une bonne pureté (95 %). Une série d'expériences a ensuite été menée afin d'étudier l'influence sur le rendement des différents paramètres réactionnels (température, temps de réaction, concentration en oxydant ainsi que la concentration en acide).
52Optimisation des conditions réactionnelles de formation de l'agent de couplage. Les conditions réactionnelles, relatives à la synthèse de l'agent de couplage, ont été optimisées en partant de la réaction du benzène et de l'iodobenzène avec comme oxydant, le mCPBA et comme acide, l'acide triflique.
53Les résultats (Tableau 6) des différentes synthèses effectuées ont permis de conclure ce qui suit :
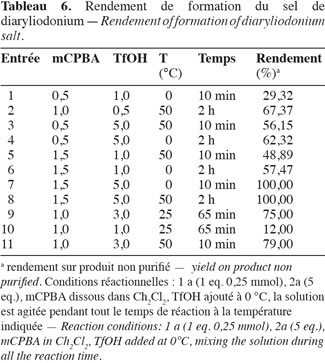
54– Lorsque les réactifs sont introduits en quantités stœchiométriques, la réaction est lente et le rendement très faible (Tableau 6, entrée 10). Les produits de la réaction ne présentent aucune trace d'iodobenzène, le processus d'oxydation est donc efficace mais la substitution aromatique électrophile inefficace. Dès lors, la quantité d'acide triflique (TfOH) a donc été augmentée et le rendement a fortement augmenté.
55– L'augmentation de la quantité d'acide méta-chloroperbenzoïque (mCPBA) entraine une hausse du rendement de la réaction (Tableau 6, entrée 6) mais faussée du fait d'une augmentation du poids du précipité par la quantité d'oxydant n'ayant pas réagi.
56– L'accroissement de la température permet de diminuer le temps de réaction et donne un sel de diaryliodonium avec un bon rendement après 10 min à 50 °C (Tableau 6, entrée 11).
57Les conditions réactionnelles optimales retenues pour les synthèses sont : 3 eq. TfOH, 1 eq. mCPBA, une agitation pendant 10 min à 50 °C.
58Méthylation sélective de la dopamine. Une deuxième phase importante et originale de cette synthèse est la protection sélective de la dopamine et l'accrochage de celle-ci sur une résine afin d'optimiser le rendement final d'obtention de la macromolécule et de simplifier les étapes de purification.
59La dopamine a été protégée sélectivement via une réaction de méthylation au diméthylsulfate (Greene et al., 1999) (Figure 10). La cinétique de réaction a été suivie, en chromatographie liquide, afin de n'obtenir qu'une mono-méthylation. Ce suivi a été réalisé en différenciant les molécules par leur spectre d'absorption (absorbance plus forte à 270 nm lorsque la méthylation se déroule). Cependant, un mélange de 3-methoxytyramine et de 4-orthomethyldopamine est obtenu (50 : 50), ce qui nécessite une séparation par chromatographie flash sur colonne de silice. Le rendement obtenu est de 40 %.
60Dans le but d'accrocher la molécule uniquement sur la fonction amine avec un bon rendement, la deuxième fonction hydroxyle a été protégée mais par un groupement facilement décrochable (sans décrochage de la résine), en vue de réaliser le couplage avec le sel de diaryliodonium en phase hétérogène (Figure 11).
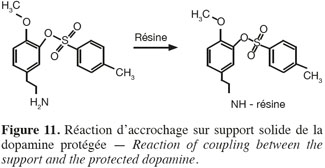
61La résine utilisée est la 2-chlorotrityl et le groupement protecteur est le chlorure de toysilate (Greene et al., 1999) (CH2Cl2, Et3N, 25 °C, 1 h). Cette résine permet d'obtenir d'excellents rendements d'accrochage (80 %), elle est acido-labile, ce qui nous permet de travailler en milieu basique. Elle doit cependant être conservée à l'abri de l'humidité (hydrolyse possible).
3.3. Formation du lien diaryléther en phase hétérogène
62La formation du lien diaryléther est réalisée entre l'agent de couplage synthétisé, le sel de diaryliodonium et la dopamine modifiée accrochée sur la résine 2-chlorotrityl. Cette réaction a pour le moment été testée en phase homogène. Le produit de synthèse a été caractérisé par IR, HPLC, RMN. Ces analyses ont confirmé la structure de la molécule attendue (Figure 4).
4. Conclusion
63Ce travail a permis de démontrer la faisabilité de la synthèse, dans un premier temps, en phase homogène, du fragment de gauche de la bastadine. La synthèse de l'agent de couplage a été réalisée via une voie oxydative utilisant l'acide méta-chloroperbenzoïque avec une bonne sélectivité et un rendement de 40 %. La dopamine, protégée sélectivement, a été accrochée en phase solide sur la 2-chlorotrityl. La poursuite de ce travail, dans un futur proche, permettra de réaliser le lien diaryléther et donc le fragment de gauche, en phase hétérogène, permettant ainsi de réduire le nombre d'étapes de purification et d'augmenter le rendement de production.
64Abréviations
65Alloc : allyloxycarbonyl
66BromoWang : (4-bromométhyl)phénoxyméthyl polystyrène
67DCM : dichlorométhane
68DIT : 3,5-diiodotyrosine
69HPLC : chromatographie haute pression en phase liquide
70IR : Infrarouge
71mCPBA : acide méta-chloroperbenzoïque
72RMN : résonnance magnétique nucléaire
73SPOS : Solid Phase Organic Synthesis
74TfOH : acide trifluorométhanesulfonique
75Tyr : tyrosine
76Wang : (4-hydroxyméthyl)phénoxyméthyl polystyrène
Bibliographie
Bielawski M. & Olofsson B., 2007. High-yielding one-pot synthesis of diaryliodonium triflates from arenes and iodine or aryl iodides. Chem. Comm., 24, 2521-2523.
Couladouros E.A. & Moustos V.I., 2005. A general method for the synthesis of bastaranes and isobastaranes : 1st total synthesis of bastadins 5,10,12,16,20 and 21. Chem. Eur. J., 11, 406-421.
Franklin M.A. et al., 1996. Bastadin 20 and bastadin O-sulfate esters from Ianthella basta: novel modulators of the Ry1R FKBP12 receptor complex. J. Nat. Prod., 59, 1121-1127.
Greene T.W. & Wuts P.G.M., 1999. Protection for phenols and catechols. In: Protective groups in organic synthesis. 3rd ed. New York, NY, USA: John Wiley & Sons, 249.
Hantson A.L., Guérit N. & De Meyer M., 2007. Use of stable isotope labelled thyroid hormones for metabolic study and GC-MS quantification. J. Labelled Compd. Radiopharm., 50, 5-6, 580-582.
Kazlauskas R. et al., 1981. Brominated tyrosine-derived metabolites from the sponge Ianthella basta. Aust. J. Chem., 34, 765-786.
Kumagai H. et al., 1970. Tyrosine phenol lyase I. Purification, crystallization, and properties. J. Biol. Chem., 245, 1773-1777.
Mack M.M., Molinski T.F., Buck E.D. & Pessah I.N., 1994. Novel modulators of skeletal muscle FKBP12/calcium channel complex from Ianthella basta. Role of FKBP12 in channel gating. J. Biol. Chem., 269, 23236-23249.
Marshall Beringer F. et al., 1959. Diaryliodonium salts. IX. The synthesis of substituted diphenyliodonium salts. J. Am. Chem. Soc., 81(2), 342-351.
Pordesimo E.O. & Schmitz F., 1990. New bastadins from the sponge Ianthella basta. J. Org. Chem., 55, 4704-4709.
Yamada H. et al., 1972. Synthesis of L-tyrosine from pyruvate, ammonia and phenol by crystalline tyrosine phenol lyase. Biochem. Biophys. Res. Commun., 46, 370-374.
Pour citer cet article
A propos de : Christelle Decamps
Univ. Mons (UMONS). Service de Biochimie et Chimie appliquées. Rue de l'Épargne, 56. B-7000 Mons (Belgique). E-mail : Christelle.decamps@umons.ac.be
A propos de : Anne-Lise Hantson
Univ. Mons (UMONS). Service de Biochimie et Chimie appliquées. Rue de l'Épargne, 56. B-7000 Mons (Belgique).
A propos de : Liza Niemirowski
Univ. Mons (UMONS). Service de Biochimie et Chimie appliquées. Rue de l'Épargne, 56. B-7000 Mons (Belgique).
A propos de : Émilie Capiau
Univ. Mons (UMONS). Service de Biochimie et Chimie appliquées. Rue de l'Épargne, 56. B-7000 Mons (Belgique).
A propos de : Michel De Meyer
Univ. Mons (UMONS). Service de Biochimie et Chimie appliquées. Rue de l'Épargne, 56. B-7000 Mons (Belgique).






