- Home
- Volume 14 (2010)
- numéro 1
- Étude des potentialités de la vision artificielle pour la reconnaissance optique des semences immatures de chicorée industrielle (Cichorium intybus L.)
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Étude des potentialités de la vision artificielle pour la reconnaissance optique des semences immatures de chicorée industrielle (Cichorium intybus L.)

Editor's Notes
Reçu le 17 février 2009, accepté le 3 août 2009
Résumé
La production commerciale de semences de chicorée industrielle (Cichorium intybus L.) implique l'élimination des semences (cypsèles) non viables de la récolte à l'aide de méthodes non destructives. Dans ce cadre, deux techniques basées sur la vision artificielle sont étudiées pour reconnaitre les semences non viables : la vision en couleur et l'imagerie fluorescente. L'analyse de 1 500 semences de la variété 'Nausica' en vision en couleur ne permet de détecter que les semences dessèchées ou non développées. Ceci est attribué à la très grande variabilité de la couleur, de la forme et de la texture des semences testées. L'imagerie fluorescente est alors envisagée, en vue d'analyser sur les différentes parties des semences (le péricarpe, la zone d'émergence de l'apex radiculaire et le pappus) la répartition de la chlorophylle qui est un indicateur de la maturité des semences. La faible teneur en chlorophylle et la grande quantité de semences à trier imposent d'utiliser un dispositif de mesure très sensible. Un dispositif d'imagerie de la fluorescence chlorophyllienne de semences est ainsi proposé. Sa particularité consiste à pouvoir modifier le spectre de la source lumineuse (dans le but d'optimiser la sensibilité) et à enregistrer l'évolution de la répartition de la fluorescence en fonction du temps. Le dispositif fournit des images de la répartition de la fluorescence chlorophyllienne sur les cypsèles de chicorée. Il pourrait permettre de réaliser des mesures à plus grande échelle, reliant les attributs de fluorescence avec le pouvoir germinatif et l'état de maturité des semences.
Abstract
Study of the potentialities of machine vision used for optical selection of immature seeds of industrial chicory (Cichorium intybus L.). The commercial production of industrial chicory seeds (cypselae) includes the postharvest elimination of non-viable seeds by non-destructive tools. For this purpose, two machine vision methods are described for the detection of non-viable seeds: color vision and fluorescence imaging. The analysis of color images of 1,500 seeds of the 'Nausica' variety allows only the recognition of desiccated and undeveloped seeds. This is caused by the large variability of seed color, shape and texture. Fluorescence imaging is set up in order to analyze the repartition of chlorophyll fluorescence, a marker of seed maturity, on different areas of the seed (pericarp, radicle tip and pappus). A very sensitive system is needed due to the low chlorophyll content and the large amount of seeds to be sorted. A fluorescence imaging system is proposed. Its distinctive feature is the possibility to modify the spectrum of the light source (in order to optimize the sensibility of the machine vision system) and to record the evolution of fluorescence repartition with time. The system is functional and delivers images of fluorescence repartition within external cypsela tissues. It could allow to analyze the fluorescence of a large sample of seeds to correlate fluorescence features to germinability and maturity.
Table of content
1. Introduction
1Les semences qui ne germent pas au champ sont responsables d'une perte directe de revenu pour l'agriculteur. Il existe des exigences légales définissant la qualité des semences commercialisées de légumes et de chicorée industrielle (Directive 2002/55/CE ; Directive 2006/124/CE ; Moniteur belge, 2006). En Région wallonne, la faculté germinative minimale des semences de chicorée industrielle (Cichorium intybus L.) est de 80 % des semences pures ; la pureté minimale spécifique est de 97 % et la teneur maximale en graines d'autres espèces de plantes est de 1 %. Les producteurs de semences peuvent avoir des exigences dépassant ces prescriptions légales.
2Actuellement, le tri des semences de chicorée est réalisé mécaniquement en fonction de leurs dimensions et de leurs densités. Le tri selon les dimensions est réalisé à l'aide de tamis vibrants et d'un trieur alvéolaire (Commeau et al., 1996). La densité est estimée au moyen de tables densimétriques qui font vibrer les semences ; celles-ci sont triées sous l'effet combiné de la force de gravité et de la résistance de l'air. À coefficient de trainée équivalent, ces tables permettent de classer les semences en différents lots en fonction de leur masse et d'éliminer des semences trop légères, qui ont une probabilité élevée d'être des akènes vides issues de fleurs non pollinisées.
3Après le tri, des échantillons appartenant aux différents lots de semences font l'objet de tests de germination effectués selon les normes de l'ISTA (International Seed Testing Association). Les semences sont mises en culture pendant 14 jours dans des conditions contrôlées (20 °C, milieu saturé en eau) et sont examinées à plusieurs reprises. On dénombre d'une part les semences qui ont germé et d'autre part, les embryons aberrants et les semences non germées, pour en déduire le pourcentage de germination des lots. Ceux dont le pourcentage est trop faible doivent faire l'objet d'un nouveau tri, voire être éliminés.
4On voit que la procédure est longue et couteuse. Les lots éliminés sont une perte pour l'entreprise chargée du tri et du conditionnement des semences. Un test de germination requiert une main-d'œuvre spécialisée pour la lecture des résultats. Il nécessite au moins trois manipulations durant lesquelles une centaine de semences sont examinées individuellement. Il serait souhaitable d'améliorer l'efficacité du tri en développant une méthode automatisée et non destructive, complémentaire au tri mécanique, qui permette d'éliminer directement les semences défectueuses. Cela permettrait de limiter les pertes de semences, le nombre d'opérations de tri mécanique et les tests de germinations supplémentaires occasionnés.
5Cependant, les causes de non germination ou de production d'embryons aberrants sont multiples : dégâts physiques se produisant lors de la récolte ou du processus post-récolte ou caractéristiques propres à la semence comme le manque de maturité, la sénescence, le parasitisme et la dormance.
6La sénescence n'apparait généralement qu'après une durée de stockage élevée, ce qui peut être évité facilement en respectant un délai suffisamment court entre la production des semences et la commercialisation. La dormance éventuelle peut être levée en effectuant un traitement adéquat. Pour la chicorée, il s'agit de l'application d'une solution de nitrate de potassium à 0,2 % (ISTA, 2005). Par contre, les dégâts physiques et le manque de maturité devraient être détectés par une méthode non destructive.
7L'objectif de ce projet est d'étudier les potentialités de la vision artificielle pour analyser le pouvoir germinatif des semences considérées individuellement. L'étude est structurée en deux parties. La première partie concerne la vision en couleur et la deuxième la vision en fluorescence.
2. Vision en couleur et tri des semences
2.1. Étude bibliographique
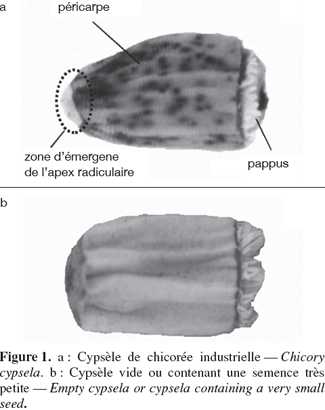
8Les semences commerciales de chicorée sont des fruits appelés cypsèles (Figure 1a) dont la couleur et la forme sont variables. Les organes visibles sont le péricarpe, la zone d'émergence de l'apex radiculaire et le pappus, ce dernier pouvant être absent. Bien que le pappus ne joue aucun rôle actif connu dans le développement et la maturation de la semence, il est susceptible de subir des transformations parallèlement au développement de celle-ci et son observation n'est donc pas superflue. La zone de l'apex radiculaire est importante pour le suivi de la germination proprement dite, ce qui représente une autre application possible du système de vision. Les cypsèles étant indéhiscents, il n'est pas envisageable d'extraire la semence de la coque externe dans le cadre de la production de semences commerciales. C'est donc le péricarpe qui doit être examiné de façon non destructive. Les semences non viables présentent parfois des caractéristiques visibles. Par exemple, les cypsèles de chicorée vides ou ceux dont la semence est trop peu développée apparaissent avec de profonds sillons dans le péricarpe (Figure 1b).
9Plusieurs auteurs décrivent le tri de semences sur base de la couleur à l'aide de dispositifs optiques. Par exemple, le soja (Glycine max (L.) Merr.), le blé (Triticum sp.), le riz (Oryza sativa L.) et le maïs (Zea mays L.) peuvent être triés par une méthode spectrométrique ou par vision artificielle afin d'améliorer la qualité des lots et éliminer les grains impropres à la consommation (Ruan et al., 2001 ; Steenhoek et al., 2001 ; Wan et al., 2002 ; Wang et al., 2002 ; Delwiche, 2003 ; Shatadal et al., 2003). Par contre, ces méthodes sont rarement utilisées pour détecter les semences non viables. Pour la chicorée en particulier, un lien a été mis en évidence entre la couleur et les performances de germination par Corbineau et al. (1990). Le parasitisme peut aussi être reconnu par un système de vision assistée par ordinateur en utilisant la longueur d'onde adéquate (Dowell et al., 2002).
2.2. Mise en évidence du pouvoir germinatif des semences de chicorée par vision en couleur
10Des semences de chicorée de variété 'Nausica' ont été analysées par imagerie couleur de façon à déterminer s'il existe un lien entre l'aspect externe et le pouvoir germinatif (Ooms, 2004). A priori, on observe une très grande variabilité de couleur, de forme et de texture sur ces semences (Figure 2).

11Le système comporte une caméra couleur 3-CCD placée dans un tunnel d'éclairage, un numériseur (frame grabber) et un ordinateur. La segmentation des images acquises sur fond bleu comprend un seuillage basé sur l'intensité des pixels dans les canaux R, G et B, une dilatation et une contraction de l'objet, ainsi que la séparation du pappus du reste de la semence par simple tronquement des images. La segmentation vis-à-vis du fond bleu donne un résultat très satisfaisant sans avoir recours à des techniques de segmentation plus avancées. La détection des pappi est basée sur une rotation de l'image selon l'axe principal de l'objet et l'analyse de la forme des extrémités. Des techniques avancées de segmentation comme le graphe de contigüité des régions (Tremeau et al., 2000), l'utilisation d'un espace couleur hybride (Vandenbroucke et al., 2003) ainsi que l'analyse de la connectivité des sous-ensembles et de l'homogénéité de la couleur (Macaire et al., 2006) permettraient probablement de séparer la zone du pappus de façon plus précise. Cependant, des problèmes pourraient survenir en raison des zones très contrastées présentes sur les semences et de l'absence de pappus sur un grand nombre d'entre elles.
12Trois cent soixante-deux attributs caractérisant la forme, la couleur et la texture des semences ont été calculés à partir des images en couleur de 1 500 semences. Ces attributs ont tous été utilisés antérieurement lors d'études similaires réalisées soit pour distinguer des variétés de semences, soit pour éliminer des grains impropres à la consommation. Les principales sources sont les 68 attributs de forme et les 78 attributs de couleur (espace RGB) utilisés par Luo et al. (1999) pour trier les grains de blé en fonction des dégâts externes, ainsi que la liste étendue d'attributs de couleur, forme et texture rassemblée par Majumdar et al. (2000a ; 2000b ; 2000c ; 2000d) pour classifier les céréales. Ont été également incluses les caractéristiques dérivées des histogrammes de niveaux de gris utilisés par Ghate et al. (1993) pour analyser l'état de maturité de noix d'arachide, les descripteurs de forme utilisés par Zayas et al. (1990) et Liao et al. (1993) pour distinguer les grains de maïs brisés et ceux utilisés par Shatadal et al. (1995) pour différencier diverses espèces de semences.
13Les attributs de couleur ont été calculés dans l'espace RGB, mais aussi dans l'espace HSI, à l'instar de Wigger et al. (1988) qui signalent que cet espace est plus intéressant pour distinguer la teinte de grains de soja. L'espace YCrCb (chrominance), dont Liu et al. (1997) citent les avantages pour distinguer les teintes jaunes, a également été utilisé. Parallèlement, tous les attributs de texture ont été estimés à partir des canaux H, S et I. Enfin, les attributs de couleur et de texture ont été évalués tant en présence qu'en absence de pappus.
14Après avoir été introduites dans la base de données, les semences ont subi un test de germination individuel et ont été classées en deux catégories : semences germinatives et non-germinatives. Les semences germinatives sont celles qui germent et produisent un embryon normal dans un délai de 14 jours. Les autres semences sont considérées comme étant non-germinatives. Un tri virtuel des semences a été effectué à l'aide de classifieurs de deux types : l'analyse discriminante (linéaire et quadratique) et un réseau de neurones de type backpropagation avec trois configurations différentes.
15Les attributs les plus significativement liés au pouvoir germinatif ont été sélectionnés par un modèle de sélection séquentielle [generalised sequential forward selection, Webb (2002)]. L'analyse d'images et la sélection des attributs ont été réalisées à l'aide d'algorithmes spécialement développés à cet effet en langage Matlab 6.5 (Mathworks).
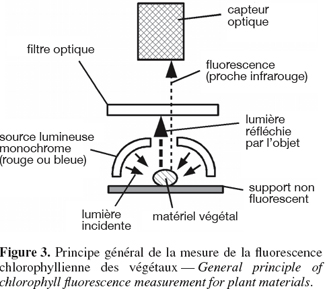
16Les attributs conduisant au taux de classement correct le plus élevé sont indiqués ci-dessous :
17– la moyenne du rapport rouge/vert (teinte),
18– la différence entre les valeurs extrêmes d'intensité bleue du péricarpe (sans pappus),
19– le Gray Level Run Length Matrix run percent ou « pourcentage de lignes homogènes de la matrice des longueurs de lignes de niveau de gris » calculé sur la teinte, qui caractérise la présence ou l'absence de lignes transversales de teinte homogène sur la semence,
20– la Gray Level Cooccurence Matrix cluster shade (GLCM) ou « zone d'ombre de la matrice de co-occurence du niveau de gris » calculée sur l'intensité, qui traduit la présence ou l'absence de zones d'ombre très marquées par rapport à la couleur moyenne,
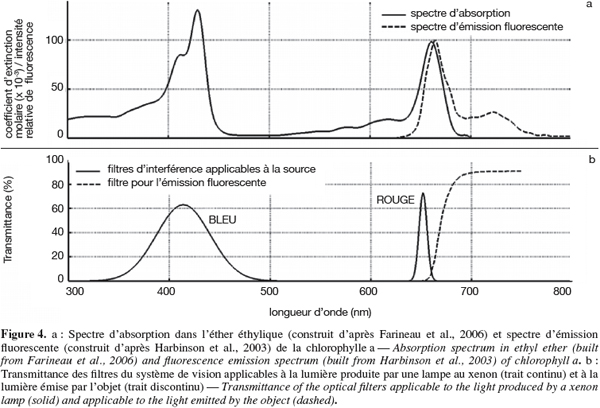
21- la GLCM correlation ou corrélation de la GLCM, calculée sur l'intensité c'est-à-dire le contraste des zones d'ombre.
22À l'exception du premier attribut, qui est lié à la teinte, tous les autres sont associés à des zones contrastées, des fentes ou des sillons, donc essentiellement à une information de texture.
23Pour obtenir les meilleurs résultats, ces attributs sont mis en œuvre soit dans un réseau de neurones (backpropagation, 4 + 1 neurones), soit par analyse discriminante quadratique. Les attributs sont utilisés individuellement ou par paires.
24En effectuant les meilleures combinaisons, le taux de classement correct (soit la proportion de semences correctement classées) n'atteint cependant que 55 à 65 %. Seules les semences dessèchées ou non développées (issues de fleurs non pollinisées) sont reconnues de façon indiscutable par le système de vision. Les variations de couleur, forme et texture observées sont principalement dues au phénotype exprimé et non à des défauts ou dégâts compromettant le pouvoir germinatif.
25La divergence de ces résultats avec ceux obtenus par Corbineau et al. (1990) est probablement due à l'apparence des semences étudiées. Comme indiqué ci-dessus, les semences de la variété ' Nausica ' présentent une très grande variabilité naturelle de couleur et de texture, tandis que les semences observées par Corbineau sont des hybrides qui peuvent être de teinte uniforme.
3. Vision en fluorescence
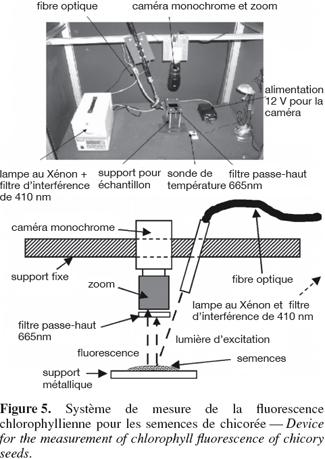
3.1. Fluorescence chlorophyllienne
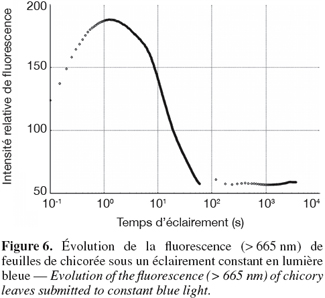
26Une molécule absorbant un photon passe à un état excité en recevant une quantité d'énergie inversement proportionnelle à la longueur d'onde du photon (Sauer, 1975). Chaque molécule est caractérisée par un spectre d'absorption qui peut varier en fonction du milieu. Les chlorophylles absorbent principalement les lumières bleue et rouge du spectre visible. Dans les tissus des plantes supérieures, on trouve principalement des chlorophylles a et b. La première présente, en solution dans l'éther éthylique, deux pics d'absorption à 430 et 662 nm, tandis que les pics d'absorption de la seconde se situent à 453 et 652 nm (Farineau et al., 2006). Cependant, les spectres d'absorption dépendent du solvant utilisé. Dans les organismes photosynthétiques vivants, une partie de l'énergie absorbée par les chlorophylles est utilisée pour la photosynthèse, le reste étant restitué au milieu. La fluorescence est l'une des formes de restitution. Il s'agit de lumière émise par la chlorophylle à une longueur d'onde plus élevée que la lumière absorbée, à savoir le rouge et l'infrarouge, au-delà de 600 nm. La chlorophylle n'est pas la seule molécule émettant de la fluorescence présente dans les végétaux. Des composés cités par Lang et al. (1991) présents dans l'épiderme des feuilles des végétaux absorbent les rayonnements ultraviolets et émettent de la fluorescence à des longueurs d'ondes plus courtes (fluorescence bleue entre 400 et 550 nm) : l'acide férulique (Chemical Abstracts Service (CAS) number 537-98-4), l'esculétine (6,7-Dihydroxy-2-chromenone), la riboflavine (CAS 83-88-5), la quercétine (CAS 117-39-5) et le β-carotène. Cette liste non exhaustive comprend des polyphénols (Cartelat et al., 2005 ; Bidel et al., 2007) dont la fluorescence peut être mesurée in vivo dans l'épiderme des végétaux (Goulas et al., 2004).
3.2. Rôle de la chlorophylle dans le développement et la maturation de la semence et son utilisation comme indicateur de la maturité
27La chlorophylle est le pigment photosynthétique essentiel des feuilles des plantes supérieures. Les nutriments accumulés dans la semence pendant son développement ont principalement pour origine les feuilles, les organes verts des fleurs (Throne-Holst et al., 2006) et, dans une proportion variable, les fruits. La photosynthèse ayant lieu dans la semence ne contribue qu'à une part minime des nutriments stockés.
28Cresswell et al. (1981) estiment que, pour certaines espèces d'adventices, une haute concentration en chlorophylle dans les semences révèle le besoin d'un stimulus lumineux pour la germination. Suhartanto (2002) a montré que, pour la tomate, la chlorophylle était active pendant les 40 premiers jours après la floraison et était nécessaire au développement de la semence. Il indique également que le contenu en chlorophylle est un indicateur de la maturité physiologique des semences de tomate. En effet, en conditions contrôlées selon la norme ISTA, le pourcentage de germination atteint un maximum entre 51 et 54 jours après la floraison, puis décroît. L'augmentation du pourcentage de germination pendant la phase de maturation correspond à une décroissance du contenu en chlorophylle. Après la date optimale de récolte, le contenu en chlorophylle des semences n'est plus un indicateur de leur germinabilité. Enfin, l'auteur mentionne que la dégradation artificielle de la chlorophylle par exposition des semences de tomate à la lumière lors du stockage ne permet pas d'améliorer leurs performances de germination. Gutierrez et al. (2007) passent en revue les mécanismes régulant la maturation des semences. La dégradation de la chlorophylle y apparait comme un phénomène concomitant à l'accumulation de protéines dans les tissus de stockage de la semence. Pour un mutant d'Arabidopsis sp., l'expression excessive du gène AGL15 implique un retard à la fois dans la diminution de la quantité de chlorophylle et la diminution du contenu en eau de la semence (Kermode, 2006).
29L'application de la mesure de la fluorescence chlorophyllienne à la détection des semences immatures a été réalisée en laboratoire pour certaines espèces : les semences (cypsèles) de carotte (Daucus carota L.) (Steckel et al., 1989), les graines de soja (Glycine max L.) (Illipronti et al., 1997), les semences de chou (Brassica oleracea L.) et de tomate (Solanum lycopersicum L.) (Jalink et al., 1998 ; 1999) ainsi que les grains d'orge (Hordeum vulgare L.) (Konstantinova et al., 2002). Suhartanto (2002) a examiné l'évolution de la fluorescence chlorophyllienne des fruits de tomate parallèlement à celle des semences. Il a montré que la première disparaissait plus tard que la seconde, alors que la maturation des semences est presque terminée. On ne peut cependant étendre cette conclusion aux cypsèles de chicorée, car les deux espèces sont très différentes.
30La mesure de la fluorescence chlorophyllienne peut être complétée et fusionnée avec d'autres caractéristiques de la semence. Par exemple, des attributs de forme et de couleur, calculés à partir d'images en couleur de semences de tomate peuvent être fusionnés avec l'intensité de la fluorescence chlorophyllienne afin d'améliorer la prédiction des performances de germination (Moshou et al., 2004).
3.3. Principales techniques de mesure du contenu en chlorophylle des végétaux
31Mesure quantitative et destructive du contenu en chlorophylle des végétaux. Une méthode largement répandue est l'analyse par chromatographie en phase liquide à haute performance (HPLC) des composants extraits en solution [méthanol, éthanol et/ou acétone (Propan-2-one)], après broyage du matériel végétal. Une variante de la méthode, décrite par Bellomo et al. (2007), est applicable aux noix de pistaches et peut servir de base à une mesure similaire sur des semences de chicorée. La spectrométrie est également utilisable en raison des spectres d'absorption très spécifiques des chlorophylles.
32Mesure non destructive du contenu en chlorophylle des végétaux. La mesure non destructive de la chlorophylle peut être effectuée par fluorimétrie. Cette méthode reste principalement qualitative et comparative. En effet, un composé fluorescent en solution émet un rayonnement proportionnel à sa concentration (Farineau et al., 2006). Cependant, pour les semences de tomate, la fluorescence chlorophyllienne détectable par observation non destructive croît exponentiellement en fonction de la quantité réelle de chlorophylle (Suhartanto, 2002).
33Le principe général de la technique de mesure est exposé à la figure 3. Une source lumineuse émet la lumière absorbée par les chlorophylles. Une fraction de cette lumière est émise sous forme de fluorescence dans le rouge et le proche infrarouge : de 1 % (Maxwell et al., 2000) à 3 % (Govindjee et al., 1975) de la lumière incidente pour une feuille vivante dont les photosystèmes sont actifs et 30 % pour de la chlorophylle en solution (Krause et al., 1991). Le pic d'émission se situe à 670 nm pour la chlorophylle a et à 645 nm pour la chlorophylle b (Harbinson et al., 2003). Les spectres d'émission peuvent varier en fonction de la longueur d'onde de la lumière absorbée et de la réabsorption possible de la lumière fluorescente émise. Dans les feuilles vivantes, la chlorophylle est intégrée dans des complexes protéiniques destinés à canaliser et concentrer l'énergie lumineuse. La réabsorption de la fluorescence y est importante et le spectre d'émission fluorescente est largement décalé vers les grandes longueurs d'ondes, en comparaison avec la chlorophylle seule.
34La plupart des appareils existants utilisent la lumière rouge (650 ou 660 nm) pour exciter la chlorophylle. En effet, les molécules présentes dans les végétaux et citées plus haut [dont les polyphenols, Goulas et al. (2004)] peuvent en principe influencer la mesure lorsque de la lumière bleue est utilisée. Ces composés absorbent les ultraviolets et la lumière bleue. Bien que leur spectre de fluorescence soit principalement localisé entre 400 et 550 nm, une fraction du spectre s'étend au-delà de 600 nm (Lang et al., 1991) et peut donc interférer avec la mesure de la fluorescence chlorophyllienne.
35Le développement d'appareils de mesure et d'imagerie de la fluorescence chlorophyllienne in vivo dans les feuilles d'organismes végétaux a connu un essor récent et rapide, mais aussi une grande spécialisation vers la détection de phénomènes liés au stress et à une perturbation des processus de photosynthèse. Lichtenthaler et al. (1997), Buschmann et al. (1998), Maxwell et al. (2000) et Oxborough (2004) passent en revue les techniques appliquées.
36Pour la détection de la chlorophylle dans les semences de chou, Jalink et al. (1998) ont mis au point un appareillage spécifique. Une diode lumineuse (Hewlett Packard HLMP-8150) et un filtre d'interférence à 656 nm constituent la source. La lumière est envoyée vers l'objet par réflection sur un miroir semi-réfléchissant et à travers une lentille. La fluorescence émise traverse ce même miroir, un filtre passe-haut à 730 nm et une autre lentille avant d'être réceptionnée par une photodiode dont le signal est amplifié. Le miroir assure l'alignement de la lumière d'excitation avec la fluorescence mesurée. Suhartanto (2002) a utilisé le fluorimètre XE-PAM (Heinz Walz GmbH, Germany) pour étudier les semences fraiches de tomate et l'appareillage de Jalink et al. (1999) pour étudier la fluorescence des semences sèches. L'avantage du premier appareil est de mesurer la réponse dynamique d'un organisme photosynthétique à des impulsions lumineuses structurées. Pour les semences horticoles, un dispositif commercialisé a pour but la reconnaissance optique des semences immatures de fleurs et de légumes [Seedscan, Satake Corp. UK division, Anon. (2008)]. Cet appareil de tri se base sur une mesure ponctuelle de la fluorescence chlorophyllienne. Il ne permet cependant pas d'estimer la répartition de la fluorescence sur la surface des cypsèles.
37La mesure du contenu en chlorophylle des cypsèles de chicorée doit tenir compte de la très faible teneur en chlorophylle des semences. La sensibilité du système de vision doit donc être élevée. De plus, ces cypsèles présentent trois organes distincts à l'œil nu : l'apex radiculaire, le péricarpe et le pappus. Il est tout à fait possible que le contenu en chlorophylle de ces organes évolue différemment pendant la maturation et par conséquent, les semences doivent être observées par imagerie. À terme, le système doit être suffisamment sensible pour limiter le temps d'exposition devant la caméra et permettre une mesure rapide satisfaisant aux exigences de débit à traiter (de l'ordre de 4 × 106 semences.h-1).
38La source lumineuse doit correspondre à tout ou partie du spectre d'absorption de la chlorophylle (Figure 4). Les principales sources lumineuses disponibles commercialement pour la production de lumière monochromatique bleue ou rouge sont les diodes lumineuses, les lasers et les sources de lumière blanche (lampe à décharge ou fluorescente) combinées à un filtre d'interférence. Dans le cas d'un laser, la lumière est monochromatique et son intensité n'est limitée que par l'aspect non destructif de l'application et les couts associés à l'utilisation de cette technologie. Les diodes ont une taille réduite, ce qui permet de les installer près de l'objet et d'y concentrer le flux lumineux. Elles émettent une lumière monochromatique dont le spectre est étroit. Nous avons choisi d'utiliser une lumière blanche produite par une lampe au xénon combinée à un filtre d'interférence qui permet de moduler à volonté le spectre lumineux, tout en gardant une intensité suffisante.
39L'utilisation de lumière bleue au lieu de lumière rouge comme source d'excitation permet d'élargir le spectre de la lumière envoyée sur l'objet ainsi que celui de la fluorescence mesurable, rendant le système de mesure beaucoup plus sensible (Figure 4). Pour utiliser de la lumière bleue, il faut cependant s'assurer que les composés fluorescents parasites (l'acide férulique, l'esculétine, la riboflavine, la quercétine, le β-carotène et éventuellement d'autres molécules non identifiées) n'affectent pas de façon importante le signal de fluorescence chlorophyllienne.
3.4. Mise au point d'un équipement d'imagerie en fluorescence pour des semences
40Un équipement d'imagerie fluorescente a donc été mis au point. Il est destiné à réaliser les expérimentations préliminaires indispensables à la conception d'un outil de tri en ligne de semences de chicorée industrielle. Ces expérimentations doivent fournir une réponse aux questions suivantes :
41– peut-on utiliser de la lumière bleue plutôt que de la lumière rouge pour augmenter la sensibilité du système de mesure ?
42– doit-on mesurer séparément la fluorescence du péricarpe, du pappus et de l'apex radiculaire ?
43– quel est le lien entre la maturité des semences, le contenu en chlorophylle et le pouvoir germinatif ?
44Le système de mesure de la fluorescence chlorophyllienne proposé est illustré à la figure 5. Une chambre noire entoure le système pour isoler le signal fluorescent de la lumière ambiante. Elle contient la source lumineuse de 150 W (lampe au xénon Hamamatsu Lightingcure L8222, modèle LC5) qui produit environ 1,8 W de lumière bleue utile entre 400 et 430 nm [fiche technique, Anon. (2003)]. Cette lumière blanche passe à travers un filtre d'interférence centré à 410 nm (bleu) et large de 80 nm (Melles Griot 03FIB002). Alternativement, un filtre d'interférence rouge centré à 650 nm (Melles Griot 03FIV022) peut être substitué à ce dernier. Le système peut donc comparer les images obtenues avec les deux types de lumière. La lumière est acheminée vers les semences à l'aide d'une fibre optique de 7 mm de diamètre. La lumière bleue (ou rouge) est absorbée par les chlorophylles des semences et provoque l'émission de fluorescence. Un filtre passe-haut à 665 nm (Melles Griot 03FCG107) permet de sélectionner le signal fluorescent de la lumière bleue (ou rouge) réfléchie par le support et l'objet. Le matériel végétal est placé sur un support non-fluorescent (plaque d'aluminium, d'acier ou support peint en noir mat). L'image fluorescente des semences est acquise à l'aide d'une caméra CCD monochrome (Hamamatsu C5405-70) sensible à l'infrarouge et munie d'un zoom, ce qui permet de photographier avec la même caméra des semences individuelles ou en vrac. La résolution des images est de 640 x 480 pixels sur 256 niveaux de gris. La chaleur produite par la lampe est évacuée par un système de climatisation (Tectro TS27) afin d'éviter toute influence de la température.
45La stabilité du système de mesure a été établie en mesurant la fluorescence d'une feuille de papier blanc sur une période de six heures. Le niveau de fluorescence émis est stable quelles que soient l'intensité lumineuse reçue par l'échantillon et l'ouverture du diaphragme de la caméra. Trois tests ont permis de vérifier l'aptitude du système à mesurer la fluorescence chlorophyllienne. Le premier consiste à mesurer la courbe de Kautsky (Kautsky et al., 19311 cité par Lichtenthaler et al., 1997) de feuilles vivantes de chicorée soumises à un éclairement constant. Les courbes mesurées correspondent effectivement à la courbe théorique décrite par Harbinson et al. (2003) et les principales caractéristiques de la courbe de Kautsky sont mises en évidence (Figure 6). La fluorescence augmente rapidement pendant la première seconde puis décroit lentement avant de se stabiliser à un niveau constant, mais faible. Le système permet donc de visualiser la cinétique de la fluorescence chlorophyllienne dans les végétaux vivants. Le deuxième test consiste à mesurer le spectre de la fluorescence de semences en utilisant des filtres d'interférence étroits à la place du filtre passe-haut. Le spectre obtenu correspond à celui de la chlorophylle a pour les zones d'intensité élevée. Pour les zones de faible fluorescence, le spectre ne peut être identifié avec certitude. Il peut s'agir soit de l'addition des spectres des chlorophylles a et b, soit de composés inconnus. Il reste donc un doute concernant les zones de faible intensité qui peuvent éventuellement correspondre à l'émission fluorescente d'un autre composé que la chlorophylle, en l'absence de celle-ci. Le troisième test est destiné à quantifier indirectement cette fluorescence parasite. Il consiste à remplacer momentanément la lumière d'excitation bleue par de la lumière rouge à laquelle seule la chlorophylle est sensible. Ce dernier test permet également de déterminer si les usages de lumière bleue et de lumière rouge sont équivalents pour l'excitation de la fluorescence. La fluorescence d'une centaine de semences a été imagée en utilisant successivement les deux types de lumières pour l'excitation. Les images ont ensuite été mises en correspondance par corrélation croisée (pour s'assurer qu'il n'y a eu aucune translation de l'objet lors du changement de filtre) puis comparées en résolution spatiale réduite. Le coefficient de corrélation était de + 0,86. Il en a été conclu que la fluorescence parasite, observable en utilisant de la lumière bleue, n'affecte pas de façon importante la mesure de la fluorescence chlorophyllienne et que le système de mesure est bien spécifique à la chlorophylle. La lumière bleue peut donc être privilégiée en raison de la plus grande sensibilité du système. En effet, l'excitation en lumière rouge nécessite l'utilisation d'un filtre à bande passante plus étroite, entrainant une baisse de l'excitation lumineuse sur l'objet et de la sensibilité du système de mesure en général.
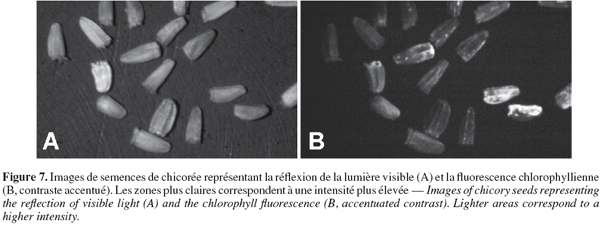
46La figure 7 représente des semences observées par réflexion en lumière visible (A) et grâce au système de vision en fluorescence (B). Sur l'image de droite, les zones les plus claires correspondent à une intensité de fluorescence élevée et donc à la présence de chlorophylle.
47En fusionnant les deux types d'équipement, il serait possible d'effectuer au même endroit la mesure de la fluorescence chlorophyllienne et celle de la réflectance en lumière visible tout en minimisant les manipulations. Cela implique soit une interruption fréquente de l'éclairage ambiant (stroboscope), soit une mesure de la fluorescence en présence de lumière ambiante. Bien que les deux solutions soient théoriquement possibles, il est plus avantageux techniquement de réaliser les deux mesures successivement le long de la chaine de production.
4. Conclusion
48La chicorée industrielle est cultivée sur de larges surfaces et la production de semences à trier représente plusieurs dizaines de millions de semences par jour. De ce point de vue, cette application est donc beaucoup plus exigeante que le tri des semences maraichères.
49Le tri des semences de chicorée industrielle peut être amélioré par la reconnaissance individuelle et non destructive des semences dont le pouvoir germinatif est insuffisant. Pour la réalisation de cette tâche, les potentialités de la vision artificielle ont été examinées, d'une part à partir d'images couleur dans le domaine du visible et d'autre part, par imagerie de la fluorescence chlorophyllienne.
50À partir d'images de semences examinées dans le domaine visible, il est possible d'obtenir des informations concernant l'aspect externe : la couleur, la forme, la texture et la présence de défauts éventuels. La difficulté réside dans la haute variabilité de l'aspect des semences (cypsèles) testées. Avec la vision en couleur, on ne peut reconnaitre que les semences dessèchées ou non développées.
51Des études montrent qu'il existe un lien entre la concentration en chlorophylle et la maturité des semences. L'imagerie fluorescente permet de mesurer la répartition de la chlorophylle dans les tissus externes. Le système doit cependant être suffisamment sensible pour détecter les faibles concentrations en chlorophylle dans la semence. Mettant en œuvre cette technique sur des semences de chicorée, il est possible d'obtenir une image de la répartition spatiale de la chlorophylle.
52L'imagerie fluorescente appliquée aux semences de chicorée doit permettre de répondre aux questions et de vérifier les hypothèses suivantes :
53– L'hypothèse d'une disparition du contenu en chlorophylle des semences pendant la maturation doit être vérifiée et le processus doit être décrit. La durée de maturation réelle des semences est mal connue. En particulier, il convient de mesurer l'évolution du contenu en chlorophylle conjointement aux performances de germination (pourcentage de germination, vigueur, viabilité des embryons). En effet, la disparition de la chlorophylle peut être antérieure, simultanée ou postérieure à l'augmentation des performances de germination pendant la maturation ;
54– La relation entre le contenu en chlorophylle et la fluorescence chlorophyllienne est-elle linéaire pour les cypsèles de chicorée ?
55– Quelles sont les modalités d'application de la technique de mesure de la fluorescence chlorophyllienne aux cypsèles de chicorée et quel est son champ d'application dans le cadre des techniques actuelles de production ?
56– La densité des semences et leur fluorescence chlorophyllienne sont-elles des indicateurs redondants ou complémentaires pour l'estimation de l'état de maturité des semences ? Cela est important pour déterminer si le tri par table densimétrique est concurrent ou complémentaire vis-à-vis du tri par vision artificielle.
57Remerciements
58Cette étude a été financée par la Direction générale des Technologies, de la Recherche et de l'Énergie de la Région Wallonne, Belgique, dans le cadre d'un projet européen "First-Europe, Objectif 1".
Bibliographie
Anon., 2003. Hamamatsu: super-quiet Xenon lamps. Shizuoka-ken, Japan: Hamamatsu Photonics K.K.
Anon., 2008. Farbsortierung, http://www.satake.co.uk/german/colour_sorting.htm, (18/09/2008).
Bellomo M. & Fallico B., 2007. Anthocyanins, chlorophylls and xanthophylls in pistachio nuts (Pistacia vera) of different geographic origin. J. Food Compos. Anal., 20(3-4), 352-359.
Bidel L.P.R. et al., 2007. Responses of epidermal phenolic compounds to light acclimation: in vivo qualitative and quantitative assessment using chlorophyll fluorescence excitation spectra in leaves of three woody species. J. Photochem. Photobiol. B: Biol., 88, 163-179.
Buschmann C. & Lichtenthaler H., 1998. Principles and characteristics of multi-colour fluorescence imaging of plants. J. Plant Physiol., 152, 297-314.
Cartelat A. et al., 2005. Optically assessed contents of leaf polyphenolics and chlorophyll as indicators of nitrogen deficiency in wheat (Triticum aestivum L.). Field Crop Res., 91, 35-49.
Commeau M.F. & Spire M.L., 1996. Technologie des semences. Paris : INRA.
Corbineau F. & Come D., 1990. Germinability and quality of Cichorium intybus L. seeds. Acta Hortic., 267, 183-189.
Cresswell E. & Grime J., 1981. Induction of light requirement during seed development and its ecological consequences. Nature, 291, 583-585.
Delwiche S., 2003. Classification of scab- and other mold-damaged wheat kernels by near-infrared reflectance spectroscopy. Trans. ASAE, 46(3), 731-738.
Directive 2002/55/CE du Conseil du 13 juin 2002 concernant la commercialisation des semences de légumes. J. Off. Communautés Eur., 20.07.02, 193/33-193/59.
Directive 2006/124/CE de la Commission du 5 décembre 2006 modifiant la directive 92/33/CEE du Conseil concernant la commercialisation des plants de légumes et des matériels de multiplication de légumes autres que les semences ainsi que la directive 2002/55/CE du Conseil concernant la commercialisation des semences de légumes. J. Off. Union Eur., 06.12.03, 339/12-339/15.
Dowell F. et al., 2002. Use of optical sorting to detect wheat kernels infected with Tilletia indica. Plant Dis., 86(9), 1011-1013.
Farineau J. & Morot-Gaudry J., 2006. La photosynthèse : processus physiques, moléculaires et physiologiques. Paris : INRA.
Ghate S.R., Evans M.D., Kvien C.K. & Rucker K.S., 1993. Maturity detection in peanuts (Arachis hypogaea L.) using machine vision. Trans. ASAE, 36(6), 1941-1947.
Goulas Y., Cerovic Z.G., Cartelat A. & Moya I., 2004. Dualex: a new instrument for field measurements of epidermal ultraviolet absorbance by chlorophyll fluorescence. Appl. Opt., 43(23), 4488-4496.
Govindjee & Govindjee R., 1975. Introduction to photosynthesis. In: Buetow D., Cameron I. & Padilla G., eds. Bioenergetics of photosynthesis. London: Academic Press Inc., 1-50.
Gutierrez L., Van Wuytswinkel O., Castelain M. & Bellini C., 2007. Combined networks regulating seed maturation. Trends Plant Sci., 12(7), 294-300.
Harbinson J. & Rosenqvist E., 2003. An introduction to chlorophyll fluorescence. In: DeEll J. & Toivonen P., eds. Practical applications of chlorophyll fluorescence in plant biology. Dordrecht, The Netherlands: Kluwer Academic Publishers, 1-29.
Illipronti R., Langerak C. & Lommen W., 1997. Variation in and relationships between physical and physiological seed attributes within a soybean seed lot. Seed Sci. Technol., 25(2), 215-231.
ISTA, 2005. International rules for seed testing. Bassersdorf, Switzerland: International Seed Testing Association.
Jalink H., Frandas A., Van der Schoor R. & Bino J., 1998. Chlorophyll fluorescence of the testa of Brassica oleracea seeds as an indicator of seed maturity and seed quality. Sci. Agric., numero especial, 88-93.
Jalink H., Van der Schoor R., Birnbaum Y. & Bino R., 1999. Seed chlorophyll content as an indicator for seed maturity and seed quality. Acta Hortic., 504, 219-227.
Kermode A., 2006. Maturation: changes in water status. In: Black M., Bewley J. & Halmer P., eds. The encyclopedia of seeds. Science, technology and uses. Wallingford, UK: CABI, 405-406.
Konstantinova P., Van der Schoor R., Van den Bulk R. & Jalink H., 2002. Chlorophyll fluorescence sorting as a method for improvement of barley (Hordeum vulgare L.) seed health and germination. Seed Sci. Technol., 30(2), 411-421.
Krause G.H. & Weis E., 1991. Chlorophyll fluorescence and photosynthesis: the basics. Annu. Rev. Plant Physiol. Mol. Biol., 42, 313-349.
Lang M., Stober F. & Lichtenthaler H., 1991. Fluorescence emission spectra of plant leaves and plant constituents. Radiat. Environ. Biophys., 30, 333-347.
Liao K., Paulsen M.R. & Reid J.F., 1993. Corn kernel breakage classification by machine vision using a neural network classifier. Trans. ASAE, 36(6), 1949-1953.
Lichtenthaler H. & Miehé J., 1997. Fluorescence imaging as a diagnostic tool for plant stress. Trends Plant Sci., 2(8), 316-320.
Liu J. & Paulsen M.R., 1997. Corn whiteness measurements and classification using machine vision. ASAE Paper n°973045. St Joseph, MI., USA: ASAE.
Luo X., Jayas D.S. & Symons S.J., 1999. Identification of damages kernels in wheat using a colour machine vision system. J. Cereal Sci., 30, 49-59.
Macaire L., Vandenbroucke N. & Postaire J.G., 2006. Color image segmentation by analysis of subset connectedness and color homogeneity properties. Comput. Vision Image Understanding, 102, 105-116.
Majumdar S. & Jayas D.S., 2000a. Classification of cereal grain using machine vision. IV. Combined morphology, color and texture models. Trans. ASAE, 43(6), 1689-1694.
Majumdar S. & Jayas D.S., 2000b. Classification of cereal grain using machine vision. III. Texture models. Trans. ASAE, 43(6), 1681-1687.
Majumdar S. & Jayas D.S., 2000c. Classification of cereal grain using machine vision. II. Color models. Trans. ASAE, 43(6), 1677-1680.
Majumdar S. & Jayas D.S., 2000d. Classification of cereal grain using machine vision. I. Morphology models. Trans. ASAE, 43(6), 1669-1675.
Maxwell K. & Johnson G., 2000. Chlorophyll fluorescence: a practical guide. J. Exp. Bot., 51, 659-668.
Moniteur belge, 2006. Arrêté du Gouvernement wallon relatif à la production et à la commercialisation des semences de légumes et des semences de chicorée industrielle. Monit. Belg., 14.03.06, éd. 2, 15061-15073.
Moshou D. et al., 2004. Seed germination prediction based on sensor fusion of machine vision and fluorescence. In: Proceedings of the International conference on agricultural engineering, 12-16 September, 2004, Leuven, Belgium. Leuven, Belgium: Technologisch Instituut vzw, 404-405.
Ooms D., 2004. Evaluation of the quality of chicory seeds using machine vision. MSc thesis: Cranfield University (UK).
Oxborough K., 2004. Imaging of chlorophyll a fluorescence: theoretical and practical aspects of an emerging technique for the monitoring of photosynthetic performance. J. Exp. Bot., 400(55), 1195-1205.
Ruan R. et al., 2001. Estimation of weight percentage of scabby wheat kernels using an automatic machine vision and neural network based system. Trans. ASAE, 44(4), 983-988.
Sauer K., 1975. Primary events and the trapping of energy. In: Govindjee, ed. Bioenergietics of photosynthesis. New York, USA: Academic Press, 115-181.
Shatadal P., Jayas D.S., Hehn J.L. & Bulley N.R., 1995. Seed classification using machine vision. Can. Agric. Eng., 37(3), 163-167.
Shatadal P. & Tan J., 2003. Identifying damaged soybeans by color image analysis. Appl. Eng. Agric., 19(1), 65-69.
Steckel J., Gray D. & Rowse H., 1989. Relationships between indices of seed maturity and carrot seed quality. Ann. Appl. Biol., 114, 177-183.
Steenhoek L., Misra C., Hurburgh Jr.C. & Bern C., 2001. Implementing a computer vision system for corn kernel damage evaluation. Appl. Eng. Agric., 17(2), 235-240.
Suhartanto M., 2002. Chlorophyll in tomato seeds: marker for seed performance? PhD thesis: Wageningen Universiteit (The Netherlands).
Throne-Holst M., Offler C. & Patrick J., 2006. Development of seeds. Sources of nutrients and water. In: Black M., Bewley J. & Halmer P., eds. The encyclopedia of seeds. Science, technology and uses. Wallingford, UK: CABI, 168.
Tremeau A. & Colantoni P., 2000. Regions adjacency graph applied to color image segmentation. IEEE Trans. Image, 9(4), 735-744.
Vandenbroucke N., Macaire L. & Postaire J.G., 2003. Color image segmentation by pixel classification in an adapted hybrid color space. Application to soccer image analysis. Comput. Vision Image Understanding, 90, 190-216.
Wan Y., Lin C. & Chiou J., 2002. Rice quality classification using an automatic grain quality inspection system. Trans. ASAE, 45(2), 379-387.
Wang D., Ram M. & Dowell F., 2002. Classification of damaged soybean seeds using near-infrared spectroscopy. Trans. ASAE, 45(6), 1943-1948.
Webb A., 2002. Statistical pattern recognition. Chichester, UK: John Wiley & sons, Ltd.
Wigger W.D., Paulsen M.R., Litchfield J.B. & Sinclair J.B., 1988. Classification of fungal-damaged soybeans using color-image processing. ASAE Paper n°883053. St Joseph, MI, USA: ASAE.
Zayas L., Converse H. & Steele J., 1990. Discrimination of whole from broken corn kernels with image analysis. Trans. ASAE, 33(5), 1642-1645.
Notes
To cite this article
About: David Ooms
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Mécanique et Construction. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : d.ooms@ulg.ac.be
About: Marie-France Destain
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Mécanique et Construction. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






