- Startpagina tijdschrift
- volume 13 (2009)
- numéro 1
- Phénomène de la transition vitreuse appliquée aux glucides alimentaires amorphes à l'état de poudre
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Phénomène de la transition vitreuse appliquée aux glucides alimentaires amorphes à l'état de poudre

Nota's van de redactie
Reçu le 11 septembre 2008, accepté le 4 février 2009
Résumé
Au cours de ces quinze dernières années, certains technologues et scientifiques du domaine alimentaire ont pris conscience de l'importance de la transition vitreuse, propriété des matériaux amorphes ou vitreux, et cela dans les processus de préparation des aliments. C'est ainsi par exemple que des études récentes ont corrélé cette notion fondamentale de la transition vitreuse à des changements techno-fonctionnels des poudres contenant des sucres simples, des oligo- ou des polysaccharides. L'objectif de cet article est de présenter de manière non exhaustive des relations entre des caractéristiques de la transition vitreuse et des applications en technologie des aliments (mottage, altérations, etc.).
Abstract
Glass transition phenomena applied to powdered amorphous food carbohydrates. During these last fifteen years, some food technologists and scientists have become aware of the importance of the glass transition, a thermal property of glassy or amorphous material, in food preparation processes. Recent studies have successfully correlated this fundamental notion to technofunctional changes within the powder. The aim of this paper is to present in a non exhaustive manner the relationship between glass transition characteristics and applications in food technology (caking, alterations, etc.).
Inhoudstafel
1. Introduction
1Aujourd'hui, la majorité des glucides alimentaires sont commercialisés sous forme de poudre, principalement en vue d'améliorer leur conservation et la manutention. Pour y parvenir, les procédés technologiques utilisés (cristallisation, atomisation, lyophilisation, broyage, etc.) génèrent des matériaux à l'état solide cristallin, amorphe ou constitués de zones amorphes et cristallines (Bhandari et al., 1999 ; Kim et al., 2001 ; Ronkart et al., 2007).
2L'importance de l'état solide amorphe (ou vitreux) des glucides alimentaires a été pour la première fois discutée dans la littérature par White et al. (1966), bien qu'évidemment l'intérêt pour l'état vitreux précède leur travail (Tammann, 1926 ; Makower et al., 1956 ; Palmer et al., 1956). De nos jours, les exigences de plus en plus poussées de la maitrise des propriétés technofonctionnelles des glucides alimentaires obligent les chercheurs à approfondir les connaissances et à caractériser jusqu'à l'échelle moléculaire les variations comportementales. Pour ce faire, les scientifiques ont recours à des techniques d'analyse de plus en plus fines. Plus particulièrement, la notion de la transition vitreuse, caractérisant le passage de l'état vitreux à celui de caoutchouteux, est très importante pour prédire le comportement en cours de conditionnement des glucides en tout ou en partie amorphes. La température à laquelle la transition vitreuse a lieu s'appelle la température de la transition vitreuse (Tg). La Tg est un descripteur pratique en raison de sa bonne corrélation avec les propriétés structurelles et thermodynamiques d'un matériau.
3Les études de base sur la transition vitreuse sont principalement réalisées dans le domaine des polymères synthétiques mais peuvent être transposées aux glucides alimentaires car elles présentent des similitudes (Levine, 2002). Cependant, des divergences existent, dont la plus importante est sans nul doute l'abondance de l'eau dans les glucides alimentaires et son rôle prédominant en tant que plastifiant. Dans cet article, les principaux paramètres influençant la Tg tels que la composition chimique, la présence d'eau et les propriétés physiques du matériau, sont décrits. Finalement, la relation entre la Tg et le phénomène du mottage des glucides alimentaires est présentée.
2. Les solides amorphes
2.1. Solide cristallin et solide amorphe
4Un solide cristallin est composé d'un empilement ordonné de molécules (ou de parties de molécules), c'est-à-dire qu'un même motif est répété à l'identique selon un réseau régulier. La plus petite partie du réseau permettant de recomposer l'empilement est appelée la maille cristalline. A l'opposé, un solide amorphe est composé de molécules (ou parties de molécules) ne respectant aucun ordre à moyenne et longue distance, ce qui les distingue des solides cristallins. Suivant la méthode de préparation, les solides amorphes sont régulièrement qualifiés d'amorphes ou de vitreux car ils présentent une structure comparable à des fragments minuscules de solide non organisé (pour l'amorphe) et à celle des liquides, mais avec une viscosité très importante (comme le verre, d'où la dénomination de vitreux), ce qui permet de les classer parmi les solides. Angell (1988) décrit un solide vitreux comme n'importe quel liquide ou liquide sous-refroidi pour lequel la viscosité est comprise entre 1012 et 1013 Pa.s. Ainsi, un produit vitreux se comporte comme un solide car il est capable de supporter son propre poids sous l'effet de la gravité. Contrairement à l'état cristallin, les solides amorphes sont dans un état qui n'est pas stable car leurs propriétés thermodynamiques ne sont pas à l'équilibre. Pour cette raison, le solide amorphe va évoluer au cours du temps pour tendre vers l'organisation de l'état cristallin (Liu et al., 2006). Cette instabilité n'est pas sans conséquence sur le comportement des produits formés. Ainsi, toute modification de l'état physique d'un produit affecte les caractéristiques physico-chimiques des divers constituants de la poudre telles que la perte ou la dégradation de composés volatils (Senoussi et al., 1995 ; Beristain et al., 2003), voire la prise en masse du produit (Saltmarch et al., 1980 ; Ronkart et al., 2006a ; Ruan et al., 2007).
5Bien que l'agencement des molécules d'un solide amorphe ou vitreux soit désordonné, elles peuvent présenter un certain ordre à une très petite échelle similaire à celui d'un cristal (Yu, 2001). En effet, l'environnement entourant une molécule dans un état amorphe ou vitreux n'est pas significativement différent de son homologue à l'état cristallin et cette similitude moléculaire à petite échelle est de l'ordre de quelques Angströms (Hancock et al., 1997). Contrairement au solide cristallin, le solide amorphe ne présente pas une structure ordonnée à grande échelle. En d'autres termes, le solide amorphe ne présente pas de répétition en trois dimensions d'un motif structuré, ce qui l'empêche de présenter des pics de diffraction caractéristiques de la maille cristalline lorsqu'il est bombardé par des rayons X (Figure 1). Certaines techniques mettant en jeu un rayonnement plus pénétrant (diffraction des neutrons, diffraction des électrons) peuvent laisser apparaitre des pics caractéristiques d'un ordre à courte distance (Mathlouthi, 1975). C'est pourquoi il est nécessaire de préciser la technique ayant permis de caractériser l'état amorphe et on parlera ainsi d'un solide amorphe ou vitreux aux rayons X, à l'infrarouge, etc. (Mathlouthi, 1995).
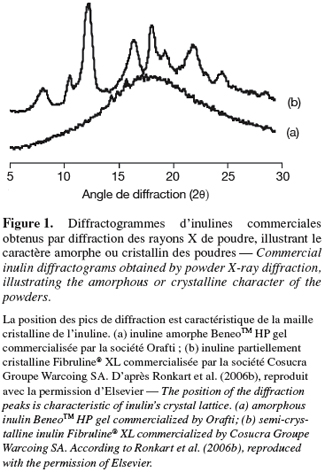
2.2. Formation des états amorphe et vitreux
6Dans le domaine alimentaire, de nombreux procédés peuvent générer la formation de divers états solides, pouvant être à l'origine de l'état amorphe ou vitreux du produit. Les principaux procédés technologiques à l'origine de la déstabilisation de l'état cristallin sont principalement les différentes formes de séchage (atomisation, lyophilisation, etc.) (Broadhead et al., 1992 ; Bhandari et al., 1999 ; 2005 ; Ronkart et al., 2007), de cisaillement mécanique (broyage, extrusion, etc.) (Kim et al., 2001 ; Le Meste et al., 2002) ou de refroidissement (Hancock et al., 1997).
7Dans le cas particulier de l'état vitreux, un requis pour sa formation est que la solidification obtenue à partir d'une substance à l'état fondu se réalise si rapidement qu'elle ne donne pas lieu à une nucléation et à un grossissement de cristaux (Hutchinson, 1995 ; Battezzati et al., 2007 ; Quintas et al., 2007). Si l'on se réfère à la figure 2, divers chemins de solidification d'un solide fondu peuvent être décrits. Dans le cas d'un refroidissement suffisamment lent, le produit suit le trajet ABLM. Il s'agit dans ce cas d'une cristallisation des molécules en dessous de la température de fusion (Tm). Par contre, si le refroidissement est trop rapide, l'échantillon peut rester à l'état liquide en dessous de son point de fusion, et l'augmentation de la viscosité du système ne permettra pas d'initier la cristallisation (ligne BC). Si au cours du refroidissement, la viscosité de ce solide fondu augmente rapidement et continuellement, alors il ne cristallisera jamais et le système se transformera en un amorphe vitreux (ligne CE). Si le fondu reste à l'état liquide lorsque la température diminue (ligne CO), l'extrapolation de cette tendance (ligne ACO) coupera celle de la ligne cristalline (ligne LP) au point M. La température correspondante (Tk) est appelée la température de Kauzmann (Kauzmann, 1948). En dessous de Tk, l'enthalpie du liquide sous-froidi est plus faible que celle du solide cristallin, ce qui veut dire que le liquide est plus ordonné que le solide. Ce fait, appelé le paradoxe de Kauzmann, est impossible car un liquide ne peut pas être plus ordonné qu'un solide cristallin (Perez, 1994). Toutefois, ce paradoxe est évité en pratique car le liquide sous-froidi se transforme toujours en un solide vitreux avant d'atteindre Tk.
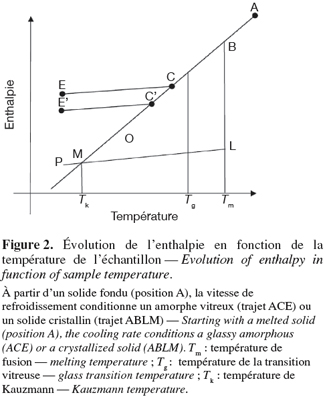
3. La transition vitreuse
3.1. Concept de la transition vitreuse
8Il existe deux catégories de transitions de phase dans les glucides alimentaires : les transitions de phases de premier ordre et celles de second ordre. La cristallisation, la fusion ou la condensation sont des transitions de phase du premier ordre, lesquelles sont caractérisées par l'absorption ou le dégagement de chaleur latente pendant le changement isotherme d'un état physique en un autre (liquide – solide, solide – liquide et gaz – liquide). La transition vitreuse est une pseudo-transition de second ordre car elle a lieu sans la libération ou l'absorption de chaleur latente. Ainsi, la transition vitreuse est préférablement qualifiée d'état de transition plutôt qu'une transition de phase (Schmidt, 2004). De plus, la transition vitreuse n'est pas réversible et est dépendante du temps, c'est-à-dire qu'elle est affectée par les conditions expérimentales telles que la vitesse de chauffage ou de refroidissement.
9La transition vitreuse est généralement caractérisée par une modification rapide des propriétés physiques, mécaniques, électriques et thermiques du matériau (Rahman, 1999). Ces changements de propriétés physiques sont classés en deux groupes :
10– les propriétés rhéologiques (viscoélasticité, etc.),
11– les propriétés thermodynamiques (chaleur spécifique, etc.).
12Bien qu'il existe divers outils thermo-analytiques qui exploitent ce changement de propriétés à la transition vitreuse, c'est l'analyse calorimétrique différentielle (DSC) qui est la plus largement utilisée.
3.2. La température de la transition vitreuse (Tg)
13Définition de la température de la transition vitreuse. La transition entre l'état vitreux et l'état caoutchouteux se produit à la température de la transition vitreuse (Tg). Cette transition peut être déterminée par chauffage ou refroidissement du matériau (Bhandari et al., 1999 ; Rahman, 1999 ; Le Meste et al., 2002). La transition vitreuse n'a pas lieu à une température unique, mais sur une gamme de température (Figure 3). Pour cette raison, la Tg peut être déterminée en début (Tg,onset), au milieu (Tg,midpoint) ou en fin de transition (Tg,endset). Afin d'être complet sur la valeur d'une Tg, il est nécessaire d'indiquer la vitesse de chauffage de l'analyse car la position de cette transition endotherme sur le thermogramme en dépend.
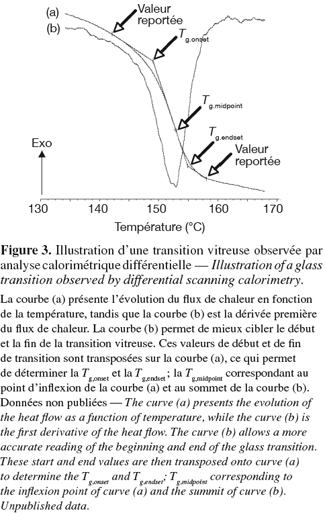
14Paramètres influençant la température de la transition vitreuse. La composition chimique, la présence d'eau et les propriétés physiques sont les principaux paramètres influençant la Tg des glucides alimentaires amorphes et sont décrits dans ce chapitre.
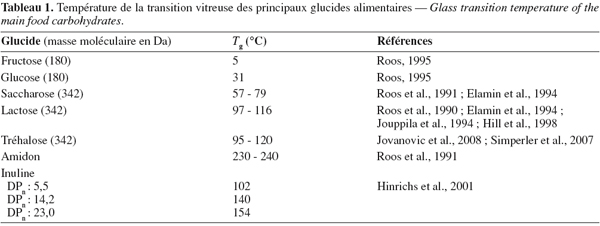
15Impact de la composition chimique et effet plastifiant : A masse moléculaire égale, la température de la transition vitreuse de glucides alimentaires est dépendante du type de monosaccharides (exemples : glucose, fructose, etc.) (Tableau 1). Pour une série homologue d'oligo- ou polysaccharides linéaires amorphes (comme les maltodextrines ou inulines), la Tg augmente avec le degré de polymérisation en raison de la diminution du volume libre du matériau. Cette augmentation de la Tg peut être modélisée selon l'équation 1, et atteint une valeur limite (Tg,∞) liée à l'enchevêtrement des molécules au-delà d'une certaine longueur de chaine (Ferry, 1980).

16où DP est le degré de polymérisation, K est une constante et Tg,∞ est la température de la transition vitreuse du polymère d'un poids moléculaire permettant la Tg la plus élevée.
17L'équation de Gordon-Taylor (équation 2) est régulièrement utilisée pour prédire la Tg d'un mélange binaire miscible (Gordon et al., 1952) :
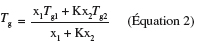
18où Tg, Tg1 et Tg2 sont les températures de la transition vitreuse du mélange binaire, du composé 1 et 2, respectivement, x1 et x2 sont les fractions molaires ou les fractions massiques des composés 1 et 2, respectivement, et K est la moyenne arithmétique de valeurs obtenues par la résolution d'une série de systèmes binaires à différents ratios des composés 1 et 2.
19Truong et al. (2002) ont exploité cette équation pour des mélanges binaires (glucide – glucide, glucide – eau) et l'ont extrapolée à des systèmes ternaires, quaternaires et d'ordres supérieurs.
20Effet plastifiant et antiplastifiant : un plastifiant est défini comme une substance incorporée dans un matériau pour augmenter sa maniabilité et sa flexibilité. Dans les systèmes alimentaires, l'eau est le principal agent plastifiant, avec une Tg de l'ordre de -136 °C, bien que la présence de cette transition vitreuse soit sujette à controverse (Johari, 2003 ; Yue et al., 2004). La Tg d'une substance hydrophile (comme les glucides) diminue lorsque la teneur en eau augmente. Cet effet plastifiant de l'eau est volontairement exploité pour déterminer la Tg de glucides présentant une température de dégradation inférieure à la Tg. Par exemple, la Tg de l'amidon anhydre est expérimentalement inaccessible car elle est estimée entre 230 et 240 °C (Roos et al., 1991), zone de température supérieure à la dégradation thermique de l'amidon. Pour palier ce problème, de nombreux auteurs ajoutent de l'eau à l'amidon afin d'obtenir une Tg inférieure à la température de dégradation du produit (Lim et al., 2001 ; Chung et al., 2002). Par extrapolation de la relation Tg – teneur en eau, la Tg de l'amidon anhydre peut être déterminée (Roos et al., 1991). Bien que le rôle de l'eau en tant qu'agent plastifiant soit très important, il n'est pas suffisamment maitrisé. En effet, les études moléculaires et structurales sont peu abondantes dans la littérature. Notons que Kilbrun et al. (2004) ont conclu que l'effet plastifiant de l'eau sur les glucides se réalise via un mécanisme complexe impliquant à la fois la formation et la rupture des liaisons hydrogène, ainsi que des changements du volume libre de la matrice. L'établissement de liaisons hydrogène entre plastifiant et amidon peut être décrit d'une manière assez précise, en adoptant une démarche stoechiométrique comme cela a été proposé dans le cas des mélanges eau – glycerol – amidon (Godbillot et al., 2006).
21Bien que l'équation de Gordon-Taylor soit largement acceptée pour prédire la Tg de tels mélanges, l'hypothèse du mélange idéal associé à la théorie du volume libre est rarement rencontrée en pratique. La théorie du mélange idéal postule que les volumes libres sont additifs et qu'aucune interaction entre les composants n'a lieu pendant le mélange. Il faut cependant noter qu'à cause de la présence de groupements hydrophiles dans les glucides, leur mélange induit généralement la formation de liaisons hydrogène intermoléculaires, ce qui entraine une augmentation de la Tg par rapport à la valeur prédite. Momany et al. (2002) ont mis en évidence que les sucres ont un effet plastifiant sur l'amidon, mais lorsque de l'eau est ajoutée au système, les sucres jouent un rôle d'antiplastifiant car ils augmentent la Tg du système. Kets et al. (2004) ont mis en évidence que les liaisons hydrogène du système saccharose – citrate de sodium induit une Tg du mélange supérieure à la Tg de chacun des constituants. L'ajout du citrate de sodium (faible poids moléculaire) au saccharose aurait dû diminuer la Tg du mélange. L'origine de cette augmentation de la Tg a été mise en évidence par la technique FT-IR (Fourier Transform - InfraRed) et a pu être corrélée à la forte liaison hydrogène entre le groupement carboxylique du citrate et l'hydroxyle du saccharose. Pittia et al. (2008) ont récemment publié une synthèse sur l'état des connaissances relatives à l'effet antiplastifiant.
22Impact de la fraction cristalline sur la Tg : l'impact de la fraction cristalline d'un produit sur sa Tg est très largement étudié dans le domaine des polymères synthétiques où la présence de cristaux a la conséquence de perturber et/ou d'augmenter la Tg de la fraction amorphe (Aref-Azar et al., 1996). Afin d'expliquer cette perturbation de la transition vitreuse par des cristaux, le modèle le plus largement accepté dans la littérature se base sur la présence de trois phases dans le produit :
23– la phase cristalline rigide,
24– la phase amorphe mobile,
25– la phase amorphe contrainte présente entre la phase amorphe mobile et la phase cristalline rigide.
26Parmi les glucides alimentaires, l'amidon présente ce cas de figure (Biliaderis, 1998). Les interactions entre les régions amorphes et cristallines induisent des changements dans la chaleur spécifique tout au long de la transition vitreuse, rendant difficile la mesure de la Tg de l'amidon. Pour cette raison, les régions cristallines sont couramment détruites afin de les convertir en zones amorphes avant la détermination de la Tg de l'amidon. Habituellement, cette étape est obtenue en gélatinisant (destruction des cristaux) les granules d'amidon par ajout d'eau et chauffage du système. Ensuite, la pâte d'amidon est déshydratée en évitant la rétrogradation de l'amidon, c'est-à-dire sa cristallisation et donc la formation de régions ordonnées engendrant des hétérogénéités au sein de la matrice amorphe (Chung et al., 2004). Toutefois, la Tg mesurée est différente de la Tg de l'amidon natif. Chung et al. (2002) ont émis diverses explications de cette différence entre la Tg de l'amidon natif ou rétrogradé et celle de l'amidon gélatinisé. Premièrement, les domaines cristallins sont entourés d'une phase amorphe continue dans les granules et jouent un lien physique avec la zone amorphe, réduisant de ce fait la mobilité des molécules amorphes. Deuxièmement, les zones amorphes intercristallines pouvant avoir une structure mixte entre des cristaux et une phase amorphe pure peuvent exister dans les granules d'amidon. De ce fait, la transition amorphe ne se distingue pas forcément de la fusion des cristaux.
27Dans le cas particulier de l'inuline qui a cristallisé à partir de l'état amorphe, la transition vitreuse de la fraction amorphe restante ne peut être observée que lors de la fusion des cristaux (Ronkart et al., 2009a ; 2009b). Bien que la détermination d'une Tg ne soit pas chose aisée lors du phénomène de fusion, un saut de chaleur spécifique a été identifié entre le début et la fin du pic endothermique de fusion, ce qui est caractéristique de la transition vitreuse.
4. Evolution des propriétés des glucides amorphes vitreux au-delà de la Tg
4.1. Diminution de la viscosité
28En dessous de la Tg, les produits amorphes sont dans un état éloigné de l'équilibre thermodynamique, bien que stable, c'est un état vitreux dont la viscosité du système est très élevée. Au-dessus de la Tg, les changements typiques des propriétés physiques d'un glucide amorphe sont le " collapse ", c'est-à-dire que la matrice ne peut plus supporter son propre poids, conduisant à des changements technofonctionnels de la poudre tels que le mottage (Tsourouflis et al., 1976). Le " collapse " résulte d'une diminution de la viscosité et d'une augmentation de la coulabilité de la poudre au-dessus de la Tg. Tsourouflis et al. (1976) et Peleg et al. (1977) ont observé que les températures de " collapse " de maltodextrines diminuent en réduisant le poids moléculaire des maltodextrines ainsi qu'en augmentant la teneur en eau. L'ajout de composés de haut poids moléculaire dans les jus d'orange ou dans des formulations pour bébé augmente la viscosité du système et joue donc un rôle dans le retardement du mottage de la poudre (Chuy et al., 1994).
29Ces phénomènes dynamiques sont contrôlés par la viscosité qui diminue drastiquement au-dessus de la Tg (Williams et al., 1955 ; Levine et al., 1986 ; Hancock et al., 1997). A une température supérieure à la Tg, le produit amorphe devient caoutchouteux, ce qui induit une nette diminution de la viscosité du système permettant au produit de s'écouler. Cette diminution de la viscosité peut être modélisée par l'équation 3 établie par William-Landel-Ferry (WLF) (Williams et al., 1955). Ce modèle décrit la dépendance de la viscosité (η) vis-à-vis de la température au-dessus de la Tg.
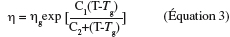
30où ηg est la viscosité à Tg, C1 et C2 sont des constantes.
31Williams et al. (1955) ont reporté des valeurs de constantes dites " universelles " de 17,44 et 51,60 pour C1 et C2, respectivement. Ces valeurs sont les moyennes des coefficients obtenus sur plusieurs polymères synthétiques et ont été exploitées pour prédire l'évolution de la viscosité de divers glucides (Raudonus et al., 2000). Toutefois, Ferry, un des auteurs du modèle WLF, a mis en garde sur l'utilisation de ces coefficients " universels " car il est plus adéquat de les déterminer pour chaque système d'étude.
4.2. Le mottage et autres défauts observés lors du stockage des glucides amorphes à l'état de poudre
32Le mottage (caking en anglais) est une dénomination générale de la modification des propriétés d'écoulement des poudres, comprenant à la fois la formation de petits agrégats (facilement friables ou durs), le collage voire la prise en masse totale de la poudre.
33La formation de liens entre les particules, due à la solidification d'une solution sursaturée à la surface des particules, était il y a 30 ans décrite comme le mécanisme responsable du mottage des poudres (Peleg et al., 1977). La prise en masse des glucides cristallins à l'état pulvérulent est dépendante de la granulométrie des particules constituant la poudre car les cristaux de faible dimension ont une surface spécifique élevée, et donc, une adsorption élevée, ce qui entraine une dissolution suivie d'une cristallisation. La formation de ces petits cristaux sert de ciment à la prise en masse de la poudre. Bien que ce mécanisme reste d'actualité pour décrire la prise en masse de glucides cristallins tels que le saccharose (Mathlouthi et al., 2003), elle n'est plus utilisée pour les poudres amorphes.
34Plus récemment, avec l'introduction du concept de la transition vitreuse, la plupart des cas de prise en masse des poudres alimentaires sont attribués à la diminution de la viscosité du matériau lors du passage de l'état amorphe rigide à celui de l'amorphe caoutchouteux (Aguilera et al., 1995). Si la poudre est conditionnée à une température inférieure à sa Tg, sa viscosité est extrêmement élevée, ce qui prend énormément de temps au plastifiant (l'eau, par exemple) pour mobiliser les particules et le temps de contact entre celles-ci doit être très long pour former un lien physique. Dans ce cas, la prise en masse n'a pas lieu au cours de la durée de vie du produit alimentaire. D'un autre côté, si la poudre est conditionnée à une température supérieure à sa Tg (à l'état caoutchouteux), la nette augmentation de la mobilité due à la diminution de la viscosité du système réduit le temps de contact et engendre un collage et une prise en masse de la poudre (Tsourouflis et al., 1976 ; Slade et al., 1991) (Figure 4). Dans ces conditions, le système peut également cristalliser avec une vitesse qui est fonction de la différence entre la température du produit et sa Tg (T- Tg), celle-ci étant plus rapide lorsque la différence est élevée (Senoussi et al., 1995).

35En plus de jouer un rôle dans le mottage et la cristallisation de la poudre, d'autres accidents de stockage peuvent apparaitre lorsque la poudre est conditionnée à une température supérieure à sa Tg. Il en est ainsi lorsque des composés amorphes cristallisent. Il y a alors rejet des molécules considérées comme impuretés en dehors de la maille cristalline, telles que des arômes encapsulés (Beristain et al., 2003) ou du diacétyle contenu dans le lait (Senoussi et al., 1995). De plus, l'état de l'eau dans le produit est modifié au cours de la cristallisation, passant d'un état mécaniquement lié à la matrice amorphe vers une forme libre migrant à la surface du cristal. Il en résulte une augmentation de l'activité de l'eau du produit, ce qui peut conduire à des réactions de dégradation, de développement microbien ou de prise en masse de la poudre.
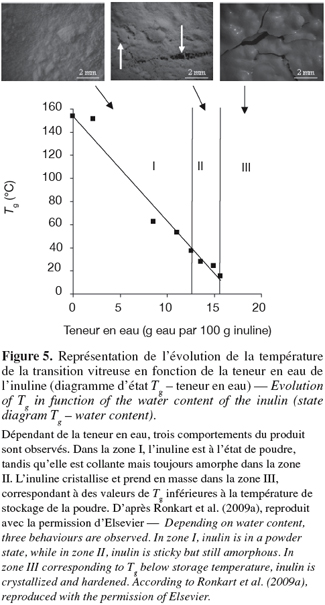
36La viscosité critique du collage (une étape avancée du mottage) est d'environ 107 Pa.s, ce qui est corrélé à la viscosité d'un matériau à la fin de la transition vitreuse (Roos et al., 1991). La température du point de " collage " (Tsticky), la température de collapse (Tcollapse) et la température de la transition vitreuse (Tg) semblent être toutes une manifestation du même phénomène physique. Pour cette raison, les transitions de phases et d'états des glucides, comme des produits alimentaires plus complexes, sont établies par des diagrammes de phase (relation Tg – teneur en eau), dont un exemple pour l'inuline est présenté à la figure 5. Ces graphiques sont très utiles en pratique pour prédire la stabilité d'une poudre dans des conditions de température ou d'humidité données (Rahman, 2006 ; Ronkart et al., 2009a).
5. Conclusion
37La compréhension de l'évolution des propriétés des poudres de glucides alimentaires lors de la production ou en cours de stockage revêt une importance primordiale pour l'industrie des ingrédients alimentaires car la plupart des produits conçus ou utilisés sont à l'état de poudre. Dans ce contexte, la maitrise et le contrôle des propriétés de base des poudres sont d'une importance capitale car elles conditionnent directement leurs technofonctionalités. Plus particulièrement, la température de la transition vitreuse ou Tg permet de prédire la stabilité des glucides à l'état de poudre. Le mottage engendre de grosses difficultés industrielles, notamment lors de la mise en œuvre ou lors de l'écoulement des poudres stockées en silo, par exemple. La littérature souligne que le mottage est observé lorsque la température de production ou de conditionnement du matériau devient supérieure à la Tg.
38La Tg d'une poudre n'est pas une valeur unique mais dépend de nombreux facteurs dont les plus importants sont la composition chimique, la teneur en eau, ainsi que les propriétés physiques de la poudre. En particulier, l'eau joue un rôle important en tant qu'agent plastifiant, ce qui rend l'établissement de diagrammes teneur en eau – Tg importants pour prédire le comportement de la poudre.
Bibliographie
Aguilera J.M., del Valle J.M. & Karel M., 1995. Caking phenomena in amorphous food powders. Trends Food Sci. Technol., 6(5), 149-155.
Angell C.A., 1988. Perspective on the glass transition. J. Phys. Chem. Solids, 49, 863-871.
Aref-Azar A., Arnoux F., Biddlestone F. & Hay J.N., 1996. Physical ageing in amorphous and crystalline polymers. Part 2. Polyethylene terephthalate. Thermochim. Acta, 273, 217-229.
Battezzati L., Castellero A. & Rizzi P., 2007. On the glass transition in metallic melts. J. Non-Crystalline Solids, 353, 3318-3326.
Beristain C.I., Azuara E., Tamayo T.T. & Vernon-Carter E.J., 2003. Effect of caking and stickiness on the retention of spray-dried encapsulated orange peel oil. J. Sci. Food Agric., 83, 1613-1616.
Bhandari B.R. & Howes T., 1999. Implication of glass transition for the drying and stability of dried foods. J. Food Eng., 40, 71-79.
Bhandari B.R. & Hartel R.W., 2005. Phase transitions during food powder production and powder stability. In: Onwulata C., ed. Encapsulated and powdered foods. New York, USA: Taylor and Francis, 261-291.
Biliaderis C.G., 1998. Structures and phase transitions of starch polymers. In: Walter R.H., ed. Polysaccharide association structures in food. New York, USA: Dekker, 57-168.
Broadhead J., Rouan Edmond S.K. & Rhodes C.T., 1992. The spray drying of pharmaceuticals. Drug Dev. Ind. Pharm., 18, 1169-1206.
Chung H.J., Lee E.J. & Lim S.T., 2002. Comparison in glass transition and enthalpy relaxation between native and gelatinized rice starches. Carbohydr. Polym., 48, 287-298.
Chung H.J. & Lim S.T., 2004. Physical aging of glassy normal and waxy rice starches. Carbohydr. Polym., 57, 15-21.
Chuy L.E. & Labuza T.P., 1994. Caking and stickiness of dairy-based food powders as related to glass transition. J. Food Sci., 59, 43-46.
Elamin A.A., Alderborn G. & Ahlneck C., 1994. The effect of precompaction processing and storage-conditions on powder and compaction properties of some crystalline materials. Int. J. Pharm., 108, 213-224.
Ferry J.D., 1980. Viscoelastic properties of polymers. 3rd ed. New York, USA: John Wiley & Sons.
Godbillot L. et al., 2006. Analysis of water binding in starch plasticized films. Food Chem., 96, 380-386.
Gordon M. & Taylor J.S., 1952. Ideal copolymers and the second-order transitions of synthetic rubbers. I. Non-crystalline copolymers. J. Appl. Chem., 2, 493-500.
Hancock B. & Zografi G., 1997. Characteristics and significance of the amorphous state in pharmaceutical system. J. Pharm. Sci., 86, 1-12.
Hill V.L., Craig D.Q.M. & Feely L.C., 1998. Characterization of spray-dried lactose using modulated differential scanning calorimetry. Int. J. Pharm., 161, 95-107.
Hinrichs W.L.J., Prinsen M.G. & Frijlink H.W., 2001. Inulin glasses for the stabilization of therapeutic proteins. Int. J. Pharm., 215, 163-174.
Hutchinson J.M., 1995. Physical aging of polymers. Prog. Polym. Sci., 20, 703-760.
Johari G.P., 2003. Calorimetric features of high-enthalpy amorphous solids and glass-softening temperature of water. J. Chem. Phys. B, 107, 9063-9070.
Jouppila K. & Roos Y., 1994. Water sorption and time-dependent phenomena of milk powders. J. Dairy Sci., 77, 1798-1808.
Jovanović N. et al., 2008. Stable sugar-based protein formulations by supercritical fluid drying. Int. J. Pharm., 346(1-2), 102-108.
Kauzmann W., 1948. The nature of the glassy state and the behaviour of liquids at low temperatures. Chem. Rev., 43, 219-256.
Kets E.P.W., Ijpelaar P.J., Hoekstra F.A & Vromans H., 2004. Citrate increases glass transition temperature of vitrified sucrose preparations. Cryobiology, 48, 46-54.
Kim Y.J. et al., 2001. Enthalpy relaxation and glass to rubber transition of amorphous potato starch formed by ball-milling. Carbohydr. Polym., 46, 1-6.
Le Meste M. et al., 2002. Glass transition and food technology: a critical appraisal. J. Food Sci., 67, 2444-2458.
Levine H., 2002. Introduction. Progress in amorphous food and pharmaceutical systems. In: Levine H., ed. Amorphous food and pharmaceutical systems. Cambridge, UK: The Royal Society of Chemistry, 1-8.
Levine H. & Slade L., 1986. A polymer physico-chemical approach to the study of commercial starch hydrolysis products (SHP's). Carbohydr. Polym., 6, 213-244.
Lim S.T., Chang E.H. & Chung H.J., 2001. Thermal transition characteristics of heat-moisture treated corn and potato starches. Carbohydr. Polym., 46, 107-115.
Liu Y., Bhandari B. & Zhou W., 2006. Glass transition and enthalpy relaxation of amorphous food saccharides: a review. J. Agric. Food Chem., 54, 5701-5717.
Makower B. & Dye W.B., 1956. Sugar crystallization, equilibrium moisture content and crystallization of amorphous sucrose and glucose. J. Agric. Food Chem., 4, 72-77.
Mathlouthi M., 1975. Etude de l'état physique du saccharose après lyophilisation. Ind. Aliment. Agric., 92, 1279-1285.
Mathlouthi M., 1995. Amorphous sugar. In: Mathlouthi M. & Reiser P., eds. Sucrose: properties and applications. London: Blackie Academic and Professional, 75-100.
Mathlouthi M. & Rogé B., 2003. Water vapour sorption isotherms and the caking of food powders. Food Chem., 82, 61-71.
Momany F.A. & Willett J.L., 2002. Molecular dynamics calculations on amylase fragments. I. Glass transition temperatures of maltodecaose at 1, 5, 10 and 15.8% hydration. Biopolymers, 63, 99-110.
Palmer K.J., Dye W.B. & Black D., 1956. X-ray diffractometer and microscopic investigation of crystallization of amorphous sucrose. J. Agric. Food Chem., 4, 77-81.
Peleg M. & Mannheim C.H., 1977. The mechanism of caking of powdered onion. J. Food Process. Preserv., 1, 3-11.
Perez J., 1994. Theories of liquid-glass transition. J. Food Eng., 22, 89-114.
Pittia P. & Sacchettia G., 2008. Antiplasticization effect of water in amorphous foods. A review. Food Chem., 106, 1417-1427.
Quintas L., Brandao T.R.S., Silva C.L.M. & Cunha R.L., 2007. Modelling viscosity temperature dependence of supercooled sucrose solutions – the random-walk approach. J. Phys. Chem. B, 111, 3192-3196.
Rahman M.S., 1999. Glass transition and other structural changes in foods. In: Rahman M.S., ed. Handbook of food preservation. New York, USA: Dekker, 75-93.
Rahman M.S., 2006. State diagram of foods: its potential use in food processing and product stability. Trends Food Sci. Technol., 17, 129-141.
Raudonus J. et al., 2000. Effect of oligomeric or polymeric additives on glass transition, viscosity and crystallization of amorphous isomalt. Food Res. Int., 53, 41-51.
Ronkart S. et al., 2006a. Determination of physical changes of inulin related to sorption isotherms: an X-ray diffraction modulated differential scanning calorimetry and environmental scanning electron microscopy study. Carbohydr. Polym., 63, 210-217.
Ronkart S.N. et al., 2006b. Determination of total water content in inulin using the volumetric Karl Fischer titration. Talanta, 70, 1006-1010.
Ronkart S.N. et al., 2007. Characterization of the physical state of spray-dried inulin. Food Biophys., 2, 83-92.
Ronkart S.N. et al., 2009a. Effect of water uptake on amorphous inulin properties. Food Hydrocolloids, 23, 922-927.
Ronkart S.N. et al., 2009b. Impact of the crystallinity on the physical properties of inulin during water sorption. Food Biophys., 4, 49-58.
Roos Y.H. & Karel M., 1990. Differential scanning calorimetry study of phase transition affecting the quality of dehydrated materials. Biotechnol. Progress, 6, 159-163.
Roos Y.H. & Karel M., 1991. Phase transitions of mixtures of amorphous polysaccharides and sugars. Biotechnol. Progress, 7, 49-53.
Roos Y., 1995. Characterization of food polymers using state diagrams. J. Food Eng., 24, 339-360.
Ruan R., Choi Y.J. & Chung M.S., 2007. Caking in food powders. Food Sci. Biotechnol., 16, 329-336.
Saltmarch M. & Labuza T.P., 1980. Influence of relative humidity on the physicochemical state of lactose in spray-dried sweet whey powders. J. Food Sci., 45, 1231-1242.
Schmidt S.J., 2004. Water and solids mobility in foods. Adv. Food Nutr. Res., 48, 1-101.
Senoussi A., Dumoulin E.D. & Berk Z., 1995. Retention of diacetyl in milk during spray-drying and storage. J. Food Sci., 60, 894-905.
Simperler A. et al., 2007. The glass transition temperatures of amorphous trehalose-water mixtures and the mobility of water: an experimental and in silico study. Carbohydr. Res., 342, 1470-1479.
Slade L. & Levine H., 1991. Beyond water activity: recent advances based on an alternative approach to the assessment of food quality and safety. Crit. Rev. Food Sci. Nutr., 30, 115-360.
Tammann G., 1926. The states of aggregation. New York, USA: Ed. VanNostrand.
Truong V., Bhandari B.R., Howes T. & Adhikari B., 2002. Analytical model for the prediction of glass transition temperature of food systems. In: Levine H., ed. Amorphous food and pharmaceutical systems. Cambridge, UK: Royal Society of Chemistry, 31-47.
Tsourouflis S., Flink J.M. & Karel M., 1976. Loss of structure in freeze-dried carbohydrates solutions: effect of temperature, moisture content and composition. J. Sci. Food Agric., 27, 509-519.
White G.W. & Cakebread S.H., 1966. The glassy state in certain sugar-containing food products. J. Food Technol., 1, 73-82.
Williams M.L., Landel R.F. & Ferry J.D., 1955. The temperature dependence of relaxation mechanisms in amorphous polymers and other glass-forming liquids. J. Am. Chem. Soc., 77, 3701-3707.
Yu L., 2001. Amorphous pharmaceutical solids: preparation, characterization and stabilization. Adv. Drug Delivery Rev., 48, 27-42.
Yue Y. & Angell C.A., 2004. Clarifying the glass-transition behaviour of water by comparison with hyperquenched inorganic glasses. Nature, 427, 717-720.
Om dit artikel te citeren:
Over : Sébastien N. Ronkart
Gembloux Agricultural University – FUSAGx. Department of Food Technology. Passage des Déportés, 2. B-5030 Gembloux (Belgium). E-mail : ronkart.s@fsagx.ac.be – Gembloux Agricultural University – FUSAGx. Department of Industrial Biological Chemistry. Passage des Déportés, 2. B-5030 Gembloux (Belgium).
Over : Christophe S. Blecker
Gembloux Agricultural University – FUSAGx. Department of Food Technology. Passage des Déportés, 2. B-5030 Gembloux (Belgium).
Over : Claude Deroanne
Gembloux Agricultural University – FUSAGx. Department of Food Technology. Passage des Déportés, 2. B-5030 Gembloux (Belgium).
Over : Michel Paquot
Gembloux Agricultural University – FUSAGx. Department of Industrial Biological Chemistry. Passage des Déportés, 2. B-5030 Gembloux (Belgium).






