- Accueil
- volume 12 (2008)
- numéro 4
- Caractéristiques moléculaires de l'immunité des plantes induite par les rhizobactéries non pathogènes
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Caractéristiques moléculaires de l'immunité des plantes induite par les rhizobactéries non pathogènes

Notes de la rédaction
Reçu le 29 janvier 2008, accepté le 6 mai 2008
Résumé
La reconnaissance par la plante de certaines bactéries de la rhizosphère peut conduire à une réaction d'immunisation lui permettant de mieux se défendre vis-à-vis d'une attaque ultérieure par un organisme pathogène. Utilisé en combinaison avec d'autres approches phytosanitaires, ce phénomène d'induction de résistance systémique (ISR) par les rhizobactéries est considéré comme une stratégie prometteuse dans la lutte biologique contre les maladies des cultures. Cet article présente les aspects moléculaires intervenant à chacune des trois étapes de ce processus, c'est-à-dire la perception des éliciteurs bactériens par les cellules de la plante, la transmission d'un signal nécessaire pour propager l'état induit dans tous les organes de la plante et l'expression des mécanismes de défense proprement dits qui vont limiter ou inhiber la pénétration du pathogène dans les tissus infectés. L'état des connaissances sur l'ISR est exposé en parallèle avec les informations dont on dispose concernant la résistance systémique acquise qui est similaire d'un point de vue phénotypique mais qui est induite suite à une interaction incompatible avec un agent pathogène.
Abstract
Molecular characteristics of the rhizobacteria-triggered plant immunity. Recognition of certain non-pathogenic rhizobacteria by plants can trigger a systemic resistance reaction that renders the host less susceptible to subsequent infection by a virulent agent. Used in combination with other approaches, this induced systemic resistance (ISR) phenomenon is considered as a promising strategy for plant disease control both in greenhouse cultures and under field conditions. This review emphasizes the molecular aspects of this three-step process involving sequentially the perception by plant cells of elicitors produced by the inducing agents that initiates the phenomenon, signal transduction that is needed to propagate the induced state systemically through the plant and expression of defense mechanisms sensu stricto that limit or inhibit pathogen penetration into the host tissues. The current state of knowledge about rhizobacteria-stimulated ISR is discussed in parallel with the better characterized systemic acquired resistance induced by incompatible pathogens.
Table des matières
1. L'Isr dans l'immunité systémique des plantes
1Lors de l'agression d'une plante par un pathogène, plusieurs cas de figure peuvent se présenter. L'interaction incompatible correspond à une incapacité du pathogène à infecter la plante et peut être due à la présence de barrières physiques (cuticule, paroi végétale) et/ou chimiques (composés antimicrobiens) (Nurnberger et al., 2005). La reconnaissance de l'attaque d'un pathogène et une réponse rapide de l'hôte peuvent également restreindre ou stopper l'invasion. Après la pénétration du phytopathogène à travers la paroi végétale ou via une blessure, sa présence peut être révélée grâce à des motifs moléculaires associés aux pathogènes (PAMPs) (Chisholm et al., 2006). La perception de ces motifs par la plante pourra initier une réponse immunitaire de base (PAMP-Triggered Immunity, PTI), afin de limiter l'invasion (Jones et al., 2006). Cependant, si les défenses mises en place sont inappropriées, si la plante ne réagit pas assez rapidement ou si les voies de défense sont « désactivées », l'interaction entre la plante et le microorganisme sera compatible et suivie par une prolifération du pathogène. En effet, les pathogènes ont appris à masquer leur présence en interférant avec les voies de défense de la plante. Cette désactivation s'effectue via la sécrétion par le pathogène d'effecteurs appelés protéines d'avirulence qui sont, dans le cas des bactéries Gram-, directement injectés dans la cellule hôte par un système spécifique (Type Three Secretion System, TTSS) (Abramovitch et al., 2004).
2En parallèle aux protéines d'avirulence, certaines plantes ont développé des protéines polymorphiques NBS-LRR (à domaines Nucleotide Binding Site et Leucine Rich Repeat), codées par les gènes de résistance R (Gómez-Gómez, 2004). Cette interaction préférentiellement intracellulaire entre les produits de gènes d'avirulence de pathogènes (Avr) et de résistance de l'hôte végétal (R) est appelée résistance « gènes pour gènes ». La réponse en découlant est notamment décrite comme l'immunité déclenchée par les effecteurs (Effector-Trigered Immunity, ETI). L'immunité ETI peut être considérée comme une version amplifiée de l'immunité PTI (Garcia-Brugger et al., 2006) et est souvent décrite comme menant à une mort cellulaire programmée localisée au niveau des tissus infectés : la réponse hypersensible (HR) (Jones et al., 2006). En plus de l'inhibition directe du phytopathogène ou de son confinement au site d'infection, la HR libérerait des signaux conditionnant les cellules adjacentes à devenir (plus) réactives et activerait des réponses plus étendues (Kombrink et al., 2001). C'est le cas de la LAR (Local Acquired Resistance), qui est caractérisée par une augmentation de la résistance des tissus adjacents du site d'infection, et de la SAR (Systemic Acquired Resistance), développée dans l'ensemble du végétal (Durrant et al., 2004). La SAR est généralement activée par des pathogènes nécrotiques mais peut aussi être induite suite au traitement par des molécules purifiées issues d'autres pathogènes (Cérébrosides, Lipid transfer protein, Oligosaccharides) et par certains composés synthétiques (acide salicylique, acide β-amino-butyrique, acide 2,6-dichloro-isonicotinique ou acibenzolar-S-methyl-benzothiadiazole, BTH) (Sticher et al., 1997). La résistance conférée par ce phénomène persiste dans le temps et est effective sur une multitude de plantes et contre un large spectre de pathogènes incluant virus, bactéries, champignons et nématodes.
3L'effet protecteur conféré par la SAR est phénotypiquement similaire à un autre phénomène, découvert plus récemment, déclenché suite à l'interaction avec un microorganisme non pathogène. Cette « immunisation » de la plante, ne provoquant pas de symptômes visibles de maladie, est appelée résistance systémique induite (ISR) (Van Loon et al., 2005). L'ISR s'est avérée être induite par des microorganismes variés et plus particulièrement par des rhizobactéries. Celles-ci incluent des bactéries Gram+ comme Bacillus pumilus, Bacillus subtilis, Bacillus amyloquefaciens et Bacillus thuringiensis (Kloepper et al., 2004), ou des bactéries Gram- qui sont les plus étudiées dans le contexte de l'ISR. Bien que des entérobactéries comme Serratia (Serratia marcesens, Serratia plymuthica) ou Pantoea agglomerans interviennent dans la mise en alerte de la plante-hôte, la plupart des souches Gram- impliquées appartiennent au genre Pseudomonas (Pseudomonas fluorescens, Pseudomonas putida, Pseudomonas aeruginosa) (Bakker et al., 2007). Comme pour la SAR, l'ISR diminue significativement l'impact de maladies causées par des champignons racinaires (Fusarium oxysporum, Pythium aphanidermatum) ou aériens (Botrytis cinerea, Alternaria brassicicola), par des bactéries (Pseudomonas syringae, Erwinia amylovora, Xanthomonas campestris), des virus (Tobacco mosaic virus, Tomato mottle virus) et par certains nématodes (Globodera pallida, Meloidogyne incognita) (Ongena et al., 2006).
4Dans l'ensemble, les bactéries ayant un impact positif sur la plante, par le biais d'un effet protecteur ou via une stimulation de sa croissance, ont communément été regroupées sous le terme de rhizobactéries promotrices de la croissance des plantes, ou PGPR (Plant Growth Promoting Rhizobacteria) (Mercado-Blanco et al., 2007).
5Contrairement aux réponses mises en place par la plante suite à des attaques par des pathogènes, celles induites par des microorganismes bénéfiques sont moins connues et beaucoup de questions concernant l'ISR restent encore à être élucidées. Néanmoins, l'ISR peut être divisée en trois étapes principales que sont la perception des molécules actives produites par le PGPR ou élicitation, la transmission d'un signal systémique dans la plante et l'expression des mécanismes de défense de l'hôte (Ongena et al., 2006) (Figure 1). Malgré un effet protecteur visiblement similaire, l'ISR semble présenter certaines divergences avec la SAR. Dans les sections suivantes, nous proposons de détailler les différentes étapes intervenant lors de l'ISR induite par des rhizobactéries et lors de la SAR.
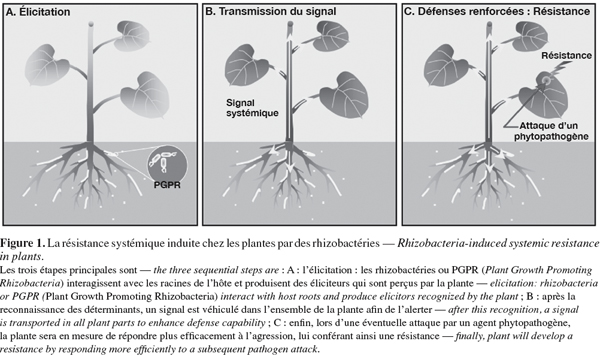
2. Perception des éliciteurs par les cellules végétales
2.1. Les éliciteurs de pathogènes
6La reconnaissance mutuelle entre un microorganisme et son hôte est basée sur une « communication » moléculaire et, en règle générale, les composés capables de déclencher une réponse de l'hôte sont dénommés éliciteurs. Les éliciteurs de phytopathogènes sont constitués des PAMPs, non spécifiques, qui sont reconnus par plusieurs plantes et des composés plus spécifiques, les protéines d'avirulence, qui sont reconnues par des cultivars particuliers (Montesano et al., 2003).
7Les PAMPs interviennent dans l'immunité PTI et appartiennent à une large classe de molécules incluant des composés lipidiques, des glycolipides, des polymères de sucres, ou des (glyco-) peptides et protéines (Tableau 1). Toutefois, les structures des différentes classes de PAMPs sont hautement conservées d'un microorganisme à l'autre. Ces éliciteurs, isolés de virus, bactéries, champignons, oomycètes ou algues marines, sont produits de manière constitutive par le pathogène car ils sont généralement essentiels à son bon fonctionnement (Nurnberger et al., 2005 ; Chisholm et al., 2006).
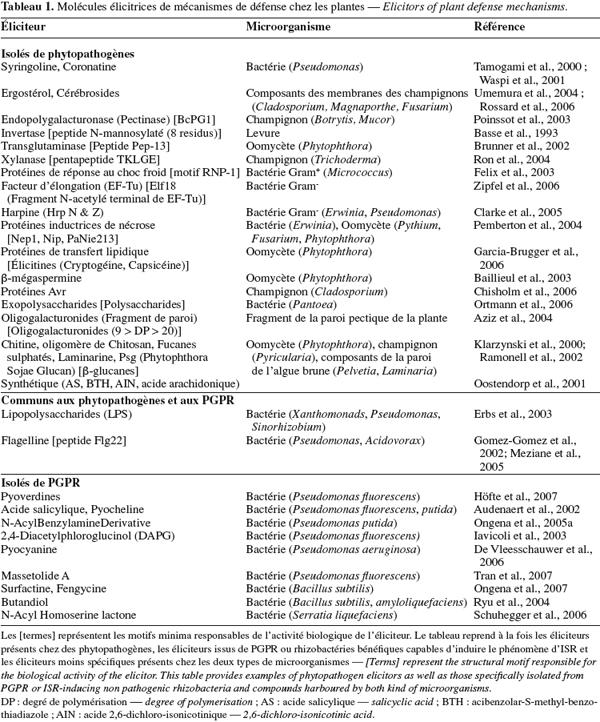
8D'autre part, bien qu'elles ne soient pas considérées comme des PAMPs, les protéines d'avirulence sont tout de même reprises comme molécules élicitrices de défense, puisqu'elles sont en mesure de déclencher une réponse hypersensible chez les plantes possédant les gènes de résistance. Chez les plantes sensibles, elles facilitent la pathogénicité, entre autre, en retardant le renforcement de la paroi (formation de callose), en modifiant l'activité de protéines dans la cellule-hôte ou en interférant avec la transcription des gènes de défense (Montesano et al., 2003 ; Chisholm et al., 2006 ; Jones et al., 2006).
9Les récepteurs des PAMPs, les PRRs (Pattern Recognition Receptors) ou RLK (Extracellular receptor-Like Kinases), n'ont pas encore été tous identifiés. Cependant, la plupart de ceux connus sont constitués de trois domaines distincts : un domaine extracellulaire (riche en leucine) interagissant avec le PAMP, un domaine transmembranaire et un domaine kinase, responsable de la transmission du signal (Nurnberger et al., 2006).
2.2. Les éliciteurs de l'ISR
10Beaucoup d'études réalisées durant la dernière décennie ont permis d'isoler une quantité toujours croissante de rhizobactéries capables de stimuler l'ISR chez divers hôtes. Cependant, les principes actifs responsables de l'activité biologique de ces souches n'ont été que rarement identifiés. Aujourd'hui, les quelques éliciteurs connus sont classés selon trois catégories : les composants de surface cellulaires, les métabolites régulés par le fer et les antibiotiques (Ongena et al., 2006).
11La mobilité et l'adhésion racinaire d'une rhizobactérie sont des éléments importants pour une colonisation effective de l'hôte. Ces propriétés dépendent en partie des lipopolysaccharides (LPS) et des flagelles présents à la surface des membranes bactériennes (Persello-Cartieaux et al., 2003). L'implication du flagelle dans le phénomène d'ISR a été démontrée en comparant les taux de protection observés après traitement par la rhizobactérie bénéfique avec leurs flagelles purifiés ou via l'utilisation de souches mutantes. C'est notamment le cas de P. putida WCS358, dont les flagelles interviennent dans l'induction de résistance chez Arabidopsis contre P. syringae (Meziane et al., 2005). D'autres travaux menés par ce groupe de recherche révèlent que la flagelline de la même souche ne semble pas apte à stimuler l'ISR chez la tomate et le haricot contre B. cinerea et Colletotrichum lindemuthianum, suggérant des propriétés différentes selon le phytosystème étudié. L'activité biologique du flagelle pourrait être due à la partie N-terminale (Flg 22) de la flagelline qui est la protéine constituant le flagelle (Gomez-Gomez et al., 2002). D'autre part, l'utilisation d'extraits d'enveloppe de cellules, de mutants ou de composés purifiés a aussi permis de démontrer le rôle des LPS dans l'induction de résistance. C'est le cas notamment lors de l'ISR induite par certaines souches de P. fluorescens, de P. putida, Burkholderia cepacia et Rhizobium elti dont les LPS ont été testés avec des résultats positifs sur des pathosystèmes aussi divers que Arabidopsis/F. oxysporum, haricot/B. cinerea, tabac/Phytophthora nicotianeae et pomme de terre/cyst nematode (VanWees et al., 1997 ; Reitz et al., 2002). Ces LPS sont constitués d'un noyau oligosaccharidique liant un groupement polysaccharidique (antigène O) à une chaîne lipidique (lipide A) intégrée dans la membrane externe des bactéries Gram-. Dans de nombreux cas, l'utilisation de LPS possédant une modification de la chaîne antigénique O n'ont pas d'activité biologique, suggérant le rôle de cette sous-structure dans la reconnaissance par la plante (Van Loon et al., 1998). Cependant, il est important de noter que les flagelles et les LPS sont des composés particuliers, car ils appartiennent à la fois à la famille des éliciteurs de l'ISR et à celle des PAMPs, présents chez les pathogènes.
12Parmi les métabolites régulés par le fer, les pyoverdines produites par les espèces fluorescentes de Pseudomonas sont des molécules chélatrices du fer (sidérophores) ayant une forte affinité pour les ions Fe3+. Leur production permet ainsi aux microorganismes de se développer dans un environnement pauvre en fer. Les pyoverdines, également appelées pseudobactines, présentent la même structure générale : une séquence peptidique de 6-12 acides aminés (spécifique de la souche bactérienne) liée à un chromophore responsable de leur activité chélatrice (Budzikiewicz, 2004). Par exemple, les pyoverdines de P. fluorescens WCS358 peuvent induire l'ISR chez Arabidopsis, le haricot, la tomate et l'eucalyptus (Höfte et al., 2007). Toujours dans des conditions limitantes en fer, certains microorganismes peuvent produire de l'acide salicylique (SA) dont l'activité élicitrice a été montrée grâce à P. aeruginosa 7NSK2 et KMPCH (De Meyer et al., 1997) et à P. fluorescens P3 (Maurhofer et al., 1998). L'AS intervient aussi comme précurseur de biosynthèse de la pyocheline, un autre sidérophore capable de stimuler une réponse défensive chez les plantes (Audenaert et al., 2002).
13Les éliciteurs appartenant à la classe des antibiotiques sont principalement produits par des bactéries du genre Pseudomonas. Le 2,4-diacetylphoroglucinol (DAPG), synthétisé par P. fluorescens CHAO, est notamment l'un des premiers à avoir été mis en évidence pour son action contre Peronospora parasitica et le nématode Meloidogyne javanicasur via la stimulation des défenses de plants d'Arabidopsis et de tomate (Iavicoli et al., 2003 ; Siddiqui et al., 2003). La pyocyanine, composé de la famille des phénazines, est l'exemple d'un autre antibiotique ayant une activité élicitrice de résistance (De Vleesschauwer et al., 2006).
14Ces deux dernières années, les recherches réalisées sur la stimulation de résistance par les microorganismes bénéfiques ont mené à l'isolation de nouveaux éliciteurs. P. putida BTP1 est en mesure de protéger le haricot, le concombre et la tomate par l'intermédiaire du NABD (N-Alkylated Benzylamine Derivated) (Ongena et al., 2005a). Dans le même sens, les N-acyl-L-homosérine lactones de Serratia liquefaciens MG1 et P. putida IsoF, sont responsables de la majorité de l'activité élicitrice des souches sur la tomate contre Alternaria alternata (Schuhegger et al., 2006). Les lipopeptides constituent un autre type d'éliciteur récemment rapporté. La massetolide A est un lipopeptide cyclique produit par P. fluorescens SS101 actif sur la tomate contre Phytophthora infestans (Tran et al., 2007) tandis que la surfactine et la fengycine, toutes deux produites par Bacillus subtilis, induisent l'ISR chez la tomate et le haricot (Ongena et al., 2007). Enfin, certains composés volatils semblent aussi avoir une activité élicitrice de l'ISR. Ryu et ses collaborateurs ont en effet observé que le butanediol, produit par Bacillus amyloliquefaciens IN937a et B. subtilis GB03 diminuait significativement l'impact de la maladie provoquée par Erwinia carotovora sur des graines d'Arabidopsis (Ryu et al., 2004).
3. Premiers événements cellulaires induits
15Plusieurs recherches sont désormais disponibles sur les événements précoces mis en place dans les cellules végétales après la reconnaissance d'un éliciteur. L'utilisation sur suspensions de cellules de la cryptogéine, protéine nécrotique secrétée par Phytophthora cryptogea, a permis d'établir un modèle lors de l'interaction avec les PAMPs (Garcia-Brugger et al., 2006). Succinctement, la fixation de l'éliciteur sur son récepteur agirait sur des canaux calciques et, via une cascade d'événements, aboutirait à l'expression de gènes de défense. Une description plus détaillée de ces phénomènes est fournie dans la figure 2.
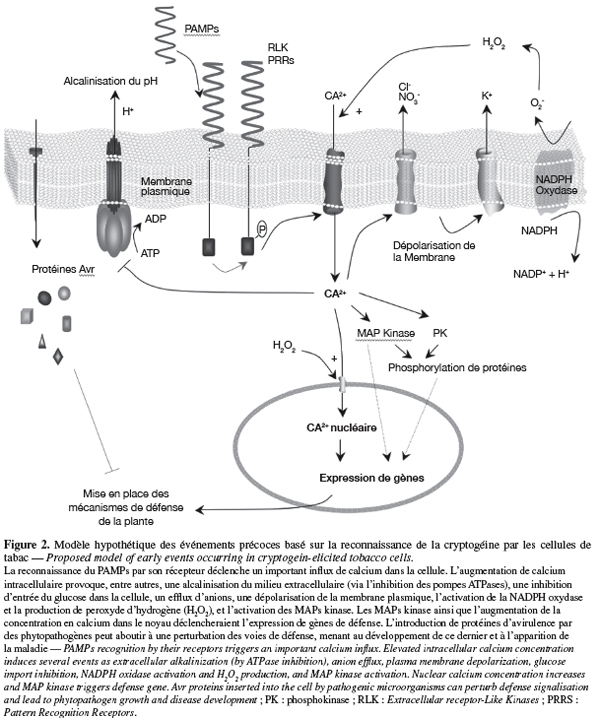
16Les études sur la flagelline ont essentiellement été menées avec des flagelles purifiés à partir de souches pathogènes ou avec des peptides synthétiques. En plus de l'alcalinisation du milieu extracellulaire ou la production d'H2O2 illustrées par certains auteurs, la flagelline est aussi en mesure de stimuler la production d'éthylène (Felix et al., 1999). En effectuant des travaux sur Arabidopsis, d'autres auteurs ont réussi à identifier l'ensemble de la cascade des MAPs kinases ainsi que des facteurs de transcription qui étaient activés après la fixation du peptide flg22 sur son récepteur FLS2 (Zipfel et al., 2004 ; Chinchilla et al., 2006). Enfin, à part une diminution de la viabilité des cellules de riz en culture, le traitement par la flagelline ne semble pas provoquer de mort cellulaire sur les cultures de cellules de plantes dicotylédones (Che et al., 2000). Il peut donc être envisageable que le récepteur FLS2 puisse aussi reconnaître les flagelles des microorganismes bénéfiques et déclencher une cascade de réponses de défense sans pour autant provoquer de dégâts dans les cellules de l'hôte. L'utilisation des LPS de B. cepacia, une souche inductrice de l'ISR, a abouti à l'identification de plusieurs phosphoprotéines chez le tabac qui seraient initialement activées par une protéine G couplée à son récepteur (Gerber et al., 2006). Celles-ci indiquent que les événements précoces induits par les LPS impliquent, entre autres, une signalisation dépendante du Ca2+, la régulation d'une H+-ATPase ou la production d'espèces oxydantes, suggérant ainsi que des mécanismes liés à la reconnaissance des LPS soient similaires à ceux déclenchés par les PAMPs.
17Hormis les LPs et contrairement aux PAMPs, peu d'études décrivant les événements précoces induits lors de l'interaction avec des éliciteurs spécifiques de l'ISR sont publiées. De Vleesschauwer et ses collaborateurs ont observé que le traitement des racines de riz par le PGPR P. aeruginosa 7NSK2 induisait une résistance contre Magnaporthe grisea, un pathogène hémibiotrophe (De Vleesschauwer et al., 2006). Cet effet protecteur est induit par la pyocyanine produite par la souche et les auteurs ont observé que l'application de l'éliciteur purifié provoquait la génération de peroxyde d'hydrogène dans les cellules de la plante hôte, pouvant inhiber la croissance du pathogène. La surfactine, un autre éliciteur de l'ISR, a récemment fait l'objet de travaux sur les événements précoces induits. Son addition à des cultures de cellules de tabac entraîne aussi des réponses telles que l'alcalinisation du milieu extracellulaire ou l'accumulation de H2O2, ainsi qu'une augmentation de la synthèse et de l'activité d'enzymes de défense comme la lipoxygénase (LOX) et la phénylalanine ammonia-lyase (PAL) (Jourdan et al., article soumis).
18La particularité de la flagelline et les LPS comme éliciteurs présents chez des phytopathogènes mais également chez des PGPR révèle la complexité dans l'établissement d'un modèle sur l'ISR. Cependant, il semble que des réponses soient communes lors de la reconnaissance des différents types d'éliciteurs et que des divergences apparaissent par la suite, menant soit à la mort des cellules en contact avec un éliciteur issu de phytopathogènes et à l'établissement d'une réponse de type SAR, soit à l'induction de l'ISR par un éliciteur de PGPR.
4. Transmission du signal
19Dans l'état actuel des connaissances, les voies de signalisation de l'état induit chez les plantes sont régulées par trois molécules, l'acide salicylique (AS), l'acide jasmonique (JA) et l'éthylène (ET). Au niveau moléculaire, la SAR est aussi caractérisée par une activation de gènes codant pour des protéines PR (Pathogenesis-related), souvent considérée comme marqueur de cette résistance (Durrant et al., 2004). La SAR est associée avec une augmentation de la concentration d'AS endogène à la fois localement au niveau du site d'infection, mais aussi de manière systémique dans les tissus distants. Des expériences réalisées avec des plants de tabac NahG, incapables d'accumuler l'AS car produisant une enzyme le dégradant en catéchol inactif, ont démontré que cette molécule était indispensable dans la voie de signalisation (Delaney, 1994). À l'origine, plusieurs hypothèses ont d'ailleurs été émises sur le rôle joué par l'AS en tant que signal systémique dans l'établissement de la SAR. Par la suite, des plants de concombre dont les feuilles, inoculées par P. syringae puis excisées avant toute accumulation d'AS, ont tout de même développé la SAR, contredisant alors les premiers résultats (Molders et al., 1996). Les hypothèses sont actuellement dirigées vers l'existence d'un composé de nature lipidique qui serait la molécule signal diffusant à travers la plante. Des expériences menées sur des plants mutés au niveau du gène Dir1 développent une résistance locale mais sont cependant incapables d'exprimer la SAR. La séquence de ce gène est proche de celles codant pour des protéines LTPs (Lipid Tranfer Proteins) et pourrait donc être impliquée dans la synthèse et la transmission du signal lipidique circulant. La signalisation semble néanmoins requérir l'intervention d'une protéine se liant à l'AS, SABP2, nécessaire à l'activation d'un facteur protéique, NPR1 (Non-expressor of Pathogenesis-Related Genes1) (Figure 3) (Durrant et al., 2004). La fixation de l'AS sur SABP2 provoquerait un changement du potentiel redox dans le milieu intracellulaire. Des oligomères de NPR1 seraient alors convertis en monomères capables de migrer vers le noyau et d'interagir avec des facteurs de transcription, aboutissant à l'expression de gènes PR intervenant dans les défenses de la plante (Fobert et al., 2005).
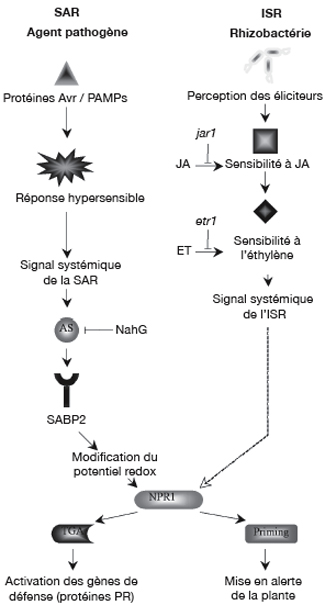

20Certaines rhizobactéries bénéfiques sont aussi en mesure d'induire une résistance associée à une accumulation d'AS. Celle-ci fut mise en évidence grâce à l'utilisation de plants NahG. Ainsi P. aeruginosa 7NSK2 n'est pas en mesure d'induire l'ISR chez des plants de tabac et de tomate transformés (Höfte et al., 2007). De même, B. pumilus SE34 protège Arabidopsis contre P. syringae pv. maculicola via une signalisation dépendante de l'AS (Ryu et al., 2003). Cependant, dans la majorité des cas, la résistance induite par les PGPRs est considérée comme étant indépendante de l'AS mais plutôt liée à la perception de l'acide jasmonique (JA) et de l'éthylène (ET). Par exemple, l'effet protecteur conféré par la rhizobactérie P. fluorescens WCS417 contre le pathogène P. syringae est maintenu, même sur des plants d'Arabidopsis NahG (Pieterse et al., 2002). Par contre, aucune protection n'est observée sur des plants mutants jar1 (JA-insensitive) ou etr1 (Ethylene-insensitive), respectivement déficients dans les voies de réponse à l'acide jasmonique et à l'éthylène. Les auteurs ont donc conclu que la voie de transduction de l'ISR chez Arabidopsis était basée sur une augmentation de la sensibilité à ces hormones plus qu'à une augmentation de leur concentration et ont montré que la perception de l'ET intervenait en aval par rapport à celle du JA (Pieterse et al., 2000). Une voie de signalisation dépendante de ces deux hormones a par la suite été observée dans de nombreux cas, comme par exemple chez des plants de tomate NahG traités par B. pumilus SE34 ou P. fluorescens 89B61 (Yan et al., 2002). De même, l'absence d'accumulation d'AS suite au traitement de racines de haricot par P. putida BTP1 suggère également une voie indépendante de la signalisation de type SAR (Ongena et al., 2004).
21Toujours dans l'optique d'identifier les voies de signalisation de l'ISR, Pieterse et ses collaborateurs ont observé que la souche WCS417 n'était pas capable d'induire l'ISR sur des plants d'Arabidopsis mutés au niveau du gène NPR1 (Pieterse et al., 1998). Ainsi, malgré des voies de signalisation globalement différentes, les résistances induites par un pathogène ou par une rhizobactérie semblent liées. Le spectre d'efficacité de la SAR et de l'ISR se chevaucherait partiellement et la protéine NPR1 serait apte à réguler distinctement l'expression de gènes de défense dépendante de l'une ou l'autre voie de signalisation, activée en amont. Ces dernières années, les mécanismes régissant les voies de transduction se sont avérés plus complexes. En effet, des recherches réalisées sur Arabidopsis ont démontré que la souche B. subtilis GB03 pouvait induire l'ISR via une voie indépendante du facteur de transcription NPR1 (Ryu et al., 2004). De même, la souche P. aeruginosa 7NSK2, précédemment citée pour induire une résistance SA-dépendante, peut déclencher l'ISR chez des plants Arabidopsis NahG (Ran et al., 2005). Enfin, les réponses induites chez Arabidopsis, préalablement inoculée par diverses rhizobactéries (B. pumilus, S. marcescens et P. fluorescens) peuvent varier selon la variété du pathogène P. syringae (Ryu et al., 2003).
5. Mécanismes de défense
22La dernière étape importante dans l'établissement des résistances systémiques est l'expression des mécanismes de défense proprement dits qui doivent conférer à la plante la capacité de résister aux agents phytopathogènes. Pour cela, les plantes disposent de plusieurs voies métaboliques inductibles et donc d'un important panel de molécules afin de lutter contre l'invasion par un phytopathogène.
23La production d'espèces oxydantes (poussée oxydative), sous forme d'intermédiaires (Reactive Oxygen Intermediates, ROI), comme l'anion superoxyde, le radical hydroperoxyl ou le peroxyde d'hydrogène (H2O2), est une des réponses de la plante les plus précoces suite à la reconnaissance du pathogène (Kombrink et al., 2001). D'autres mécanismes, de nature physique et/ou biochimique comme le renforcement des parois ou la synthèse de protéines de défense, pourront intervenir afin de limiter l'infection.
24Les protéines PR (Pathogenesis Related) ont à l'origine été définies comme des protéines s'accumulant à l'intérieur ou à l'extérieur des cellules végétales suite à une interaction avec le pathogène (HammondKosack et al., 1996). Toutefois, le terme a été étendu à d'autres protéines également impliquées dans les mécanismes de défense mais exprimées de façon constitutive, comme la phénylalanine ammonia-lyase (PAL) ou la lipoxygénase (LOX) (Van Loon et al., 2006). La PAL est une enzyme de la voie de phénylpropanoïdes aboutissant, entre autres, à la synthèse d'AS, à celle de molécules composant la lignine ou à la synthèse de précurseurs qui seront utilisés par d'autres branches métaboliques pour générer des phytoalexines (voir plus loin) (Dixon et al., 2002). La LOX est impliquée dans la transformation de composés lipidiques et, via la voie des oxylipines, est aussi à l'origine de molécules signal comme l'acide jasmonique ou de composés fongitoxiques (Shah, 2005). Ces enzymes permettent donc la production de métabolites directement toxiques pour le pathogène mais pourraient également ralentir sa progression indirectement en favorisant la mort cellulaire via des dommages sur les membranes des cellules (HammondKosack et al., 1996). La plupart des protéines PR font partie de familles conservées chez les différentes espèces de plante. Elles sont induites par l'accumulation d'AS, de JA ou d'éthylène et certaines possèdent en elles-mêmes des propriétés antimicrobiennes comme les chitinases et les glucanases (Van Loon et al., 2006). Dans les phénomènes d'induction de résistance, la protéine PR1 est souvent considérée comme un marqueur spécifique de la SAR. Cependant, plusieurs exemples de rhizobactéries induisant l'expression de protéines PR sont désormais disponibles (Park et al., 2000 ; Tjamos et al., 2005). Chez le haricot, P. putida BTP1 accroît l'activité LOX dans les feuilles infectées par B. cinerea aboutissant à une concentration plus élevée en Z-3-hexenal, un composé fongitoxique (Ongena et al., 2004). La même souche peut aussi retarder l'infection de plants de concombre par P. aphanidermatum grâce à l'accumulation de phytoalexines (Ongena et al., 2000). Ces dernières sont des composés antimicrobiens, lipophiles et de faible poids moléculaire qui s'accumulent rapidement au niveau du site d'infection. Les phytoalexines ont des structures variées et dérivent de diverses voies métaboliques comme celles menant aux phénylpropanoides, flavonoides, isoflavonoides ou encore sesquiterpènes et polyketides (Hammerschmidt, 1999). Dans la majorité des cas, leur synthèse nécessite la participation de plusieurs enzymes, suggérant une coordination dans les voies de signalisation des cellules infectées. Leur participation dans l'immunisation conférée par des PGPR a initialement été remarquée chez l'œillet (Van Peer et al., 1991) et le haricot (Zdor et al., 1992) mais les exemples d'induction de phytoalexines dans le contexte de l'ISR restent assez rares.
25Enfin, les plantes peuvent faire face à l'invasion d'un pathogène en ralentissant sa pénétration dans les tissus végétaux. Ce retardement est assuré par l'épaississement des parois par apposition de lignine ou de callose (un polymère de B-1,3 glucane difficilement dégradable), sous la forme d'une excroissance intracellulaire, ou papille, au niveau du site d'infection (Huckelhoven, 2007). Par ailleurs, les précurseurs de la lignine ainsi que les radicaux libres produits pendant les réactions de polymérisation peuvent affecter la plasticité de la membrane ou inactiver les enzymes de pathogènes. Parmi les quelques exemples, nous pouvons citer B. pumilus SE34, qui agit sur le pois contre F. oxysporum (Benhamou et al., 1996), ou P. fluorescens 63-28 et B. amyloliquefaciens EXTN-1, qui renforcent le concombre respectivement contre P. aphanidermatum et Colletotrichum orbiculare (Chen et al., 2000 ; Jeun et al., 2004).
6. Mise en alerte de la plante
26Dans le contexte des réactions de défense systémiques, l'interaction avec le microorganisme inducteur ne mène pas toujours directement au renforcement du végétal. Durant ces dernières années, un concept basé sur la mise en alerte des plantes ou potentialisation (priming) semble s'être généralisé. Cet état induit n'est pas très perceptible d'un point de vue moléculaire tant que l'agression par le pathogène n'est pas ressentie. Il permet cependant à l'hôte végétal de mettre en place de manière plus rapide et plus violente les différents mécanismes de défense et ainsi de répondre de manière plus efficace à une éventuelle agression par des pathogènes ou des insectes mais aussi à divers stress abiotiques (Conrath et al., 2006). Ce mécanisme permet à la plante de se « préparer » à une infection future sans pour autant engendrer d'investissements lourds au niveau des ressources métaboliques et énergétiques (au détriment des processus cellulaires fondamentaux) alors qu'aucune agression ne doit encore être combattue (Van Hulten et al., 2006). La première mise en évidence du priming dans le cadre de l'ISR a été démontrée sur l'œillet inoculé par une souche de Pseudomonas. Van Peer et ses collaborateurs (Van Peer et al., 1991) ont observé une accumulation de composés antifongiques significativement plus rapide chez les plants traités par la bactérie après l'infection par F. oxysporum alors qu'aucune différence n'avait pu être détectée avant l'introduction du pathogène. Le même phénomène apparaît chez le pois traité par B. pumilus SE34, où un dépôt rapide de callose et de matériel phénolique sur les parois au niveau du site de pénétration n'est observé qu'après l'ajout du pathogène F. oxysporum (Benhamou et al., 1996).
27En parallèle aux analyses biochimiques, les techniques d'analyse d'expression de gènes ont aussi contribué à la mise en évidence du priming. Dans l'étude du transcriptome d'Arabidopsis après élicitation par P. fluorescens WCS417, Verhagen et ses collaborateurs (Verhagen et al., 2004) n'ont visualisé que très peu de changements dans les transcripts, tant au niveau des cellules racinaires que dans les tissus foliaires. Par contre, une nette augmentation dans l'expression de certains gènes au niveau des feuilles était mesurable dès l'infection par le phytopathogène P. syringae pv. tomato DC3000. Toujours au niveau génétique, des analyses d'hybridation soustractive sur le concombre ont également démontré que l'expression de certains gènes induits par la bactérie bénéfique P. chororophis O6 ne devenait apparente qu'après l'infection des feuilles par Corynespora cassiicola (Kim et al., 2004). Dans certains cas cependant, une expression génétique spécifiquement induite suite à la perception du PGPR a été rapportée. Par exemple, des travaux réalisés avec la souche B. subtilis S499 sur le concombre et la tomate ont montré que l'ISR était tout de même associée avec des changements au niveau transcriptionnel avant infection par P. aphanidermatum (Ongena et al., 2005b). Le priming peut aussi intervenir dans le cas de la SAR ou plus généralement dans le cadre de la résistance aux pathogènes (champignons, insectes) et même aux stress abiotiques, mais il n'y est pas invariablement associé comme cela semble être le cas pour l'ISR.
7. Conclusion
28Les différentes approches en génétique, biologie et biochimie ont permis de mieux comprendre les interactions entre plantes et microorganismes dans le contexte de l'immunisation de l'hôte végétal. Ces interactions peuvent avoir lieu entre des phytopathogènes ou des PGPR et respectivement aboutir à l'établissement de la SAR ou de l'ISR. Cependant, les réactions permettant une discrimination par la plante entre éliciteur de l'ISR et PAMP ne sont à ce jour pas connus. Certains mécanismes semblent communs, suggérant un lien étroit dans la reconnaissance d'un microorganisme, pathogène ou non. Ce rapprochement intervient également lors de la transmission du signal systémique, puisque le facteur de transcription NPR1 est nécessaire dans l'induction de l'ISR et de la SAR. En plus des voies de signalisation ou des réponses de défense mises en place, l'ISR chez une plante donnée semble aussi être influencée par la nature de la rhizobactérie inductrice et par la nature du pathogène. En effet, des études présentées sur Arabidopsis avec B. pumilus révèlent l'implication de deux voies distinctes suivant le pathovar utilisé. De même, la capacité d'une souche de PGPR à induire l'ISR varie en fonction des phytosystèmes sur lesquels elle est testée. Une meilleure connaissance, d'un point de vue moléculaire, de toutes les étapes du phénomène est nécessaire pour mieux comprendre la combinaison des facteurs qui sont à l'origine de cette spécificité. Les PGPR apparaissent néanmoins comme un atout majeur dans le développement du végétal. En effet, en plus de l'activité stimulatrice de croissance de certaines souches, il semble que les PGPR puissent préparer les défenses de leur hôte sans pour autant les « allumer », conférant ainsi une spécificité nuancée au phénomène d'ISR.
29Remerciements
30Emmanuel Jourdan bénéficie d'une bourse pour la Formation à la Recherche dans l'Industrie et l'Agriculture (F.R.I.A.) et Marc Ongena est chercheur qualifié au Fonds National de la Recherche Scientifique (F.R.S-FNRS). Nos travaux ont été subventionnés par les programmes FRFC n°2.4.570.00 et n°2.4624.06 des fonds associés du F.R.S-FNRS en Belgique.
Bibliographie
Abramovitch R.B. & Martin G.B., 2004. Strategies used by bacterial pathogens to suppress plant defenses. Curr. Opin. Plant Biol., 7, 356-364.
Audenaert K., Pattery T., Cornelis P. & Höfte M., 2002. Induction of systemic resistance to Botrytis cinerea in tomato by Pseudomonas aeruginosa 7NSK2: Role of salicylic acid, pyochelin, and pyocyanin. Mol. Plant-Microbe Interactions, 15, 1147-1156.
Aziz A., Heyraud A. & Lambert B., 2004. Oligogalacturonide signal transduction, induction of defense-related responses and protection of grapevine against Botrytis cinerea. Planta, 218, 767-774.
Baillieul F., De Ruffray P. & Kauffmann S., 2003. Molecular cloning and biological activity of alpha-, beta-, and gamma-megaspermin, three elicitins secreted by Phytophthora megasperma H20. Plant Physiol., 131, 155-166.
Bakker P.A.H.M., Pieterse C.M.J. & Van Loon L.C., 2007. Induced systemic resistance by fluorescent Pseudomonas spp. Phytopathology, 97, 239-243.
Basse C.W., Fath A. & Boller T., 1993. High affinity binding of a glycopeptide elicitor to tomato cells and microsomal membranes and displacement by specific glycan suppressors. J. Biol. Chem., 268, 14724-14731.
Benhamou N., Kloepper J.W., Quadt-Hallman A. & Tuzun S., 1996. Induction of defense-related ultrastructural modifications in pea root tissues inoculated with endophytic bacteria. Plant Physiol., 112, 919-929.
Brunner F. et al., 2002. Pep-13, a plant defense-inducing pathogen-associated pattern from Phytophthora transglutaminases. Embo J., 21, 6681-6688.
Budzikiewicz H., 2004. Siderophores of the Pseudomonadaceae sensu stricto (fluorescent and non-fluorescent Pseudomonas spp.). Prog. Chem. Org. Nat. Prod., 87, 81-237.
Che F.S. et al., 2000. Flagellin from an incompatible strain of Pseudomonas avenae induces a resistance response in cultured rice cells. J. Biol. Chem., 275, 32347-32356.
Chen C.Q., Belanger R.R., Benhamou N. & Paulitz T.C., 2000. Defense enzymes induced in cucumber roots by treatment with plant growth-promoting rhizobacteria (PGPR) and Pythium aphanidermatum. Physiol. Mol. Plant Pathol., 56, 13-23.
Chinchilla D. et al., 2006. The Arabidopsis receptor kinase FLS2 binds flg22 and determines the specificity of flagellin perception. Plant Cell, 18, 465-476.
Chisholm S.T., Coaker G., Day B. & Staskawicz B.J., 2006. Host-microbe interactions: shaping the evolution of the plant immune response. Cell, 124, 803-814.
Clarke A., Mur L.A.J., Darby R.M. & Kenton P., 2005. Harpin modulates the accumulation of salicylic acid by Arabidopsis cells via apoplastic alkalization. J. Exp. Bot., 56, 3129-3136.
Conrath U. et al., 2006. Priming: getting ready for battle. Mol. Plant-Microbe Interactions, 19, 1062-1071.
De Vleesschauwer D., Cornellis P. & Höfte M., 2006. Redox-active pyocyanin secreted by Pseudomonas aeruginosa 7NSK2 triggers systemic resistance to Magnaporthe grisea but enhances Rhizoctonia solani susceptibility in rice. Mol. Plant-Microbe Interactions, 19, 1406-1419.
Delaney T.P., 1994. A central role of salicylic-acid in plant-disease resistance. Science, 266, 1247-1250.
De Meyer G. & Höfte M., 1997. Salicylic acid produced by the rhizobacterium Pseudomonas aeruginosa 7NSK2 induces resistance to leaf infection by Botrytis cinerea on bean. Phytopathology, 87, 588-593.
Dixon R.A. et al., 2002. The phenylpropanoid pathway and plant defence - a genomics perspective. Mol. Plant Pathol., 3, 371-390.
Durrant W.E. & Dong X., 2004. Systemic acquired resistance. Annu. Rev. Phytopathol., 42, 185-209.
Erbs G. & Newman M.A., 2003. The role of lipopolysaccharides in induction of plant defence responses. Mol. Plant Pathol., 4, 421-425.
Felix G., Duran J.D., Volko S. & Boller T., 1999. Plants have a sensitive perception system for the most conserved domain of bacterial flagellin. Plant J., 18, 265-276.
Felix G. & Boller T., 2003. Molecular sensing of bacteria in plants. The highly conserved RNA-binding motif RNP-1 of bacterial cold shock proteins is recognized as an elicitor signal in tobacco. J. Biol. Chem., 278, 6201-6208.
Fobert P.R. & Despres C., 2005. Redox control of systemic acquired resistance. Curr. Opin. Plant Biol., 8, 378-382.
Garcia-Brugger A. et al., 2006. Early signaling events induced by elicitors of plant defenses. Mol. Plant-Microbe Interactions, 19, 711-724.
Gerber I.B., Laukens K., Witters E. & Dubery I.A., 2006. Lipopolysaccharide-responsive phosphoproteins in Nicotiana tabacum cells. Plant Physiol. Biochem., 44(5-6), 369-379.
Gómez-Gómez L., 2004. Plant perception systems for pathogen recognition and defence. Mol. Immunol., 41, 1055-1062.
Gomez-Gomez L. & Boller T., 2002. Flagellin perception: a paradigm for innate immunity. Trends Plant Sci., 7, 251-256.
Hammerschmidt R., 1999. Phytoalexins: what have we learned after 60 years?, Annu. Rev. Phytopathol., 37, 285-306.
HammondKosack K.E. & Jones J.D.G., 1996. Resistance gene-dependent plant defense responses. Plant Cell, 8, 1773-1791.
Höfte M. & Bakker P.A.H.M., 2007. Competition for iron and induced systemic resistance by siderophores of plant growth promoting rhizobacteria. In: Soil biology: Microbial siderophores. Heidelberg, Germany: Springer-Verlag Berlin, 121-133.
Huckelhoven R., 2007. Cell wall. Associated mechanisms of disease resistance and susceptibility. Annu. Rev. Phytopathol., 45, 101-127.
Iavicoli A., Boutet E., Buchala A. & Metraux J.P., 2003. Induced systemic resistance in Arabidopsis thaliana in response to root inoculation with Pseudomonas fluorescens CHA0. Mol. Plant-Microbe Interactions, 16, 851-858.
Jeun Y.C. et al., 2004. Cytological observations of cucumber plants during induced resistance elicited by rhizobacteria. Biol. Control, 29, 34-42.
Jones J.D.G. & Dangl J.L., 2006. The plant immune system. Nature, 444, 323-329.
Kim M.S., Kim Y.C. & Cho B.H., 2004. Gene expression analysis in cucumber leaves primed by root colonization with Pseudomonas chlororaphis O6 upon challenge-inoculation with Corynespora cassiicola. Plant Biol., 6, 105-108.
Klarzynski O. et al., 2000. Linear beta-1,3 glucans are elicitors of defense responses in tobacco. Plant Physiol., 124, 1027-1037.
Kloepper J.W., Ryu C.M. & Zhang S.A., 2004. Induced systemic resistance and promotion of plant growth by Bacillus spp. Phytopathology, 94, 1259-1266.
Kombrink E. & Schmelzer E., 2001. The hypersensitive response and its role in local and systemic disease resistance. Eur. J. Plant Pathol., 107, 69-78.
Maurhofer M. et al., 1998. Salicylic acid biosynthetic genes expressed in Pseudomonas fluorescens strain P3 improve the induction of systemic resistance in tobacco against tobacco necrosis virus. Phytopathology, 88, 678-684.
Mercado-Blanco J. & Bakker P.A.H.M., 2007. Interactions between plants and beneficial Pseudomonas spp.: exploiting bacterial traits for crop protection. Antonie Van Leeuwenhoek, 92, 367-389.
Meziane H. et al., 2005. Determinants of Pseudomonas putida WCS358 involved in inducing systemic resistance in plants. Mol. Plant Pathol., 6, 177-185.
Molders W., Buchala A. & Metraux J.P., 1996. Transport of salicylic acid in tobacco necrosis virus-infected cucumber plants. Plant Physiol., 112, 787-792.
Montesano M., Brader G. & Palva E.T., 2003. Pathogen derived elicitors: searching for receptors in plants. Mol. Plant Pathol., 4, 73-79.
Nurnberger T. & Lipka V., 2005. Non-host resistance in plants: new insights into an old phenomenon. Mol. Plant Pathol., 6, 335-345.
Nurnberger T. & Kernmerling B., 2006. Receptor protein kinases - pattern recognition receptors in plant immunity. Trends Plant Sci., 11, 519-522.
Ongena M. et al., 2000. Systemic induction of phytoalexins in cucumber in response to treatments with fluorescent pseudomonads. Plant Pathol., 49, 523-530.
Ongena M. et al., 2004. Stimulation of the lipoxygenase pathway is associated with systemic resistance induced in bean by a nonpathogenic Pseudomonas strain. Mol. Plant-Microbe Interactions, 17, 1009-1018.
Ongena M. et al., 2005a. Isolation of a N-alkylated benzylamine derivative from Pseudomonas putida as elicitor of induced systemic resistance in bean. Mol. Plant-Microbe Interactions, 18, 562-569.
Ongena M. et al., 2005b. Bacillus subtilis M4 decrease plant susceptibility towards fungal pathogens by increasing host resistance associated with differential gene expression. Appl. Microbiol. Biotechnol., 67, 692-698.
Ongena M. & Thonart P., 2006. Resistance induced in plants by non-pathogenic microorganisms: elicitation and defense responses. In: Floriculture, ornamental and plant biotechnology: advances and topical issues. 1st ed. Japan: Global Science Books, 447-463.
Ongena M. et al., 2007. Surfactin and fengycin lipopeptides of Bacillus subtilis as elicitors of induced systemic resistance in plants. Environ. Microbiol., 9, 1084-1090.
Oostendorp M., Kunz W., Dietrich B. & Staub T., 2001. Induced disease resistance in plants by chemicals. Eur. J. Plant Pathol., 107, 19-28.
Ortmann I., Conrath U. & Moerschbacher B.M., 2006. Exopolysaccharides of Pantoea agglomerans have different priming and eliciting activities in suspension-cultured cells of monocots and dicots. FEBS Lett., 580, 4491-4494.
Park K.S. & Kloepper J.W., 2000. Activation of PR-1a promoter by rhizobacteria that induce systemic resistance in tobacco against Pseudomonas syringae pv. tabaci. Biol. Control, 18, 2-9.
Pemberton C.L. & Salmond G.P.C., 2004. The Nep1-like proteins - a growing family of microbial elicitors of plant necrosis. Mol. Plant Pathol., 5, 353-359.
Persello-Cartieaux F., Nussaume L. & Robaglia C., 2003. Tales from the underground: molecular plant-rhizobacteria interactions. Plant Cell Environ., 26, 189-199.
Pieterse C.M.J. et al., 1998. A novel signaling pathway controlling induced systemic resistance in Arabidopsis. Plant Cell, 10, 1571-1580.
Pieterse C.M.J. et al., 2000. Rhizobacteria-mediated induced systemic resistance (ISR) in Arabidopsis requires sensitivity to jasmonate and ethylene but is not accompanied by an increase in their production. Physiol. Mol. Plant Pathol., 57, 123-134.
Pieterse C.M.J. et al., 2002. Signalling in rhizobacteria-induced systemic resistance in Arabidopsis thaliana. Plant Biol., 4, 535-544.
Poinssot B. et al., 2003. The endopolygalacturonase 1 from Botrytis cinerea activates grapevine defense reactions unrelated to its enzymatic activity. Mol. Plant-Microbe Interactions, 16, 553-564.
Ramonell K.M. et al., 2002. Microarray analysis of chitin elicitation in Arabidopsis thaliana. Mol. Plant Pathol., 3, 301-311.
Ran L.X., van Loon L.C. & Bakker P.A.H.M., 2005. No role for bacterially produced salicylic acid in rhizobacterial induction of systemic resistance in Arabidopsis. Phytopathology, 95, 1349-1355.
Reitz M. et al., 2002. Importance of the O-antigen, core-region and lipid A of rhizobial lipopolysaccharides for the induction of systemic resistance in potato to Globodera pallida. Nematology, 4, 73-79.
Ron M. & Avni A., 2004. The receptor for the fungal elicitor ethylene-inducing xylanase is a member of a resistance-like gene family in tomato. Plant Cell, 16, 1604-1615.
Rossard S. et al., 2006. Early changes in membrane permeability, production of oxidative burst and modification of PAL activity induced by ergosterol in cotyledons of Mimosa pudica. J. Exp. Bot., 57, 1245-1252.
Ryu C.M., Hu C.H., Reddy M.S. & Kloepper J.W., 2003. Different signaling pathways of induced resistance by rhizobacteria in Arabidopsis thaliana against two pathovars of Pseudomonas syringae. New Phytol., 160, 413-420.
Ryu C.M. et al., 2004. Bacterial volatiles induce systemic resistance in Arabidopsis. Plant Physiol., 134, 1017-1026.
Schuhegger R. et al., 2006. Induction of systemic resistance in tomato by N-acyl-L-homoserine lactone-producing rhizosphere bacteria. Plant Cell Environ., 29, 909-918.
Shah J., 2005. Lipids, lipases, and lipid-modifying enzymes in plant disease resistance. Annu. Rev. Phytopathol., 43, 229-260.
Siddiqui I.A. & Shaukat S.S., 2003. Suppression of root-knot disease by Pseudomonas fluorescens CHA0 in tomato: importance of bacterial secondary metabolite, 2,4-diacetylpholoroglucinol. Soil Biol. Biochem., 35, 1615-1623.
Sticher L., MauchMani B. & Metraux J.P., 1997. Systemic acquired resistance. Annu. Rev. Phytopathol., 35, 235-270.
Tamogami S. & Kodama O., 2000. Coronatine elicits phytoalexin production in rice leaves (Oryza sativa L.) in the same manner as jasmonic acid. Phytochemistry, 54, 689-694.
Tjamos S.E., Flemetakis E., Paplomatas E.J. & Katinakis P., 2005. Induction of resistance to Verticillium dahliae in Arabidopsis thaliana by the biocontrol agent K-165 and pathogenesis-related proteins gene expression. Mol. Plant-Microbe Interactions, 18, 555-561.
Tran H. et al., 2007. Role of the cyclic lipopeptide massetolide A in biological control of Phytophthora infestans and in colonization of tomato plants by Pseudomonas fluorescens. New Phytol., 175, 731-742.
Umemura K. et al., 2004. Cerebroside elicitor confers resistance to Fusarium disease in various plant species. Phytopathology, 94, 813-818.
Van Hulten M. et al., 2006. Costs and benefits of priming for defense in Arabidopsis. Proc. Natl Acad. Sci. USA, 103(14), 5602-5607.
Van Loon L.C., Bakker P.A.H.M. & Pieterse C.M.J., 1998. Systemic resistance induced by rhizosphere bacteria. Annu. Rev. Phytopathol., 36, 453-483.
Van Loon L.C. & Bakker P.A.H.M., 2005. Induced systemic resistance as a mechanism of disease suppression by rhizobacteria. In: Siddiqui Z.A., ed. PGPR: Biocontrol and biofertilization. Dordrecht, The Netherlands: Springer, 39-66.
Van Loon L.C., Rep M. & Pieterse C.M.J., 2006. Significance of inducible defense-related proteins in infected plants. Annu. Rev. Phytopathol., 44, 135-162.
Van Peer R., Niemann G.J. & Schippers B., 1991. Induced resistance and phytoalexin accumulation in biological control of Fusarium wilt of carnation by Pseudomonas sp. strain WCS417r. Phytopathology, 81, 728-734.
Van Wees S.C.M. et al., 1997. Differential induction of systemic resistance in Arabidopsis by biocontrol bacteria. Mol. Plant-Microbe Interactions, 10, 716-724.
Verhagen B.W.M. et al., 2004. The transcriptome of rhizobacteria-induced systemic resistance in Arabidopsis. Mol. Plant-Microbe Interactions, 17, 895-908.
Waspi U., Schweizer P. & Dudler R., 2001. Syringolin reprograms wheat to undergo hypersensitive cell death in a compatible interaction with powdery mildew. Plant Cell, 13, 153-161.
Yan Z.N. et al., 2002. Induced systemic protection against tomato late blight elicited by plant growth-promoting rhizobacteria. Phytopathology, 92, 1329-1333.
Zdor E.R. & Anderson A.J., 1992. Influence of root colonizing bacteria on the defence responses of bean. Plant Soil, 140, 99-107.
Zipfel C. et al., 2004. Bacterial disease resistance in Arabidopsis through flagellin perception. Nature, 428, 764-767.
Zipfel C. et al., 2006. Perception of the bacterial PAMP EF-Tu by the receptor EFR restricts Agrobacterium-mediated transformation. Cell, 125, 749-760.
Pour citer cet article
A propos de : Emmanuel Jourdan
Université de Liège. Centre wallon de Biologie industrielle. Boulevard du Rectorat, Bâtiment 40 P70. B-4000 Liège (Belgium).
A propos de : Marc Ongena
Gembloux Agricultural University – FUSAGx. Unité de Bioindustries. Passage des Déportés, 2. B-5030 Gembloux (Belgium). E-mail : ongena.m@fsagx.ac.be
A propos de : Philippe Thonart
Université de Liège. Centre wallon de Biologie industrielle. Boulevard du Rectorat, Bâtiment 40 P70. B-4000 Liège (Belgium) – Gembloux Agricultural University – FUSAGx. Unité de Bioindustries. Passage des Déportés, 2. B-5030 Gembloux (Belgium).






