- Portada
- Volume 26 (2022)
- Numéro 4
- Les insectes auxiliaires dans les paysages agricoles : apports faunistiques, écologiques et fonctionnels de récentes études dans le canton de Genève (Suisse)
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Les insectes auxiliaires dans les paysages agricoles : apports faunistiques, écologiques et fonctionnels de récentes études dans le canton de Genève (Suisse)

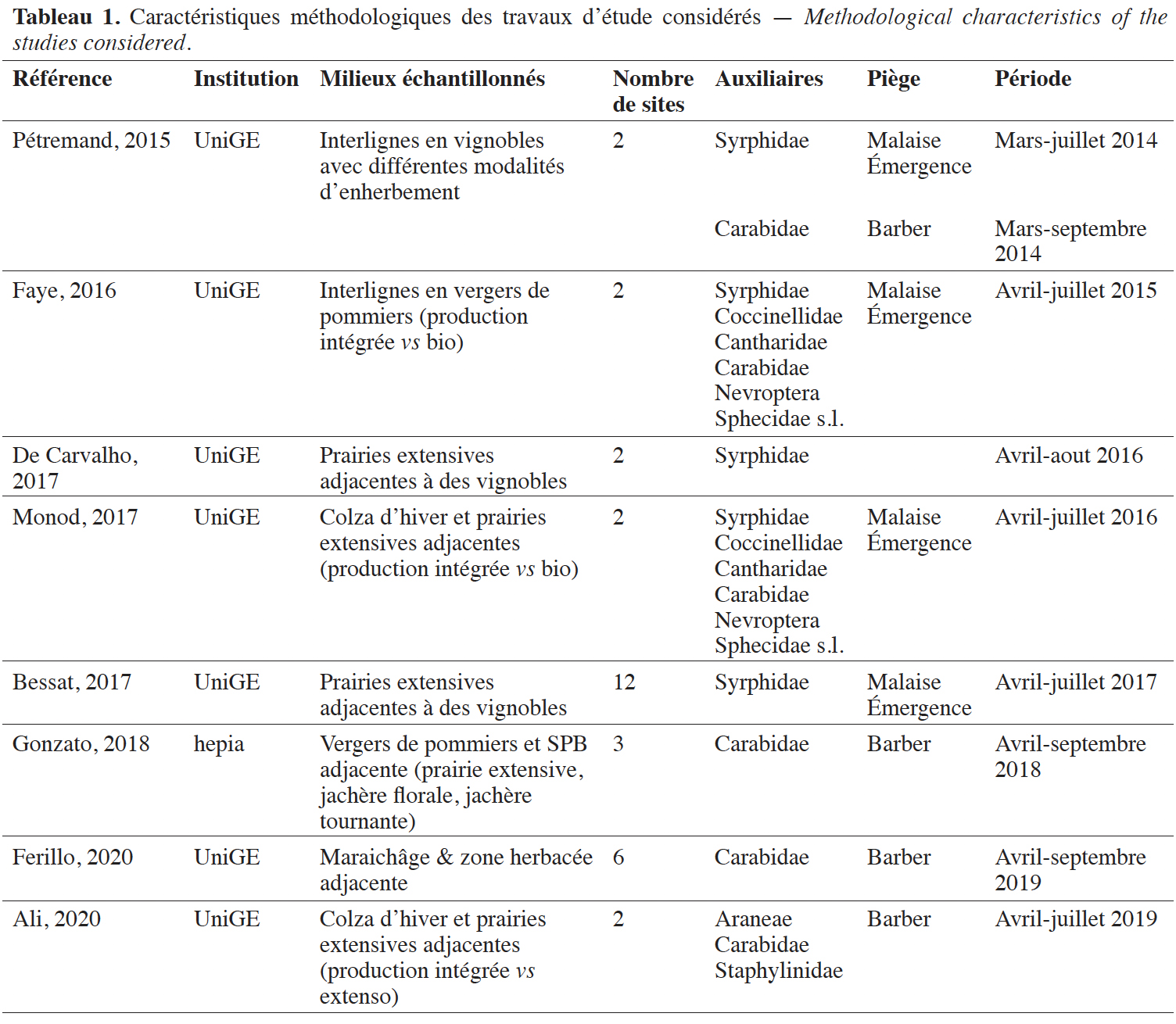
Résumé
Description du sujet. Dans le contexte actuel de réduction des risques liés à l’utilisation de produits phytosanitaires et de promotion de la biodiversité dans les milieux agricoles, il apparaît primordial d'améliorer nos connaissances sur les insectes auxiliaires qui fréquentent et se développent dans ces écosystèmes.
Objectifs. Cet article vise à dresser un état des connaissances sur les auxiliaires et à mettre en lumière les principaux apports faunistiques, écologiques et fonctionnels tirés de récentes études réalisées en contexte agricole à Genève.
Méthode. Les données ont été acquises de 2014 à 2019 sur plusieurs familles d'auxiliaires prédateurs et pollinisateurs dans des contextes agricoles variés (prairies extensives, vignes, vergers, cultures de colza, maraîchage) à l’aide de pièges Barber, Malaise et à émergence.
Résultats. Ces travaux ont permis de récolter 48 921 données et d'inventorier 477 espèces appartenant aux grandes familles d’auxiliaires ; parmi elles, quatre espèces sont observées pour la première fois en Suisse et une cinquantaine dans le canton de Genève. Au total, 357 (± 75 %) des espèces inventoriées possèdent un stade prédateur et 103 (± 22 %) sont considérées comme de bons auxiliaires des cultures. L'utilisation de pièges à émergence a permis d'attester qu'un tiers au moins des espèces inventoriées, dont certaines rares ou menacées, peuvent compléter leur cycle de vie dans les milieux agricoles ou les utiliser comme site d'hivernation.
Conclusions. Cette synthèse contribue à améliorer notre compréhension de la composition de la biodiversité des milieux agricoles qui constitue une composante non négligeable de la biodiversité en Suisse et dans les pays voisins. Elle met également en lumière le rôle des habitats semi-naturels, tels que les prairies extensives ou les interlignes des vignes, comme support pour le développement de nombreuses espèces rares et parfois menacées.
Abstract
Beneficial insects in agricultural landscapes: faunal, ecological and functional contributions of recent studies in the canton of Geneva (Switzerland)
Description of the subject. In the context of biodiversity maintenance in agricultural environments and of risk reduction related to the use of phytosanitary products, it seems essential to improve our knowledge of the beneficial insects that develop in these ecosystems.
Objectives. This article reviews the state of knowledge regarding insect auxiliaries and highlights the main faunal, ecological and functional contributions from recent studies carried out in an agricultural context in Geneva.
Method. Data were collected from 2014 to 2019 on several families of predatory and pollinating auxiliaries in various agricultural contexts (extensive grasslands, vineyards, orchards, rapeseed crops, vegetable crops) using Barber, Malaise and emergence traps.
Results. 48,921 individual records were collected belonging to 477 species of the main families of auxiliaries. Of these, four species were observed for the first time in Switzerland and 50 in the canton of Geneva. 357 (± 75%) of the species had a predatory stage and 103 (± 22%) could be regarded as valuable crop auxiliaries. The use of emergence traps made it possible to attest that at least a third of the species, including some rare or threatened species, are able to successfully carry out their life cycles within agricultural environments or to use them as overwintering sites.
Conclusions. This review increases our understanding of the composition of the biodiversity of agricultural environments, which constitutes a significant component of biodiversity in Switzerland and in neighboring countries. It also highlights the role of semi-natural habitats as extensive grasslands or inter-rows of vineyards in supporting the development of many rare and sometimes threatened species.
Tabla de contenidos
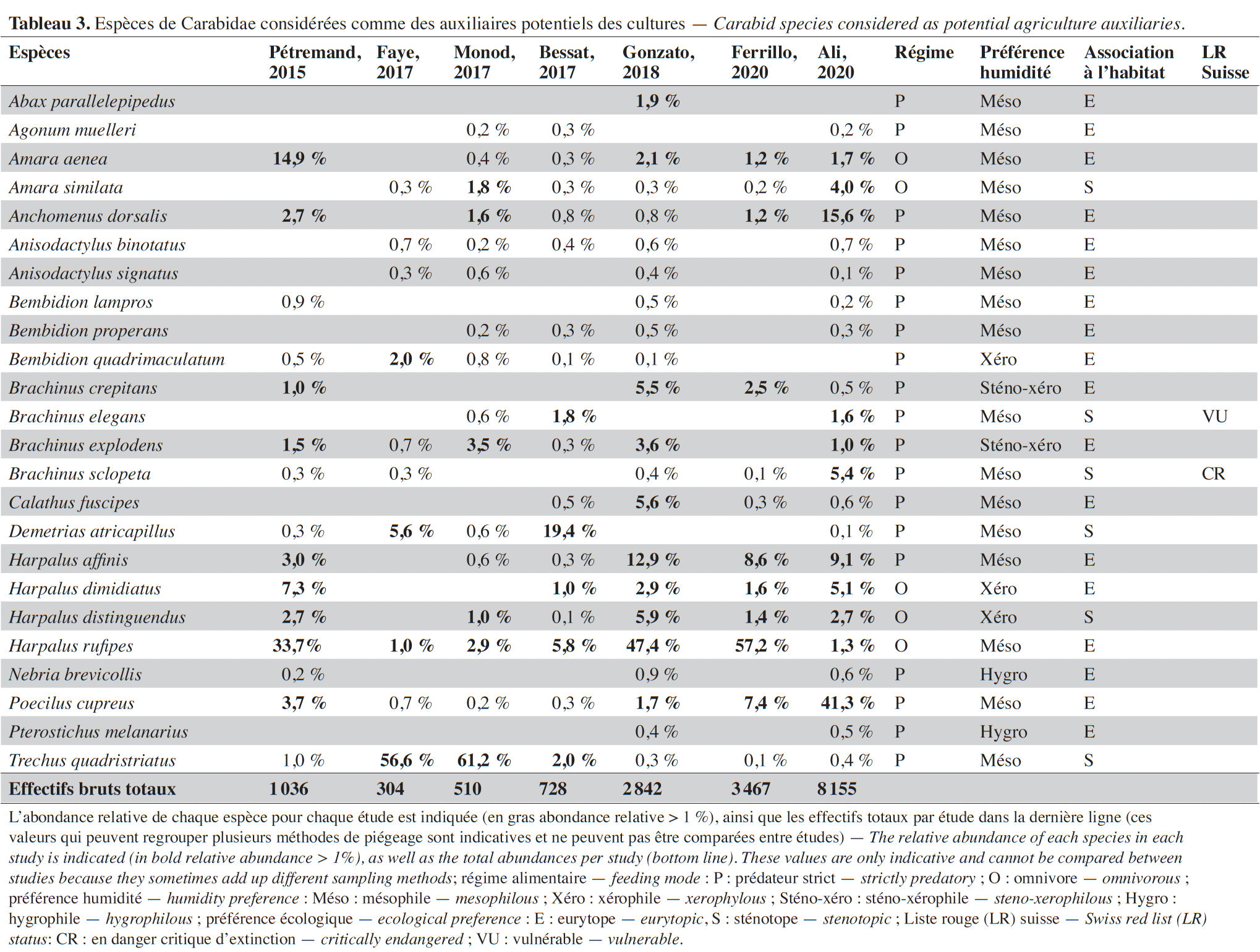
Reçu le 23 février 2022, accepté le 6 octobre 2022, mis en ligne le 1 décembre 2022
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
1. Introduction
1L'étude des insectes auxiliaires en milieux agricoles prend, ces dernières années, de plus en plus d'ampleur (eg. Djoudi et al., 2019 ; Beaumelle et al., 2021). En effet, dans un contexte international de stratégies de réduction des risques liés à l’application de produits phytosanitaires (PPh) et de lutte contre l’érosion de la biodiversité, l’occurrence d’insectes auxiliaires dans les cultures intéresse de près les acteurs du monde agricole (Begg et al., 2017 ; Altieri & Nicholls, 2018). L'émergence du paradigme du contrôle biologique par conservation tente de répondre aux impacts des insecticides en favorisant la biodiversité en milieu agricole grâce à l'implantation d'habitats semi-naturels (Barbosa, 1998). Mais que savons-nous de cette biodiversité « utile » ? Quelles espèces fréquentent réellement les milieux agricoles ? Ces milieux hébergent-ils par ailleurs des espèces rares ou menacées ? En Suisse, peu d'inventaires existent à ce sujet. Dans le canton de Genève, la seule étude généralisée a été réalisée sur les carabes (Coleoptera, Carabidae) (Jenny et al., 2002).
2Dans un souci de synthèse des connaissances acquises depuis 2014, l’Office Cantonal de l’Agriculture et de la Nature (OCAN) a financé une étude visant à valoriser le matériel issu des captures effectuées dans le cadre des travaux de master réalisés en milieux agricoles, le projet GE-Auxi (Pétremand & Castella, 2021). Celle-ci avait comme objectif d'extraire d'échantillons préexistants, les spécimens appartenant aux principales familles de prédateurs. Dans cet article sont présentés les principaux groupes d'auxiliaires inventoriés dans le cadre de ce projet avec un accent sur les espèces patrimoniales et celles présentant, dans l’état des connaissances actuelles, un potentiel de prédation sur les ravageurs. Parmi les groupes inventoriés, les syrphes (Diptera, Syrphidae) et les carabes (Coleoptera, Carabidae) ont été échantillonnés plus intensivement et dans une plus grande diversité de milieux. Cet article présente également des données inédites sur les guêpes sphéciformes (Hymenoptera, Crabronidae) dans les milieux agricoles de Genève, un groupe encore rarement étudié en Suisse malgré un fort potentiel de bioindication et de prédation sur les ravageurs des cultures (Gayubo et al., 2005 ; Le Divelec et al., 2016 ; Biddinger & Joshi, 2017).
2. Méthode
2.1. Périmètre d'étude
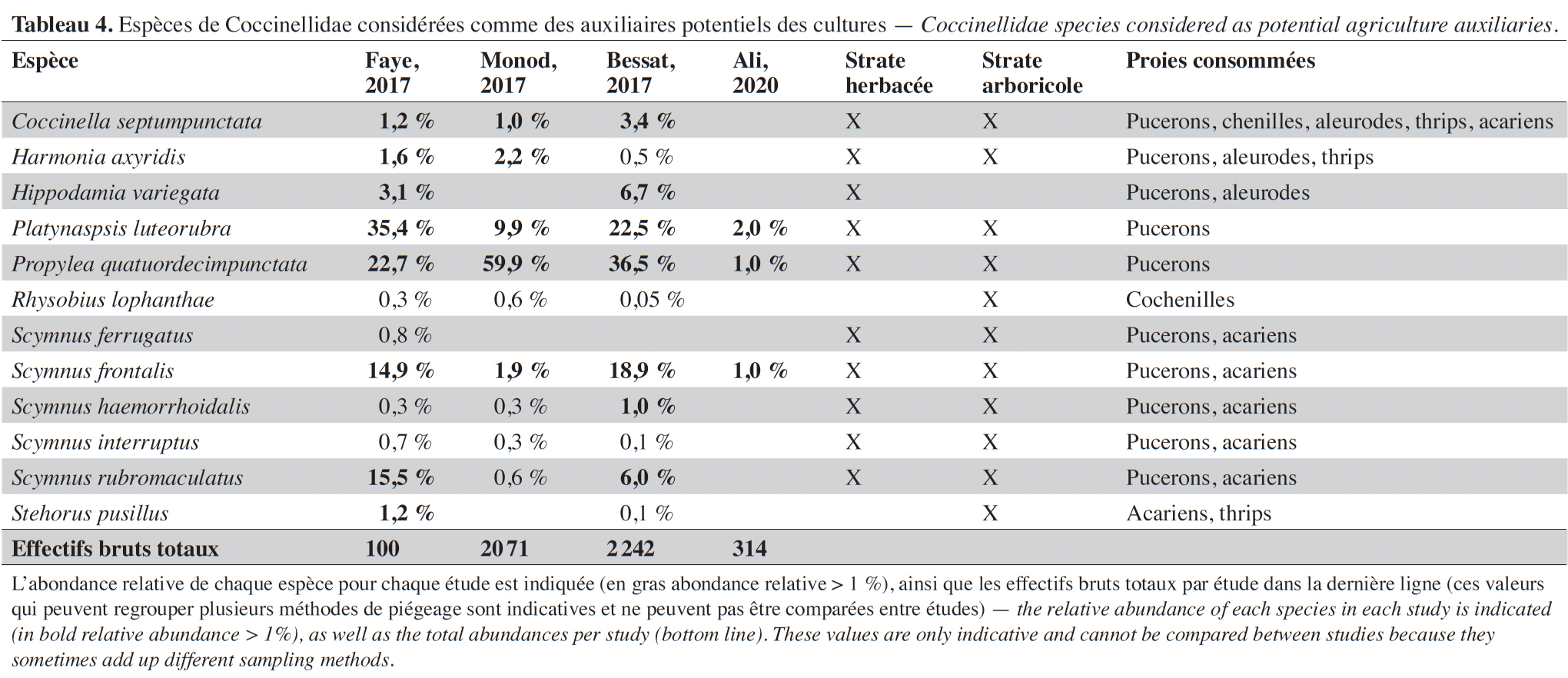
3Seules les études menées depuis 2014 dans le périmètre du canton de Genève (Suisse) ont été considérées. D’un point de vue biogéographique, le canton se situe à l’extrême sud-ouest du plateau suisse (Gonseth et al., 2001), la région de basse altitude qui s’étend du nord-est au sud-ouest du pays entre les chaînes alpine au Sud et jurassienne à l’Ouest, et profite d’un climat semi-continental tempéré. La température moyenne annuelle est d’environ 10,5 °C et les précipitations moyennes annuelles d'environ 1 000 mm.
4Le contexte géologique cantonal se caractérise principalement par des dépôts mollassiques datant de l’orogénèse alpine, des dépôts glaciaires rhodaniens déposés lors du retrait de la dernière glaciation (Würm) ainsi que des dépôts fluviatiles récents. Ces différents dépôts ont généralement donné lieu à la présence actuelle de sols riches et drainants propices à l’agriculture (grandes cultures, vignes).
5L’ensemble du canton se trouve dans l’optimum climacique de la chênaie à charme et ceci notamment grâce à une très faible variation de l’altitude sur l’ensemble du canton (369 m – 516 m).
6La surface agricole utile (SAU) occupe environ 36 % (± 10 050 ha) du territoire genevois (DETA, 2015). Plus de la moitié (56 %) de la SAU est occupée par des grandes cultures dominées par le blé et l'orge pour les céréales, le colza et le tournesol chez les oléagineux, ainsi que d'autres cultures comme les pois protéagineux et le maïs. Viennent ensuite les surfaces herbagères qui couvrent environ un quart des surfaces (24 % de la SAU). Dans les cultures pérennes, la viticulture couvre un huitième de la SAU (12,5 %) et l'arboriculture moins d'1 %. Le maraîchage ne représente quant à lui que 2,1 % (DETA, 2015). Les habitats semi-naturels ou surfaces de promotion de la biodiversité (SPB) recouvrent près de 15 % de la surface agricole utile (moyenne suisse = 12 %). Les prairies extensives sont les SPB qui occupent la surface la plus importante (± 900 ha). Elles sont suivies des jachères florales (± 250 ha), des pâturages extensifs (± 90 ha), des jachères tournantes (± 50 ha) et des haies (± 45 ha) (OCAN, 2021).
2.2. Sources des données
7La provenance des données utilisées dans cet inventaire est présentée de manière synthétique (Tableau 1). Les échantillons obtenus au cours de quatre travaux (Bessat, 2017 ; Faye, 2017 ; Monod, 2017 ; Ali, 2020) ont fait l'objet d'un tri approfondi dans le cadre du projet GE-Auxi afin d'en extraire différentes familles d'auxiliaires prédateurs. Parmi les travaux utilisés, deux ont déjà fait l'objet d'analyses publiées relatives à l'impact de l'enherbement viticole sur les Carabidae et les Syrphidae (Pétremand et al., 2016 ; Pétremand et al., 2017a), ainsi qu’à l'influence des prairies extensives sur les communautés de Syrphidae (Bessat et al., 2019).
2.3. Méthodes d’échantillonnage
8Les pièges d’interception Malaise utilisés dans tous les travaux sont identiques (L : 170 cm, h :170 cm, l : 110 cm). Les piège à émergence sont des pièges Malaise clos (L : 170 cm, h : 170 cm, l : 110 cm) couvrant 1,8 m2 de surface au sol, ils capturent les insectes ayant hiverné ou effectué une partie de leur cycle de développement (généralement le stade larvaire) sur cette surface. Tous les pièges proviennent de B&S Entomological Services, Co. (Armagh, Irlande du Nord, GB).
9Différents modèles de pièges Barber ont été utilisés dans les différentes études (Pétremand, 2015a ; Gonzato, 2018 ; Ali, 2020 ; Ferrillo, 2020). Toutefois, chaque étude a utilisé des pièges avec un diamètre d’environ 10 mm et couverts d’un toit afin d’empêcher les précipitations d’y pénétrer.
2.4. Identification des insectes auxiliaires prédateurs
10La plupart des groupes prédateurs généralistes (Alford, 2019) ont été étudiés. Seuls les Hétéroptères n’ont pas pu être identifiés à l’espèce faute de ressources humaines et financières. Dans les autres groupes taxonomiques, toutes les identifications ont été faites au niveau spécifique par les auteurs (Syrphidae, Sphecidae s.l., Carabidae, Cantharidae, Coccinellidae, Araneae) ou des experts externes (Staphylinidae, Neuroptera), excepté pour quelques genres où les femelles n’étaient pas identifiables à l'espèce.
11Les spécialistes suivants ont été consultés pour effectuer ou vérifier des identifications : Yannick Chittaro (Carabidae, Cantharidae), Henryk Luka (Staphylinidae), Stephano Pozzi (Araneae), Irene Salzmann (Sphecidae s.l.), Andreas Sanchez (Coccinellidae), Martin C.D. Speight (Syrphidae), Davide Badano (Neuroptera).
12Cette étude se focalise sur les prédateurs d’insectes ravageurs causant des dégâts économiques aux cultures, bien que la plupart des Syrphidae, des Sphecidae s.l., ainsi que certaines espèces de Chrysopidae et de Cantharidae se nourrissent également de pollen ou de nectar au stade adulte et sont intéressants pour leur double rôle de prédateurs et de pollinisateurs (Alford, 2019).
13Seuls les groupes taxonomiques échantillonnés les plus fréquemment et permettant des comparaisons entre types de cultures ou d’habitats sont analysés plus en détail dans cet article. C’est la raison pour laquelle certains groupes comme les staphylins, les cantharides ou les araignées n’ont pas été présentés. Pour les syrphes et les carabes, les données compilées étant particulièrement riches, des analyses ont été conduites pour comparer les différents milieux échantillonnés.
14La qualification d’espèce dite « auxiliaire » se base en premier lieu sur les espèces reconnues comme telles dans la littérature existante (Tableau 2) qui permet d’attester leur potentiel de prédation sur certains ravageurs des cultures. En second lieu, dans le cadre de cet article, cette qualification prend en compte les espèces prédatrices dominantes (abondance relative > 5 %) ou subdominantes (abondance relative > 1 %) dans l’un des milieux cultivés de cette étude. De ce fait, une espèce présente en très faible abondance dans une culture, bien que prédatrice, n’a pas été considérée comme pouvant exercer une pression suffisante sur les ravageurs et n’a de fait pas été considérée comme « auxiliaire ». De même, les espèces dominantes ou subdominantes n’ayant pas parmi leurs proies connues dans la littérature de potentiels ravageurs n’ont pas été prises en considération en tant qu’« auxiliaires ».

2.5. Analyses quantitatives
15Lorsque des données quantitatives pouvaient être comparées (même groupe taxonomique, même technique de capture), les abondances standardisées par effort de capture ont été calculées (abondances pour 100 jours et par piège à émergence pour les syrphes, abondance par piège Barber et par jour pour les carabes) et représentées en boxplot à l’aide du logiciel R version 4.0.3 (R Core team, 2020). Les différences d’abondance ou de richesse entre habitats ont été testées à l’aide de tests de Wilcoxon.
3. Résultats
16Cette synthèse a permis de récolter dans les milieux agricoles genevois 48 921 spécimens d’insectes et araignées appartenant à 477 espèces au sein des groupes d’auxiliaires définis précédemment (Annexe). Environ trois-quarts de ces espèces (357) possèdent un stade prédateur connu dans leur développement, parmi celles-ci ± 22 % (103) peuvent être qualifiées de prédateurs généralistes et sont reconnues comme auxiliaires dans les cultures. Ces résultats permettent également d’attester que ± 30 % (149) des espèces ayant été collectées dans les pièges à émergence utilisent le milieu agricole comme habitat larvaire ou d’hivernage au cours de leur développement (Annexe).
17Trente espèces de syrphes (Pétremand & Speight, 2015 ; Pétremand et al., 2017b ; Bessat et al., 2018 ; Speight et al., 2019) ainsi que 20 espèces appartenant aux autres groupes étudiés n’avaient jamais été observées sur le territoire cantonal avant les études menées depuis 2014 (Annexe). Parmi ces espèces, certaines sont même nouvelles pour la faune de Suisse : une coccinelle, Rhysobius lophantae (Blaisdell, 1892) (Sanchez et al., 2021), une guêpe sphéciforme, Mimumesa beaumonti (van Lith, 1949) (Pétremand et al., 2021) et deux syrphes, Malotta fuciformis (Fabricius, 1794) et Melangyna quadrimaculata (Verrall, 1873) (Speight et al., 2019). L’observation de deux staphylins permet par ailleurs de confirmer leur présence en Suisse : Stenistoderus nothus (Erichson, 1839) et Xantholinus gallicus Coiffait, 1956 (Henryk Luka, com. pers.).
18Les données concernant l’ensemble des groupes étudiés dont certains ne sont pas détaillés ci-dessous (staphylins, araignées, cantharides, etc.) peuvent être consultées dans l’annexe.
3.1. Les carabes (Coleoptera, Carabidae)
19Dans cette famille, 17 042 spécimens ont été identifiés, lesquels appartiennent à 101 espèces. Quatre d’entre elles sont signalées pour la première fois à Genève d’après la liste de Marggi (2012) : Agonum nigrum Dejean, 1828, Nothiophilus aestuans Dejean, 1826 (Pétremand, 2015b), Harpalus luteicornis (Duftschmid, 1812) et Nebria salina Fairmaire & Laboulbène, 1854. Quatre espèces n'avaient pas été signalées dans le canton depuis respectivement 1952 pour Amara tricuspidata Dejean ; 1831 pour Amara apricaria (Paykull, 1790) ; 1962 pour Harpalus smaragdinus (Duftschmid, 1812) ; 1970 pour Carabus auratus Linnaeus, 1760 (guichet cartographique info fauna : https://lepus.unine.ch/carto/18024).
20Par ailleurs, 21 espèces figurent sur la liste rouge suisse (Duelli, 1994) (Annexe). L'une d'elles, Aculpalpus exiguus Dejean, 1829, possède le statut d’espèce « éteinte » et d’autres comme Amblystomus niger (Heer, 1841) et Brachinus sclopeta (Fabricius, 1792) sont considérées comme « en danger d'extinction ».
21Environ 75 % des espèces ont un régime alimentaire prédateur ou omnivore au stade adulte. Par conséquent, toutes ces espèces possèdent un potentiel de régulation en contexte agricole. Toutefois, dans cette étude, seules 25 % des espèces peuvent être considérées comme auxiliaires potentiellement bénéfiques aux cultures, les principales étant Poecilus cupreus (Linnaeus, 1758), Harpalus rufipes (De Geer, 1774), Anchomenus dorsalis (Pontoppidan, 1763), Harpalus affinis (Schrank, 1781) et Trechus quadristriatus (Schrank, 1781) qui sont toutes des espèces mésophiles et peu exigeantes relativement à l'habitat (eurytope) (Tableau 3). Les autres espèces d’auxiliaires sont parfois xérophiles ou sténotopes et dépendantes de conditions écologiques plus particulières au sein des agroécosystèmes. Certaines espèces sont majoritairement présentes au sein de cultures spécifiques. Par exemple, Calathus fuscipes (Goeze, 1777) semble surtout abondant dans les vergers de pommiers. Il est aussi notable que deux espèces, T. quadristriatus et Demetrias atricapillus (Linnaeus, 1758), ont été principalement collectées dans les pièges à émergence et très peu dans les pièges Barber. Dans des études qui utilisent uniquement cette dernière méthode de piégeage, les effectifs de ces deux espèces sont probablement souvent sous-estimés.
22Dans les milieux échantillonnés à l’aide de pièges Barber, les abondances moyennes standardisées peuvent être comparées entre milieux (Figure 1) :
23– le colza ainsi que les jachères (florales ou tournantes) possèdent des abondances significativement plus élevées en carabes comparativement aux prairies extensives, aux cultures maraîchères et aux cultures pérennes (vignes ou vergers) (test de Wilcoxon, p-values < 0,01) ;
24– les cultures maraîchères, bien que formant un milieu très ouvert (part importante de sol nu), montrent des abondances comparativement faibles ;
25– les zones de limites (LIM) entre une culture et une SPB montrent des abondances intermédiaires significativement inférieures aux milieux à sol découvert (colza, JF) (test de Wilcoxon, p-values < 0,02) et supérieures aux milieux avec une végétation herbacée dense (PE, vergers, vigne) (test de Wilcoxon, p-values < 0,001).
26– les prairies extensives possèdent des abondances similaires à l'enherbement interligne de vergers, qui possède une strate herbacée relativement dense ;
27– en vignes, les abondances observées sont significativement plus basses que pour tous les autres milieux (test de Wilcoxon, p-values < 0,02).
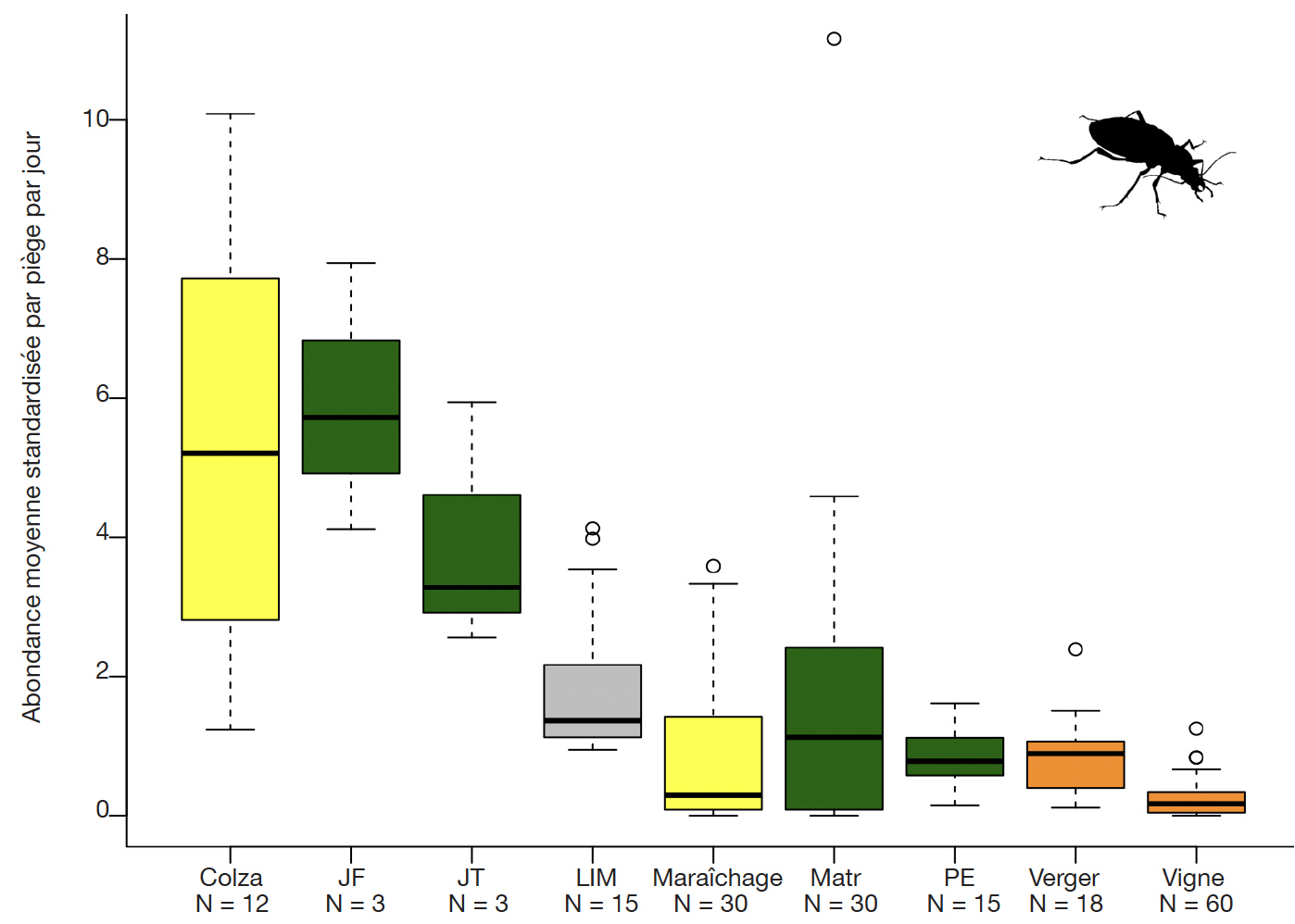 Figure 1. Abondances moyennes standardisées (nombre moyen d’individus par jour et par piège Barber) des carabes auxiliaires dans les milieux ruraux échantillonnés — Standardised average abundances of auxiliary carabids in rural habitats sampled (average number of individuals per day per pitfall trap).
Figure 1. Abondances moyennes standardisées (nombre moyen d’individus par jour et par piège Barber) des carabes auxiliaires dans les milieux ruraux échantillonnés — Standardised average abundances of auxiliary carabids in rural habitats sampled (average number of individuals per day per pitfall trap).
En jaune : cultures annuelles; en vert : zones hors cultures (JF : jachère florale, JT : jachère tournante, Matr : matrice, milieux herbacés adjacents aux cultures maraîchères, PE : prairie extensive); en gris : zone de transition SPB-culture (LIM : limite culture - SPB); en orange : cultures pérennes (verger, vigne) — in yellow : annual crops (rape, vegetables), green : non-crop habitats (JF : floral fallow, JT : rotation fallow, Matr : grass strip adjacent to vegetable crops, PE : extensive grassland), grey : transition zone (LIM) between a crop and a biodiversity promotion area (SPB), orange : perennial crops (orchards, vineyards) ; N : nombre de pièges — number of traps.
3.2. Les coccinelles (Coleoptera, Coccinellidae)
28Vingt-sept espèces de coccinelles ont été inventoriées sur les 66 espèces connues à Genève (Besuchet et al., 2012). Une espèce est signalée pour la première fois en Suisse grâce à cet inventaire : R. lophantae (Sanchez et al., 2021) et une autre pour la première fois dans le canton : Scymnus schmitdi Fürsch, 1958. Soixante-quatorze pourcent des espèces ont été observées dans les pièges à émergence en prairies extensives et sur l'enherbement interligne en vergers.
29À l'exception de trois espèces fongivores, Calvia decemguttata (Linnaeus, 1767), Psyllobora vigintiduopunctata (Linnaeus, 1758) et Tytthaspis sedecimpunctata (Linnaeus, 1761), toutes les coccinelles ont un stade adulte et larvaire prédateur. Près de la moitié des espèces prédatrices sont abondantes dans les cultures et peuvent être considérées comme des auxiliaires potentiels (Tableau 4), les plus répandues étant : Propylea quatuordecimpunctata (Linnaeus, 1758), Platynapsis luteorubra (Goeze, 1777), Scymnus frontalis (Fabricius, 1787) et Scymnus rubromaculatus (Goeze, 1777). À quelques exceptions près, les espèces auxiliaires sont inféodées à la strate herbacée et à la strate arbustive. La plupart se nourrissent de pucerons ainsi que d'autres arthropodes à corps mous (acariens, aleurodes, thrips ou cochenilles).
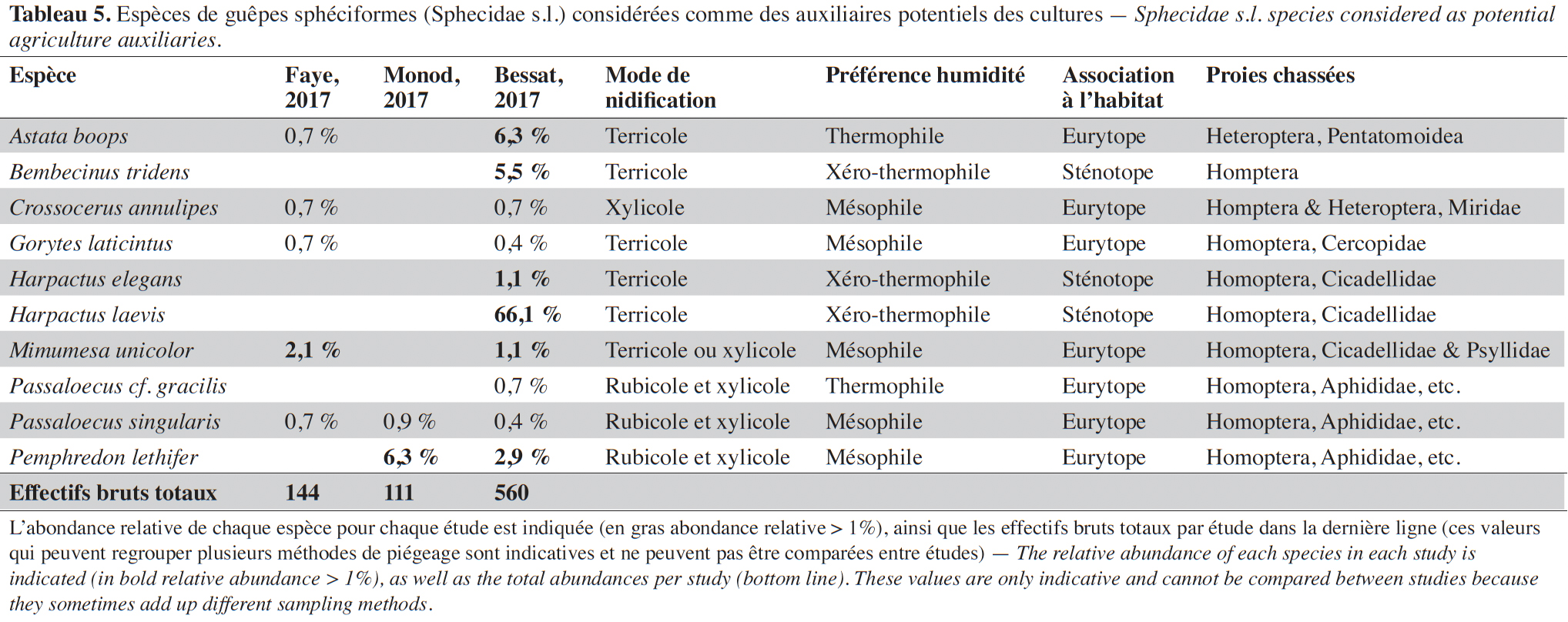
3.3. Les guêpes sphéciformes (Hymenoptera, Sphecidae s.l.)
30Quarante-sept espèces de guêpes sphéciformes ont été inventoriées parmi les 1 002 individus collectés. Trois espèces sont signalées pour la première fois à Genève (Boillat, 2012) : Pison atrum (Spinola, 1808), Trypoxylon beaumonti Antropov, 1991 et M. beaumonti. Pour cette dernière espèce, le spécimen collecté constitue également le premier spécimen helvétique (Pétremand et al., 2021).
31Dans les pièges à émergence, 17 espèces (41 %) ont été répertoriées. Ces données attestent de la nidification de ces espèces dans les prairies extensives ou dans l’enherbement des vergers. Certaines de ces espèces sont d’intérêt patrimonial et sont présentes sur la liste rouge allemande (Schmid-Egger, 2010) : Astata kashmirensis Nurse 1909, Bembecinus tridens Fabricius 1781, Harpactus elegans Lepeletier 1832, Harpactus laevis Latreille 1792 et Tachysphex tarsinus Lepeletier 1845. En Suisse, H. elegans est une espèce rare pour laquelle aucune donnée n’était disponible postérieurement à 2000 (Pétremand et al., 2021).
32Au total, 25 % des espèces répertoriées peuvent être considérées comme auxiliaires potentiels, les plus abondantes étant : H. laevis, Astata boops (Schrank, 1781), B. tridens et Pemphredon lethifer (Shuckard, 1837) (Tableau 5). Toutes les espèces les plus fréquentes sont des prédatrices d’hémiptères, principalement de cicadelles, pucerons, psylles et autres punaises hétéroptères. Plusieurs espèces sténotopes avec une affinité xérothermophile ont été trouvées (Tableau 5). Ce sont pour la plupart des espèces terricoles qui trouvent donc des sites de nidification au sein même des cultures (prairies extensives par exemple).
3.4. Les mouches Syrphidés (Diptera, Syrphidae)
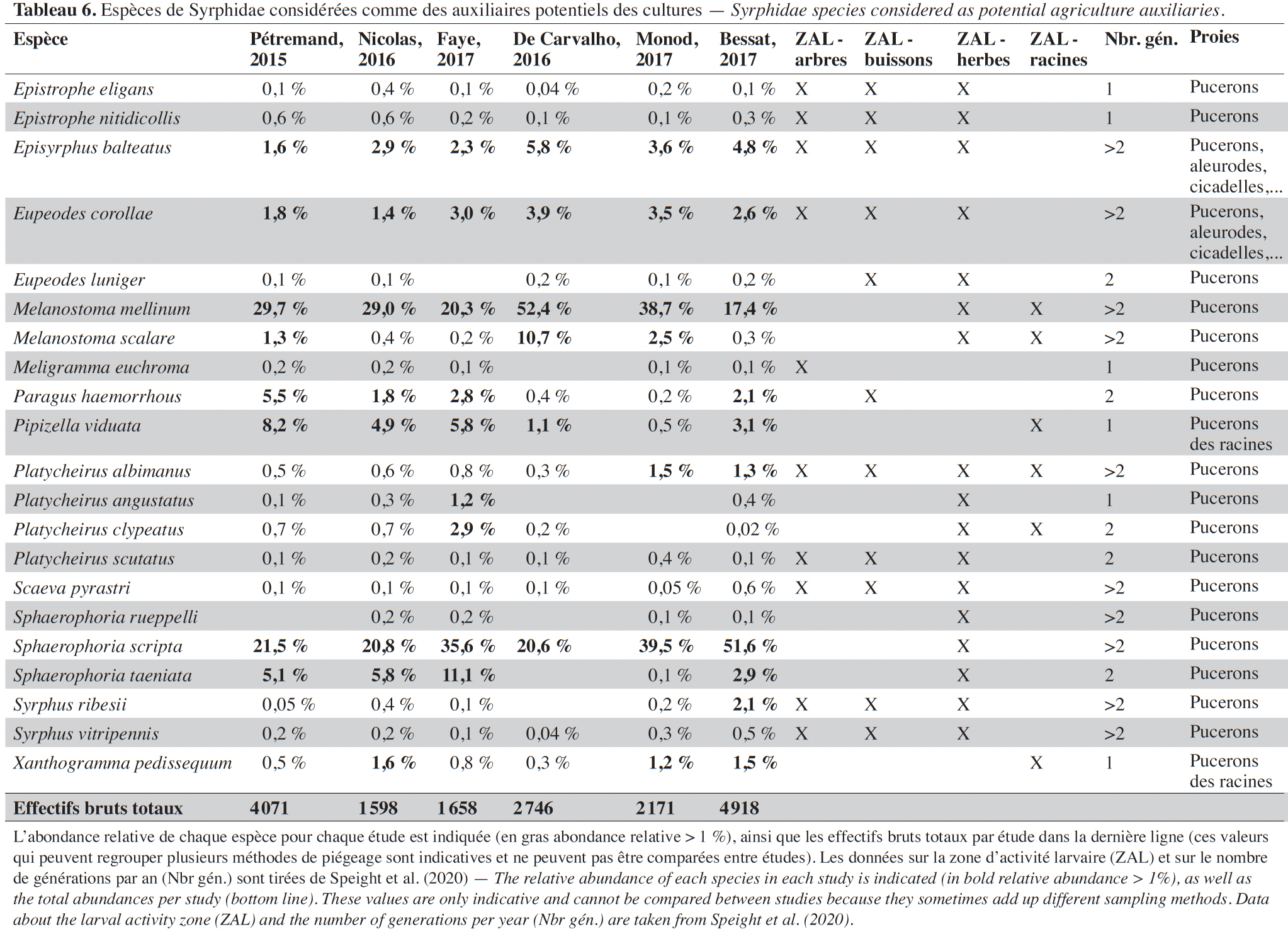
33De 2014 à 2017, 17 161 Syrphidés ont été récoltés et identifiés à l’espèce. Au total, 130 espèces ont été inventoriées dont près de 50 sont communes dans les agroécosystèmes et une trentaine observée pour la première fois dans le canton grâce à ces recensements. Environ 25 % des espèces (33) ont été collectées dans les pièges à émergence, témoignant de l’accomplissement du développement larvaire dans les agroécosystèmes (ici : enherbement en vignes ou en vergers et prairies extensives). Parmi l’ensemble des espèces, ± 55 % (69) possèdent des larves aphidiphages. Les espèces aphidiphages généralistes qui peuvent être considérées comme des auxiliaires potentiels représentent ± 30 % (21) des espèces (Tableau 6), la quasi-totalité ayant été observée dans des pièges à émergence. Au stade larvaire, la grande majorité des espèces est associée à la strate herbacée, certaines d’entre elles étant également associées à la strate arbustive ou arborée (Tableau 6). Quelques espèces se développent uniquement grâce à la présence d’arbres ou de buissons ou dans le sol (zone racinaire).
34Les études compilées permettent d’évaluer le potentiel de diverses cultures et habitats périphériques pour le développement des syrphes en milieux agricoles. Étonnamment, ce sont les vignobles en Production Intégrée (PI) qui permettent le développement du plus grand nombre de syrphes auxiliaires (Figure 2). Cette différence est significative entre les vignes en PI et les prairies extensives (test Wilcoxon, p-value = 0,009).
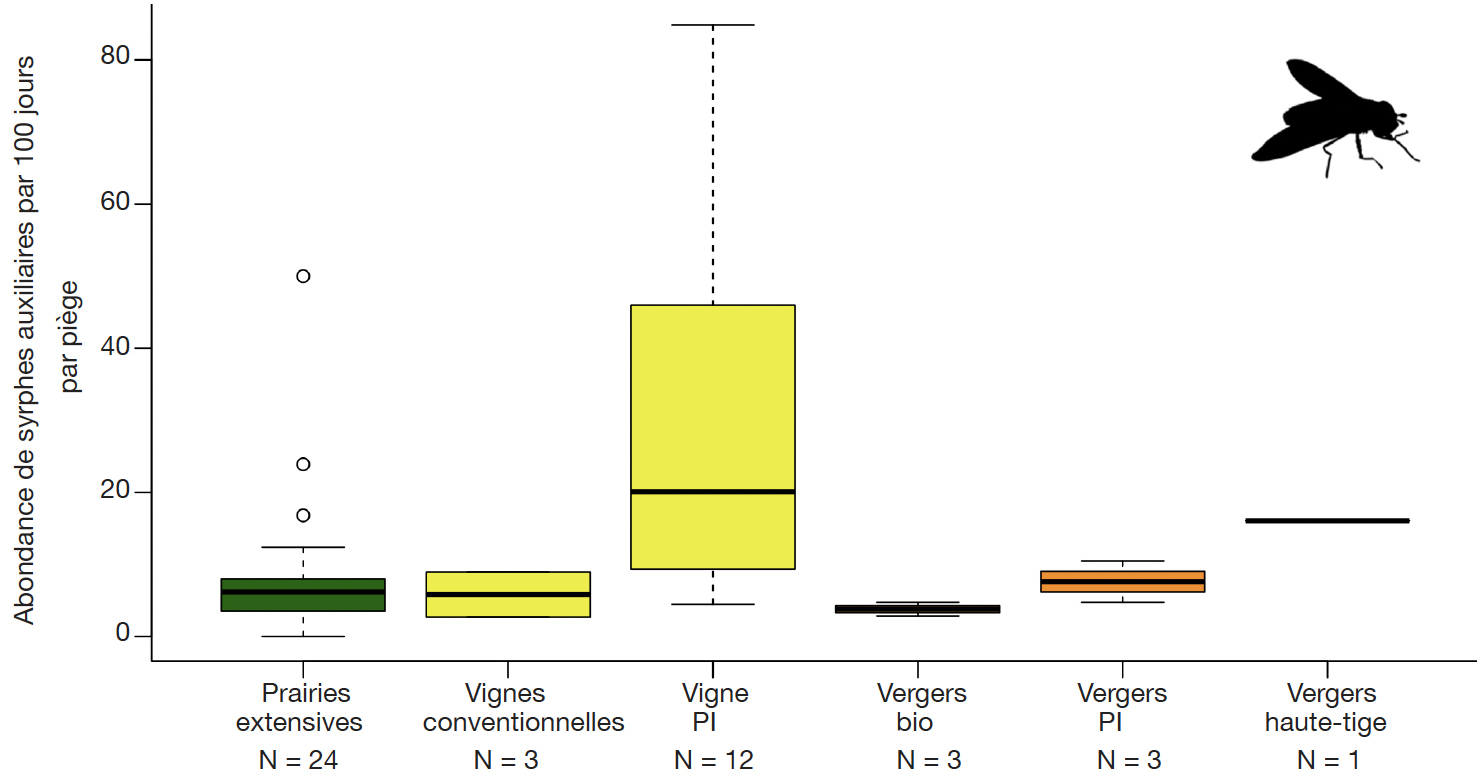 Figure 2. Abondances standardisées (nombre d’individus par 100 jours par piège à émergence) des syrphes auxiliaires dans les pièges à émergence dans différents milieux ruraux — Standardised average abundances of auxiliary syrphids in rural habitats (number of individuals per 100 days per emergence trap).
Figure 2. Abondances standardisées (nombre d’individus par 100 jours par piège à émergence) des syrphes auxiliaires dans les pièges à émergence dans différents milieux ruraux — Standardised average abundances of auxiliary syrphids in rural habitats (number of individuals per 100 days per emergence trap).
N : nombre de pièges — number of traps ; PI : production intégrée — integrated production.
35En termes de richesses spécifiques, le constat est quasiment similaire (Figure 3). Les richesses en vignes PI sont significativement supérieures à celles des prairies extensives (test Wilcoxon, p-value = 0,0015), vergers Bio (test Wilcoxon, p-value = 0,02) et des vergers PI (test Wilcoxon, p-value = 0,04). Les prairies extensives possèdent également des richesses significativement supérieures à celles de vergers Bio (test Wilcoxon, p-value = 0,04).
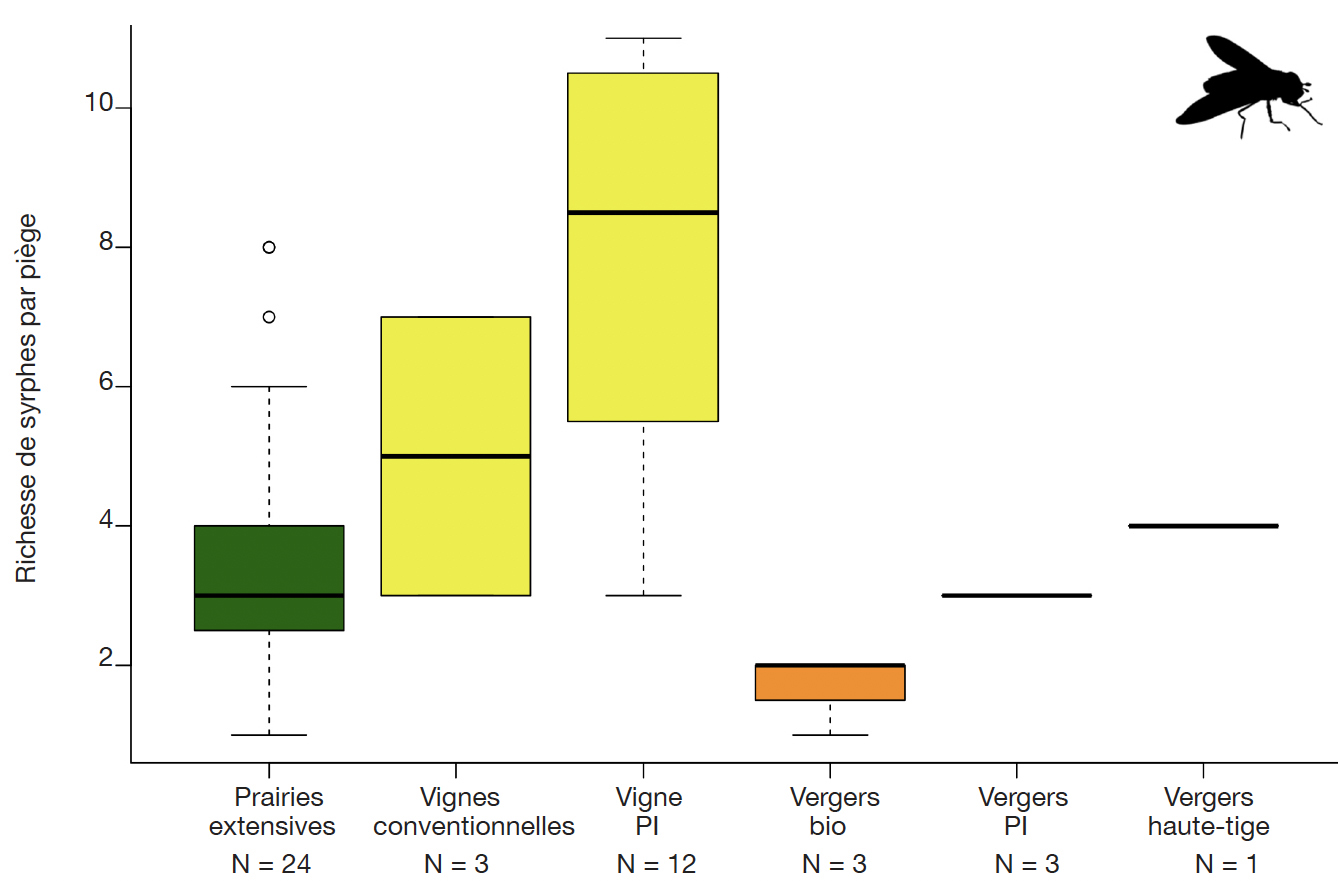 Figure 3. Richesse spécifique des syrphes dans les pièges à émergence dans différents milieux ruraux (nombre d’espèces par piège à émergence) — Species richness of auxiliary syrphids in rural habitats (number of species per emergence trap).
Figure 3. Richesse spécifique des syrphes dans les pièges à émergence dans différents milieux ruraux (nombre d’espèces par piège à émergence) — Species richness of auxiliary syrphids in rural habitats (number of species per emergence trap).
N : nombre de pièges — number of traps ; PI : production intégrée — integrated production.
3.5. Les Névroptères et Raphidioptères (Neuroptera et Raphidioptera )
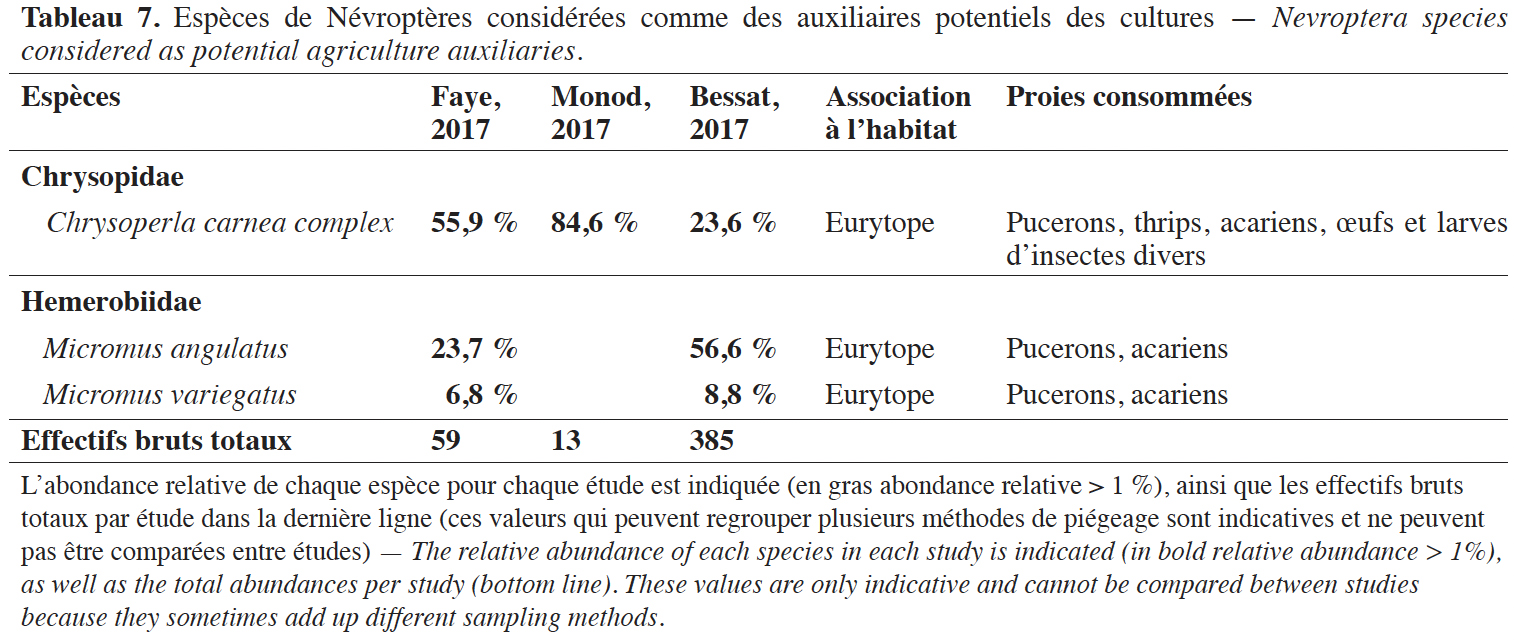
36Le présent inventaire a permis de répertorier 474 spécimens de sept espèces de Chrysopidae, six espèces d’Hemerobiidae, une espèce de Raphididae, Venustoraphidia nigricollis (Albarda, 1891), et une espèce de Myrmeleontidae, Distoleon tetragrammicus (Fabricius, 1798), dans les agroécosystèmes. Parmi elles, Chrysopa viridana Schneider, 1845, Chrysoperla lucasina (Lacroix, 1912), Cunctochrysa albolineata (Killington, 1935), Hypochrysa elegans (Burmeister, 1839), Hemerobius micans Olivier, 1792, Sympherobius pygmaeus (Rambur, 1842) et Micromus variegatus (Fabricius, 1793) sont ici signalées pour la première fois dans le canton de Genève d'après la liste de Hollier (2012).
37Deux espèces présentes sur la liste rouge suisse (Duelli, 1994) ont été inventoriées : Psectra diptera (Burmeister, 1839) (Hemerobiidae) et C. viridana (Chrysopidae).
38Pour ± 65 % des espèces de Névroptères (7 sur 11), au moins un spécimen a été collecté dans un piège à émergence, attestant de l’utilisation d'habitats agricoles au cours de leur développement. Au vu de l’abondance des espèces inventoriées, seules trois peuvent raisonnablement être considérées comme des auxiliaires potentiels majeurs dans les agroécosystèmes genevois : Chrysoperla carnea complex, Micromus angulatus (Stephens, 1836) et M. variegatus (Tableau 7). Ces trois espèces sont communes, eurytopes et s’attaquent en particulier aux petits arthropodes à corps mou (pucerons, acariens, etc.).
4. Discussion
4.1. Les carabes dans les milieux agricoles
39Une grande richesse de carabes (101 espèces) a été observée, au sein de laquelle figurent de nombreuses espèces rares et menacées en Suisse. Parmi celles qui semblent les plus menacées selon Duelli (1994), certaines ont depuis été répertoriées sur différents sites à Genève et en Suisse. Brachinus sclopeta semble d'ailleurs être aujourd’hui très abondant à Genève, profitant selon toute vraisemblance du réchauffement des températures. Bien qu'insoupçonnée, la richesse considérable en espèces « menacées » échantillonnée dans ces milieux agricoles souligne leur importance pour la conservation de la biodiversité. Le fait que 58 % des espèces observées aient été échantillonnées dans des pièges à émergence (cf. Annexe) permet de penser que l'agroécosystème permet à ces espèces d'effectuer leur développement larvaire dans les habitats échantillonnés (prairies extensives, enherbement interligne de vignes et vergers).
40La comparaison des abondances de carabes dans les milieux échantillonnés et les tendances observées permettent de suggérer que le maintien de populations importantes de carabes dans les agroécosystèmes genevois peut être favorisé par la présence de milieux herbacés peu denses proches des cultures (ex. jachères). Dans les cultures pérennes et notamment en vergers, l'enherbement interligne dense semble jouer pour les carabes un rôle similaire à celui d'une prairie. Uzman et al. (2020) ont de même démontré que les carabes étaient désavantagés plus l’enherbement interligne devenait dense dans les vignes. Il convient de gérer ces surfaces de la manière la plus extensive possible, en minimisant les impacts que peuvent avoir les PPh ou la compaction du sol due aux passages de machines sur les arthropodes du sol. En vignes, le rôle de l'enherbement semble différent de celui des vergers ; la végétation spontanée ou le semis d'un enherbement diversifié favorisant la biodiversité (Pétremand et al., 2016) ainsi qu’un enherbement peu dense (Uzman et al., 2020) semblent être les meilleurs moyens de promouvoir les populations de carabes.
41L’abondance élevée des carabes dans les cultures de colza comparativement aux milieux échantillonnés est notable. Dans cette culture, ce sont les carabes qui joueraient le plus grand rôle dans la régulation des principaux ravageurs (Alford, 2000 ; Serée et al., 2021). Leur présence dans les champs de colza est donc primordiale et semble être favorisée par la proximité d’habitats forestiers (Sutter et al., 2018) et défavorisée par un travail du sol en été (labour) ou au printemps (ex. sarclage) (Kosewska, 2016 ; Sivčev et al., 2018 ; Chmelík et al., 2019).
42Ces résultats mettent en lumière le rôle primordial joué par les milieux avec une végétation éparse (culture annuelle, jachères) pour favoriser l’activité des carabes dans l’agroécosystème. Les vignes et les cultures maraîchères font figure d’exception et semblent être largement défavorables à une forte activité des carabes auxiliaires, ce qui peut être expliqué par une grande instabilité du sol (perturbation mécanique, érosion) et/ou un manque de ressources alimentaires.
4.2. Les coccinelles dans les milieux agricoles
43Cet inventaire a permis de répertorier près de la moitié des espèces connues dans le canton de Genève. Parmi elles, près des trois-quarts se développent dans les prairies extensives et les vergers, deux structures pérennes. Ces milieux contribuent donc largement à la préservation des espèces de coccinelles présentes dans les milieux agricoles. La grande majorité des espèces sont prédatrices et peuvent être considérées comme de bons auxiliaires. Ces résultats témoignent donc de l’importance de ce groupe pour la lutte naturelle contre les ravageurs ainsi que de l’importance des habitats herbacés pérennes pour le maintien de la diversité des coccinelles dans les milieux agricoles.
4.3. Les guêpes sphéciformes dans les milieux agricoles
44Les données inédites présentées ici témoignent de l’importance des agroécosystèmes genevois pour ces espèces rares de guêpes sphéciformes qui, comme les abeilles sauvages, sont sensibles aux modifications environnementales et à la disponibilité des ressources nécessaires à leur survie (Le Divelec et al., 2016). Cette sensibilité est notamment due au fait que toutes les espèces soient univoltines (une seule génération par an) et qu’elles ne s’éloignent que faiblement de leur site de nidification pour trouver des ressources (une centaine de mètres seulement). Les présents résultats témoignent également de la présence d’espèces « utiles » dans les agroécosystèmes qu’il conviendrait de favoriser afin d’accroître leur impact en tant qu’auxiliaires des cultures pour la régulation des ravageurs et en tant que pollinisateurs. Toutefois, seules un quart des espèces recensées sont considérées comme auxiliaires prédateurs pour les cultures. En effet, les espèces de certains genres tels que Nysson sont des parasites et d’autres ne peuvent pas être considérées comme auxiliaires car elles chassent des arthropodes de groupes auxquels n’appartiennent aucun ravageur. Par exemple, les espèces de Trypoxylon sont très abondantes en milieu agricole et chassent uniquement des araignées (Bitsch et al., 2001) qui sont elles-mêmes des auxiliaires. L’abondance des Trypoxylon renseigne donc sur l’abondance des araignées.
45À Genève, une diversification de structures semi-naturelles des milieux agricoles pourrait avoir un impact non négligeable pour ce groupe, dont les sites de nidification sont rares (sols nus, tiges de végétaux, branches creuses, bois mort, etc.). En France, des études démontrent l’importance et la sensibilité de ce groupe dans les agroécosystèmes, ce qui mériterait une attention accrue dans de futures études (Le Divelec et al., 2016).
4.4. Les syrphes
46Près de 60 % de la syrphifaune genevoise (130 sur 228) ont été recensées dans les milieux agricoles. Une majorité d’entre elles sont toutefois surtout associées aux milieux forestiers au stade larvaire. Ces données témoignent de l’utilisation des milieux agricoles par les adultes pour la recherche de nourriture (nectar, pollen). Les agroécosystèmes semblent jouer un rôle primordial comme habitat et/ou ressource pour une grande diversité d’espèces.
47Les espèces de syrphes auxiliaires (Tableau 6) participent activement à la régulation de colonies de pucerons et de populations d’autres homoptères à corps mous (aleurodes ou cicadelles) dans différentes cultures (Chambers & Adams, 1986 ; Rojo et al., 2003 ; Rodríguez-Gasol et al., 2020). Par ailleurs, la quasi-totalité des espèces de Syrphidae étant des insectes pollinisateurs au stade adulte, ils participent aussi à la pollinisation des cultures et de la végétation naturelle. Les espèces les plus abondantes dans les agroécosystèmes sont principalement des espèces aphidiphages généralistes bi- ou plurivoltines (deux ou plus de deux générations par an) qui sont présentes dans une large gamme d’habitats (Tableau 6). Plusieurs espèces des genres Pipizella, Paragus et Xanthogramma sont des aphidiphages spécialisés des pucerons racinaires. Ces espèces se trouvent spécifiquement dans des prairies ou des vignobles avec une végétation herbacée peu entretenue (Pétremand et al., 2017a ; Bessat et al., 2019).
48D’après les résultats obtenus, les vignobles représentent un réservoir de syrphes auxiliaires significativement plus important, par unité de surface, que les prairies extensives ou les vergers. Cet élément met en valeur l’importance des habitats de type enherbement viticole en tant que SPB dans les milieux agricoles ; en revanche, les interlignes non enherbés (vignes conventionnelles) ne possèdent pas ce potentiel (Pétremand et al., 2017a). Dans le cas des vergers, bien qu'il s'agisse aussi de cultures pérennes comportant un interligne enherbé, ils ne montrent pas d’abondances élevées de syrphes auxiliaires émergents. L’explication de ce phénomène réside a priori dans des applications d’insecticides (Bio ou de synthèse) encore fréquentes en arboriculture pour contrôler les insectes ravageurs qui sont défavorables à la faune hypogée, contrairement à la viticulture où la lutte par confusion sexuelle (vers de la grappe) a permis l’arrêt des insecticides depuis nombre d’années dans la majorité du vignoble genevois.
49Les comparaisons des richesses de syrphes émergents mettent en avant le fait que les vignes en PI ne favorisent pas seulement l’abondance de syrphes auxiliaires mais également la diversité spécifique de cette famille. Les vignes en gestion conventionnelle favorisent elles aussi une diversité importante en espèces, indépendamment de la présence d’un enherbement ou de l’intensité des traitements avec des PPh. Les vergers Bio semblent abriter une faible diversité de syrphes. Un plus grand nombre d’interventions avec des PPh peut être évoqué comme cause probable. Il semble notable dans les vignes que le remplacement d’applications insecticides par la lutte par confusion sexuelle permet aux espèces sensibles de s'installer et d'augmenter la richesse biologique. En arboriculture (PI ou Bio), il existe plusieurs types de phéromones (carpocapse, capua, petite tordeuse, etc.) pour lutter par confusion sexuelle mais, malheureusement, ce moyen de lutte ne couvre pas la totalité des espèces, causant des dommages générant un impact économique.
50Ces résultats mettent en lumière la valeur biologique des vignes enherbées comme culture pérenne sans application d'insecticides. L’application d’insecticides en vergers semble être un des facteurs limitant l’abondance et la diversité des syrphes. L’autre facteur limitant, également valable pour les prairies extensives, pourrait être la dominance des Poacées et une faible représentation des Fabacées dans la strate herbacée, qui ne favorise pas la présence de pucerons. Dans les vignes, la dominance du trèfle rampant (Trifolium repens) dans les parcelles étudiées (Pétremand et al., 2016) pourrait favoriser la présence des pucerons et donc des syrphes dans l’interligne.
4.5. Les Névroptères
51Les présents résultats ont permis de doubler la liste des chrysopes et hémérobes connus à Genève, fait s’expliquant par le peu d’études effectuées sur ces groupes par le passé (Hollier, 2012).
52Parmi les espèces présentes sur la liste rouge suisse, Psectra diptera n’est pas connue pour se développer dans les milieux agricoles mais dans des milieux alluviaux de basse altitude (Duelli, 1994). Cependant, et depuis la mise hors-culture dès les années 1980 d’une partie de la zone agricole, Psectra diptera a notamment été recensée en grand nombre dans des anciennes prairies de fauche en Grande-Bretagne (Hollier et al., 1997). Ces auteurs suggèrent également une association entre la présence de cet hémérobe et celle du lotier corniculé (Lotus corniculatus L.) ou des ronces (Villenave et al., 2005). Six individus ont été collectés dans des pièges à émergence installés dans des PE de trois parcelles différentes. Ces captures indiquent que cette espèce puisse effectuer au moins une partie de son développement dans ces structures. Chrysopa viridana a été capturée dans un piège Malaise au sein d’un verger Bio. L’espèce était jusqu’à maintenant surtout connue des chênaies pubescentes au Tessin et en Valais (Duelli, 1994).
53Les espèces recensées dans cette étude et considérées comme auxiliaires peuvent jouer un rôle de prédation important dans tous types de cultures (annuelles ou pérennes) (Villenave-Chasset, 2017).
54Une augmentation d’éléments boisés (bosquets, haies) serait un élément clé pour favoriser ces prédateurs dans les milieux agricoles, ces habitats leur servant de sites d’hivernation et de repos (Villenave-Chasset 2017).
5. Conclusions
55Les données compilées et analysées ici mettent avant tout en lumière un important déficit de connaissance des arthropodes auxiliaires dans les agroécosystèmes du canton de Genève et, de manière plus générale, en Suisse. La plupart des groupes présentés dans cette synthèse demeurent rarement étudiés au niveau spécifique dans les milieux agricoles. Bien souvent, les spécimens de ces groupes sont dénombrés à la famille pour fournir une évaluation de leur abondance dans les cultures et déduire leur potentiel de prédation vis-à-vis de certains ravageurs (Moonen et al., 2016). Une approche spécifique révèle une plus grande complexité. En effet, dans la plupart des groupes abordés, seule une partie des espèces possèdent un régime alimentaire et une abondance suffisante pour posséder un impact potentiel effectif sur les populations de ravageurs en les amenant sous un seuil économique de tolérance. Les résultats présentés contribuent à améliorer nos connaissances faunistiques et biogéographiques sur les espèces présentes dans les agroécosystèmes. De plus, en termes agronomiques, ils mettent en évidence les espèces pouvant jouer un rôle d’auxiliaire pour la régulation des ravageurs. Par ailleurs, les données récoltées dans les pièges à émergence renseignent sur les espèces utilisant les milieux agricoles comme habitat et non seulement comme une ressource au stade adulte (ex. syrphes pollinisateurs effectuant leur développement larvaire en forêt).
56La découverte de nombreuses espèces, figurant sur la liste rouge ou encore non répertoriées pour le canton de Genève, atteste du rôle important qu’exercent les milieux agricoles en tant qu’habitats et ressources pour le maintien de la biodiversité locale. Aujourd’hui, la conservation et l’amélioration des conditions environnementales au sein des agroécosystèmes, par exemple en assurant la présence de SPB diversifiées, semblent représenter une clé permettant de favoriser la biodiversité, de lutter contre les insectes ravageurs par une meilleure résilience des milieux agricoles (Altieri & Nicholls, 2018) et d’atténuer les effets des épisodes climatiques extrêmes (Mijatović et al., 2013).
Remerciements
57Nous remercions toutes les personnes ayant participé à l’identification ou la vérification taxonomique : Yannick Chittaro (info fauna), Andreas Sanchez (info fauna), Irene Salzmann, Henryk Luka (FiBL), Martin C.D. Speight (Trinity Colledge, Dublin), Stefano Pozzi, ainsi que l'Office Cantonal de l'Agriculture et de la Nature pour le financement du projet GE-Auxi. Certains des travaux de masters de l’Université de Genève ont bénéficié d’un soutien financier du Master en Sciences Naturelles de l’Environnement (MUSE) de l’Institut des Sciences de l’Environnement.
Bibliographie
Alford D.V., 2019. Beneficial insects. Boca Raton, FL, USA: CRC Press.
Alford D.V., 2000. Biological control of insect pests on oilseed rape in Europe. Pestic. Outlook, 11(5), 200-202, doi.org/10.1039/b008023n
Ali M., 2020. Biodiversité fonctionnelle en milieu agricole : gestion des populations de ravageurs du colza par les araignées (Araneae) en relation avec les Surfaces de promotion à la biodiversité (SPB). Master MUSE, Université de Genève.
Altieri M. & Nicholls C., 2018. Biodiversity and pest management in agroecosystems. Boca Raton, FL, USA: CRC Press.
Barbosa P.A. (ed.), 1998. Conservation biological control. Elsevier.
Beaumelle L. et al., 2021. Benefits of increased cover crop diversity for predators and biological pest control depend on the landscape context. Ecol. Solutions Evidences, 2, e12086, 1-12, doi.org/10.1002/2688-8319.12086
Begg G.S. et al., 2017. A functional overview of conservation biological control. Crop Prot., 97, 145-158, doi.org/10.1016/j.cropro.2016.11.008
Bessat M., 2017. Biodiversité fonctionnelle en paysage agricole. Végétation et Diptères Syrphidae de Surfaces de Promotion de la Biodiversité (SPB) et acariens typhlodromes des vignobles adjacents. Master MUSE, Université de Genève.
Bessat M., Speight M.C. & Castella E., 2018. Addition de trois nouvelles espèces à la liste des Syrphidae (Diptera) du canton de Genève. Entomo Helv., 11, 73-78.
Bessat M. et al., 2019. Biodiversité fonctionnelle en paysage agricole : étude floristique et syrphidologique de Surfaces de Promotion de la Biodiversité (SPB). Biotechnol. Agron. Soc. Environ., 23(4), 226-244.
Besuchet C., Reuteler C. & Merz B., 2012. Cucujoidea. In: Merz B., éd. Liste annotée des insectes (Insecta) du canton de Genève. Instrumenta Biodiversitatis, Vol.VIII. Genève, Suisse : Musée d’histoire naturelle, 53-55.
Biddinger D.J. & Joshi N.K., 2017. First report of native Astata unicolor (Hymenoptera: Crabronidae) predation on the nymphs and adults of the invasive brown marmorated stink bug (Hemiptera: Pentatomidae). Florida Entomol., 100, 809-812, doi.org/10.1653/024.100.0408
Bitsch J. & Leclerc J., 1993. Hyménoptères Sphecidae d’Europe Occidentale, I. Coll. Faune de France, 79. Paris : Fédération Française des Sociétés de Sciences Naturelles.
Bitsch J. et al., 1997. Hyménoptères Sphecidae d’Europe Occidentale, II. Coll. Faune de France, 82. Paris : Fédération Française des Sociétés de Sciences Naturelles.
Bitsch J. et al., 2001. Hyménoptères Sphecidae d’Europe Occidentale, III. Coll. Faune de France, 86. Paris : Fédération Française des Sociétés de Sciences Naturelles.
Boillat H., 2012. Apoidea (Sphecidae s.l.). In: Merz B., éd. Liste annotée des insectes (Insecta) du canton de Genève. Instrumenta Biodiversitatis, Vol. VIII. Genève, Suisse : Musée d’histoire naturelle, 225-230.
Canard M., Séméria Y. & New T.R., eds, 1984. Biology of Chrysopidae. The Hague: W. Junk.
Carminati J., Mora F. & Cretin J.-Y., 2019. Liste commentée des Hyménoptères Sphéciformes de Franche-Comté (Ampulicidae, Crabronidae, Sphecidae). Besançon, France : Conservatoire Botanique National de Franche-Comté – Observatoire régional des Invertébrés.
Chambers R.J. & Adams T.H.L., 1986. Quantification of the impact of hoverflies (Diptera: Syrphidae) on cereal aphids in winter wheat: an analysis of field populations. J. Appl. Ecol., 23, 895-904, https://www.jstor.org/stable/2403942
Chmelík V. et al., 2019. The effect of farming system and management practices on surface-dwelling soil macrofauna. Zemdirbyste-Agriculture, 106(4), 291-296, doi.org/10.13080/z-a.2019.106.037
De Carvalho A.G., 2017. Les communautés de syrphes associés au Surface de Promotion de la Biodiversité en milieu viticole. Master MUSE, Université de Genève.
DETA, 2015. L’environnement genevois en chiffres. République et Canton de Genève, https://static1.squarespace.com/static/5c7cf78df8135a44ada9c479/t/5c862ed415fcc08f42bc-34da/1552297723047/environnement_en_chiffres_12-2015.pdf, (1.06.2021).
Devetak D. & Klokočovnik V., 2016. The feeding biology of adult lacewings (Neuroptera): a review. Trends Entomol., 12, 30-42.
Djoudi E.A., Plantegenest M., Aviron S. & Pétillon J., 2019. Local vs. landscape characteristics differentially shape emerging and circulating assemblages of carabid beetles in agroecosystems. Agric. Ecosyst. Environ., 270, 149-158, doi.org/10.1016/j.agee.2018.10.022
Duelli P., éd., 1994. Liste rouge des espèces animales menacées de Suisse. Berne : Office fédéral de l’environnement, des forêts et du paysage.
Faye J.D., 2017. Les Syrphidae (Insectes Diptères) associés à deux vergers de pommiers différents par leur gestion. Master MUSE, Université de Genève.
Ferrillo T., 2020. Que nous apprennent les coléoptères Carabidae sur la qualité écologique des agroécosystèmes urbains du canton de Genève? Master MUSE, Université de Genève.
Gayubo S.F., González J.A., Asís J.D. & Tormos J., 2005. Conservation of European environments: the Spheciformes wasps as biodiversity indicators (Hymenoptera: Apoidea: Ampulicidae, Sphecidae and Crabronidae). J. Nat. Hist., 39(29), 2705-2714, doi.org/10.1080/00222930500114095
Gonseth Y., Wohlgemuth T., Sansonnens B. & Buttler A., 2001. Les régions biogéographiques de la Suisse – Explications et division standard. Cahier de l’environnement n° 137. Berne : Office fédéral de l’environnement, des forêts et du paysage.
Gonzato E., 2018. Biodiversité fonctionnelle et surfaces de promotion de la biodiversité en verger de pommiers : impact sur les Carabidae. Thèse de bachelor : Hepia, Genève.
Hagen K.S., 1962. Biology and ecology of predaceous Coccinellidae. Annu. Rev. Entomol., 7(1), 289-326, doi.org/10.1146/annurev.en.07.010162.001445
Hollier J.A., Smith P.H.D. & Mortimer S., 1997. Habitat use and wing form in Psectra diptera (Neuroptera: Hemerobiidae). Entomologist, 116, 28-30.
Hollier J., 2012. Neuroptera. In: Merz B., éd. Liste annotée des insectes (Insecta) du canton de Genève. Instrumenta Biodiversitatis, Vol. VIII. Genève, Suisse : Musée d’histoire naturelle, 198-199.
Homburg K. et al., 2014. Carabids. org–a dynamic online database of ground beetle species traits (Coleoptera, Carabidae). Insect Conserv. Divers., 7(3), 195-205, doi.org/ 10.1111/icad.12045
Jenny M. et al., 2002. Perdrix grise. Rapport final 1991-2000. Cahier de l’environnement n° 335. Berne : OFEFP & Station ornithologique suisse.
Klaiber J. et al., 2017. Fauna indicativa. WSL Berichte, 54.
Kosewska A., 2016. Conventional and non-inversion tillage systems as a factor causing changes in ground beetle (Col. Carabidae) assemblages in oilseed rape (Brassica napus) fields. Period. biol., 118(3), 231-239, doi.org/ 10.18054/pb.2016.118.3.4074
Kromp B., 1999. Carabid beetles in sustainable agriculture: a review on pest control efficacy, cultivation impacts and enhancement. Agric. Ecosyst. Environ., 74(1-3), 187-228, doi.org/10.1016/S0167-8809(99)00037-7
Le Divelec R. et al., 2016. Étude des Sphécides en grandes cultures dans la moitié nord de la France : caractérisation des communautés, évaluation du potentiel auxiliaire et mise en évidence des habitats favorables (Hymenoptera Ampulicidae, Crabronidae et Sphecidae). Bull. Mens. Soc. Linn. Lyon, 86(1-2), 29-64.
Luka H. et al., 2009. Coleoptera, Carabidae: ecology, atlas. Fauna Helvetica, Vol. 24. Neuchâtel, Suisse : Centre suisse de cartographie de la faune.
Marggi W., 2012. Superfamille Caraboidea (Carabidae). In: Merz B., éd. Liste annotée des insectes (Insecta) du canton de Genève. Instrumenta Biodiversitatis, Vol. VIII. Genève, Suisse : Musée d’histoire naturelle, 90-97.
McEwen P.K., New T.R. & Whittington A.E., eds, 2001. Lacewings in the crop environment. Cambridge, UK: Cambridge University Press.
Mijatović D., Van Oudenhoven F., Eyzaguirre P. & Hodgkin T., 2013. The role of agricultural biodiversity in strengthening resilience to climate change: towards an analytical framework. Int. J. Agric. Sustainability, 11(2), 95-107, doi.org/ 10.1080/14735903.2012.691221
Monod V., 2017. Diversité spécifique et fonctionnelle en grandes cultures. Végétation et entomofaune de surfaces semi-naturelles associées à des cultures de colza (Canton de Genève, Suisse). Master MUSE, Université de Genève.
Moonen A.C. et al., 2016. Beneficials database management and scoring system development. EU FP7 QUESSA project Deliverable 2.4., http://docs.wixstatic.com/ugd/3ccd83_67154bd3e2314acf9c8a080e8d4b7925.pdf?index=true, (14/11/2022).
OCAN (Office cantonal de l’Agriculture et de la Nature), 2021. Rapport d’activité, annexes et statistiques du rapport d'activité 2020. Genève, Suisse : OCAN.
Pétremand G., 2015a. Pratiques agricoles et biodiversité : impact de l’enherbement viticole sur l’entomofaune auxiliaire (Diptera : Syrphidae, Coleoptera : Carabidae). Master MUSE, Université de Genève.
Pétremand G., 2015b. Trois espèces de carabes (Coleoptera: Carabidae) sur la liste rouge suisse capturées dans le vignoble du canton de Genève. Entomo Helv., 8, 157-160.
Pétremand G. & Speight M.C., 2015. Additions à la liste des Syrphidae (Diptera) du canton de Genève, incluant des espèces rares en Suisse. Entomo Helv., 8, 47-58.
Pétremand G., Fleury D., Castella E. & Delabays N., 2016. Influence de l’enherbement viticole sur les Carabidae (Coleoptera) et intérêt potentiel pour le contrôle de certains ravageurs de la vigne. Biotechnol. Agron. Soc. Environ., 20(3), 375-385.
Pétremand G. et al., 2017a. Hoverfly diversity supported by vineyards and the importance of ground cover management. Bull. Insectology, 70(1), 147-155.
Pétremand G., De Carvalho A.G., Speight M.C.D. & Castella E., 2017b. Observations récentes de Callicera aurata (Rossi, 1790) (Diptera: Syrphidae) en Suisse. Entomo Helv., 10, 73-79.
Pétremand G. & Castella E., 2021. Inventaire des groupes d’auxiliaires prédateurs dans les agroécosystèmes du canton de Genève. Projet GE-Auxi 2019-2020. Genève, Suisse : Office cantonal de l’agriculture et de la nature.
Pétremand G., Salzmann I. & Castella E., 2021. Hyménoptères Crabronidae remarquables des milieux agricoles genevois et nouvelle espèce pour la Suisse. Entomo Helv., 14, 85-92.
R Core team, 2020. R: a language and environment for statistical computing. Vienna: R foundation for Statistical Computing, https://www.r-project.org/, (14/11/2022).
Rodríguez-Gasol N., Alins G., Veronesi E. & Wratten S., 2020. The ecology of predatory hoverflies as ecosystem-service providers in agricultural systems. Biol. Control, 151, 104405, doi.org/10.1016/j.biocontrol.2020.104405
Rojo S. et al., 2003. A world review of predatory hoverflies (Diptera, Syrphidae: Syrphinae) and their prey. Alicante, Spain: CIBIO Ediciones.
Sanchez A., Pétremand G., Attias D. & Chittaro Y., 2021. Rhyzobius lophanthae Blaisdell, 1892, une coccinelle exotique nouvelle pour la faune de Suisse (Coleoptera, Coccinellidae). Entomo Helv., 14, 165-167.
Schmid-Egger C., 2010. Rote Liste der Wespen Deutschlands. Ampulex, 1, 5-39.
Serée L. et al., 2021. Exploring multitrophic interactions in oilseed rape fields reveals the prevailing role of Carabidae. Ecol. Evol., 11(21), 15377-15388, doi.org/ 10.1002/ece3.8229
Sivčev L. et al., 2018. Ground beetle assemblages affected by oilseed rape management practice. Acta Zool. Bulg., 70(3), 367-376.
Speight M.C.D. et al., 2019. Révision de la liste des Diptères Syrphidae du canton de Genève, incluant cinq espèces nouvelles pour la Suisse. Entomo Helv., 12, 87-98.
Speight M.C.D., Castella E. & Sarthou J.-P., 2020. StN 2020. In: Speight M.C.D., Castella E., Sarthou J.-P. & Vanappelghem C., eds. Syrph the Net on CD, Issue 12. Dublin: Syrph the Net Publications.
Sutter L., Amato M., Jeanneret P. & Albrecht M., 2018. Overwintering of pollen beetles and their predators in oilseed rape and semi-natural habitats. Agric. Ecosyst. Environ., 265, 275-281.
Uzman D., Entling M.H., Leyer I. & Reineke A., 2020. Mutual and opposing responses of carabid beetles and predatory wasps to local and landscape factors in vineyards. Insects, 11, 746, doi.org/10.3390/insects11110746
Villenave-Chasset J., 2017. Biodiversité fonctionnelle - Protection des cultures et auxiliaires sauvages. Paris : Agriproduction, Éditions France Agricole.
Villenave J., Canard M., Lodé T. & Rat-Morris E., 2005. Ecological and eidonomic notes on the lacewing species Psectra diptera in western France (Neuroptera: Hemerobiidae). Entomol. Generalis, 28(3), 183-192.
Witt R., 2009. Wespen. Oldenburg, Germany: Vademecum-Verlag.






