- Portada
- Volume 21 (2017)
- Numéro 1
- Entandrophragma cylindricum (Sprague) Sprague (Meliaceae), une espèce ligneuse concurrentielle en Afrique centrale (synthèse bibliographique)
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Entandrophragma cylindricum (Sprague) Sprague (Meliaceae), une espèce ligneuse concurrentielle en Afrique centrale (synthèse bibliographique)

Notes de la rédaction
Reçu le 9 janvier 2016, accepté le 18 octobre 2016
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
Résumé
Introduction. De nos jours, la gestion des ressources forestières ne se focalise plus sur l’exploitation exclusive du bois d’œuvre, mais prend également en considération les produits forestiers non ligneux. Entandrophragma cylindricum (Sprague) Sprague, de son nom commercial « sapelli/sapele », de la famille des Meliaceae, illustre parfaitement cette situation. Le présent article fait un état de l’art des connaissances concernant E. cylindricum et présente quelques informations sur la chenille qui lui est inféodée.
Littérature. Le sapelli est une des espèces ligneuses les plus exploitées d’Afrique centrale pour son bois d’œuvre. Il est répandu dans la forêt dense humide semi-caducifoliée du domaine guinéo-congolais. C’est une espèce semi-héliophile, son mode de dispersion est anémochore et sa phénologie est régulière. Selon la sylviculture appliquée, sa croissance en diamètre peut atteindre jusque 0,82 cm par an. Cette essence est également l’hôte d’une espèce de chenille comestible riche en protéines, Imbrasia oyemensis Rougeot. Fortement appréciée par les populations locales, cette chenille fait également l’objet d’un commerce régional et international. Enfin, l’écorce du sapelli est reconnue pour son intérêt ethnobotanique, particulièrement en médecine traditionnelle.
Conclusions. Les informations tirées de la littérature ont permis de mettre en évidence certaines lacunes relatives à l’écologie et au mode de reproduction de cette espèce et, ceci, en dépit de son importance pour le commerce du bois. De plus, les inconnues quant à la productivité et la saisonnalité des chenilles d’Imbrasia oyemensis sur cet arbre nécessitent de développer des recherches complémentaires pour garantir la durabilité de l’exploitation simultanée de la ressource ligneuse et non ligneuse et pour proposer des modes de gestion concertés entre exploitants industriels et populations locales.
Abstract
Entandrophragma cylindricum (Sprague) Sprague (Meliaceae), a competitive tree species in Central Africa. A review
Introduction. Nowadays, the management of forest resources is no longer focused on the exclusive extraction of timber; it must also consider the use and management of non-timber forest products. Entandrophragma cylindricum (Sprague) Sprague, whose trade name is “sapelli/sapele”, and which belongs to the Meliaceae family, perfectly illustrates this issue. This article proposes an overview of the existing literature regarding E. cylindricum and presents some information on its host caterpillar.
Literature. Sapele is among the most exploited tree species in Central Africa, due to its valuable timber. This tree is common in the semi-deciduous rainforest of the Guinean–Congolese domain. It is a non-pioneer, light-demanding species, its dispersal mode is anemochorous and the phenology is regular. Logging coupled with thinning boosts the diametric growth of individuals by up to 0.82 cm·year-1. Sapele is also the host of an edible caterpillar species that is rich in protein, Imbrasia oyemensis Rougeot. Highly appreciated by the local populations, this caterpillar is sought out for regional and international trade purposes. In addition, the bark of the sapele is renowned for its ethnobotanical properties, especially in traditional medicine.
Conclusions. The information reviewed from the literature helped to highlight some gaps in the knowledge regarding the reproductive ecology of this species, despite its importance for the timber trade. In addition, the current lack of information regarding the productivity and the seasonality of caterpillars of I. oyemensis inhabiting this tree requires the development of complementary research to ensure the sustainability of timber and non-timber uses for sapele. In addition, it is important that such improved silvicultural techniques involve concerted management interventions between logging companies and the local populations.
Tabla de contenidos
1. Introduction
1Les forêts et autres terres boisées sont reconnues comme étant des ressources qui fournissent de nombreux services (Yapp et al., 2010), indispensables à la survie d’environ 1,4 milliard d’habitants (FAO, 2014a). La superficie totale des forêts du monde selon la Fao (2016) serait de 4 milliards d’hectares. Considérées comme le second massif continu de forêts tropicales de la planète, les forêts denses humides du bassin du Congo couvrent environ 200 millions d'hectares (De Wasseige et al., 2012). Ces forêts ont régressé à raison de 0,14 % entre 2000 et 2010, principalement suite à leur conversion en surfaces cultivables. Toutefois, le taux de déforestation entre 1990 et 2010 avait diminué de 0,05 % pour l’ensemble des forêts humides d’Afrique centrale (De Wasseige et al., 2015).
2La production de bois d’œuvre enregistrée par les statistiques des États d’Afrique centrale (Cameroun, RCA, Gabon et la République du Congo principalement) est restée stable depuis 2010 et représente environ 6 millions de m³ de bois produit par an. Parmi les essences les plus prisées, on compte Entandrophragma cylindricum (Sprague) Sprague (Meliaceae), essence connue sous le nom commercial de « sapelli » avec 1,3 million de m³ de grumes exploités par an et dont les principaux pays producteurs sont la République du Congo et le Cameroun (Bayol et al., 2012). Un enjeu sociétal important autour de cet arbre est lié au fait que son écorce est utilisée en médecine traditionnelle (Kemeuze, 2008), mais surtout au fait que cette essence héberge saisonnièrement une chenille comestible très prisée par les populations locales, Imbrasia oyemensis Rougeot, 1955 (Saturniidae).
3Cette chenille répond à la définition que donne la FAO (1999) d’un produit forestier non ligneux (PFNL), à savoir : « un produit d'origine biologique issu de la forêt et autre que le bois ». Le double intérêt que représente E. cylindricum (bois d’œuvre et source alimentaire au travers de la chenille) lui confère le statut d’essence concurrentielle, c’est-à-dire une espèce végétale recherchée à la fois par les populations et les exploitants forestiers (Vermeulen et al., 2009). Ceci le met au centre des préoccupations sociétales du fait de son importance, d’une part pour l’industrie du bois d’œuvre et, d’autre part, comme source d’alimentation pour les peuples forestiers (Chupezi Tieguhong & Ndoye, 2007). Afin d'assurer une gestion durable de ces deux ressources, il est nécessaire de posséder des connaissances approfondies de l’écologie du sapelli, de celle de sa chenille ainsi que de leurs interactions.
4Cet article présente une synthèse bibliographique des informations scientifiques disponibles sur E. cylindricum et cherche à relever les lacunes scientifiques éventuelles qui mériteraient d’être explorées afin de proposer des modes de gestion concertés de cette espèce pour les principaux utilisateurs. La recherche documentaire a été menée en consultant :
5– les bases de données Scopus et ScienceDirect, ainsi que la littérature « grise » via le moteur de recherche Google Scholar ;
6– divers ouvrages répertoriés dans la base de données de la bibliothèque centrale de la Faculté des Sciences agronomiques de Gembloux Agro-Bio Tech (Belgique).
7Les mots-clés employés, autant en français que dans la traduction anglaise, pour cette recherche bibliographique sont dérivés des termes suivants : Entandrophragma cylindricum, sapelli/sapele, mahogany, taxonomie, écologie, reproduction, génétique, ethnobotanique, commerce du bois, Imbrasia oyemensis, chenille comestible.
2. Distribution géographique
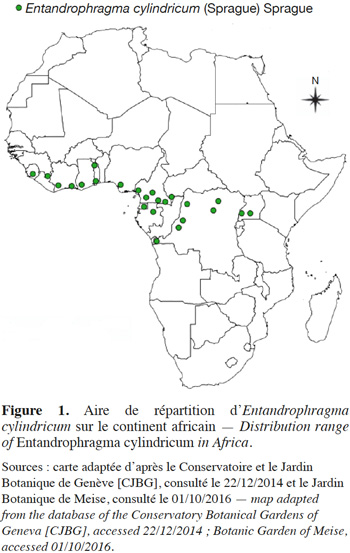
8Entandrophragma cylindricum est une espèce endémique de la région guinéo-congolaise, plus particulièrement localisée dans les forêts semi-caducifoliées et se retrouvant jusqu’à la limite des forêts denses sempervirentes (Anonyme, 1974 ; Palla et al., 2002). Elle est répandue depuis la Sierra Leone jusqu’en Ouganda, près du Lac Victoria sauf au Togo et au Bénin, zone communément appelée Dahomey Gap (Staner, 1941 ; Anonyme, 1974 ; Vivien & Faure, 1985 ; Palla et al., 2002), entre 12° Nord et 5° Sud (Figure 1). D’une région à l’autre, E. cylindricum porte divers noms vernaculaires: Aboudikro (Côte d’Ivoire), Penkwa ou Sapele (Nigeria, Ghana), Assié ou Asi (Cameroun et Gabon), M’boyo (République centrafricaine et Nord-Congo), Libuyu (République Démocratique du Congo) et Muyovu (Ouganda) (Aubréville, 1959 ; Anonyme, 1974 ; Vivien & Faure, 1985).
3. Taxonomie et description botanique
3.1. Genèse de la description de l’espèce
9Le genre Entandrophragma, de la famille des Meliaceae, a été décrit pour la première fois en 1894 par Casimir De Candolle à partir d’un arbre originaire d’Angola qu’il a différencié du genre Swietenia par la présence d’un disque connecté à la base du tube staminal de la fleur et présentant 10 cloisons distinctes (Chevalier, 1909 ; Sprague, 1910 ; Tailfer, 1989).
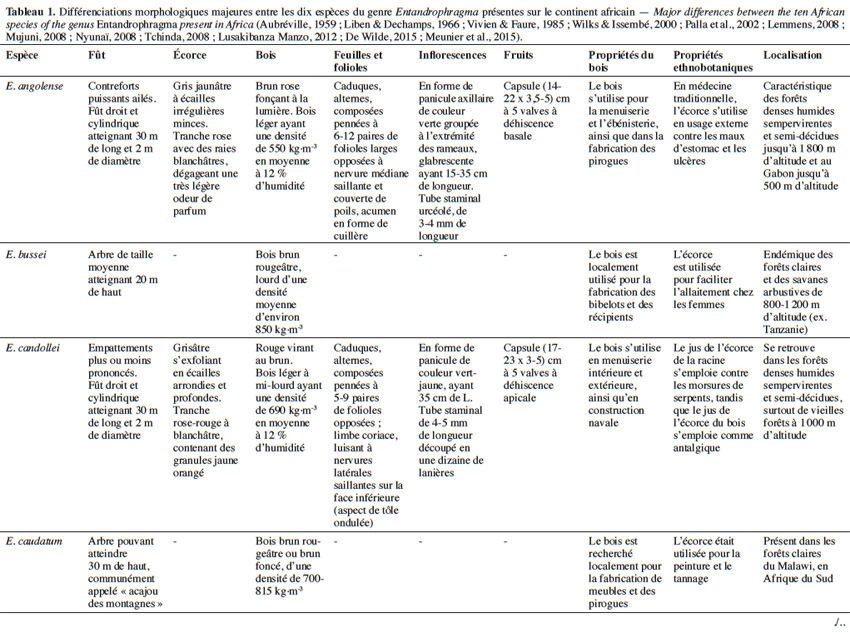
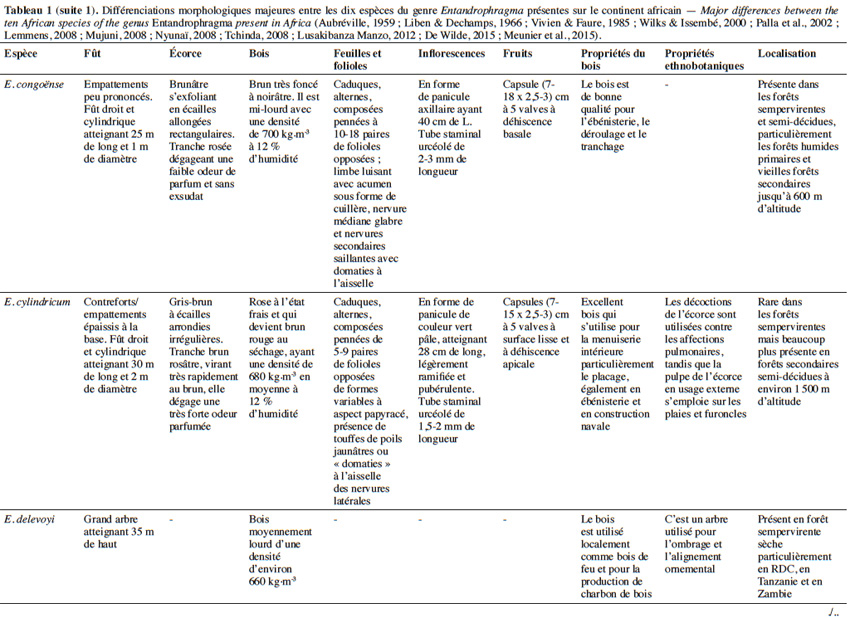
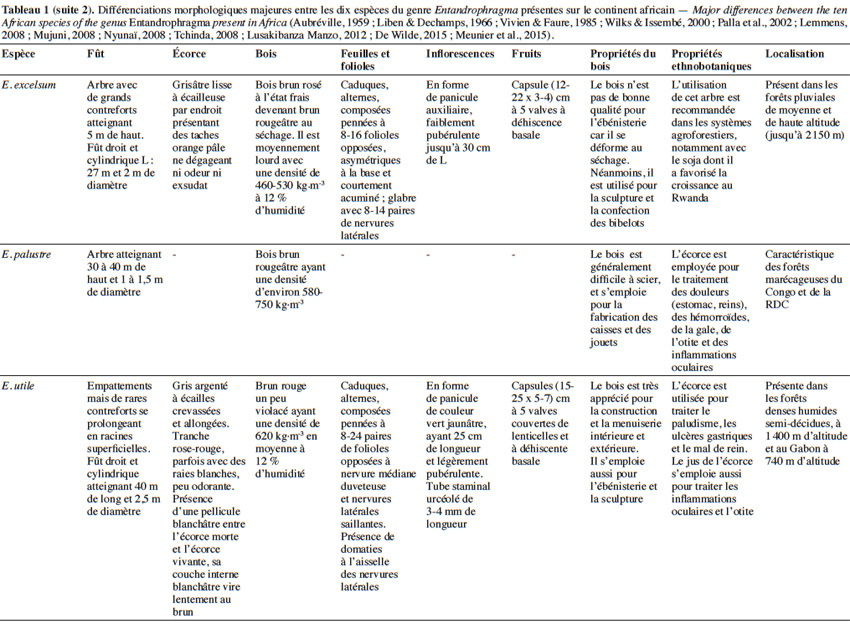
10Aujourd’hui, 10 espèces appartenant au genre Entandrophragma sont reconnues et se retrouvent en forêt dense humide africaine (De Wilde, 2015 ; The Plant List, 2015). Les espèces les plus connues comme essences de bois d’œuvre sont : Entandrophragma utile (Dawe & Sprague) Sprague, Sipo, Entandrophragma candollei Harms, Kossipo, Entandrophragma angolense Welw. C.DC., Tiama blanc, Entandrophragma congoënse (Pierre ex De Wild.) A.Chev., Tiama noir et Entandrophragma cylindricum (Sprague) Sprague (Aubréville, 1959 ; Vivien & Faure, 1985). Entandrophragma palustre Staner, Entandrophragma caudatum (Sprague) Sprague, Entandrophragma excelsum Dawe & Sprague (Sprague), Entandrophragma bussei Harms ex. Engl. et Entandrophragma delevoyi De Wild. sont de moindre qualité en matière d’ébénisterie (Lemmens, 2008) ; elles ne sont certes pas commercialisées mais possèdent une valeur écologique fondamentale et pourraient être utilisées notamment pour les plantations d’enrichissement en zone de forêt sèche sempervirente (Malaisse, 1993). Compte tenu de la très grande ressemblance entre les espèces du genre Entandrophragma sur le terrain, le tableau 1 présente les principaux critères discriminants entre les différentes espèces présentes sur le continent africain.
3.2. Description botanique
11La description botanique d’E. cylindricum ci-dessous est une synthèse établie sur base des publications de Sprague (1910), Pellegrin (1929), Staner (1941), Aubréville (1959), De La Mensbruge (1966), Vivien & Faure (1985), ATIBT (1986), Tailfer (1989), Palla et al. (2002), Insidewood (2004) Kemeuze (2008), Meunier et al. (2015) et De Wilde (2015). Entandrophragma cylindricum est un arbre pouvant atteindre 60 m de hauteur. Son fût est droit et cylindrique jusqu’aux premières grosses branches. Il peut mesurer jusqu’à 2 m de diamètre et présente souvent des empattements ou contreforts parallélépipédiques et épaissis à la base (Figure 2). L’écorce a de 2 à 8 cm d’épaisseur et est de couleur gris argenté ou brun grisâtre. Elle comporte de nombreuses lenticelles et se desquame en plaques irrégulières. Sa tranche, à l’état frais, est de couleur rose, elle présente un aspect non fibreux, assez tendre, devenant brun-cannelle en séchant à l’air et dégageant une forte odeur parfumée. La cime est arrondie. Les jeunes rameaux, côtelés vers le sommet, sont veloutés, pubérulents et ponctués de nombreuses lenticelles brunâtres. Les feuilles sont généralement imparipennées, rarement paripennées, à pétiole élargi et aplati à la base (Figure 3). Les 10 à 18 folioles sont pétiolulées. Le limbe est elliptique ou lancéolé, généralement dissymétrique à la base, brillant à la face supérieure, de 6 à 15 cm de long et de 2 à 5 cm de large, aigu ou obtus au sommet (Figure 4). Souvent sont perceptibles des touffes de poils jaunâtres à l’aisselle des nervures latérales et parfois de fines pubérulences sur les nervures médianes et latérales. Les nervures sont au nombre de 6 à 10 paires, anastomosées en arc vers le bord, proéminentes à la face inférieure. L’inflorescence est en amples panicules groupées au sommet des rameaux, à rachis et ramuscules pubérulents. Les fleurs hermaphrodites et régulières, de couleur vert tendre, ont un léger parfum. Le calice est déprimé à l'insertion du pédicelle, à 5 lobes largement triangulaires. Les 5 pétales sont étalés à l'anthèse avec des extrémités recourbées intérieurement en crochet (Figure 3). Le tube staminal est urcéolé, de 1,5 à 2 mm de longueur et à bord légèrement denté. Les anthères sont lancéolées se terminant en une pointe. L'ovaire est conique et surbaissé, surmonté d'un style presque nul et d'un stigmate épais. Le fruit est une capsule fusiforme de 7 à 15 cm de long et de 2,5 à 3 cm de large, subaigüe ou mucronulée au sommet. La déhiscence est apicale et comporte cinq valves oblongues lancéolées, de consistance ligneuse et de couleur d’un gris brunâtre luisant à l’intérieur. La columelle est plus ou moins pentagonale, de couleur jaune paille. La vingtaine de graines ailées, soit 3 à 4 par lobe, ont 1,5 à 2 cm de large et 6 à 11 cm de long (Figure 3). Les plantules ont une germination épigée, l’hypocotyle et l’épicotyle sont légèrement couverts de poils, les cotylédons sont épais et aplatis, les deux premières feuilles sont simples, opposées de couleur vert-foncé avec 4 à 8 paires de nervures et le pétiole est duveteux. Le bois est composé de l’aubier et du duramen. L’aubier se distingue du bois par sa couleur blanchâtre d’une épaisseur de 4 à 8 cm. Le duramen, par contre, est constitué de plusieurs fibres de parenchymes cloisonnées et non cloisonnées. La succession de ces fibres de parenchymes donne un aspect rubané au bois (une succession de fils et de contrefils) qui s’observe lors du tranchage ou du sciage du bois.

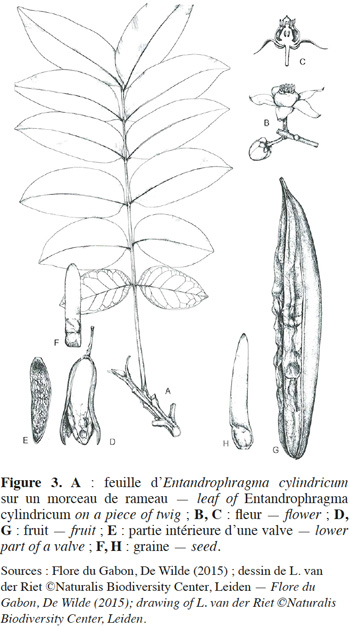
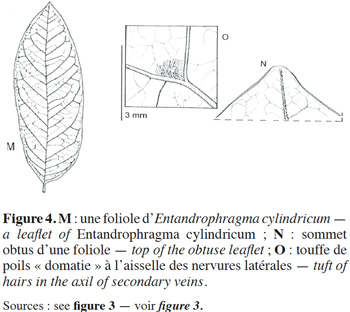
4. Écologie, croissance et régénération d’E. cylindricum
4.1. Exigences abiotiques
12Entandrophragma cylindricum est limité aux basses altitudes (< 1 000 m). Toutefois, aux abords du lac Victoria en Ouganda, on le retrouve à une altitude comprise entre 1 100 m et 1 500 m, en faible effectif et en mélange avec des espèces typiques de la mosaïque régionale (Chrysophyllum spp., Khaya spp., Pouteria spp. par exemple) (Wright, 1996). Entandrophragma cylindricum est particulièrement commun dans les zones où les sols sont bien drainés (Hawthorne, 1995), où la pluviométrie se situe entre 1 600 mm et 2 000 mm par an et où les températures moyennes sont comprises entre 24 à 26 °C (Wright, 1996). Hall et al. (2004) révèlent dans une étude menée au Ghana, qu’E. cylindricum s’établirait préférentiellement sur des sols pauvres en phosphore disponible (P), à pH relativement élevé, avec une faible teneur en Al+++ et relativement riches en bases échangeables (Ca++, Mg++, Mn++).
4.2. Phénologie et dispersion des graines
13Entandrophragma cylindricum est une espèce caducifoliée. La défeuillaison est généralement annuelle et dure de deux à trois semaines (Détienne & Mariaux, 1977). Dans l'hémisphère nord, de la Côte d’Ivoire à la République centrafricaine, l'espèce perd ses feuilles entre octobre et janvier. La floraison a lieu après le renouvellement des feuilles (Aubréville, 1959 ; Palla et al., 2002). La pollinisation est assurée par les insectes ; l’hypothèse a été émise que ce soit le fait de papillons, mais d’une manière générale, très peu d’informations existent sur les agents pollinisateurs des espèces arborescentes en Afrique centrale (Aveling, 2009). La fructification quant à elle a lieu d’aout à octobre (fin de la petite saison sèche) en Côte d’Ivoire et de mai à aout (petite saison sèche) au Cameroun et en République centrafricaine (Palla et al., 2002). C'est aussi à ce moment que se déroulent les proliférations de chenilles défoliatrices. Le rythme de fructification est cependant variable. Il est généralement annuel au niveau d'une population déterminée, toutefois des cas de fructification biannuelle ont été reportés (Hall, 2011). À maturité, le fruit s’ouvre par cinq valves à partir du sommet. Les premières fructifications sont observées chez des individus ayant atteint un diamètre de 25-30 cm (Détienne et al., 1998). Le diamètre de fructification efficace (lorsque 80 % des arbres situés en forêts semi-caducifoliées sont aptes à produire des fruits) serait de 50-60 cm (Durrieu de Madron & Daumerie, 2004). Cependant, des variations peuvent être observées à l’échelle locale en fonction de la position des fruits par rapport au soleil, mais des études pour le démontrer sont nécessaires. Tous ces épisodes phénologiques montrent toutefois un décalage variable dans l'hémisphère sud, compte tenu du phénomène d'inversion climatique (Mure, 1986).
14La dispersion des graines ailées est assurée par le vent jusqu’à 150 m de distance des arbres producteurs (Palla et al., 2002). Toutefois, la plus forte densité de graines se retrouve à une distance moyenne de 20 m du fût (Hall, 2011). On observe en général un taux de germination de l’ordre de 85 % pour des graines issues des fruits matures. Cependant, à cause de la nature oléagineuse des graines ainsi que de l’épaisseur réduite de l’enveloppe recouvrant la graine, celle-ci perd rapidement son pouvoir germinatif, en moyenne au bout de 2 à 3 semaines (De La Mensbruge, 1966 ; Palla et al., 2002). Selon Hall (2008), en forêt centrafricaine semi-caducifoliée, les graines sont régulièrement victimes d'attaques d’insectes (55 %) et de champignons (28 %). Le taux de survie des plantules d’E. cylindricum au bout de six mois dans le sous-bois des forêts africaines est de 12 %, et seulement 1 % des plantules atteindraient le stade gaulis (Dupuy, 1998 ; Palla et al., 2002).
4.3. Tempérament et régénération naturelle
15Il existe très peu d'études abordant de façon précise la variation des besoins en lumière au cours de l'ontogenèse d'E. cylindricum. Pieters (1976), puis Hawthorne (1995), décrivent E. cylindricum comme une espèce qui tolère un faible éclairement dans les premiers stades de son développement et qui, par la suite, a besoin de plus de lumière pour poursuivre sa croissance. Elle est donc classée parmi les « non pioneer light demanding species » (NPLD) (Hawthorne, 1995) ou « semi-héliophiles » (Doucet, 2003). En conséquence, la régénération d'E. cylindricum est généralement médiocre sous un couvert fermé. Selon Hall et al. (2003b), les besoins en lumière des semis des différentes espèces d’Entandrophragma sont relativement proches, l'optimal se situant entre 7 % et 30 % d'éclairement relatif. Agyeman et al. (1999), dans une expérimentation contrôlée intégrant E. utile, ont mis en exergue une croissance relative maximale aux alentours de 30 % d’éclairement pour des plants de 30 cm de haut. Ainsi, afin de favoriser la régénération d'E. cylindricum, Hall et al. (2003a) suggèrent de créer des trouées correspondant à un éclairement intermédiaire (19-39 %), là où des plages de semis sont présentes.
4.4. Croissance
16Des études de croissance par analyse de cernes ont été réalisées sur E. cylindricum par Détienne & Mariaux (1977) en Côte d’Ivoire et au Cameroun. Des faux-cernes peuvent être observés chez cette espèce. Ils ne semblent pas pouvoir être assimilés à un ralentissement de la croissance diamétrique, mais plutôt à des conditions externes propres à chaque individu. L'attaque de chenilles défoliatrices pourrait peut-être l'expliquer, mais des études confirmant cette hypothèse n’ont pas été menées jusqu’à présent. Il ressort des analyses de cernes susmentionnées que la croissance s'arrête pendant la grande saison sèche et reprend avec le retour des pluies entre le mois de février et le mois d’avril au nord de l’équateur. Entandrophragma cylindricum est une espèce à croissance diamétrique relativement lente, son accroissement annuel moyen étant compris entre 3 et 6 mm (Tableau 2). Selon Bedel et al. (1998), l'exploitation forestière et la pratique de l'éclaircie dynamiseraient cette croissance. Dans une expérimentation conduite à M’baïki (République centrafricaine), ces auteurs ont comparé les accroissements observés en parcelle témoin et en parcelles exploitées avec éclaircie et sans éclaircie. Entre la première et la 4e année d’observation, les accroissements diamétriques annuels moyens sont passés de 0,58 cm·an-1 en parcelle témoin à 0,81 cm·an-1 en parcelle exploitée, et 0,82 cm·an-1 en parcelle exploitée avec éclaircies, pour des classes diamétriques de 40 à 80 cm. En outre, la densité des tiges après exploitation est restée relativement faible, soit 4,6 tiges·ha-1 en parcelle exploitée et 4,9 tiges·ha-1 en parcelle exploitée avec éclaircie, comparé à la densité des tiges en parcelle témoin qui était de 6,8 tiges·ha-1 (Bedel et al., 1998). Gourlet-Fleury et al. (2013) ont également démontré au bout de 24 années d’expérimentation dans ce dispositif de M’baïki que l’exploitation avec éclaircie a contribué à booster la croissance des tiges d’avenir avec un gain considérable en biomasse (soit le triple en comparaison avec les parcelles témoins), mais ce traitement n’a presque pas eu d’effet sur la densité des tiges soit 0,81 ± 0,74 m³·ha-1·an-1 pour l’ensemble des espèces.

5. Sylviculture et aménagement forestier d’E. cylindricum
5.1. Sylviculture
17Au 20e siècle, plusieurs techniques sylvicoles ont été testées. L’une d'elles est la « méthode de régénération naturelle par coupe d’ensemencement et d’abri unique » pratiquée en forêt tropicale dense humide d’Afrique, notamment en Côte d’Ivoire, au Cameroun, au Gabon et en République du Congo. Elle consistait en une exploitation des espèces commerciales, suivie d’une éclaircie parmi les espèces secondaires (Dupuy, 1998). Le but visé par l’emploi de cette méthode sylvicole était de booster la régénération des essences commerciales. Cette méthode provoqua néanmoins la prolifération des espèces secondaires et des lianes et fut abandonnée en raison de son cout jugé prohibitif. De même, Bedel et al. (1998), en expérimentant les traitements sylvicoles dans le dispositif de M’baïki, ont observé une augmentation du taux de recrutement (nombre de tiges ayant atteint 10 cm de diamètre) de 0,16 % en parcelles témoins à 2,41 % en parcelles exploitées après huit années d’expérimentation.
18Une autre technique sylvicole appelée « méthode des layons » a été testée et expérimentée en 2003. Elle consistait à introduire dans des layons de 10 m de large, ouverts en forêt, des plants préalablement produits en pépinière (Palla et al., 2002 ; Mountanda et al., 2005). L'ensoleillement s'est toutefois avéré insuffisant pour permettre une bonne croissance des plants. Au bout de huit années d’expérimentation en République du Congo, les individus d’E. cylindricum ne mesuraient en moyenne que 1,03 cm de diamètre et 0,89 m de haut (Mountanda et al., 2005).
19Enfin, Kouadio & Doucet (2009) ont testé une méthode d'enrichissement par semis direct dans des trouées d'abattage. Cette méthode s'est également soldée par un échec car les jeunes pousses d’E. cylindricum étaient surcimées par une concurrence exubérante.
20La sylviculture d'E. cylindricum n'en est donc qu'à des balbutiements car, si la méthode de régénération naturelle par ensemencement s'est avérée être efficace, son cout prohibitif et le contexte socio-économique actuel ne sont guère favorables à son application à large échelle. Aujourd'hui, selon les législations des pays producteurs, la durabilité de l'exploitation de l'espèce repose avant tout sur l'aménagement forestier dit durable.
5.2. Aménagement des populations naturelles
21Prélever des arbres tout en assurant la disponibilité des tiges pour le futur est un des fondements de l’aménagement forestier durable. Le diamètre minimum d’exploitabilité ou DME est perçu comme étant un outil fondamental d’aménagement durable qui tient compte de la structure diamétrique des populations d’arbres et de la nécessité de préserver de l’abattage la fraction de semenciers devant assurer la régénération (Durrieu de Madron et al., 1998). Cette notion avait déjà été évoquée par le passé par Bariteau & Geoffroy (1989), dans le cadre de l’aménagement d’une forêt guyanaise au sein du dispositif de Paracou. Le DME du sapelli est fixé par voie règlementaire ; il est de 60 cm en Côte d’Ivoire, 80 cm au Congo, en RDC et en République centrafricaine, 90 cm au Gabon et au Liberia, 100 cm au Cameroun et 110 cm au Ghana (Palla et al., 2002 ; Kemeuze, 2008). Il peut éventuellement être revu à la hausse par le gestionnaire forestier afin de permettre un taux de reconstitution suffisant (généralement de l'ordre de 50 %) au bout de la première rotation (Durrieu de Madron & Forni, 1997). La figure 5 présente la structure de population (effectif et volume) de E. cylindricum sur une surface d’environ 145 000 ha dans la région du sud-est du Cameroun : la courbe des effectifs est d’abord décroissante puis est suivie d’un pic vers les classes médianes (FRM, 2004b). Une telle structure, s’écartant sensiblement de la courbe de population idéale (une décroissance ininterrompue des plus faibles aux plus grandes classes diamétriques) peut se traduire par un taux de reconstitution faible si le DME est fixé vers ce mode, environ 85 cm en l’occurrence. Dans ce cas particulier, la population n’affiche toutefois pas de déficit de régénération. En ce qui concerne l’évolution des volumes, la figure 5 montre bien que les DME actuels, lorsqu’ils se situent autour des classes médianes, engendreraient un prélèvement en première rotation de la grande majorité du volume disponible. Cette tendance est assez générale. Karsenty & Gourlet-Fleury (2006) ont simulé l'évolution des stocks en effectif et en volume de sapelli sur dix rotations dans les forêts de la République centrafricaine. Leurs résultats démontrent que l'effectif prélevé en premier passage ne peut pas être bien reconstitué au bout d'une rotation de 30 ans et que la réduction de volume sera importante lors de la seconde rotation (période 30-60 ans). Ils suggèrent une limitation des normes relatives au taux de prélèvement ou un allongement de la durée de rotation pour stabiliser l'effectif exploitable.
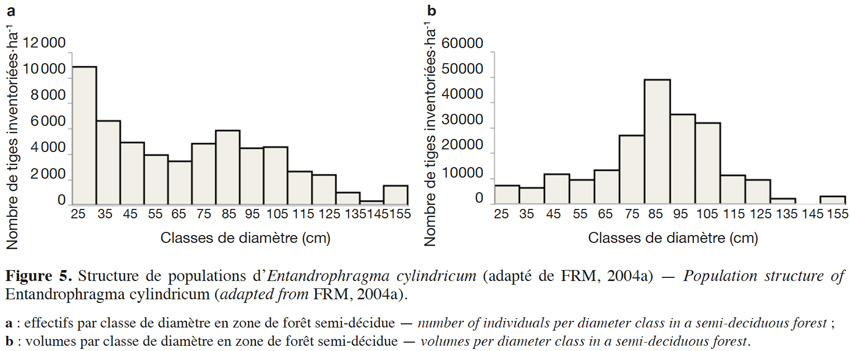
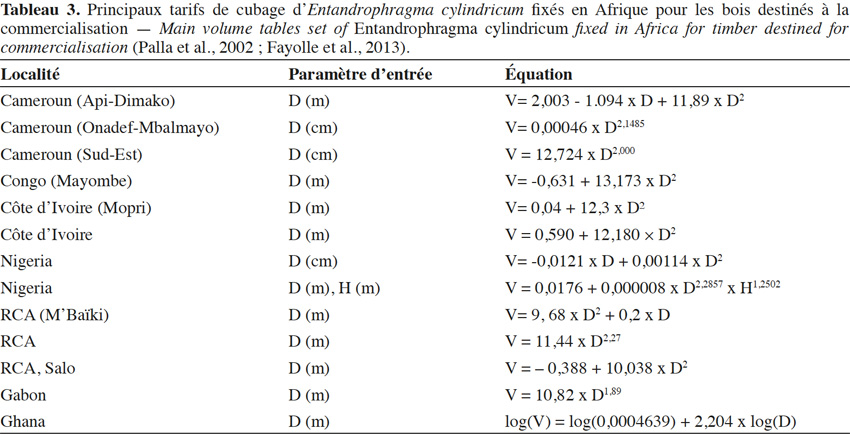
22L’estimation des volumes exploitables repose sur l'utilisation de tarifs de cubages (Lanly, 1965 ; Rondeux, 1973). La diversité des zones géographiques ainsi que leur cadre d’application ont conduit Fayolle et al. (2013) à l’élaboration de douze équations pour E. cylindricum en Afrique (Tableau 3). En outre, les modalités de conception de ces tarifs n’ont pas toujours été bien décrites ; Fayolle et al. (2013), dans une étude dans le sud-est du Cameroun, ont montré que l'équation adoptée par l’administration forestière et contenu dans le logiciel TAIMA (Tchatat et al., 2008) sous-estimait significativement le volume sur écorce de la grume. Pour pallier à ces erreurs, Fayolle et al. (2013) proposent une méthode dont le calcul des volumes se fait sur des billons de 2 m de long chacun. Le diamètre grand bout est pris à 30 cm au-dessus des contreforts et le diamètre petit bout est pris à 30 cm de la première grosse branche. Au final, Fayolle et al. (2013) préconisent d’utiliser l’équation suivante : V(m³) = 12,724 × D(m)2,000 pour les individus de sapelli présents dans les forêts de cette région.
6. Diversité et structure génétique d’E. cylindricum
23Peu d’études ont été réalisées sur la génétique d’E. cylindricum. Les flux de gènes au sein de ses populations ont été examinés par Lourmas et al. (2007) au Cameroun. Un faible taux d’autopollinisation, de l’ordre de 2 %, ainsi qu’une distance moyenne de pollinisation allant de 266 à 385 m ont été mis en évidence. Ces auteurs signalent toutefois que ces chiffres sont probablement sous-évalués. En étudiant l’effet de l’exploitation sélective sur la diversité génétique, les résultats initialement obtenus par Garcia et al. (2004) et plus tard par Lourmas et al. (2007) ont révélé que la diversité génétique était similaire entre sites exploités et non exploités, démontrant que l’exploitation telle qu’elle est pratiquée dans les concessions sous aménagement durable n’avait pas d’impact sur la variabilité génétique, du moins à moyen terme et dans des peuplements ayant une densité moyenne d’un pied par hectare (dhp > 30 cm). En définitive, les peuplements ont un niveau élevé de diversité génétique identique ainsi qu’une faible différenciation génétique ; la diversité génétique se situe plutôt à l’échelle intra population plutôt qu’entre diverses populations (Palla et al., 2002).
7. Origine et légalité de la source d’approvisionnement du bois
24En vue de vérifier l'origine et la légalité des bois exploités, une étude pilote a été réalisée par Jolivet & Degen (2012). En utilisant des marqueurs « microsatellites », ces auteurs sont parvenus à retracer l’origine géographique de certains échantillons d’E. cylindricum, mais les résultats restent encore incomplets et ne sauraient véritablement retracer la provenance exacte de tout échantillon d’E. cylindricum telle que définie par le concept de traçabilité des bois (FAO, 2014b). Afin d’améliorer la résolution spatiale de la détection de l’origine des échantillons, cette même équipe a initié un programme de grande ampleur utilisant des marqueurs SNP (Single Nucleotide Polymorphism) qui offrent globalement davantage de variabilité (DoubleHelix Tracking Technologies, 2012). Les résultats sont attendus et devraient offrir une alternative aux voies classiques de traçabilité basée sur des vérifications documentaires jugées peu fiables (Cerutti et al., 2013).
8. Caractéristiques du bois, commerce et usages d’E. cylindricum
8.1. Caractéristiques du bois
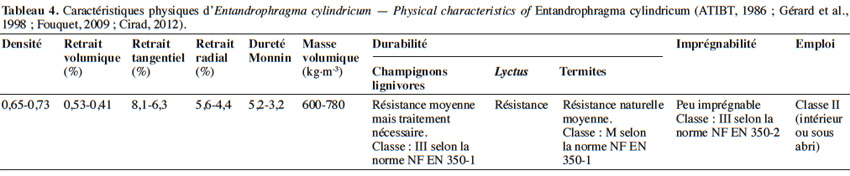
25Le bois d’E. cylindricum présente de bonnes qualités mécaniques. C’est un bois léger à mi-lourd, mi-dur, flottable et de masse volumique (à 12 % d’humidité) d’environ 680 kg·m-3 (Fouquet, 2009 ; ATIBT, 2014). Le bois sèche assez lentement, autant à l’air libre qu’en conditions artificielles. Son grain est fin et présente un contrefil en bande étroite donnant un aspect rubané (Gérard et al., 1998). En général, c’est un bois naturellement résistant aux attaques de champignons lignivores (tant qu’il n’est pas exposé longtemps à de fortes humidités), résistant aussi aux attaques de lyctus et de termites. Ces qualités sont toutefois attribuées au duramen et non à l’aubier qui se distingue par sa couleur plus claire. La présence de fibres de parenchyme tendres dans l’aubier le rend vulnérable à l’attaque des parasites (Gérard et al., 1998). La classe d'emploi est de type II, c'est-à-dire que le bois est destiné à un usage intérieur, à abri de l’humidité, mais supportant des réhumidifications occasionnelles et non persistantes (Fouquet, 2009 ; ATIBT, 2014). Le grain d’orge et la roulure sont les défauts majeurs du bois (Palla et al., 2002). Le tableau 4 synthétise les principales propriétés du bois.
26Les grumes sont sciées, tranchées ou déroulées. Le bois est de très bonne qualité pour l’ameublement, et notamment pour la fabrication de parquets, contreplaqués et lambris, mais aussi pour les constructions navales. Lors de la transformation du bois, le sciage et le clouage se font assez bien, malgré la présence du contrefil qui rend l’usinage assez difficile (ATIBT, 1986 ; Palla et al., 2002 ; Kemeuze, 2008).
8.2. Bois d’œuvre à forte valeur économique
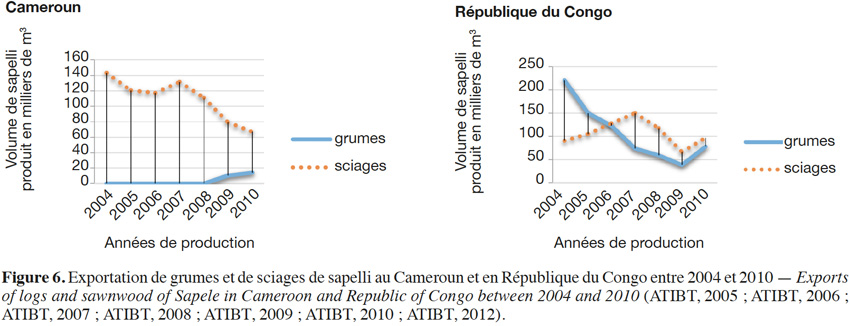
27Entandrophragma cylindricum fait partie des essences les plus exploitées en Afrique centrale avec l’ayous (Triplochiton scleroxylon) et l’okoumé (Aucoumea klaineana). Au fil des années, les exportations de sapelli ont été délocalisées de l’Afrique de l’Ouest, dans les années 1960, vers l’Afrique centrale, région qui de nos jours constitue le principal pôle de production. En effet, dans les années 1960, le Ghana et la Côte d’Ivoire étaient les principaux pays exportateurs de sapelli avec des moyennes de plus de 100 000 m³ de grumes exploitées par an, principalement issus de la Côte d’Ivoire, volume équivalent à toutes les exportations des pays d’Afrique centrale réunis (Cameroun, République centrafricaine et la République du Congo). Par contre, depuis le début des années 2000, la tendance s’est inversée avec des exportations de sapelli d’Afrique centrale égales au quadruple de celles d’Afrique de l’Ouest (Kemeuze, 2008). De nos jours, le Cameroun et le Congo sont les principaux exportateurs de cette essence (Figure 6). De cette figure, nous constatons que dès 2008, il y a eu une chute considérable des exportations imputable à la crise économique mondiale.
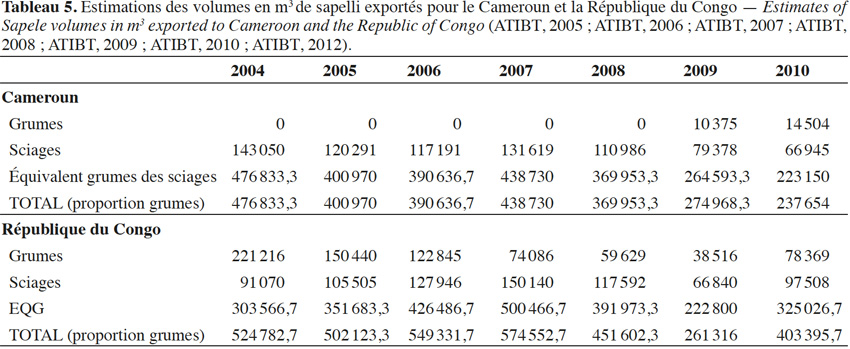
28Une estimation de l’importance de l’exploitation du sapelli au Cameroun et en République du Congo présentée dans le tableau 5 montre en équivalent grume (EQG) les volumes de sapelli abattus entre 2004 et 2010.
29La production totale des grumes de sapelli exportées depuis le Cameroun et la République du Congo selon les statistiques officielles de ces deux pays au cours de l’année 2012 a été estimée à environ 800 000 m³ (avec un taux de rendement de la transformation des grumes égal à 30 %) (De Wasseige et al., 2014). Ce chiffre représente une estimation basse par rapport à la production totale si on tient compte de la production du secteur informel qui pourrait contribuer à une part équivalente (Cerutti & Lescuyer, 2011). En février 2015, la valeur « Free On Board » (FOB), utilisée comme base pour le calcul des taxes volumétriques auxquelles sont assujetties les sociétés forestières, était de 620 €·m-3 pour les sciages et de 360 €·m-3 pour les grumes (ITTO, 2015).
8.3. Autres usages
30Les autres usages reconnus pour le sapelli sont liés aux propriétés chimiques de son écorce. Il a notamment été rapporté que des potions à base d’infusion de l’écorce étaient utilisées par les peuples forestiers d’Afrique centrale pour le traitement des affections pulmonaires et pour faciliter l’accouchement difficile chez les femmes (Palla et al., 2002 ; Kemeuze, 2008). Ces propriétés seraient liées à la présence de terpènes dont six molécules ont déjà été isolées (3-hydroxy-copa-2-en, 2α-hydroxy-copa-3-en, 10-hydroxy-trans-calamenene, T-cadinol, ledol et mustacon). Ces molécules jouent aussi un rôle dans la défense de l’arbre contre les attaques des insectes xylophages tels que Trogoderma granarium, Tribolium confusum et Sitophilus granarius (Daniewski et al., 1996). Par ailleurs, l’acide cis-vaccénique, un acide gras majeur contenu dans les graines de sapelli, pourrait être utilisé pour la fabrication d’une forme industrielle de plastique (Kemeuze, 2008).
9. Entomofaune sur E. cylindricum
31Tout comme les autres espèces appartenant à la famille des Meliaceae, le sapelli subit des attaques d’insectes appartenant au genre Hypsipyla, lépidoptère de la famille des Pyralidae. Les deux espèces bien connues comme étant des ravageurs chez les espèces de la sous-famille des Swietenioideae sont Hypsipyla grandella (Zeller), notamment chez Swietenia macrophylla (King) et Cedrela odorata L. en Amérique et Hypsipyla robusta (Moore) chez Chukrasia tabularis A. Juss. et Toona ciliata M. Roem. en Asie/Australie (Grijpma & Gara, 1970 ; Cunningham et al., 2005). Les études sur l’espèce H. robusta ont été approfondies en Afrique sur les autres espèces du genre Entandrophragma, notamment E. angolense et E. utile, ainsi que sur celles du genre Khaya, notamment Khaya ivorensis et Khaya anthotheca (Opuni-Frimpong et al., 2008a). Hypsipyla robusta est un foreur de jeunes pousses dont les attaques sur les plants de 4 à 5 ans exposés en plein soleil auraient des répercussions négatives sur la croissance et la conformation de l’arbre ; on note une perte de croissance en hauteur dans 50 % des cas. Au-delà de 19 ans, les attaques de l’insecte ont des effets nettement atténués (Brunck & Mallet, 1993). Il a été démontré l’existence de composés organiques volatils émis par les plantes hôtes et à l’origine de l’attraction de l’espèce H. robusta (Abraham et al., 2014). Cet insecte semble même être un obstacle au succès des plantations monospécifiques (Opuni-Frimpong et al., 2008b). D’autres papillons de la famille des Pyralidae attaquent aussi d’autres parties de l’arbre, notamment les espèces Catopyla dysorphaena et Mussidia nigrivenella, dont les larves se nourrissent des graines (Palla et al., 2002).
32Le sapelli est aussi l’arbre hôte d’Imbrasia oyemensis, un papillon appartenant à la famille des Saturniidae qui présente comme particularité d’être comestible à l’état de chenille et qui consomme spécifiquement ses feuilles (Palla et al., 2002 ; Balinga et al., 2004 ; Van Huis, 2013). Cette chenille est consommée dans la zone d’occurrence du sapelli et est fortement appréciée par les populations locales qui s’en nourrissent pendant la période de prolifération, en remplacement de la viande et du poisson (Akpossan et al., 2009). Vers la fin des année 1990, un commerce international des chenilles séchées avait été identifié et provenait d’une manière générale d’Afrique centrale (Tabuna, 1999). Selon N’Gasse (2003), un revendeur de chenilles obtient comme bénéfice à la fin de la saison des chenilles environ 400 €, mais des statistiques plus récentes sont nécessaires pour estimer les quantités de chenilles d’Imbrasia dans ce commerce. Pour 100 g de matière sèche, cette chenille serait composée d’environ 55 g de protéines, aurait 477 kcal comme valeur énergétique et contiendrait un peu plus de 150 mg de sels minéraux, en majorité de potassium, calcium et phosphore (Foua Bi et al., 2015). Une telle valeur nutritive pourrait conduire à diverses mesures de conservation, voire de protection, du sapelli afin de répondre aux besoins alimentaires des populations qui consomment ces chenilles (Vantomme & Gazza, 2010). L’intérêt que revêt le sapelli pour l’industrie forestière et les populations locales pourrait en faire une ressource « concurrentielle » (Vermeulen et al., 2009).
33La même chenille se retrouverait aussi sur d’autres espèces du genre Entandrophragma, mais des études complémentaires sont nécessaires pour le confirmer (Balinga et al., 2004 ; Lisingo et al., 2010). En outre, le cycle de vie ainsi que l’écologie de ce papillon demeurent inconnus. En définitive, aucune étude à ce jour n’a jamais été réalisée permettant de comprendre l’interaction biologique entre la chenille comestible d’Imbrasia oyemensis et le sapelli, pas plus que la compréhension des choix préférentiels des sites de ponte par les papillons pour certains sapelli par rapport à d’autres.
10. Conclusions et perspectives de recherche
34L’état des lieux des connaissances existantes sur l’espèce Entandrophragma cylindricum, dénommé « sapelli », arbre des forêts denses humides semi-caducifoliées d’Afrique centrale révèle que peu d’études ont été menées sur l’écologie de sa reproduction et cela, malgré son importance économique. Celle-ci nécessite de lui accorder une attention particulière, notamment sur les mesures à prendre pour assurer sa pérennisation dans les massifs forestiers africains. La sylviculture de l'espèce mérite notamment d'être repensée en intégrant le contexte socio-économique actuel. En outre, la présence saisonnière des chenilles de l’espèce Imbrasia oyemensis sur E. cylindricum, consommées comme PFNL, justifie une attention accrue et une prise en compte systématique dans l’élaboration des plans d’aménagement des forêts de production. Afin de répondre aux exigences de gestion durable, des stratégies de gestion concertées de ces deux ressources doivent être proposées sur la base de résultats fiables. Les filières de commercialisation des chenilles étant mal connues, des données sur les quantités produites, consommées, vendues localement et à l’étranger sont nécessaires pour élaborer des mesures de gestion participative de ces ressources. Cette synthèse bibliographique ouvre ainsi de nouvelles voies de recherche relatives à la relation entre le sapelli et sa chenille, et des interactions pouvant exister sur leur biologie respective.
35Des investigations nouvelles sont nécessaires pour :
36– quantifier l’abondance des chenilles par pied de sapelli ; dresser le cycle biologique de la chenille Imbrasia oyemensis ainsi que comprendre le choix spécifique de certains pieds de sapelli par ce papillon afin d’envisager des protocoles d’élevage sur la base des résultats obtenus ;
37– évaluer l’impact que ces chenilles pourraient avoir sur la dynamique du sapelli et compléter les données écologiques relatives à la dynamique des populations d’E. cylindricum en relation avec sa chenille ;
38– mesurer l’importance sur le plan socio-économique des chenilles en tant que PFNL pour les populations locales, par exemple par l’identification des filières de commercialisation ainsi que leur contribution dans les revenus de tous les acteurs de la filière ;
39– quantifier l’impact de l’exploitation du sapelli sur la disponibilité en chenilles.
40La prise en compte simultanée de ces quatre dimensions de la recherche devrait permettre de proposer des modalités de gestion des populations de sapelli qui tiennent compte des différents usages et de son intérêt écologique.
41Remerciements
42Nos remerciements vont à l’endroit du Programme EURAXESS pour la bourse de mobilité accordée au cours du séjour de recherche effectué à l’Université de Liège, à l’ASBL Nature+ pour l’assistance scientifique et technique et à la société SFID Mbang, compagnie forestière partenaire pour la réalisation des travaux de terrain. Une profonde gratitude aux professeurs Philippe Lejeune et Bonaventure Sonké, à Charles Bracke, Jean-Yves de Vleeschouwer et à Adeline Fayolle, pour leurs conseils. De sincères remerciements à Richard Feteke, Félicien Tosso et Armel Loïc Donkpegan pour leurs diverses contributions à l’élaboration de cet article.
Bibliographie
Abraham J. et al., 2014. Olfactory cues of mahogany trees to female Hypsipyla robusta. Bull. Insectology, 67, 21-30.
AgyemanV ., Swaine M. & Thompson J., 1999. Responses of tropical forest tree seedlings to irradiance and the derivation of a light response index. J. Ecol., 87, 815-827.
Akpossan R.A., Dué E.A., Kouadio J.P.E.N. & Kouamé L.P., 2009. Valeur nutritionnelle et caractérisation physicochimique de la matière grasse de la chenille (Imbrasia oyemensis) séchée et vendue au marché d’Adjamé (Abidjan, Côte d’Ivoire). J. An. Plant Sci., 3, 243-250.
Anonyme, 1974. Sapelli. Bois For. Trop., 154, 27-40.
ATIBT (Association Technique Internationale des Bois Tropicaux), 1986. Atlas des bois tropicaux – Afrique. Paris : ATIBT.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2005. La lettre de l’ATIBT n°22 : statistiques 2004. Paris : ATIBT.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2006. La lettre de l’ATIBT n°24 : statistiques 2005. Paris : ATIBT.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2007. La lettre de l’ATIBT n°26 : statistiques 2006. Paris : ATIBT.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2008. La lettre de l’ATIBT n°28 : statistiques 2007. Paris : ATIBT.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2009. La lettre de l’ATIBT n°30 : statistiques 2008. Paris : ATIBT.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2010. La lettre de l’ATIBT n°32 : statistiques 2009. Paris : ATIBT.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2012. La lettre de l’ATIBT n°34 : statistiques 2010. Paris : ATIBT.
ATIBT (Association Technique Internationale des Bois Tropicaux), 2014. Les connaissances clés sur le bois tropical à portée de main - La durabilité du bois. Paris : ATIBT.
Aubréville A., 1959. La flore forestière de la Côte d'Ivoire. 2e éd. révisée. Nogent-sur-Marne, France : Centre Technique Forestier Tropical.
Aveling C., 2009. La contribution de la biodiversité dans le maintien des produits et services forestiers. In : De Wasseige C. et al. Les forêts du bassin du Congo. État des forêts 2008. Luxembourg : Office des Publications de l’Union européenne, 163-178.
Balinga M.P., Mapunzu P.M., Moussa J.-B. & N'gasse G., 2004. Contribution des insectes de la forêt à la sécurité alimentaire. L’exemple des chenilles d’Afrique centrale. Rome : FAO.
Bariteau M. & Geoffroy J., 1989. Sylviculture et régénération naturelle en forêt guyanaise. Rev. For. Fr., 41, 309-323.
Bayol N. et al., 2012. La gestion des forêts et la filière bois en Afrique centrale. In : De Wasseige C. et al. Les forêts du bassin du Congo. État des forêts 2010. Luxembourg : Office des Publications de l’Union européenne, 43-62.
Bedel F. et al., 1998. Dynamique de croissance dans des peuplements exploités et éclaircis de forêt dense africaine : le dispositif de M'Baïki en République Centrafricaine (1982-1995). Montpellier, France : CIRAD-forêt.
Brunck F. & Mallet B., 1993. Les problèmes phytosanitaires de l'acajou en Côte d'Ivoire. Bois For. Trop., 237, 9-29.
Cerutti P.O. & Lescuyer G., 2011. Le marché domestique du sciage artisanal au Cameroun. État des lieux, opportunités et défis. Bogor, Indonésie : CIFOR.
Cerutti P.O., Tacconi L., Lescuyer G. & Nasi R., 2013. Cameroon's hidden harvest: commercial chainsaw logging, corruption, and livelihoods. Soc. Nat. Resour., 26, 539-553.
Chevalier A., 1909. Les végétaux utiles de l'Afrique tropicale française : études scientifiques et agronomiques. Première étude sur les bois de la Côte d'Ivoire. Paris : A. Challamel.
Chupezi Tieguhong J. & Ndoye O., 2007. L'impact de l'exploitation du bois des concessions forestières sur la disponibilité des produits forestiers non ligneux dans le Bassin du Congo. Étude pilote sur les techniques d'exploitation forestière. Rome : FAO.
CIRAD, 2012. Sapelli. Montpellier, France : CIRAD.
Cunningham S.A., Floyd R.B., Griffiths M. & Wylie F.R., 2005. Patterns of host use by the shoot-borer Hypsipyla robusta (Pyralidae: Lepidoptera) comparing five Meliaceae tree species in Asia and Australia. For. Ecol. Manage., 205, 351-357.
Daniewski W.M. et al., 1996. Sesquiterpenoid constituents of Entandrophragma cylindricum. Phytochemistry, 43, 811-814.
De la Mensbruge G., 1966. La germination et les plantules des essences arborées de la forêt dense humide de la Côte d'Ivoire. Nogent-sur-Marne, France : Centre Technique Forestier Tropical.
De Wasseige C. et al., 2012. Les forêts du Bassin du Congo. État des forêts 2010. Luxembourg : Office des Publications de l’Union européenne.
De Wasseige C. et al., 2014. Les forêts du Bassin du Congo. État des forêts 2013. Neufchâteau, Belgique : Weyrich.
De Wasseige C., Aba’a atyi R. & Doumenge C., 2015. Les forêts du Bassin du Congo. Forêts et changements climatiques. Neufchâteau, Belgique : Weyrich.
De Wilde J.F.E., 2015. Meliaceae. In: Sosef M.S.M. et al., eds. Flore du Gabon. Margraf Publishers.
Détienne P. & Mariaux A., 1977. Nature et périodicité des cernes dans les bois rouges de méliacées africaines. Bois For. Trop., 175, 52-61.
Détienne P. et al., 1998. L'analyse de cernes : applications aux études de croissance de quelques essences en peuplements naturels de forêt dense africaine. Montpellier, France : CIRAD-Forêt.
Double helix tracking technologies, 2012. Double helix tracking, http://www.doublehelixtracking.com/, (10 janvier 2015).
Doucet J.-L., 2003. L'alliance délicate de la gestion forestière et de la biodiversité dans les forêts du centre du Gabon. Thèse de doctorat : Faculté des Sciences agronomiques de Gembloux (Belgique).
Dupuy B., 1998. Bases pour une sylviculture en forêt dense tropicale humide africaine. Montpellier, France : CIRAD.
Durrieu de Madron L. & Forni E., 1997. Aménagement forestier dans l'Est du Cameroun : structure du peuplement et périodicité d'exploitation. Bois For. Trop., 254, 39-50.
Durrieu de Madron L. et al., 1998. Croissance et productivité en forêt dense humide : bilan des expérimentations dans le dispositif de Mopri-Côte d'Ivoire (1978-1992). Montpellier, France : CIRAD-Forêt.
Durrieu de Madron L. & Daumerie A., 2004. Diamètre de fructification de quelques essences en forêt naturelle centrafricaine. Bois For. Trop., 281, 87-95.
FAO, 1999. Vers une définition harmonisée des produits forestiers non ligneux. Unasylva, 50, 63-64.
FAO, 2014a. Situation des forêts du monde - Mieux tirer parti des avantages socioéconomiques des forêts. Rome : FAO.
FAO, 2014b. Le processus Accord de partenariat volontaire (APV) dans les pays d’Afrique centrale et de l’Ouest : de la théorie à la pratique. Rome : FAO.
FAO, 2016. Situation des forêts du monde 2016. Forêts et agriculture : défis et possibilités concernant l’utilisation des terres. Rome : FAO.
Fayolle A. et al., 2013. Réviser les tarifs de cubage pour mieux gérer les forêts du Cameroun. Bois For. Trop., 317, 35-49.
Foua Bi F. et al., 2015. Étude de la qualité biochimique et nutritionnelle de la poudre séchée d’Embrasai oyemensis, chenilles consommées au Centre-Ouest de la Côte d’Ivoire. J. Appl. Biosci., 96, 9039-9048.
Fouquet D., 2009. Durabilité naturelle et préservation des bois tropicaux. Versailles, France : Éditions Quæ.
FRM (Forest Ressources Management), 2004a. Plan d'aménagement de l'unité forestière d'aménagement 10-038 - SFID. Montpellier, France :FRM.
FRM (Forest Ressources Management), 2004b. Plan d'aménagement de l'unité forestière d'aménagement 10-038 – SFID. Montpellier, France : FRM.
Garcia F., Noyer J.-L., Risterucci A.-M. & Chevallier M.-H., 2004. Genotyping of mature trees of Entandrophragma cylindricum with microsatellites. J. Heredity, 95, 454-457.
Gérard J. et al., 1998. Synthèse sur les caractéristiques technologiques de référence des principaux bois commerciaux africains. Montpellier, France : CIRAD-Forêt.
Gourlet-Fleury S. et al., 2013. Tropical forest recovery from logging: a 24 year silvicultural experiment from Central Africa. Philos. Trans. R. Soc. London, Ser. B, 368, 20120302.
Grijpma P. & Gara R., 1970. Studies of the shootborer Hypsipyla grandella (Zeller). II. Host preference of the larva. Turrialba, 20, 241-247.
Hall J.S., 2008. Seed and seedling survival of African mahogany (Entandrophragma spp.) in the Central African Republic: implications for forest management. For. Ecol. Manage., 255, 292-299.
Hall J.S., 2011. Natural forest silviculture for Central African Meliaceae. In: Günter S., Weber M., Stimm B. & Mosandl R., eds. Silviculture in the Tropics. Berlin: Springer.
Hall J.S., Ashton P.M.S. & Berlyn G.P., 2003a. Seedling performance of four sympatric Entandrophragma species (Meliaceae) under simulated fertility and moisture regimes of a Central African rain forest. J. Trop. Ecol., 19, 55-66.
Hall J.S., Medjibe V., Berlyn G.P. & Ashton P.M.S., 2003b. Seedling growth of three co-occurring Entandrophragma species (Meliaceae) under simulated light environments: implications for forest management in central Africa. For. Ecol. Manage., 179, 135-144.
Hall J.S., Mckenna J.J., Ashton P.M.S. & Gregoire T.G., 2004. Habitat characterizations underestimate the role of edaphic factors controlling the distribution of Entandrophragma. Ecology, 85, 2171-2183.
Hawthorne W., 1995. Ecological profiles of Ghanaian forest trees. Tropical forestry papers, 29. Oxford, UK: Oxford Forestry Institute.
InsideWood, 2004. InsideWood library, http://insidewood.lib.ncsu.edu/search, (16 septembre 2016).
ITTO (International Tropical Timber Organization), 2015. Tropical timber market report, 1st-15th March 2015. Trop. Timber Market Rep., 19(5).
Jolivet C. & Degen B., 2012. Use of DNA fingerprints to control the origin of sapelli timber (Entandrophragma cylindricum) at the forest concession level in Cameroon. Forensic Sci. Int. Genet., 6, 487-493.
Karsenty A. & Gourlet-Fleury S., 2006. Assessing sustainability of logging practices in the Congo Basin’s managed forests: the issue of commercial species recovery. Ecol. Soc., 11, 26.
Kemeuze V.A., 2008. Entandrophragma cylindricum (Sprague) Sprague. In: Louppe D., Oteng-Amoaka A.A. & Brink M., eds. Prota 7(1): Timbers/Bois d’œuvre 1, http://database.prota.org/PROTAhtml/Entandrophragma%20cylindricum_Fr.htm, (31 janvier 2017).
Kouadio Y.L. & Doucet J.-L., 2009. Étude du comportement de Baillonella toxisperma Pierre (moabi) dans les trouées d'abattage enrichies. Biotechnol. Agron. Soc. Environ., 13, 317.
Lanly J., 1965. Les tarifs de cubage. Bois For. Trop., 100, 19-35.
Lemmens R.H.M.J., 2008. Entandrophragma excelsum (Dawe & Sprague) Sprague. In : Louppe D., Oteng-Amoako A.A. & Brink M., eds. Fiche de PROTA4U, http://www.prota4u.org/search/asp, (31 janvier 2017).
Liben L. & Dechamps R., 1966. Entandrophragma congoense (De Wild.) A. Chev. espèce méconnue du Congo. Bull. Jardin Bot. État Bruxelles, 36, 415-424.
Lisingo J., Wetsi J.-L. & Ntahobavuka H., 2010. Enquête sur les chenilles comestibles et les divers usages de leurs plantes hôtes dans les districts de Kisangani et de la Tshopo (R.D. Congo). Géol. Géogr. Écol. Trop., 34, 139-146.
Lourmas M. et al., 2007. Reduced density due to logging and its consequences on mating system and pollen flow in the African mahogany Entandrophragma cylindricum. Heredity, 99, 151-160.
Lusakibanza Manzo M., 2012. Étude phytochimique et pharmacologique des plantes antipaludiques utilisées en médecine traditionnelle congolaise. Thèse de doctorat : Université de Kinshasa (RDC) et Université de Liège (Belgique).
Malaisse F., 1993. The ecology of Zambezian dry evergreen forest with recommendations for conservation management. In: Lieth N.H. & Lohmann M., eds. Restoration of tropical forest ecosystems. Dordrecht, The Netherlands: Kluwer Academic Publishers.
Meunier Q., Moumbogou C. & Doucet J.-L., 2015. Les arbres utiles du Gabon. Gembloux, Belgique : Les Presses agronomiques de Gembloux.
Mountanda A., Ombi A., Taty P. & Kaya J.-A. P., 2005. Les unités pilotes d’aménagement, de reboisement et d’agroforesterie : nouvelle approche de gestion durable des forêts congolaises. Bois For. Trop., 285, 25-34.
Mujuni D.B., 2008. Entandrophragma utile (Dawe & Sprague) Sprague. In : Louppe D., Oteng-Amoako A.A. & Brink M., eds. Prota 7(1): Timbers/Bois d’œuvre 1, http://database.prota.org/PROTAhtml/Entandrophragma%20utile_Fr.htm, (31 janvier 2017).
Mure V., 1986. Comportement phénologique d'arbres plantés hors de leurs aires d'origine, et notamment de ceux changés d'hémisphère. Rev. Écol. La Terre et la Vie, 41(2-3), 129-171.
N’Gasse G., 2003. Contribution des chenilles/larves comestibles à la réduction de l’insécurité alimentaire en République Centrafricaine (RCA). Rapport de Consultation. Rome : FAO.
Nyunaï N., 2008. Entandrophragma candollei Harms. In : Louppe D., Oteng-Amoako A.A. & Brink M., eds. Fiche de PROTA4U, http://www.prota4u.org/search/asp, (31 janvier 2017).
Opuni-Frimpong E. et al., 2008a. Relative susceptibility of four species of African mahogany to the shoot borer Hypsipyla robusta (Lepidoptera: Pyralidae) in the moist semideciduous forest of Ghana. For. Ecol. Manage., 255, 313-319.
Opuni-Frimpong E., Karnosky D., Storer A. & Cobbinah J., 2008b. Silvicultural systems for plantation mahogany in Africa: influences of canopy shade on tree growth and pest damage. For. Ecol. Manage, 255, 328-333.
Palla F., Louppe D. & Forni E., 2002. Sapelli. Fiche technique, écologique et sylvicole. Montpellier, France : CIRAD-Forêt.
Pellegrin F., 1929. De quatre acajous de la Côte d'Ivoire. Bull. Soc. Bot. Fr., 76, 731-737.
Pieters A., 1976. Étude de l’influence du milieu sur la germination et la croissance dans le jeune âge d’Entandrophragma cylindricum Sprague. In : International Union of Forestry Research Organizations, éds. Actes du 16e Congrès mondial norvégien du Comité IUFRO, 20 juin-2 juillet 1976, Oslo, Norvège, 551-566.
Rondeux J., 1973. Principes de construction des tarifs de cubage mathématiques et de traitement automatique d'observations dendrométriques. Bull. Soc. R. For. Belg. = Tijdschr. K. Belg. Bosbouwmaatschappij, 80, 165-187.
Sprague T., 1910. Entandrophragma, Leioptyx and Pseudocedrela. Bull. Miscellaneous Inf. Kew, 177-182.
Staner P., 1941. Les Méliacées du Congo Belge. Bull. Jardin Bot. État Bruxelles, 16, 109-251.
Tabuna H., 1999. Le marché des produits forestiers non ligneux de l’Afrique centrale en France et en Belgique. Bogor, Indonésie : CIFOR.
Tailfer Y., 1989. La forêt dense d'Afrique centrale : identification pratique des principaux arbres. Paris : Agence de Coopération Culturelle et Technique (ACCT) ; Wageningen, Pays-Bas : CTA.
Tchatat M., Ndoumbe Nkeng M., Abena J.C. & Foahom B., 2008. Volumes de bois autorisés à l’exploitation au Cameroun : détermination des valeurs maximales de dépassement tolérable. Bois For. Trop., 295, 35-46.
Tchinda A.T., 2008. Entandrophragma angolense (Welw.) C.DC. In : Louppe D., Oteng-Amoako A.A. & Brink M., eds. Fiche de PROTA4U, http://www.prota4u.org/search.asp, (31 janvier 2017).
The Plant List, 2015. Meliaceae – Entandrophragma, http://www.theplantlist.org/1.1/browse/A/Meliaceae/Entandrophragma/, (13 novembre 2015).
Van Huis A., 2013. Potential of insects as food and feed in assuring food security. Annu. Rev. Entomol., 58, 563-583.
Vantomme P. & Gazza S., 2010. Le défi de la sylviculture en faveur des produits forestiers non ligneux sous les tropiques : de la cueillette à l’agriculture. Bois For. Trop., 304, 5-13.
Vermeulen C. et al., 2009. Enjeux méthodologiques autour des produits forestiers non ligneux dans le cadre de la certification en Afrique centrale. Bois For. Trop., 300, 69-78.
Vivien J. & Faure J.J., 1985. Arbres des forêts d'Afrique Centrale. Paris : Agence de coopération culturelle et technique (ACCT).
Wilks C. & Issembé Y., 2000. Guide pratique d’identification : les arbres de la Guinée équatoriale. Région continentale. Bata, Guinée équatoriale : Projet CUREF.
Wright S.J., 1996. Phenological responses to seasonality in tropical forest plants. Tropical forest plant ecophysiology. Springer.
Yapp G., Walker J. & Thackway R., 2010. Linking vegetation type and condition to ecosystem goods and services. Ecol. Complexity, 7, 292-301.






