- Accueil
- volume 10 (2006)
- numéro 1
- Expression de différents écotypes de gombo (Abelmoschus esculentus L.) au déficit hydrique intervenant pendant la boutonnisation et la floraison.
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Expression de différents écotypes de gombo (Abelmoschus esculentus L.) au déficit hydrique intervenant pendant la boutonnisation et la floraison.

Notes de la rédaction
Reçu le 25 juin 2005, accepté le 27 octobre 2005
Résumé
Nonobstant ses multiples utilisations et son apport nutritionnel avéré, le gombo est cultivé sur de très petites surfaces, aux abords des cases et souvent dans les dépotoirs. à ce peu d’intérêt s’ajoutent la sécheresse et les maladies qui provoquent une réduction importante de sa production, l’amenant ainsi à jouer les derniers rôles dans les programmes de recherches agricoles du pays et ce malgré l’existence d’écotypes à cycle court ou résistants à certaines contraintes abiotiques. Le faible taux d’existence des variétés améliorées milite en faveur d’une stratégie de sélection participative qui prend en compte les critères de sélection des paysans, intégrant la tolérance ou la résistance du génotype aux conditions drastiques du milieu telles le déficit hydrique aux périodes critiques de la réalisation de son potentiel génétique. Six écotypes obtenus par une sélection variétale participative dans cinq directions régionales agricoles (DRA) du Burkina Faso ont fait l’objet d’une évaluation à la tolérance au déficit hydrique survenant lors de la boutonnisation et de la floraison. Les résultats obtenus montrent que l’effet du stress hydrique en phase de boutonnisation est très néfaste pour le gombo. Il se manifeste par une baisse des composantes du rendement que sont la longueur, le diamètre, le nombre et le poids des fruits. Deux types de période de floraison chez le gombo ont été constatés : celui qui intervient pendant la phase de croissance accélérée de la tige principale (type 1) et celui qui s’installe une fois que commence l’amorce du ralentissement de la croissance de la tige principale (type 2) ; ce dernier type est le plus fréquemment rencontré. Le stress hydrique en phase de boutonnisation conduit à une précocité de floraison chez les plantes de type 2 et à un retard de floraison pour le type 1. Les variables qui discriminent le mieux les écotypes de gombo sous stress hydrique sont la teneur relative en eau (RWC), la longueur et le nombre de fruits. Trois écotypes (V1, V3 et V4) sont retenus pour être inclus dans un programme d’amélioration variétale du gombo à la résistance au déficit hydrique.
Abstract
Behaviour of different ecotypes of okra (Abelmoschus esculentus L.) under water deficit during budding and flowering phases. Despite numerous uses and its well known nutritional value, okra is cultivated on very small surfaces, on surroundings of traditional houses and often in dumping ground. To this little interest are added drought, diseases and pests that generate an important reduction of yield, leading okra to play the last roles in agricultural research programs of the country and this, despite the existence of early maturing ecotypes or resistant to some abiotic constraints. The low rate of improved varieties is the proof that it is necessary to develop strategies for participatory breeding programs that take into account farmers selection criteria including genotypes tolerant or resistant to drastic conditions such as water deficit to periods where the plant is expressing its genetic potential. Six ecotypes obtained through participatory plant breeding process in five agricultural districts of the country have been assessed for the tolerance to the drought occurring during the budding and the flowering phases. Results show that water deficit during budding phase has disastrous consequences for okra plants. The yield declines, and also the length, the number and the weight of fruits. Two types of period of flowering phases of okra plant have been observed: the period which intervenes during the accelerated growth phase of the main stem (type 1) and the one which starts once the growth of main stem begins to decline (type 2); this last type is the most frequently met. Water deficit during the phase of budding causes earlier flowering of type 2 plants and leads to delayed flowering of the type 1 plants. The best variables for discriminating okra ecotypes during water deficit are the relative water content (RWC), the length and the number of fruits. Three ecotypes (V1, V3 and V4) are chosen to be used in breeding program of okra for resistance to water deficit.
Table des matières
1. Introduction
1Le gombo fait partie de la famille des Malvacées. Cette famille est représentée au Burkina Faso par plusieurs espèces cultivées telles le cotonnier (Gossypium barbadense L.) cultivé pour ses fibres et ses graines, l’oseille (Hibiscus sabdariffa L.) et le gombo (Abelmoschus esculentus L.). Le gombo est caractérisé par une diversité de la forme et de la couleur des fruits et des tiges (Seck, 1991) (Photo 1). C’est un légume que l’on retrouve à l’état frais dans tous les marchés durant la période hivernale et à l’état sec (tranches, rondelles séchées ou en poudre) durant la saison sèche. Cela est dû à sa richesse en mucilage, à sa forte valeur marchande et à son importance vitale dans l’alimentation des populations des villes et des campagnes (Projet de conservation in situ, INERA/BF, 2001). Il existe même des variétés qui sont recommandées pour faciliter ou enrichir la nutrition des malades. Le gombo revêt une importance économique considérable pour la gent féminine et joue un rôle essentiel dans l’équilibre nutritionnel des populations rurales. Le fruit est en effet riche en glucides (7 à 8 % de la matière sèche) présents sous forme de mucilage. Il est assez pauvre en fibres mais riche en protéines pour un légume fruit (1,8 % de la matière sèche), l’acide aspartique et l’arginine représentent 10 % des acides aminés. Malgré une teneur moyenne en vitamine A (300 UI), les teneurs en thiamine, riboflavine, acide ascorbique (Vitamine C) sont bonnes. Une consommation quotidienne de 100 g de gombo frais fournirait environ 20 % des besoins en calcium, 15 % des besoins en fer et 50 % des besoins en vitamines C (Hamon, 1988). Il contient peu de calcium (90 mg pour 100 g), de phosphore (56 mg) et de magnésium (43 mg pour 100 g), et très peu de potassium.

2Selon Hamon (1988), les travaux les plus importants ont été réalisés en Inde et au Sud des Etats-Unis. Ils ont accordé une importance aux caractéristiques de la pigmentation des diverses parties de la plante et se sont intéressés aux formes des fruits, aux types foliaires et au degré de pubescence. Hamon (1983) soutient que l’étude de la variabilité génétique du genre Abelmoschus n’a jamais été réellement abordée. Très peu d’informations sont disponibles sur la variabilité génétique de l’espèce cultivée A. esculentus en général, et en particulier en Afrique de l’Ouest (Hamon, 1988). Les études récentes réalisées sur le genre en Afrique de l’Ouest sont basées sur la caractérisation agromorphologique de certains paramètres tels que la densité des plantes, la productivité (Fondio, Kouame, 1999) ou sur certaines interactions entre le génotype et l’environnement (Ariyo, Ayo, 2000). Aucune de ces études ne sont réalisées dans les conditions agro-écologiques similaires de nos sites. Par ailleurs, les aspects physiologiques de cette plante ne sont nulle part abordés.
3La culture du gombo reste une activité essentiellement féminine au Burkina Faso. Depuis les semis jusqu’aux récoltes, les fruits, les feuilles et les graines de gombo sont manipulés par la gent féminine qui l’affectionne surtout pour ses multiples utilisations : sauce, salade, beignets et nutrition des malades. Le gombo demeure aussi une source sûre de revenus pour les femmes qui exploitent plus de 87,32 %, 93,12 % et 96,51 % des superficies occupées par cette culture respectivement dans les trois sites retenus : Pobé-Mengao, Thiougou et Tougouri, situés dans trois zones agro-écologiques différentes du Burkina Faso que sont respectivement la zone nord (située en région sahélienne entre l’isohyète 400 mm et 500 mm, avec une pluviométrie annuelle autour de 400 mm), la zone centre nord (située en région sahélo-soudanienne, entre les isohyètes 500 mm et 600 mm avec près de 700 mm d’eau par an) et la zone du sud-est (située dans la région soudanienne entre les isohyètes 800 mm et 1000 mm avec plus de 900 mm d’eau par an).
4Les jeunes fruits frais du gombo sont plus appréciés. En effet, lorsqu’ils ont trois à cinq centimètres de long ils sont récoltés et vendus sur la place du marché à raison de quatre à cinq fruits pour 100 à 150 F CFA ; le plat ou “ assiettée ” (environ 800 g) de gombo sec coûte 1500 F CFA à certains marchés de la campagne (Projet de conservation in situ, INERA/BF, 2001) contre 1800 à 2000 F CFA aux marchés de Ouagadougou. Ces coûts déjà élevés sont souvent augmentés de 50 à 60 % pendant les périodes sèches de l’année.
5Malgré ses multiples utilisations, son apport nutritionnel avéré et sa valeur financière, le gombo est cultivé sur de très petites surfaces, aux abords des cases et souvent dans les dépotoirs. On ne signale pas encore la culture de variétés améliorées de gombo au Burkina Faso. Ce sont souvent des écotypes locaux que l’on observe chez les paysans burkinabé en empruntant le point de vue de Leland (1987) selon lequel l’écotype est une race locale (race écologique) dont les génotypes sont adaptés à un habitat spécifique limité par suite de la sélection naturelle dans le milieu local. Ces écotypes cultivés par des paysans seraient probablement plus des populations que des lignées pures. à ce peu d’intérêt, s’ajoutent la sécheresse, les maladies et les attaques des insectes ravageurs qui provoquent une réduction importante de sa production (Dubey, Bhagat, 1998 ; Fugro, 1999 ; Ali, Hossain, 2000) l’amenant ainsi à jouer les derniers rôles dans les programmes de recherches agricoles du pays et ce malgré l’existence d’une diversité d’écotypes pouvant être utilisés dans la création de variétés à cycle court ou résistantes à certaines contraintes abiotiques. Le faible taux d’existence des variétés améliorées milite en faveur d’une stratégie de sélection participative qui prend en compte les critères de sélection des paysans, intégrant la tolérance ou la résistance du génotype aux conditions drastiques du milieu tel le déficit hydrique aux périodes critiques de la réalisation de son potentiel génétique (Sawadogo et al., 2004). L’objectif premier de nos travaux est d’étudier l’impact du déficit hydrique temporaire survenant lors de la boutonnisation et de la floraison à travers l’évaluation des éléments de rendement, la teneur en eau et la perméabilité membranaire. Cela permet d’évaluer le niveau de réaction anatomo-morphologique et physiologique de différents morphobiotypes dans les conditions de stress hydrique et de retenir les meilleurs génotypes pour un programme d’amélioration.
2. Matériel et méthodes
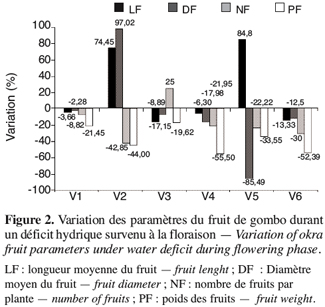
2.1. Matériel végétal
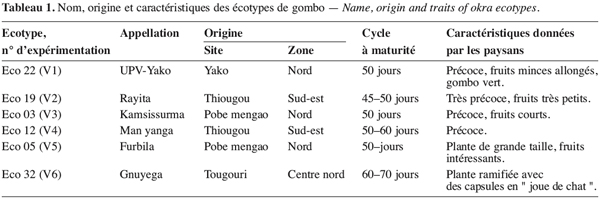
6Le matériel végétal est constitué de six écotypes du Burkina Faso obtenus par sélection variétale participative (Witcombe, Joshi, 1996 ; Weltzien et al., 1998) avec les paysans relevant de trois zones agro-écologiques différentes (zone nord, zone centre nord et sud-est) dans le cadre du projet de conservation in situ de la diversité biologique agricole. L’écotype V1 est issu de l’épuration d’une collecte de gombo du marché de Yako (situé à 100 km de la capitale Ouagadougou et approximativement à 145 km de Pobe Mengao) que l’équipe d’amélioration génétique des légumineuses a réalisé durant les campagnes agricoles 2002-2003 et 2003-2004. Ces écotypes ont été par ailleurs caractérisés suivant les critères de sélection des paysans et les caractéristiques essentielles sont présentées dans le tableau 1.
2.2. Dispositif expérimental et conditions de culture
7L’expérimentation a eu lieu dans les serres de l’Unité de Formation et de Recherche (UFR) en Sciences de la Terre et de la Vie (SVT) de l’Université de Ouagadougou durant la campagne agricole 2003-2004. Chaque écotype est semé dans six pots de 15 m3 chacun dont trois d’entre eux ont servi de témoin (arrosé deux fois par jours) tandis que les trois autres pots sont appelés essai (dont l’arrosage est interrompu à l’apparition de 50 % des boutons floraux ou de 50 % floraison). Les différents paramètres physiologiques de la plante sont mesurés une fois que la plante commence à se faner (on estime alors que l’effet du stress est sensible). Après la mesure des différents paramètres physiologiques, on reprend l’arrosage des plantes essai. Ceci permet d’apprécier le niveau de réparation des différents organismes. Les semis ont été réalisés le 30 juin 2004 à cinq graines par pot et les jeunes pousses de deux semaines d’âge ont été démariées à deux pieds par pot. Un traitement au Décis (deltaméthrine) à 2 ml par litre d’eau a été appliqué contre les insectes piqueurs-suceurs pendant la phase de boutonnisation. Les données climatiques ont été relevées à l’aide des appareils placés sous les serres durant l’expérimentation.
2.3. Méthodes de collecte des données
8La longueur (LF) et le diamètre (DF) des trois premiers fruits sont mesurés à maturité à l’aide d’une règle graduée et exprimés en centimètres. Le diamètre de la tige principale (DP) à maturité est pris au niveau du premier nœud et exprimé en millimètres.
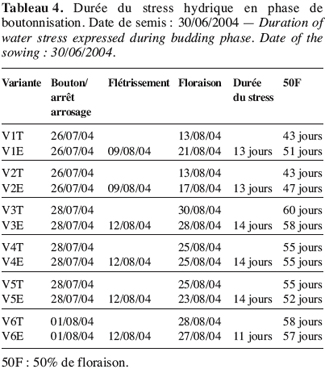
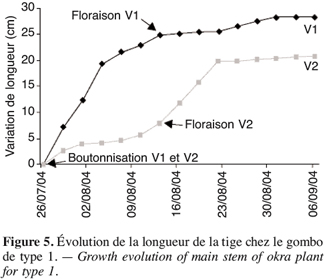
9Dix variables ont été observées. Il s’agit des caractères 50 % boutonnisation (50B), 50 % floraison (50F), fixés visuellement dès l’apparition du premier bouton floral ou de la première fleur et exprimés en nombre moyen de jours sur l’ensemble des six plantes que compte chacune des variantes, soit six plantes pour chaque témoin et six autres plantes pour les essais. La longueur (LP) et le diamètre (DP) de la plante sont mesurés tous les trois jours à partir de la boutonnisation jusqu’à la maturité. Le nombre de fruits (NF) est obtenu par comptage depuis le premier fruit jusqu’au dernier de la récolte. Les poids frais et sec des fruits (PFF, PFS) sont obtenus par pesée ainsi que les poids frais (PPF) et sec (PPS) de la partie aérienne de la plante et le poids frais des racines (PRF).
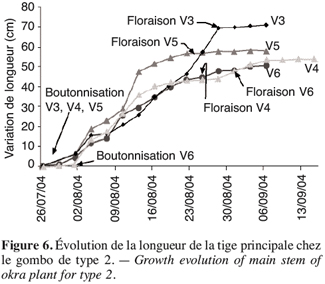
2.4. Méthodes de mesure des paramètres physiologiques
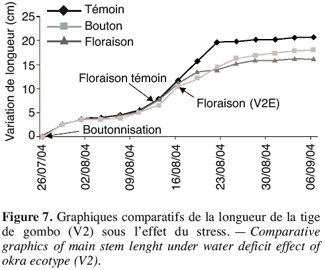
10Mesure de la teneur en eau (TE) et de la teneur relative en eau (RWC). Des disques d’environ 0,5 à 1 cm de diamètre sont réalisés dans la feuille fraîche lavée à l’eau distillée à l’aide d’un emporte-pièce. Ils sont pesés et représentent la masse fraîche (MF). Ils sont ensuite disposés dans une boîte de Petri dont le fond est tapissé de papier filtre humidifié. L’ensemble est mis à 4 °C, à l’obscurité pendant 15 heures. Après avoir légèrement épongé l’échantillon entre deux feuilles de papier absorbant, celui-ci est pesé, sa masse est dite à saturation (MT). Enfin, l’échantillon est placé dans une étuve à 85 °C pendant 24 à 48 heures. Il est pesé et la masse sèche (MS) est enregistrée. La teneur relative en eau est exprimée par le rapport de la masse d’eau contenue dans l’échantillon après récolte sur la masse d’eau contenue dans l’échantillon à pleine turgescence :
11RWC (%) = (MF-MS).100/(MT-MS).
12La teneur en eau (TE) est calculée par le rapport à la masse d’eau contenue dans l’échantillon sur la masse sèche de l’échantillon (Bin Yan et al., 1996 ; Qiujie Dai et al., 1997) :
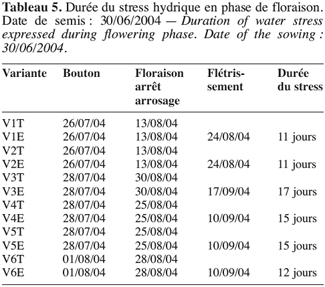
13TES (%) = (MF-MS).100/MS.
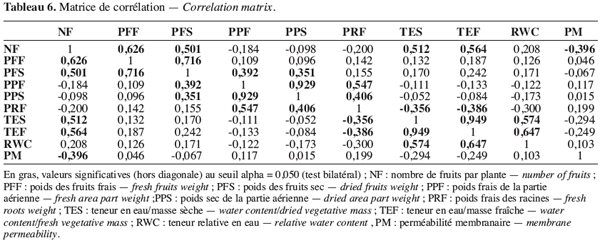
14Elle est aussi exprimée par rapport à la masse fraîche de l’échantillon :
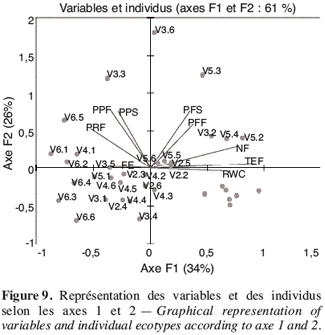
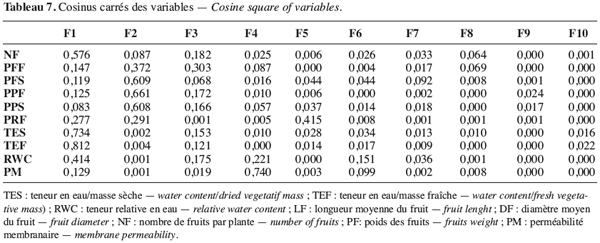
15TEF (%) = (MF-MS).100/MF.
16Mesure de la perméabilité membranaire. Cinq disques sont prélevés dans une feuille grâce à un emporte-pièce et sont rincés dans une boite de Petri contenant de l’eau distillée. Les disques sont ensuite placés dans un tube contenant 10 ml d’eau distillée. La conductivité de la solution est alors mesurée (C1) pour une première fois avec un conductimètre préalablement étalonné. L’échantillon est mis ensuite au bain-marie bouillant pendant 20 min puis refroidi à la température ambiante. La conductivité est mesurée une seconde fois (C2). Le pourcentage de fuite d’électrolytes est calculé suivant la formule (Bin Yan et al., 1996 ; Qiujie Dai et al., 1997) :
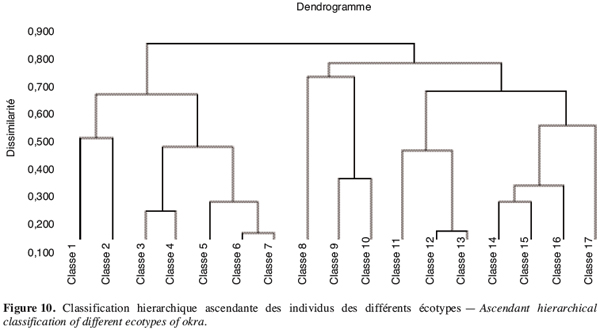
17PM (%) = C1.100/C2.
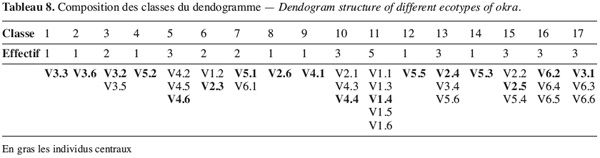
18Analyses statistiques. Les données ont fait l’objet d’une analyse de variance simple réalisée avec le logiciel XLSTAT (version 6.1.9 d’évaluation 2004). Avec le logiciel de STAT-ITCF (version 5), on a mis en évidence les liaisons entre variables par le calcul des corrélations totales. Une analyse en composante principale (ACP) (Cherisey, 1983 ; Philipeau, 1986) a été effectuée sur les données et a permis d’établir les matrices de corrélation. De même une classification ascendante hiérarchique (CAH) a été faite à partir des coordonnées des individus fournies par l’ACP avec troncature de l’arbre hiérarchique à 0,20 de dissimilarité. Les contributions relatives des axes et les variables explicatives ont servi au choix des axes à retenir (Bonifas et al., 1984 ; Escofier, Pages, 1998). Les groupes d’individus semblables ont été constitués grâce à la troncature de l’arbre hiérarchique en maximisant la variance interclasse.
3. Résultats et discussion
3.1. Variation des paramètres du fruit des différents génotypes de gombo sous le stress hydrique
19Le stress survenu en phase de boutonnisation a eu pour effet la réduction des quatre paramètres du fruit que sont la longueur (LF), le diamètre (DF), le nombre (NF) et le poids frais (PF) des fruits (Figure 1). Cette réduction est fonction des écotypes ; en effet les écotypes V1, V3 et V4 enregistrent une variation moindre que les écotypes V2, V5 et V6 chez qui la réduction de la longueur des fruits atteint 63,69 % (V2) et celle du poids des fruits 60,66 % (V6). Par ailleurs les paramètres les plus affectés sont la longueur du fruit et le nombre de fruits par plante à la récolte.
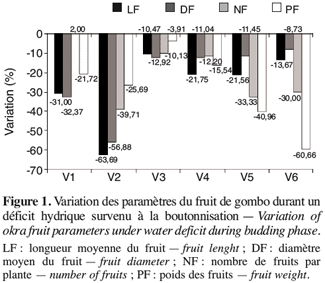
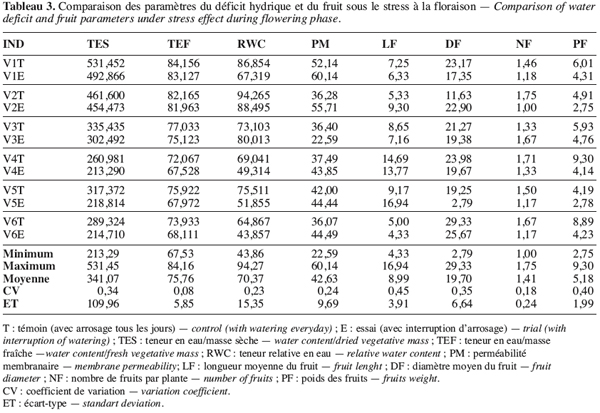
20Lorsque le déficit hydrique intervient durant la phase de floraison, les réponses sont beaucoup plus variables en fonction des génotypes en présence (Figure 2). Les écotypes V1, V4 et V6 se caractérisent par une baisse des paramètres du fruit mais à des degrés différents. Les écotypes V2 et V5 enregistrent une augmentation de la longueur du fruit jusqu’à plus de 75 %. En outre on remarque que si l’écotype V1 perd des fruits avec une réduction du nombre de 8,82 %, la V3 voit le nombre de ses fruits augmenter de 25 % alors que les autres paramètres diminuent. Néanmoins, les écotypes V1 et V2 paraissent les moins touchés par le stress survenu en floraison.
3.2. Variation de la teneur en eau et de la perméabilité membranaire des différents génotypes sous le stress hydrique
21Une comparaison de la variation de la teneur en eau et de la perméabilité membranaire durant le déficit hydrique en phase de boutonnisation (Figure 3) montre, en général, une réduction des paramètres de la teneur en eau (TES, TEF, RWC) et une valeur plus élevée de la perméabilité membranaire traduisant une fuite importante des électrolytes. Les réponses des différents génotypes sont variables. Ainsi les écotypes V3 et V4 enregistrent la plus faible variation de la perméabilité membranaire : soit respectivement une réduction de 2,29 % et 1,97 % ; contre une augmentation de 9,52 % à 25,04 % pour les quatre autres écotypes (V1, V2, V5 et V6). L’écotype V3 montre une augmentation du nombre de ses fruits de 25 % (Figure 2), or ce même écotype enregistre la plus faible variation de la perméabilité membranaire (Figure 3).
22Les fortes variations de la perméabilité membranaire constatées chez V1, V2, V5 et V6 attestant une fuite importante d’électrolytes, traduisent une rupture probable de la structure normale des membranes cellulaires. Cette situation peut entraîner le déplacement des protéines membranaires contribuant ainsi à une perte de sélectivité des membranes, un accroissement dans la cellule de la concentration en électrolytes. La conséquence de tous ces évènements serait une perturbation du métabolisme cellulaire lors de la réhydratation (Hopkins, 2003), ce qui aurait abouti à une réduction des paramètres du fruit constatée chez ces variétés.
23Quand ce déficit hydrique se manifeste durant la phase de floraison (Figure 4), on observe la même tendance qu’en phase de boutonnisation sauf que l’écotype V3 se caractérise par une diminution de 61,11 % de la perméabilité membranaire.
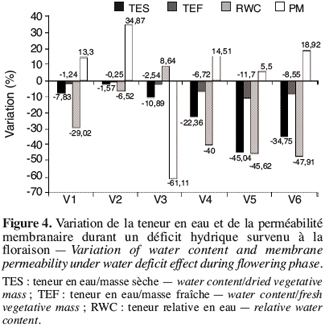
3.3. Variabilité des paramètres sous l’effet du stress hydrique
24Les paramètres les plus variables permettant de mieux discriminer les écotypes sont la teneur relative en eau (RWC), la longueur du fruit (LF) et le nombre de fruits (NF) qui, indépendamment de la période d’intervention du déficit hydrique, présentent un coefficient de variation relativement élevé, allant de 0,24 (RWC) à 0,39 (LF) (Tableau 2).
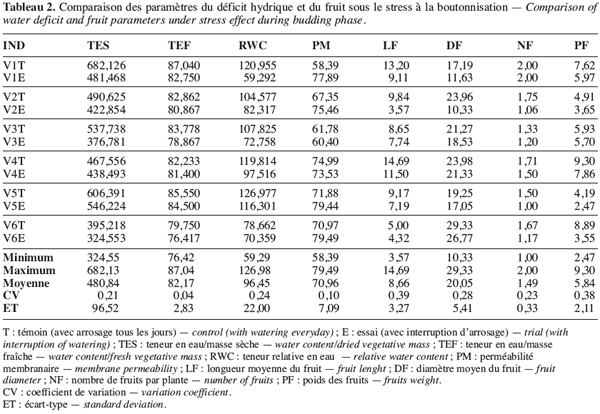
25Le nombre et le poids des fruits constituent de bons indicateurs de rendement du gombo et leur niveau de variation peut être utilisé pour apprécier le niveau de tolérance d’un génotype à la sécheresse. Ainsi nous pouvons constater que, quelle que soit la période du stress, la variation du nombre des fruits de l’écotype V1 reste relativement faible (Tableau 2). Le nombre de fruits reste 2,00 pour V1T et 2,00 aussi pour V1E sous le stress de boutonnisation. Il passe de 1,46 pour V1T à 1,18 pour V1E sous le stress à la floraison. Cette faible variabilité témoigne de la tolérance de V1 aux deux types de stress. Néanmoins les écotypes les moins sensibles au stress de boutonnisation sont V3T (5,93) et V4E (5,70), la variation étant très faible (Tableau 2). Par contre, V5T (4,19) passe à V5E (2,47), donc une variation élevée qui montre l’existence d’une plus grande sensibilité au stress de cette période de formation des boutons floraux. Par ailleurs, si le stress intervient pendant la floraison, V2, V4, et V6 sont les plus touchés et les plus résistants sont V1 et V3 (Tableau 3).
26Une remarque importante à noter par rapport au rendement par plante est la valeur du poids des fruits sous l’effet du stress hydrique en phase de boutonnisation et de floraison ; même si l’écotype V3 semble plus résistant au stress de boutonnisation, il demeure moins productif que les écotypes V1 et V4 sous les mêmes conditions de stress. Les écotypes V1 et V4 sont les mieux adaptés pour une poche de sécheresse intervenant durant la boutonnisation. L’écotype V3 est adapté au stress hydrique intervenant en phase de floraison.
3.4. Variation de la longueur de la tige principale des différents écotypes de gombo sous stress hydrique
27La période de récupération de la plante après l’effet d’un stress est très déterminante pour le rendement. Les écotypes précoces V1 et V2 sont les premiers à avoir les boutons, soit 26 jours après les semis (Tableau 4). L’évolution de la longueur de la tige principale (Figure 5) montre que la croissance dans le temps de V1 est plus grande que celle de V2. Cette croissance atteint 25 cm à la floraison chez V1 contre moins de 10 cm chez V2. La croissance de V1 devient très lente à partir de la phase de floraison alors que la croissance maximale de V2 est observée après la floraison : V2 continue de croître après la floraison.
28La figure 6 montre que les écotypes V3, V4, V5, V6 ont une croissance lente à partir de la floraison. Mais avant cette étape on observe une croissance rapide de la tige principale de gombo qui se stabilise quelques jours après la floraison.
3.5. Effet du stress hydrique sur la croissance de la tige principale du gombo
29Lorsque le stress intervient à la boutonnisation, il y a un ralentissement de la croissance de V2 (Figure 7). L’apport d’eau réalisé le 9 août 2004 a permis une légère remontée de sa croissance mais sans atteindre le témoin. La plante stressée reste naine et la floraison intervient quatre jours après celle du témoin ; le même comportement est observé chez V1 dont la floraison sous stress de boutonnisation intervient une semaine après la floraison du témoin (Tableau 5).
30Les résultats obtenus chez V3, V4, V5 et V6 sont légèrement différents des deux écotypes précédents. En effet pour ce groupe, le stress survenu en phase de boutonnisation conduit à une précocité de la floraison. Ainsi, on peut constater que V3E fleurit deux jours avant V3T (Figure 8, Tableau 4).
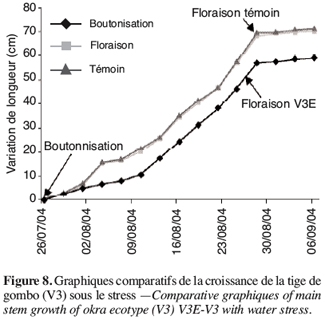
31Cet effet de stress en phase de boutonnisation est d’autant plus néfaste pour ces écotypes V1 et V2 qu’il contribue à un rallongement du cycle 50 % floraison (50F). En effet, le cycle passe de 43 à 51 jours pour V1 et 43 à 47 jours pour V2 (Tableau 4).
32Les tableaux 4 et 5 laissent entrevoir que l’installation de l’effet de stress hydrique en phase de boutonnisation ou en phase de floraison est d’une durée moyenne de 13 à 14 jours. Elle est très vite ressentie par V1 et V2 et moins vite par V3.
3.6. Associations des caractères
33Les relations entre les variables sont décrites par les coefficients de corrélation totale (Tableau 6). Le poids des fruits par plante est fortement lié au nombre de fruits par plante. Outre les corrélations telles que celles entre le nombre de fruits, le poids des fruits secs et frais, on observe une corrélation positive et significative entre le nombre de fruits par plante et les teneurs en eau par masse sèche et par masse fraîche. Ainsi les écotypes précoces possédant un grand nombre de fruits sont ceux qui ont une teneur élevée en eau. Par ailleurs, plus la plante possède de fruits, plus la perméabilité membranaire est réduite.
3.7. Stratification de la variabilité des écotypes testés
34La variabilité des écotypes testés a été décrite grâce à l’analyse en composante principale (ACP) suivie de la classification ascendante hiérarchique. Les deux premières composantes de l’ACP expliquant 61 % de l’information ont été retenues (Figure 9). La première composante expliquant 34,15 % de l’information est liée aux variables teneur en eau par rapport à la masse fraîche et sèche, nombre de fruits par plante et à une moindre mesure la teneur relative en eau (Tableau 7). L’axe deux qui explique 26,36 % de l’information est lié à la biomasse fraîche et sèche de la plante et au poids des fruits secs.
35La représentation des individus montre une certaine hétérogénéité de distribution des individus d’un même écotype. Cela témoigne d’un certain degré d’hétérogénéité intra écotype, à l’exception de l’écotype V2 qui a une meilleure représentation de tous les six individus sur ce plan.
3.8. La classification ascendante
36La classification ascendante suivie de la troncature de l’arbre hiérarchique (à 0,20) a permis la constitution de 17 classes d’écotypes semblables (Figure 10) exhibant 83 % de variation interclasse.
37Il ressort de cette analyse une forte hétérogénéité à l’intérieur d’un même écotype. En effet à l’exception de l’écotype V1 qui a, au niveau de la classe 11, cinq de ses six individus, tous les autres écotypes enregistrent un éparpillement des individus d’un même écotype à travers plusieurs classes différentes : ainsi l’écotype V5 est représenté dans six classes différentes (classes 4, 7, 12, 13, 14 et 15) par un individu (Tableau 8). Ceci témoigne d’un niveau élevé d’hétérogénéité de cet écotype. Il en est de même pour l’écotype V3 dont les individus sont dans plusieurs classes.
38Cette hétérogénéité est beaucoup plus visible chez les écotypes (V3, V4, V5) les plus résistants au stress hydrique. Si on considère ce facteur, on pourrait affirmer que l’hétérogénéité à l’intérieur de l’écotype assure une certaine résistance du gombo à la sécheresse.
4. Conclusions
39La sélection participative qui a abouti aux choix de ces différents écotypes comme les plus préférés par les paysans des différentes régions agricoles permet de fixer rapidement les objectifs de la sélection en tenant compte des préoccupations réelles de ces derniers. Ceci facilite le choix des caractères à améliorer et permet de raccourcir le cycle de la sélection variétale. Le choix du paysan est beaucoup plus lié aux caractéristiques morphologiques et culinaires du fruit, à la capacité de résistance ou de tolérance à la sécheresse des écotypes. Ce comportement des paysans s’explique par le fait que les régions agro-écologiques concernées au Burkina Faso connaissent des poches de sécheresse tous les ans. Ceci oblige le paysan à rechercher des variétés précoces et productives en raison des conditions agro-écologiques. En effet comme nous pouvons le constater, tous ces écotypes dont le cycle 50 % floraison est compris entre 43 et 60 jours arrivent à supporter jusqu’à 10 à 14 jours de déficit d’eau.
40L’effet du stress hydrique en phase de boutonnisation est très néfaste pour le gombo. Il se manifeste par une baisse des composantes du rendement que sont la longueur, le diamètre, le nombre et le poids des fruits. Néanmoins les écotypes réagissent différemment face à cette contrainte. Ainsi, V3 et V4 sont les moins sensibles et peuvent être recommandés pour les cultures en début de saison hivernale où très souvent les pluies sont interrompues créant des poches de sécheresse allant de une à deux semaines après les semis.
41Une grande disparité de réponses des plantes de gombo au stress hydrique s’observe lorsque le déficit s’installe en phase de floraison ; ceci permet de mieux discriminer les écotypes.
42La plante de gombo a une croissance rapide de la boutonnisation à la floraison. Ensuite cette croissance ralentit considérablement durant la phase de fructification pour s’annuler quelques temps après. La plante a atteint sa croissance maximale et ses efforts sont beaucoup plus consacrés à l’accumulation de la matière plastique synthétisée dans les organes de réserve.
43L’analyse des résultats et les observations font ressortir deux types de période de floraison chez le gombo : celui qui intervient pendant la phase de croissance accélérée de la tige principale (type 1) et celui qui s’installe une fois que commence l’amorce du ralentissement de la croissance de la tige principale (type 2). Ce dernier groupe est le plus fréquemment rencontré.
44Le stress hydrique en phase de boutonnisation conduit à une précocité de floraison chez les plantes de type 2 et à un retard de floraison pour le type 1.
45Les variables qui discriminent le mieux les écotypes de gombo sous stress hydrique sont la teneur relative en eau (RWC), la longueur et le nombre de fruits.
46Ces caractères agro-morphologiques ne sont pas suffisants pour distinguer génétiquement les cultivars du paysan au Burkina Faso. En termes de diversité génétique, les écotypes cultivés par le paysan méritent une investigation moléculaire poussée pour mieux les discriminer.
47Toutefois les informations agro-morphologiques ont permis d’identifier trois écotypes (V1, V3 et V4) qui pourraient être introduits dans un programme de sélection pour la tolérance ou la résistance au déficit hydrique.
Bibliographie
Ali M., Hossain MZ. (2000). Inheritance of Yellow Vein Mosaic Virus (YVMV) tolerance in a cultivar of okra (Abelmoschus esculentus L. Moench). Euphytica 111 (3), p. 205–209.
Ariyo OJ., Ayo VMA. (2000). Analysis of genotype x environment interaction of okra (Abelmoschus esculentus L. Moench). J. Genet. Breed. 54 (1), p. 35–40.
Bin Y., Qiujie D., Xiaozhong L. (1996). Flooding induced membrane damage, lipid oxidation and activated oxygen generation in corn leaves. Plant Soil 179, p. 261–268.
Bonifas I., Escoufier Y., Gonzalez PL., Sabatier R. (1984). Choix de variables en analyse en composantes principales. Rev. Statist. Appl. 23, p. 5–15.
Cherisey M. (1983). Contribution à l’évaluation des ressources génétiques du millet (Setaria italica). Variabilité des caractères quantitatifs. Thèse de 3e cycle. ORSAY, 219 p.
Escofier B., Pages J. (1998). Analyses factorielles simples et multiples (3e éd.). Paris : Dunod.
Dubey VK., Bhagat KP. (1998). Effect of insecticides and plant products against shoot and fruit borer of okra, Earias vittella (Fab.). Agric. Sci. Digest. 18 (2), p. 120–122.
Fondio L., Kouame CNG. (1999). Sowing density, growth and yield of two okra cultivars (Abelmoschus spp.) in Côte d’Ivoire. Cah. Agric. 8 (5), p. 413–415.
Fugro PA. (1999). A new disease of okra (Abelmoschus esculentus L.) in India. J. Mycol. Plant Pathol. 29 (2), p. 264.
Hamon S. (1983). Discrimination de deux espèces de gombo cultivées en Côte d’Ivoire (A. esculentus et A. sp.) sur la base de leurs profils enzymatiques. ORSTOM Adiopodoumé, rapport multigraphié.
Hamon S. (1988). Organisation évolutive du genre Abelmoschus (gombo). Coadaptation et évolution de deux espèces de gombo cultivées en Afrique de l’Ouest, A. esculentus et A. caillei. Paris : ORSTOM, Travaux et documents microédités 46, 191 p.
Hopkins WG. (2003). Physiologie des stress. In Physiologie végétale. USA : Université d’Ontario, p. 451–473.
Leland R. House (1987). Manuel pour la sélection du sorgho. (2e éd.). Andhra Pradesh, Inde : ICRISAT.
Philipeau G. (1986). Comment interpréter les résultats d’une analyse en composantes principales? ITCF, 63 p.
Projet de conservation in situ INERA/BF. (2001). Rapport Technique Annuel (Janvier à Décembre 2001. Coordination Nationale du Projet in situ). Ouagadougou, Burkina Faso : INERA.
Qiujie D., Bin Y., Shaobai H. (1997). Response of oxidative stress defense systems in rice (Oryza sativa) leaves with supplemental UV B radiation. Physiol. Plant. 101, p. 301–308.
Sawadogo M., Ouedraogo J., Belem M., Balma D., Dossou B., Jarvis D. (2004). Influence of ecosystem components on cultural practices affecting the in situ conservation of agricultural biodiversity. PGR News 139, p. 19–25.
Seck A. (1991). Okra germplasme evaluation in Senegal. Workshop on okra genetic resources. In Report of an international workshop on okra genetic resources held at the National Bureau for Plant Genetic Ressources, International Crop Network Series N°5., Rome : IBPGR. New Delhi, India, 8-12 Oct. 1990.
Weltzien RE., Whitaker ML., Rattunde HFW., Dhamotharan M., Anders MM. (1998). Participatory approaches in pearl millet breeding. In Witcombe JR., Virk DS., Farrington J. (eds.). Seeds of Choice. Making the most of new varieties for small farmers. New Delhi, India: Oxford and IBH, 271 p.
Witcombe JR., Joshi A. (1996). The impact of farmer participatory research on biodiversity of crops. In Sperling L., Loevinsohn M. (eds.). Using diversity. Enhancing and maintaining genetic resources on-farm, Proceedings of a workshop held on 19-21 June 1995. New Delhi, India: International Development Research Centre, p. 87–101.
Pour citer cet article
A propos de : Mahamadou Sawadogo
Université de Ouagadougou, UFR/SVT. 03 BP 7021 Ouagadougou 03 (Burkina Faso). E-mail : sawma@univ-ouaga.bf - amsocologe@yahoo.fr
A propos de : Gérard Zombré
Université de Ouagadougou, UFR/SVT. 03 BP 7021 Ouagadougou 03 (Burkina Faso).
A propos de : Didier Balma
Institut de l’Environnement et de Recherches agricoles (INERA). Centre de Recherches environnementales et agricoles de Kamboinse (CREAF). 01 BP 476 Ouagadougou 01 (Burkina Faso).






