- Home
- Volume 18 (2014)
- Numéro 3
- La prénylation des protéines chez les insectes : cible prometteuse pour le développement d’insecticides biorationnels ciblant les Lépidoptères ?
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
La prénylation des protéines chez les insectes : cible prometteuse pour le développement d’insecticides biorationnels ciblant les Lépidoptères ?

Editor's Notes
Reçu le 18 novembre 2013, accepté le 5 mai 2014
Résumé
Les « short-chain » prényltransférases (farnésyl diphosphate synthase [FPPS] et géranylgéranyl diphosphate synthase [GGPPS]) et les protéine-prényltransférases (farnésyltransférase et géranylgéranyltransférase) sont des familles d’enzymes impliquées respectivement dans la synthèse des groupements prényl C15 et C20 et dans leur attachement à l’extrémité C-terminale de plusieurs protéines d’eucaryotes. La voie de prénylation des protéines étant une voie importante pour la localisation et l’activation de plusieurs protéines, ces enzymes ont fait l’objet de nombreuses études de caractérisation chez les mammifères dans le but de développer de nouveaux outils thérapeutiques anticancéreux. Chez les insectes, seules la FPPS et la GGPPS ont été caractérisées à ce jour. La FPPS semble présenter, chez le groupe des Lépidoptères, des traits uniques, constituant ainsi une cible potentielle pour le développement d’insecticides biorationnels qui visent à perturber le mécanisme de plusieurs voies métaboliques importantes incluant la biosynthèse de l’hormone juvénile et la prénylation des protéines. La poursuite des travaux de caractérisation des FPPS et des GGPPS et l’étude des protéine-prényltransférases d’insectes fourniront des données essentielles permettant de développer des insecticides biorationnels ciblant les enzymes de la prénylation.
Abstract
Protein prenylation in insects: a potential target for the development of bio-rational insecticides targeting the Lepidoptera? Short-chain prenyltransferases (farnesyl diphosphate synthase [FPPS] and geranylgeranyl diphosphate synthase [GGPPS]) and protein-prenyltransferases (farnesyltransferase and geranylgeranyltransferase) are enzyme families involved in the synthesis of C15 and C20 prenyl moieties and in their attachment to the carboxyl-termini of a variety of eukaryotic proteins, respectively. Given that protein prenylation is an important post-translational modification essential for the localization and activation of many proteins, these enzymes have been the focus of many studies in mammals, with a view to developing new therapeutic tools for the treatment of cancer. In insects, only FPPS and GGPPS have been characterized to date. FPPS displays unique features in the Lepidoptera, thereby making it a potential target for the development of bio-rational insecticides that can disrupt key pathways, such as juvenile hormone biosynthesis and protein prenylation. Further characterization of insect FPPS and GGPPS, and biochemical investigations of insect protein-prenyltransferases may provide the foundation for the development of bio-rational insecticides targeting protein prenylation.
Table of content
1. Introduction
1La prénylation des protéines est une modification post-traductionnelle qui consiste en l’attachement par liaison covalente d’un groupement farnésyl (C15) ou géranylgéranyl (C20) à l’extrémité C-terminale de certaines protéines. Cette modification est nécessaire pour permettre à ces protéines de s’ancrer aux membranes cellulaires ou pour moduler leurs interactions avec d’autres protéines, acquérant ainsi une activité normale (Figure 1).
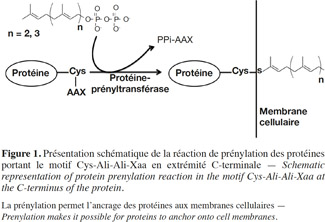
2Les premières observations concernant ce phénomène remontent à 1979, lorsque les premières protéines prénylées, la Rhodotorucine A (Kamiya et al., 1979) et l’hormone Tremérogène A-10 (Sakagami et al., 1979), ont été identifiées chez des champignons. En 1986, l’analyse de la structure primaire des protéines prénylées RAS chez la levure Saccharomyces cerevisiae révélait la présence d’un motif conservé au niveau de leur extrémité C-terminale. Ce motif était formé d’un résidu cystéine, suivi de deux résidus aliphatiques et d’un quatrième résidu de nature variable (Cys-Ali-Ali-Xaa) (Powers et al., 1986). Suite à cette étude, ce motif a été décelé à nouveau dans plusieurs protéines d’eucaryotes qui nécessitent une prénylation. Ces protéines sont aussi impliquées dans des voies de transduction de signal et jouent un rôle important dans la régulation de la réplication et de la différenciation cellulaire, dans l’organisation du cytosquelette et dans le trafic vésiculaire. Parmi les protéines bien connues qui subissent une prénylation, on retrouve les protéines Ras ainsi que d’autres protéines oncogènes, dont les protéines G apparentées aux Ras telles les Rab, Rho, Rac et la sous-unité γ du trimère de la protéine G, et d’autres protéines telles les phosphodiestérases (PDE) spécifiques au cGMP et les lamines nucléaires (Kawata et al., 1990 ; Lowe et al., 1990 ; Buss et al., 1991; Catty et al., 1991 ; Kinsella et al., 1991; Kitten et al., 1991; Kloc et al., 1991; Yamane et al., 1991 ; Anant et al., 1992). Les études du processus de prénylation des oncogènes Ras chez les mammifères constituent la base de l’établissement des mécanismes moléculaires de la prénylation.
3Chez les insectes, les études d’identification des protéines prénylées sont beaucoup moins nombreuses. Par exemple, les ADNc codant pour trois protéines Ras (BmRas1, BmRas2 et BmRas3) ont été clonés tout récemment chez le Lépidoptère Bombyx mori (Ogura et al., 2009). Chez Drosophila melanogaster, les gènes codant pour plusieurs homologues apparentés aux PDE spécifiques au cGMP des vertébrés ont été identifiés à partir du génome de cet insecte. Parmi ces gènes, on compte le gène CG8279 qui est l’homologue de la PDE6 des humains chez qui elle est exprimée dans le système rétinal où elle contrôle la phototransduction (Day et al., 2005). Chez la drosophile, cette protéine semble être localisée dans la membrane apicale des tubules de Malpighi, où elle est responsable de la modulation de la concentration locale du cGMP et du mécanisme de détoxification par les tubules (Day et al., 2008).
4Vu l’important rôle physiologique des protéines prénylées, autant chez les mammifères que chez les insectes, la compréhension des mécanismes biochimiques régulant la prénylation et la caractérisation des enzymes impliquées dans ce processus sont d’un grand intérêt. Ces deux éléments constituent d’ailleurs le sujet de la présente synthèse, laquelle est axée sur l’implication des connaissances récemment acquises dans ce domaine pour le développement d’insecticides biorationnels ciblant les Lépidoptères. Notre synthèse se veut donc un complément à celle publiée précédemment (Vandermoten et al., 2008b), laquelle n’abordait pas le sujet de la prénylation des protéines, mais portait plutôt sur les isoprényl diphosphate synthases d’insectes, avec une attention particulière accordée à celles des pucerons et à leurs rôles dans la biologie de ces insectes.
2. Les protéine-prényltransférases
5Les protéine-prényltransférases sont les enzymes qui catalysent la réaction de prénylation. Ces enzymes affichent généralement une affinité pour les motifs conservés (par exemple, Cys-Ali-Ali-Xaa) qui sont localisés à l’extrémité C-terminale des protéines cibles. Chez les mammifères, il existe trois types de protéine-prényltransférases : les farnésyltransférases (FTase) et les géranylgéranyltransférases de type I (GGTase-1), lesquelles reconnaissent le même motif chez leurs substrats (Cys-Ali-Ali-Xaa), formant ainsi le groupe des protéine-prényltransférases CaaX ; et les géranylgéranyltransférases de type II (GGTase-2 ; aussi connue sous le nom de géranylgéranyltransférase Rab), lesquelles reconnaissent d’autres motifs, ce qui leur a valu l’appellation de protéine-prényltransférases non-CaaX (Casey et al., 1996).
6La FTase est responsable de l’attachement d’un groupement farnésyl à la cystéine du motif CaaX, dans lequel « X » correspond à une méthionine, une glutamine, une sérine, une thréonine ou une cystéine, et « a » à un acide aminé aliphatique (Manne et al., 1990 ; Moores et al., 1991). La GGTase-1 catalyse, quant à elle, l’attachement d’un groupement géranylgéranyl à la cystéine du motif CaaX, où « X » désigne une leucine, une isoleucine ou une phénylalanine (Roskoski et al., 1998). La GGTase-2 transfère un groupement géranylgéranyl à des protéines possédant à l’extrémité C-terminale le motif CC, CCX, ou CXC (Casey et al., 1996).
7Les protéine-prényltransférases ont, à ce jour, été caractérisées seulement chez les mammifères, mais certaines études récentes s’intéressent à leur caractérisation chez les plantes, les champignons, les insectes et les protozoaires. Ainsi, on connait la localisation chromosomale et le nombre d’exons pour les gènes des protéine-prényltransférases chez différents organismes eucaryotiques, dont Homo sapiens, Mus musculus, Drosophila melanogaster, Arabidopsis thaliana et Saccharomyces cerevisiae (Maurer-Stroh et al., 2003).
8Sur le plan structural, les enzymes FTase, GGTase-1 et GGTase-2 ont toutes les trois une structure hétérodimérique (Casey et al., 1996 ; Park et al., 1997 ; Zhang et al., 2000). Chaque enzyme est constituée de deux sous-unités, α et β, qui se distinguent par leur repliement et qui ne semblent pas être issues d’un ancêtre commun (Andres et al., 1993 ; Dhawan et al., 1998). Chez la plupart des organismes, les sous-unités α de la FTase et la GGTase-1 sont encodées par le même gène (Maurer-Stroh et al., 2003).
9Les études de localisation tissulaire des protéine-prényltransférases chez les humains indiquent leur expression dans une variété de tissus. Puisque les niveaux d’expression détectés sont parfois proches du seuil de détection, il se pourrait que ces résultats ne reflètent pas le vrai profil d’expression de ces enzymes (Haverty et al., 2002 ; HuGE Index ; Maurer-Stroh et al., 2003).
10Chez les insectes, aucune étude de caractérisation biochimique de protéine-prényltransférases n’a été rapportée à ce jour. Toutefois, des analyses transcriptionnelles préliminaires de ces enzymes chez le Lépidoptère Choristoneura fumiferana ont été présentées par Barbar et al. (2013). Dans cette étude, il a été démontré que les transcrits des sous-unités β des trois protéine-prényltransférases atteignent leur niveau le plus élevé à la fin du 6e (dernier) stade larvaire, probablement pour prényler et activer des protéines impliquées dans le processus de la métamorphose. On y a aussi noté que la prénylation par la géranylgéranylation avec les GGTases semble être la forme prédominante de prénylation des protéines durant les différents stades de développement de l’insecte (Barbar et al., 2013), comme cela est le cas chez les mammifères (Farnsworth et al., 1990 ; Rilling et al., 1990 ; Epstein et al., 1991).
11De façon surprenante, d’autres analyses transcriptionnelles ont suggéré que la sous-unité α, présumée commune à la FTase et la GGTase-1 de Choristoneura fumiferana, est exprimée très fortement dans les tubules de Malpighi alors que l’abondance des transcrits spécifiques à la sous-unité β est faible (Barbar et al., non publié). Cette observation s’apparente à celle faite dans certains tissus humains. Elle suggère que la sous-unité α pourrait avoir une activité de prénylation indépendante ou une activité dépendante d’une interaction avec une protéine qui n’appartient pas à la famille des protéine-prényltransférases (Maurer-Stroh et al., 2003).
3. Mécanisme typique de prénylation des protéines
12Les mécanismes moléculaires de cette voie métabolique ont été élucidés dans le cadre de travaux réalisés sur des cellules de mammifères. La prénylation débute par la reconnaissance du motif CaaX par la FTase et la GGTase-1, après leur liaison respective au farnésyl et au géranylgéranyl. Le transfert d’une chaine farnésyl ou géranylgéranyl à l’atome de sulfure de la cystéine du motif s’effectue par la formation d’un complexe entre le cation bivalent Zn2+ et la cystéine (Park et al., 1997). Après le transfert, les trois acides aminés en aval de la cystéine sont éliminés par une protéase. Finalement, une méthyltransférase catalyse l’ajout d’un groupement méthyl au groupement α-carboxyl de la cystéine. Ces modifications donnent naissance à une protéine ayant une extrémité C-terminale S-farnésyl (ou S-géranylgéranyl) cystéine α-méthyl ester (Figure 2).
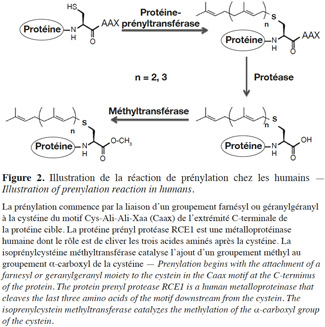
13Contrairement à la FTase et à la GGTase-1, la GGTase-2 ne requiert pas un motif particulier à l’extrémité C-terminale de la protéine devant être prénylée. Toutefois, les protéines cibles se terminent habituellement par CC ou CXC et un groupe géranylgéranyl peut être ajouté à chacune des deux cystéines. La GGTase-2 reconnait la protéine cible en raison du complexe qu’elle forme avec une protéine d’accompagnement (Rab escort protein [REP] ou la composante A) ; elle explore alors l’extrémité C-terminale de la protéine cible à la recherche de cystéines prénylables (Alexandrov et al., 1999). Le transfert du groupe géranylgéranyl à la protéine substrat requiert aussi la présence d’ions bivalents Zn2+.
14La protéine d’accompagnement est impliquée dans le transport de la protéine géranylgéranylée et dans sa localisation au niveau de la membrane cellulaire (Alexandrov et al., 1999).
4. Métabolisme des terpènes fpp et ggpp
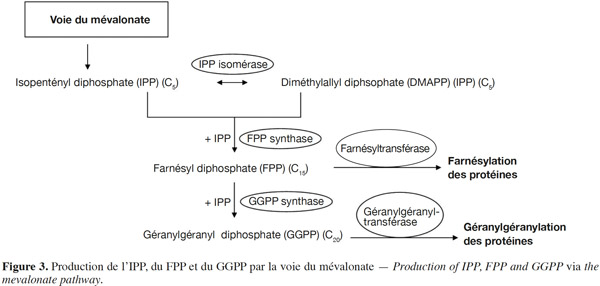
15En 1985, le rôle-clé de la voie du mévalonate dans la réaction de prénylation des protéines a été mis en évidence lorsque l’inhibition de la réplication de l’ADN dans une culture de cellules de mammifères dépourvues de mévalonate a été associée à l’absence de protéines prénylées (Sinensky et al., 1985). En effet, les groupements farnésyl et géranylgéranyl transférés aux protéines sont les produits de la voie métabolique du mévalonate. Le mévalonate subit deux phosphorylations successives ainsi qu’une décarboxylation conduisant à la formation de l’unité isoprénique, l’isopentényl diphosphate (IPP), formé de cinq atomes de carbones. Le farnésyl diphosphate (FPP) et le géranylgéranyl diphosphate (GGPP) sont obtenus à la suite de la condensation de trois ou quatre unités isopréniques, respectivement. Ainsi, la chaine du groupement FPP est formée de 15 carbones et celle du groupement GGPP de 20 carbones. Les prényltransférases FPP synthase (FPPS) et GGPP synthase (GGPPS) sont responsables de la catalyse de la condensation de ces groupements (Figure 3). Ces enzymes ont été largement étudiées et caractérisées chez les mammifères (Yeh et al., 1977 ; Barnard et al., 1981 ; Wilkin et al., 1990 ; Sagami et al., 1994 ; Kuzuguchi et al., 1999 ; Kavanagh et al., 2006 ; Miyagi et al., 2007).
16Chez les insectes, l’enzyme FPPS est la prényltransférase qui a été la mieux caractérisée à ce jour, principalement dans le but de comprendre son implication dans la biosynthèse des hormones juvéniles. Elle a fait l’objet d’études structurales (modélisation), biochimiques et fonctionnelles, surtout chez les Lépidoptères, chez lesquels elle présente des caractéristiques uniques (Barbar et al., non publié ; Cusson et al., 2006 ; Kinjoh et al., 2007). En effet, chez ce groupe d’insectes, la FPPS existe sous deux formes paralogues distinctes : la FPPS de type I et la FPPS de type II. La FPPS de type II semble être adaptée à la synthèse de formes homologues du FPP à branches éthyliques, non identifiées chez d’autres organismes. La FPPS de type I, quant à elle, semble structuralement distincte des FPPS d’autres organismes et pourrait être impliquée dans la prénylation des protéines dans tous les tissus, principalement dans les tubules de Malpighi (Barbar et al., non publié).
17D’autre part, la GGPPS a été séquencée chez une variété d’insectes incluant D. melanogaster (Lai et al., 1998) et le termite Nasutitermes takasagoensis (Hojo et al., 2007). Plusieurs GGPPS d’insectes ont été identifiées dans le cadre de projets de séquençage de génomes et leurs séquences ont été déposées dans GenBank. Cependant, les mécanismes moléculaires impliqués dans la synthèse du GGPP et sa régulation dans la voie de prénylation des protéines chez les insectes n’avaient, jusqu’à récemment, fait l’objet d’aucune étude. Pour combler cette lacune, Barbar et al. (2013) ont présenté la première caractérisation biochimique, structurale et transcriptionnelle d’une GGPPS d’insecte, celle du Lépidoptère Choristoneura fumiferana. Cette enzyme affiche des caractéristiques typiques que l’on retrouve chez la plupart des GGPPS de type III étudiées (par exemple, GGPPS de mammifères et de levures). Des études cinétiques et de modélisation moléculaire de cette enzyme ont indiqué que, tout comme les GGPPS humaine et bovine (Sagami et al., 1994 ; Kavanagh et al., 2006), la GGPPS de C. fumiferana subit une inhibition par son produit, le GGPP, suggérant l’existence d’un site dit inhibiteur en position centrale de la cavité catalytique de l’enzyme. Toutefois, l’enzyme de C. fumiferana affiche des caractéristiques catalytiques et structurales qui n’avaient pas été observées précédemment chez d’autres organismes. Ces particularités semblent responsables de son inhibition par son substrat allylique, le FPP, lorsque celui-ci est présent à de hautes concentrations (Barbar et al., 2013). Plus récemment, la GGPPS du scolyte Dendroctonus ponderosae a fait l'objet d'une étude qui a mis en évidence le rôle important de cette enzyme dans la production de la phéromone « frontaline » pour les mâles de cette espèce (Keeling et al., 2013).
5. Lutte contre les insectes ravageurs : les enzymes de la voie de prénylation des protéines comme cibles pour le développement de nouveaux produits antiparasitaires
18Depuis quelques années, un nouveau groupe de produits antiparasitaires, les insecticides « biorationnels », offrent un compromis intéressant entre efficacité et innocuité environnementale, et entre les pesticides biologiques et les insecticides chimiques conventionnels. Le principe actif de ces insecticides vise à perturber la fonction d’une enzyme spécifique à un groupe d’insectes. Il s’en suit une perturbation du processus physiologique contrôlé par la molécule ciblée. Dans ce contexte, les enzymes des voies biosynthétiques de l’hormone juvénile, des phéromones sexuelles ou d’alarme chez les Lépidoptères et les pucerons sont considérées comme des cibles intéressantes pour ce type d’insecticides. Et d’ailleurs, plusieurs études ont porté sur l’identification des particularités structurales et biochimiques des FPPS chez ces groupes d’insectes (Cusson et al., 2006 ; Sen et al., 2007 ; Vandermoten et al., 2008a ; Vandermoten et al., 2009). Récemment, Barbar et al. (2013) ont cloné, chez C. fumiferana, l’enzyme GGPPS qui est connue pour jouer un rôle important dans la prénylation des protéines chez les mammifères. Cette enzyme de Lépidoptère présente des particularités structurales et biochimiques uniques et, dès lors, l’idée de développer des insecticides « biorationnels » ciblant cette enzyme ou d’autres enzymes de la voie de prénylation des protéines devient intéressante.
19D’ailleurs, il est important de souligner que la FPPS, la GGPPS et les protéine-prényltransférases sont les cibles de divers inhibiteurs enzymatiques aux propriétés thérapeutiques chez l’humain, et dont l’activité entraine un blocage de la prénylation, là où cette voie métabolique est la cause de l’apparition de diverses maladies (Appels et al., 2005 ; Dunford et al., 2006 ; Dunford, 2010). Ainsi, il s’avère que des molécules aux propriétés inhibitrices, spécifiques aux enzymes de la prénylation, existent déjà (par exemple, bisphosphonates) et qu’il pourrait suffire de les modifier pour leur conférer des propriétés insecticides.
20Au-delà des considérations abordées plus haut à propos de la FPPS et de la GGPPS, plusieurs pistes de recherche fondamentale restent à explorer. C’est le cas, par exemple, de la caractérisation des structures tridimensionnelles des enzymes cibles par cristallographie à rayons x, laquelle permet d’approfondir la connaissance de leurs particularités structurales et fonctionnelles. De plus, des études de caractérisation des protéine-prényltransférases d’insectes sont requises puisqu’on en connait très peu à leur sujet. Il est aussi important d’identifier clairement, chez les insectes, les protéines dont l’inhibition de la prénylation entrainera des perturbations physiologiques importantes. Dans ce contexte, des algorithmes permettant d’identifier les protéines prénylées (par exemple, PrePs) (Maurer-Stroh et al., 2007) pourraient s’avérer utiles. Ces approches combinées permettront peut-être de développer des inhibiteurs spécifiques aux protéine-prényltransférases, lesquels pourraient être utilisés comme insecticides dans la lutte contre les ravageurs.
21Remerciements
22Nous remercions B. Arsenault et P. Cheers pour la révision du texte. Ce travail a été subventionné par le Conseil de Recherche en Sciences naturelles et en Génie du Canada et par le Service canadien des Forêts de Ressources naturelles Canada.
Bibliographie
Alexandrov K. et al., 1999. Characterization of ternary complex between Rab7, REP-I and rab geranylgeranyl transferase. Eur. J. Biochem., 265, 160-170.
Anant J.S. et al., 1992. In vivo differential prenylation of retinal cyclic GMP phosphodiesterase catalytic subunits. J. Biol. Chem., 267, 687-690.
Andres D.A. et al., 1993. cDNA cloning of the two subunits of human CAAX farnesyltransferase and chromosomal mapping of FNTA and FNTB loci and related sequences. Genomics, 18, 105-112.
Appels N.M., Beijnen J.H. & Schellens J.H., 2005. Development of farnesyl transferase inhibitors: a review. Oncologist, 10, 565-578.
Barbar A. et al., 2013. Cloning, expression and characterization of a lepidopteran geranylgeranyl diphosphate synthase from Choristoneura fumiferana. Insect Biochem. Mol. Biol., 43, 947-958.
Barnard G.F. & Popjak G., 1981. Human liver prenyltransferase and its characterization. Biochim. Biophys. Acta, 661, 87-99.
Buss J.E. et al., 1991. The COOH-terminal domain of the Rap1A (Krev-1) protein is isoprenylated and supports transformation by an H-Ras: Rap1A chimeric protein. Mol. Cell. Biol., 11, 1523-1530.
Casey P.J. & Seabra M.C., 1996. Protein prenyltransferases. J. Biol. Chem., 271, 5289-5292.
Catty P. & Deterre P., 1991. Activation and solubilization of the retinal cGMP-specific phosphodiesterase by limited proteolysis. Role of the C-terminal domain of the beta-subunit. Eur. J. Biochem., 199, 263-269.
Cusson M. et al., 2006. Characterization and tissue-specific expression of two lepidopteran farnesyl diphosphate synthase homologs: implications for the biosynthesis of ethyl-substituted juvenile hormones. Proteins, 65, 742-758.
Day J.P., Dow J.A.T., Houslay M.D. & Davies S.A., 2005. Cyclic nucleotide phosphodiesterases in Drosophila melanogaster. Biochem. J., 388, 333-342.
Day J.P., Cleghon V., Houslay M.D. & Davies S.A., 2008. Regulation of a Drosophila melanogaster cGMP-specific phosphodiesterase by prenylation and interaction with a prenyl-binding protein. Biochem. J., 414, 363-374.
Dhawan P., Yang E., Kumar A. & Mehta K.D., 1998. Genetic complexity of the human geranylgeranyltransferase I beta-subunit gene: a multigene family of pseudogenes derived from mis-spliced transcripts. Gene, 210, 9-15.
Dunford J.E., 2010. Molecular targets of the nitrogen containing bisphosphonates: the molecular pharmacology of prenyl synthase inhibition. Curr. Pharm. Des., 16, 2961-2969.
Dunford J.E. et al., 2006. Inhibition of protein prenylation by bisphosphonates causes sustained activation of Rac, Cdc42, and Rho GTPases. J. Bone Miner. Res., 21, 684-694.
Epstein W.W. et al., 1991. Quantitation of prenylcysteines by a selective cleavage reaction. Proc. Natl. Acad. Sci. USA, 88, 9668-9670.
Farnsworth C.C., Gelb M.H. & Glomset J.A., 1990. Identification of geranylgeranyl-modified proteins in HeLa cells. Science, 47, 320-322.
Haverty P.M. et al., 2002. HugeIndex: a database with visualization tools for high-density oligonucleotide array data normal human tissues. Nucleic Acids Res., 30, 214-217.
Hojo M., Matsumoto T. & Miura T., 2007. Cloning and expression of a geranylgeranyl diphosphate synthase gene: insights into the synthesis of termite defence secretion. Insect Mol. Biol., 16, 121-131.
HuGE Index, http://hugeindex.org/, (14/2/2014).
Kamiya Y., Sakurai A., Tamura S. & Takahashi N., 1979. Structure confirmation of S-trans-trans-farnesylcysteine in rhodotorucine A by application of sulfonium salt cleavage reaction. Agric. Biol. Chem., 43, 1049-1053.
Kavanagh K.L. et al., 2006. The crystal structure of human geranylgeranyl pyrophosphate synthase reveals a novel hexameric arrangement and inhibitory product binding. J. Biol. Chem., 281, 22004-22012.
Kawata M. et al., 1990. Posttranslationally processed structure of the human platelet protein smg p21B: evidence for geranylgeranylation and carboxyl methylation of the C-terminal cystein. Proc. Natl. Acad. Sci. USA, 87, 8960-8964.
Keeling C. et al., 2013. Frontalin pheromone biosynthesis in the mountain pine beetle, Dendroctonus ponderosae, and the role of isoprenyl diphosphate synthases. Proc. Natl. Acad. Sci. USA, 110, 18838-18843.
Kinjoh T. et al., 2007. Control of juvenile hormone biosynthesis in Bombyx mori cloning of the enzymes in the mevalonate pathway and assessment of their developmental expression in the corpora allata. Insect Biochem. Mol. Biol., 37, 807-818.
Kinsella B.T., Erdman R.A. & Maltese W.A., 1991. Carboxyl-terminal isoprenylation of ras-related GTP-binding proteins encoded by rac1, rac2 and ralA. J. Biol. Chem., 266, 9786-9794.
Kitten G.T. & Nigg E.A., 1991. The CaaX motif is required for isoprenylation, carboxyl methylation, and nuclear membrane association of lamin B2. J. Cell Biol., 113, 13-23.
Kloc M., Reddy B., Crawford S. & Etkin L.D., 1991. A novel 110-kDa maternal CAAX box-containing protein from Xenopus is palmitoylated and isoprenylated when expressed in baculovirus. J. Biol. Chem., 266, 8206-8212.
Kuzuguchi T. et al., 1999. Human geranylgeranyl diphosphate synthase. J. Biol. Chem., 274, 5888-5894.
Lai C. et al., 1998. Quemao, a Drosophila bristle locus, encodes geranylgeranyl pyrophosphate synthase. Genetics, 149, 1051-1061.
Lowe P.N., Sydenham M. & Page M.J., 1990. The Ha-ras protein, p21, is modified by a derivative of mevalonate and methyl-esterified when expressed in the insect/baculovirus system. Oncogen, 5, 1045-1048.
Manne V. et al., 1990. Identification and preliminary characterization of protein-cysteine prenyltransferase. Proc. Natl. Acad. Sci. USA, 87, 7541-7545.
Maurer-Stroh S., Washietl S. & Eisenhaber F., 2003. Protein prenyltransferases. Genome Biol., 4, 212.
Maurer-Stroh S. et al., 2007. Towards complete sets of farnesylated and geranylgeranylated proteins. PLoS Comput. Biol., 3, e66.
Miyagi Y., Matsumura Y. & Sagami H., 2007. Human geranylgeranyl diphosphate synthase is an octamer in solution. J. Biochem., 142, 377-381.
Moores S.L. et al., 1991. Sequence dependence of protein isoprenylation. J. Biol. Chem., 266, 14603-14610.
Ogura T. et al., 2009. Identification and expression analysis of ras gene in silkworm, Bombyx mori. PLoS ONE, 4, e8030.
Park H.W. et al., 1997. Crystal structure of protein farnesyltransferase at 2.25 angstrom resolution. Science, 275, 1800-1804.
Powers S. et al., 1986. RAM, a gene of yeast required for a functional modification of RAS proteins and for production of mating pheromone a-factor. Cell, 47, 413-422.
Rilling H.C., Breunger E., Epstein W.W. & Crain P.F., 1990. Prenylated proteins: the structure of the isoprenoid group. Science, 247, 318-320.
Roskoski R. & Ritchie P., 1998. Role of the carboxyterminal residue in peptide binding to protein farnesyltransferase and protein geranylgeranyltransferase. Arch. Biochem. Biophys., 356, 167-176.
Sagami H., Morita Y. & Ogura K., 1994. Purification and properties of geranylgeranyl-diphosphate synthase from bovine brain. J. Biol. Chem., 269, 20561-20566.
Sakagami Y. et al., 1979. Structure of tremerogen A-10, a peptidal hormone inducing conjugation tube formation in Tremella mesenterica. Agric. Biol. Chem., 43, 2643-2645.
Sen S.E. et al., 2007. Purification, properties and heteromeric association of type-1 and type-2 lepidopteran farnesyl diphosphate synthases. Insect Biochem. Mol. Biol., 37, 819-828.
Sinensky M. & Logel J., 1985. Defective macromolecule biosynthesis and cell-cycle progression in a mammalian cell starved for mevalonate. Proc. Natl. Acad. Sci. USA, 82, 3257-3261.
Vandermoten S. et al., 2008a. Characterization of a novel aphid prenyltransferase displaying dual geranylgeranyl diphosphate synthase activity. FEBS Lett., 582, 1928-1934.
Vandermoten S. et al., 2008b. La biosynthèse des isoprénoides chez les pucerons : une cible potentielle de nouveaux bio-insecticides ? Biotechnol. Agron. Soc. Environ., 12, 451-460.
Vandermoten S. et al., 2009. Structural features conferring dual geranyl/farnesyl diphosphate synthase activity to an aphid prenyltransferase. Insect Biochem. Mol. Biol., 39, 707-716.
Wilkin D.J., Kutsunai S.Y. & Edwards P.A., 1990. Isolation and sequence of the human farnesyl pyrophosphate synthetase cDNA. Coordinate regulation of the mRNAs for farnesyl pyrophosphate synthetase, 3-hydroxy-3-methylglutaryl coenzyme A reductase, and 3-hydroxy-3-3-methylglutaryl coenzyme A synthase by phorbol ester. J. Biol. Chem., 265, 4607-4614.
Yamane H.K. et al., 1991. Membrane-binding domain of the small G protein G25K contains an S-(all-trans-geranylgeranyl)cysteine methyl ester at its carboxyl terminus. Proc. Natl. Acad. Sci. USA, 88, 286-290.
Yeh L.S. & Rilling H.C., 1977. Purification and properties of pig liver prenyltransferase: interconvertible forms of the enzyme. Arch. Biochem. Biophys., 183, 718-725.
Zhang H., Seabra M.C. & Deisengofer J., 2000. Crystal structure of Rab geranylgeranyltransferase at 2.0 Å resolution. Structure, 8, 241-251.






