- Accueil
- Volume 18 (2014)
- numéro 2
- Les indicateurs de la pression du cerf élaphe sur la végétation du sous-bois en forêt feuillue tempérée (synthèse bibliographique)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Les indicateurs de la pression du cerf élaphe sur la végétation du sous-bois en forêt feuillue tempérée (synthèse bibliographique)

Notes de la rédaction
Reçu le 24 septembre 2012, accepté le 8 octobre 2013
Résumé
L’augmentation des populations des grands herbivores au cours de ces dernières décennies affecte de plus en plus la végétation forestière et peut ainsi compromettre la gestion multifonctionnelle des forêts. Afin d’évaluer et de surveiller l'état de cet équilibre sylvo-cynégétique, le gestionnaire doit disposer d'informations fiables sur les objectifs préalablement fixés. Les indicateurs écologiques constituent en ce sens des outils privilégiés pour estimer et suivre cet équilibre. Le présent article propose une revue critique des indicateurs écologiques publiés dans la littérature et utilisés pour caractériser la pression du cerf élaphe (Cervus elaphus L.) sur la végétation du sous-bois en forêt tempérée décidue. Les paramètres de la végétation du sous-bois susceptibles de servir d’indicateurs de changements écologiques sont le recouvrement, la hauteur moyenne, la densité de tiges, la biomasse et la diversité spécifique. Le choix des indicateurs est ensuite discuté en relation avec les plantes indicatrices à partir desquelles ils sont calculés. Certains paramètres sont associés à une ou plusieurs espèces, alors que d’autres le sont à l’ensemble de la végétation du sous-bois. Ces plantes appartiennent à la strate herbacée, à la régénération forestière ou encore à certaines espèces particulières telles que la myrtille (Vaccinium myrtillus L.) et la ronce commune (Rubus fruticosus L.). L’influence de l’appétence sur le choix des plantes indicatrices est également examinée. Ces indicateurs permettent de mieux appréhender les relations entre la biodiversité, la capacité d’accueil du milieu et les populations de cervidés. Par ailleurs, en les confrontant avec les objectifs sylvicoles préalablement fixés, ils constituent pour les gestionnaires forestiers de précieux outils permettant de suivre l’état d’équilibre sylvo-cynégétique.
Abstract
Indicators of red deer pressure on understory vegetation in temperate deciduous forest. A review. During recent decades, populations of large herbivores have increased. Consequently, their pressure on forest vegetation has been exacerbated and, in some forests, has reached levels that have reduced the diversity of forest ecosystem services. Assessing the balance between timber production and hunting remains a crucial question for forest users (foresters, hunters) and requires reliable tools such as ecological indicators. This paper reviews the ecological indicators that characterize the pressure of red deer (Cervus elaphus L.) on understory vegetation in temperate deciduous forest. Such indicators monitor the cover, height, stem density, biomass and species diversity of different indicator plant groups. These plant groups embrace species belonging to the herbaceous stratum, forest regeneration or particular species such as bilberry (Vaccinium myrtillus L.) and bramble (Rubus fruticosus L.). As the choice of indicator plants affects considerably the performance of the ecological indicator of deer pressure on understory vegetation, such decisions must be carried out with caution, taking into account plant abundance and palatability. The reviewed indicators help us to understand the relationship between biodiversity, carrying capacity and deer populations. They are intended for use by forest managers who would like to monitor red deer pressure in relation to forest management goals and forest sustainability.
Table des matières
1. Introduction
1Durant ces dernières décennies, les populations de grand gibier ont considérablement augmenté et dépassent maintenant des niveaux historiques dans de nombreuses régions du monde (Milner et al., 2006). Des conditions climatiques, alimentaires ainsi que des pratiques de gestion favorables ont largement contribué à l’essor de ces populations. En conséquence, la pression exercée sur les peuplements forestiers s’est largement accrue, que ce soit avec les écorcements sur les arbres adultes (Ligot et al., 2013) ou avec les abroutissements sur les jeunes plants forestiers (Reimoser et al., 1996 ; Van Hees et al., 1996 ; Pépin et al., 2006 ; Barančeková et al., 2007 ; Pellerin et al., 2010) et sur la végétation du sous-bois (Melis et al., 2006).
2Les surdensités de cerf élaphe (Cervus elaphus L.) rencontrées en de nombreux endroits peuvent compromettre sérieusement la durabilité de la gestion forestière. Lorsque les densités s’accroissent de manière trop importante, la pression d’herbivorie engendrée augmente également et peut entrainer des conséquences sur la structure et la dynamique des communautés végétales, des pertes économiques et écologiques, voire même empêcher la réalisation de certains objectifs sylvicoles tels que le renouvellement naturel des forêts (Reimoser et al., 1996) en limitant le développement de nombreuses espèces par l’action de l’abroutissement et par la destruction de graines et de jeunes plantules (Oheimb et al., 2005). On parle alors de déséquilibre puisque certains objectifs assignés aux forêts (production ligneuse ou conservation de la nature) sont compromis en raison de la pression exercée par la grande faune. En outre, la durabilité de la gestion forestière est également remise en question, alors que cette notion fait l’objet de certification labellisée, voire d’obligation légale.
3L’évaluation et le suivi au cours du temps de l’état d’équilibre sylvo-cynégétique fait partie intégrante de la gestion adaptative des forêts, ceci suppose l’utilisation d’indicateurs ad hoc. Ces indicateurs doivent renseigner sur les dommages écologiques passés et fournir des signes avant-coureurs de changements écologiques imminents (Dale et al., 2001). Ils constituent ainsi de précieux outils permettant aux gestionnaires de suivre l’état d’équilibre sylvo-cynégétique.
4Pour la gestion des grands ongulés, trois grandes familles d’indicateurs écologiques sont distinguées (Morellet et al., 2007 ; Garel et al., 2010). Ils concernent :
5– la description de la performance des animaux (reproduction, mortalité et qualité phénotypique),
6– l'abondance relative des animaux,
7– l'impact de l’herbivorie sur l’habitat.
8Les limites des indicateurs traduisant la performance et l'abondance relative des animaux sont largement connues et documentées (Williams et al., 2002 ; Morellet et al., 2007). Par contre, les recherches concernant les indicateurs de l'impact de l’herbivorie sur l'habitat sont plus récentes. De plus, ceux-ci constituent des outils plus concrets et facilement utilisables pour les gestionnaires. Dans cet article, nous nous intéressons aux Indicateurs de la Pression du Cerf élaphe sur la Végétation du sous-bois (IPCV) en forêt tempérée décidue. De nombreux auteurs ayant déjà synthétisé les méthodes déployées pour leur mise au point (Dale et al., 2001 ; Morellet et al., 2007), nous nous concentrons sur une approche descriptive et critique de ces indicateurs. En analysant les différentes composantes de ces indicateurs, cette synthèse vise à aider gestionnaires et scientifiques dans l’identification des IPCV les plus pertinents en fonction de différents facteurs environnementaux, de l’état d’équilibre sylvo-cynégétique présumé et de considérations pratiques pour leur mise en œuvre.
9Au début de cette synthèse, nous discutons les deux composantes clefs des IPCV :
10– les variables caractéristiques de l’évolution de la végétation induite par la pression du cerf,
11– les plantes indicatrices sur lesquelles ces variables sont mesurées.
12Ensuite, nous examinons comment l’appétence des plantes indicatrices influence la variabilité des indicateurs correspondants et, par conséquent, leur efficacité. Enfin, l’ensemble de ces caractéristiques nous permettent de discuter du choix des indicateurs, de leur mise en œuvre et d’émettre diverses recommandations de gestion.
2. Paramètres de la végétation du sous-bois influencés par le cerf
2.1. Recouvrement et biomasse
13Par le simple fait de s’alimenter, le cerf peut affecter le recouvrement et la biomasse des plantes. La modification du recouvrement de certaines plantes indicatrices traduit l'évolution de la pression exercée par le cerf (Melis et al., 2006 ; Boulanger et al., 2009 ; Krojerová-Prokesová et al., 2010 ; Iravani et al., 2011). Le recouvrement est donc un indicateur efficace pour mesurer l’impact du cerf sur la végétation.
14L’importance de l’abroutissement peut être quantifiée à partir de méthodes s’appuyant sur les recouvrements. La plupart de ces approches se basent sur la démarche d’Aldous (1944) qui propose de noter le recouvrement des espèces ligneuses ainsi que leur taux d'abroutissement. Par exemple, de mise en œuvre plus complexe, l’indice d’abroutissement moyen est calculé par Boulanger et al. (2009) à partir de mesures couplées de l’abondance et de la proportion d’abroutissement réalisées dans des placettes circulaires de 400 m² disposées systématiquement tous les 10 ha. Au sein de chaque placette, le recouvrement de chaque espèce de la végétation disponible est estimé à l’aide d'une échelle proche de celle de Braun-Blanquet (1964).
15Pour chaque placette j, l'indice d’abroutissement moyen (ABj) est calculé comme suit :
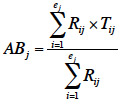
16où Rij est le pourcentage de recouvrement au sol pour chaque espèce i présente dans la placette j ; Tij, le pourcentage des tiges abrouties pour chaque espèce i dans la placette j et ej, le nombre total de taxons présents dans la placette j (Boulanger et al., 2009).
17ABj permet de caractériser au niveau local la pression de l’herbivorie, ainsi que ses variations dans l'espace et le temps (Boulanger et al., 2009). Dans le cas d'un suivi à long terme, c’est également un indicateur des variations des niveaux de population.
18Par l’abroutissement, les cervidés ont également des effets importants sur la biomasse foliaire (Kramer et al., 2003). La biomasse est habituellement exprimée en poids sec (Van Hees et al., 1996 ; Melis et al., 2006). Elle n’a pas fait l’objet d’une validation pour le cerf, mais est acceptée pour d’autres espèces de cervidés. Par exemple, Saïd et al. (2005) ont mis au point une méthode d’estimation de la biomasse aérienne par comptage des feuilles et des tiges afin de quantifier la disponibilité en fourrages pour le chevreuil. La méthode prend en compte les caractéristiques des feuilles (forme, taille et épaisseur) pour estimer, grâce à des relations allométriques, la biomasse de la végétation. Comme la variation de la biomasse dépend du stade de développement de la régénération et des essences présentes dans le milieu (Van Hees et al., 1996), les relations allométriques doivent être calibrées en fonction de la strate de végétation et des espèces du sous-bois rencontrées. L’étalonnage de ces relations est généralement une étape contraignante et reste donc un frein pour l’emploi de la biomasse comme variable caractéristique du changement de la végétation induite par la pression du cerf.
2.2. Hauteur moyenne
19La pression du cerf agit négativement sur la croissance des plantes en consommant les pousses terminales. La hauteur moyenne de certaines plantes est suivie au cours du temps à partir de dispositifs enclos-exclos (Gill, 2000 ; Renaud et al., 2003 ; Lehaire et al., 2013). Cela permet une comparaison de l’évolution des hauteurs moyennes dans les parcelles clôturées (enclos) avec celles ouvertes aux cerfs (exclos). La classe de hauteurs la plus touchée par l’abroutissement dépend fortement de la taille du corps des ongulés présents dans le milieu. Selon les auteurs, l’abroutissement imputable au cerf varie entre 80 et 180 cm de hauteur (Saint-Andrieux et al., 1999 ; Motta, 2003 ; Renaud et al., 2003 ; Barančeková et al., 2007). Les tiges dont la hauteur est supérieure à 180 cm sont donc hors de portée des abroutissements qui touchent la pousse terminale. Cependant, lorsque les plants peuvent être pliés par le cerf ou lors d’une épaisse couverture neigeuse, la limite de la hauteur maximale de référence peut être relevée (Renaud et al., 2003). Dans le cas de la présence simultanée du cerf et du chevreuil Capreolus capreolus L., une forte proportion d’abroutissement au-delà d’un mètre de hauteur signifie une plus forte incidence du cerf par rapport au chevreuil (Prokešova, 2004 ; Barančeková et al., 2007).
2.3. Densité de tiges
20La densité de tiges est réduite sous l’action de l’abroutissement du cerf (Gill et al., 2001 ; Kuijper et al., 2010a) et de sa consommation des graines et des fruits (Gebert et al., 2001). Comme pour la hauteur moyenne, la comparaison de la densité de tiges entre enclos et exclos est habituellement utilisée comme un indicateur écologique intéressant (Kuijper et al., 2010b ; Lehaire et al., 2013).
2.4. Diversité spécifique
21Le cerf a un régime alimentaire varié et variable suivant les saisons (Storms et al., 2006). Lorsque la pression d’herbivorie devient excessive, on peut observer une réduction de la diversité végétale (Gill et al., 2001 ; Frerker et al., 2013 ; Lehaire et al., 2013). Généralement, cette diversité végétale est exprimée en fonction du nombre d’espèces présentes (richesse spécifique) ou encore à partir de variables dérivées telles que l’indice de diversité de Shannon (Shannon et al., 1949).
22Cette perte de diversité est induite par l'abroutissement dirigé préférentiellement vers les espèces les plus appétantes. Pour la régénération, la principale cause de la perte de diversité n’est généralement pas due à la mort directe d’arbres suite à un abroutissement, mais plutôt à cause de leur mortalité indirecte. En effet, le cerf réduit la taille et la croissance en hauteur des jeunes arbres de certaines essences qu’il broute régulièrement. Ces individus restent plus petits que les autres essences moins broutées et finissent par mourir sous l’effet de la concurrence. Dans ces conditions, la diversité spécifique est seulement sensible à la pression de l’herbivorie lorsque celle-ci est soutenue suffisamment longtemps dans le temps.
3. Plantes indicatrices
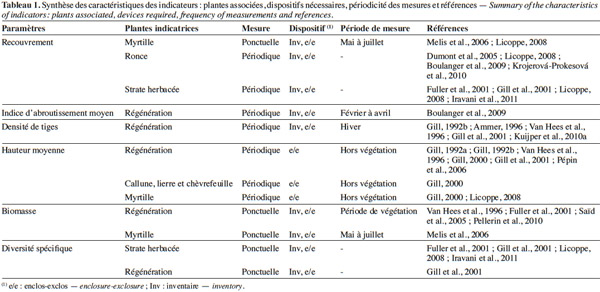
23Le choix des plantes sur lesquelles sont mesurées les variables précédemment décrites est crucial pour caractériser efficacement la pression du cerf. Ce choix doit prendre en compte le comportement alimentaire du cerf, les objectifs sylvicoles, la facilité de la prise de mesure et l’occurrence de ces plantes au sein de l’habitat étudié. Généralement, il est plus pertinent d’utiliser des espèces fréquentes et avec une large amplitude écologique. Ces espèces sont aussi bien des herbacées, des semis de la strate arbustive et arborée (régénération forestière), que d’autres essences non ligneuses (par exemple, la myrtille Vaccinium myrtillus L. et la ronce commune Rubus fruticosus L., tableau 1).
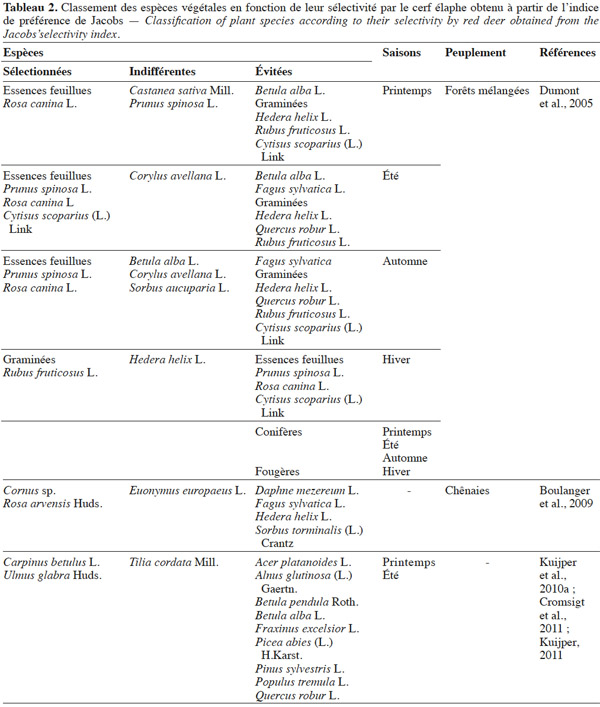
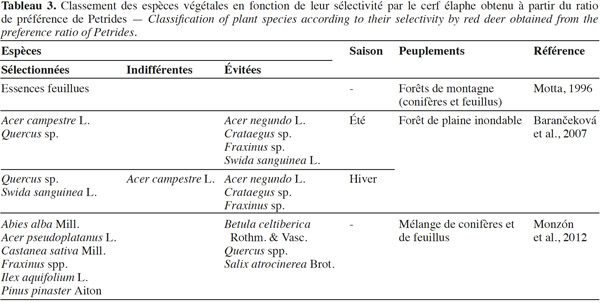
3.1. Strate herbacée
24Les herbacées correspondent à l’ensemble des espèces non ligneuses situées au-dessus de la strate cryptogamique composée de lichens et de mousses et en dessous de la strate arbustive composée d’arbustes et de buissons.
25Les herbacées sont un fourrage important pour les ruminants tels que le cerf (allant jusqu’à 50 % de son alimentation, Gebert et al. [2001]). Le cerf disperse les graines des herbacées grâce aux adaptations d’endozoochorie et d’épizoochorie, affectant ainsi considérablement la dynamique de la végétation (Iravani et al., 2011). Par ces adaptations, le cerf favorise la diversité spécifique et le recouvrement de la strate herbacée (Fuller et al., 2001 ; Gill et al., 2001 ; Licoppe, 2008 ; Iravani et al., 2011). Lorsque les populations de cerfs sont limitées à des niveaux faibles à intermédiaires, l’hypothèse des perturbations intermédiaires propose que ces perturbations induites par ces grands herbivores contribuent parfois à maintenir une plus grande diversité spécifique végétale (Connell et al., 1977), en empêchant les espèces les plus compétitives à dominer, permettant ainsi la coexistence des espèces colonisatrices et compétitrices.
3.2. Régénération
26Les indicateurs concernant la régénération sont directement en lien avec la durabilité de la gestion sylvo-cynégétique car ils évaluent les effets des grands ongulés sur le renouvellement des peuplements et, donc, sur la pérennité de l’état forestier. De plus, comme pour de nombreuses espèces d'ongulés, les jeunes arbres constituent une part importante de l’alimentation du cerf (Gill, 1992b ; Ammer, 1996 ; Gebert et al., 2001). En forêt de plaine, l’alimentation du cerf est composée en moyenne de 71 % de pousses d’essences feuillues (Prokešova, 2004). L’indice d’abroutissement moyen a été testé afin de quantifier l’importance de ces prélèvements. Par l’action de l’abroutissement des semis d'arbres et arbustes, les cerfs ont également tendance à réduire la densité de tiges, la diversité spécifique, la hauteur moyenne et la biomasse, entrainant des changements dans la structure et la composition du milieu favorable à la création d'un sous-étage plus ouvert et le développement des herbacées (Gill et al., 2001 ; Melis et al., 2006).
27Le monitoring de la densité de tiges est très dépendant du stade de développement étudié, car plus les jeunes arbres sont grands, plus ils auront la capacité de survivre à des abroutissements répétés (Gill, 1992b). En outre, la densité de semis semble être moins affectée dans les ouvertures du peuplement, les coupes à blanc ou encore dans les zones fortement éclaircies (Ammer, 1996 ; Van Hees et al., 1996). En général, la densité en ongulés joue un rôle important en matière de recrutement à long terme des espèces d'arbres. Ainsi, dans le parc national de Białowieża, le recrutement total de toutes les espèces d'arbres combinées (nombre de recrues avec un diamètre à hauteur de poitrine supérieur ou égal à 5 cm par hectare et par an) était corrélé négativement avec la densité totale de cerf (Kuijper et al., 2010a).
28Durant la période de végétation, les « feuilles » de la strate arbustive comptent parmi les aliments les plus importants pour les cervidés (Saïd et al., 2005). Le cerf réduit la biomasse en consommant les pousses terminales et latérales ainsi que le feuillage (Gill, 1992a ; Gill, 1992b ; Ammer, 1996 ; Van Hees et al., 1996 ; Fuller et al., 2001 ; Gill et al., 2001).
29Le suivi de la hauteur moyenne évalue directement l’impact des abroutissements sur la croissance en hauteur des semis (Gill, 1992a ; Gill, 1992b ; Van Hees et al., 1996 ; Gill et al., 2001). Par exemple, les cerfs réduisent fortement la hauteur du coudrier Corylus avellana L., du houx Ilex aquifolium L. et du cornouiller Cornus sp. (Gill, 2000). Cette perte de croissance dépend de la sévérité ainsi que de la fréquence des abroutissements, elle peut varier considérablement d’une espèce à l’autre (Gill et al., 2001). Par exemple, le frêne commun Fraxinus excelsior L., le châtaignier Castanea sativa Mill., le chêne pédonculé Quercus robur L. et le merisier Prunus avium L. rencontrent une forte altération de leur croissance, alors que le saule marsault Salix caprea L. admet une forte croissance compensatoire (Pépin et al., 2006). Ainsi, une perte de croissance de 10 cm par an sur la hauteur moyenne des semis d’une essence peut être considérée comme plus ou moins acceptable en fonction de l’essence et du milieu considéré, ainsi que des objectifs poursuivis par les gestionnaires.
30Le résultat de 13 études montre que les cerfs ont tendance à réduire la diversité spécifique de la végétation du sous-bois et que l'effet augmente avec les densités de cervidés (Gill et al., 2001). Une pression d’herbivorie importante peut ainsi imposer des changements à long terme sur la composition des communautés végétales en favorisant certaines essences et en en réduisant d’autres (Gill, 2000 ; Kuijper et al., 2010a ; Pellerin et al., 2010).
3.3. Espèces particulières
31La myrtille est une espèce montrant une large amplitude écologique et présentant la faculté de survivre malgré une forte pression d’abroutissement. Son appétence et son caractère sempervirent la rendent fortement attractive au cours de l’hiver (Melis et al., 2006 ; Licoppe, 2008). En milieu montagneux, la myrtille en présence de baies mûres est également identifiée comme une source importante de nourriture (Krojerová-Prokesová et al., 2010). L’évolution de la hauteur de la myrtille peut être utilisée comme indicateur annuel (Gill, 2000) ou pluriannuel (tous les 3 à 4 ans, Licoppe [2008]). L’utilisation de la myrtille avec les méthodes employant le recouvrement et la biomasse s’est avérée efficace et a permis de distinguer significativement des sites avec un degré de pression de pâturage différent (Melis et al., 2006).
32Le cerf s’alimente de nombreuses ronces Rubus sp. (Krojerová-Prokesová et al., 2010). En hiver, il montre une forte préférence pour la ronce commune allant jusqu’à éviter toutes les autres espèces ligneuses (Dumont et al., 2005). En effet, en hiver, dans les forêts de feuillus tempérées, la disponibilité alimentaire est limitée et la ronce commune a une place importante dans le régime du cerf (Boulanger et al., 2009). Le recouvrement de la ronce semble un indicateur pertinent de l’impact sur la végétation de l’espèce cerf puisqu’il est déjà utilisé pour d’autres espèces de cervidés tels que le daim européen Dama dama L. et le Muntjac de Reeve Muntiacus reevesi Ogilby (Morecroft et al., 2001).
33La hauteur moyenne de plantes de petite taille comme la callune Calluna vulgaris Hull, ainsi que d’espèces plus grandes comme le lierre Hedera helix L. et le chèvrefeuille des bois Lonicera periclymenum L. est réduite par l’action du cerf (Gill, 2000), ce qui permet d’en tenir compte comme indicateur.
4. L’appétence
34La connaissance des préférences alimentaires du cerf est nécessaire pour interpréter les relations entre les populations de cerf et les plantes. L’abroutissement des ongulés peut réduire la proportion d'espèces appétantes favorisant ainsi la dominance des espèces de moindres appétences, mais également des espèces tolérantes aux prélèvements (Kuijper et al., 2010a ; Jensen et al., 2012). Toutefois, certaines espèces appétantes peuvent être favorisées lorsqu’elles sont aussi résistantes à l’abroutissement (Van Hees et al., 1996). À long terme, l’abroutissement par le cerf influence donc la structure, la composition et la dynamique des écosystèmes forestiers (Kuijper et al., 2010a). L’appétence est de ce fait un paramètre dont il faut tenir compte lors du diagnostic de l’équilibre sylvo-cynégétique et du choix des plantes indicatrices.
35Gebert et al. (2001) rassemblent les études traitant de l’alimentation du cerf en Europe qui comptabilisent pas moins de 145 espèces de plantes. Les essences les plus appréciées par le cerf en peuplements feuillus sont les érables Acer spp., le coudrier, la bourdaine Frangula alnus Mill., les frênes Fraxinus spp., le tremble Populus tremula L., le merisier (Pépin et al., 2006), les chênes Quercus spp., les saules Salix spp. et le sorbier des oiseleurs Sorbus aucuparia L. (Motta, 2003 ; Hothorn et al., 2010). Les essences qui se trouvent en revanche être les moins prisées sont les aulnes Alnus spp., les bouleaux Betula spp., les charmes Carpinus spp., le hêtre Fagus sylvatica L. et les tilleuls Tilia spp. (Gill, 1992a). Enfin, certaines caractéristiques peuvent rendre les plants forestiers plus attractifs pour le gibier. C’est le cas des plants produits en pépinière qui sont généralement plus pauvres en fibres et plus riches en sucres ainsi qu’en sels minéraux du fait d’une croissance accélérée (Barančeková et al., 2007).
36Tout d’abord, nous examinons les indices permettant de connaitre l’appétence des plantes selon leur disponibilité dans le milieu, puis nous discutons de l’influence de cette appétence sur le choix des plantes indicatrices.
4.1. Appétence selon la disponibilité du milieu
37Peu d’études ont réussi à mettre en avant le prélèvement de certaines espèces en fonction de la disponibilité dans le milieu (Gebert et al., 2001 ; Boulanger et al., 2009). Cependant, il est indispensable d'inclure cette disponibilité des ressources alimentaires pour obtenir des modèles de dynamique des populations de cerfs fiables (Gebert et al., 2001) et permettre ainsi un suivi de l’équilibre sylvo-cynégétique (Kuijper et al., 2010a ; Cromsigt et al., 2011).
38Les deux indices les plus couramment rencontrés liés à l’appétence des essences par les ongulés selon la disponibilité dans le milieu sont l’indice de préférence de Jacobs (appelé également indice de sélectivité des espèces, Jacobs [1974]) et l’indice de préférence de Petrides (Petrides, 1975). L’indice de Jacobs, qui est une modification de l’indice « Ivlev’s electivity » (Ivlev, 1961), montre en fonction de la disponibilité des espèces, celles qui sont évitées, préférées ou utilisées indifféremment. Cet indice de Jacobs (Si) est défini comme suit :
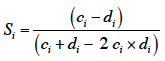
39où ci et di sont respectivement les proportions de l’essence i dans la consommation du cerf et dans la disponibilité relative du milieu étudié (comprises entre 0 et 1). Si varie entre -1 et +1, ce qui permet de classer les espèces en trois groupes (Boulanger et al., 2009) :
40– espèces « sélectionnées » lorsque Si ainsi que la limite inférieure de son intervalle de confiance sont supérieurs à 0 ;
41– espèces « évitées » lorsque Si ainsi que la limite supérieure de son intervalle de confiance sont inférieurs à 0 ;
42– espèces « indifférentes » lorsque l'intervalle de confiance intercepte 0.
43Quant à l’indice de préférence de Petrides, il est obtenu en divisant ci par di. Il est inférieur à l’unité lorsque l’espèce est négligée, alors qu’il est supérieur à 1 lorsque l’espèce est préférée. En outre, une valeur de 0 signifie que l’espèce est complètement évitée, alors qu’une valeur égale à 1 correspond aux espèces « indifférentes ». Plus la valeur de l’indice est élevée, plus le degré d’appétence de l’espèce selon sa disponibilité dans le milieu est important.
44Les tableaux 2 et 3 reprennent les connaissances actuelles concernant la sélectivité des espèces végétales par le cerf obtenues respectivement à partir des indices de préférence de Jacobs et de Petrides.
4.2. Influence de l’appétence sur le choix des plantes indicatrices
45L’appétence est un paramètre important à prendre en compte lors du choix des plantes indicatrices. Lors d’une pression d’herbivorie faible, l’intérêt des espèces appétantes pour le calcul des indicateurs réside dans leur rapidité de réaction par rapport aux variations de pression (Figure 1). Elles sont privilégiées pour estimer la pression du cerf sur son environnement dans le cas d’une situation proche de l’équilibre sylvo-cynégétique. Dans le cas de plantes indicatrices appétantes peu représentées dans le milieu ou encore d’une forte pression du cerf induisant une diminution, voire une raréfaction importante des espèces appétantes, ces indicateurs peuvent devenir inutilisables ou encore présenter un comportement imprévisible (Cromsigt et al., 2011). Dans ces conditions, les paramètres de ces plantes ne pourront pas être pris en considération puisqu’ils induiront une forte variabilité dans la réponse.
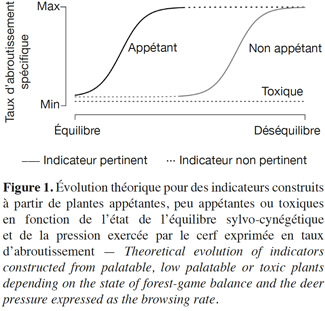
46Par contre, les espèces non appétantes seront à privilégier dans une situation de déséquilibre sylvo-cynégétique (Figure 1). Dans ces conditions, la variabilité des paramètres calculés sur des plantes non appétantes est généralement plus réduite que celle des paramètres calculés sur des plantes appétantes. De cette manière, l’information récoltée est plus précise et plus fiable. D’un autre côté, les plantes non appétantes et rares dans le milieu sont à éviter puisque leur choix mènerait à une augmentation de la variabilité des paramètres.
47Les espèces non appétantes qui ne sont pas consommées (e.g. plante toxique) peuvent également indiquer la pression de l’herbivorie sur la végétation du sous-bois. En effet, selon les traits de vie de ces espèces, la pression du cerf peut favoriser leur développement au détriment des espèces plus appétantes. La densité de tiges, le recouvrement, la biomasse et la diversité spécifique de ces espèces sont corrélés positivement à la pression d’herbivorie. Par contre, dans ce cas précis, le suivi de la hauteur moyenne de ces espèces est à exclure car il dépend peu de la pression de l’herbivorie (plantes toxiques, Figure 1). Notons que des études spécifiques avec des protocoles ad hoc sont requises pour valider les paramètres de ces espèces comme des indicateurs adéquats.
48Le choix des indicateurs ainsi que des plantes indicatrices dépend donc de l’abondance et de l’appétence de ces plantes. Une espèce peu représentée dans le milieu n’est généralement pas utilisée comme plante indicatrice. Lorsque l’état de l’équilibre sylvo-cynégétique n’est pas connu, le juste compromis réside certainement dans la juxtaposition d’indicateurs : par exemple, en suivant la densité des essences appétantes tout en prenant en compte la densité des essences non appétantes.
5. Discussion
5.1. Dispositif de mesure
49Certains indicateurs peuvent être mesurés directement dans le milieu naturel à partir d’inventaire par échantillonnage, mais ils peuvent également être obtenus suite à l’installation de dispositifs enclos-exclos (Tableau 1). Les inventaires par échantillonnage permettent d’obtenir une réponse directe et représentative de l’état de l’équilibre sylvo-cynégétique pour de grands massifs forestiers. Les dispositifs enclos-exclos nécessitent un suivi périodique, particulièrement intéressant pour étudier la croissance de la végétation. Ils permettent également de comparer les indicateurs entre les enclos à densités de cerfs contrôlées et les exclos avec des densités du milieu étudié (Lehaire et al., 2013). Le suivi de ces dispositifs à partir des bioindicateurs constitue une base de comparaison fiable entre ces différentes densités de cerfs, tout en apportant des informations sur l’évolution de la végétation. Ils peuvent servir à déterminer les indicateurs adéquats pour un type de milieu, connaitre la croissance compensatoire de certaines essences suite à un abroutissement ou encore définir l’appétence ainsi que la résistance aux prélèvements de certaines plantes indicatrices. Dans le cas de la régénération, le suivi de la hauteur moyenne peut être mis en relation avec l’accroissement en hauteur théorique obtenu à partir d’enclos qui ne comprennent pas de cerfs.
50L’estimation de certains indicateurs ne nécessite que des mesures ponctuelles. Ces derniers peuvent donc être mis en œuvre lors d’un inventaire par échantillonnage ponctuel, alors que d’autres indicateurs requièrent un mesurage périodique et nécessitent donc le remesurage des placettes inventoriées ou des dispositifs enclos-exclos (Tableau 1). Les indicateurs qui ne nécessitent que des mesures ponctuelles peuvent bien entendu être suivis périodiquement.
5.2. Choix des indicateurs
51Le cerf est classé parmi les grands herbivores comme un mangeur intermédiaire, entre un paisseur (un mangeur de fourrages comme les bovins, les mouflons et les moutons) et un brouteur (mangeur de pousses ligneuses comme l’élan Alces alces L. et le chevreuil, Hofmann [1989] ; Krojerová-Prokesová et al. [2010]). Le cerf s'adapte ainsi aux variations saisonnières tant dans la quantité que dans la qualité des aliments disponibles en se tournant alternativement vers les espèces ligneuses et les plantes herbacées. Un tel régime conduit à recourir à un panel d’indicateurs afin d’appréhender au mieux ces variations spatio-temporelles de la pression de consommation du cerf sur la végétation.
52Les cerfs ont de grands domaines vitaux pouvant englober une grande variété d'habitats (Bruinderink et al., 2003). Pour couvrir cette diversité d’habitats, il convient de privilégier des indicateurs impliquant des espèces largement représentées dans le milieu.
53Selon le milieu étudié, le choix des indicateurs dépendra également de leur facilité de mise en place, du temps nécessaire à leur suivi et de leur variabilité intrinsèque.
5.3. Recommandations de gestion
54Lorsque le déséquilibre sylvo-cynégétique prédit est trop marqué, le premier outil à mettre en œuvre reste la chasse (Hothorn et al., 2010). À des niveaux raisonnables de population, les autres moyens sont principalement l’amélioration de l'habitat et l’aménagement ciblé de zones de quiétude pour les animaux au sein du massif forestier. Pour améliorer l’habitat du cerf, il faut promouvoir une sylviculture privilégiant la diversité de la composition et de la structure du milieu afin d’augmenter la disponibilité des ressources alimentaires du cerf via, par exemple, l’ouverture du couvert de la strate arborée pour apporter de la lumière en sous-étage et ainsi favoriser le développement de la végétation basse (Reimoser et al., 1996 ; Storms et al., 2006).
55Les principes actuels de la gestion forestière, qui intègrent des fonctions à la fois économiques, sociales et environnementales, encouragent la mise en œuvre du processus de certification pour une gestion durable des forêts (Monzón et al., 2012). La première étape consiste à fixer des objectifs explicites, par exemple, en termes de productivité et/ou de qualité des habitats forestiers. Afin d'évaluer si ces objectifs sont atteints, divers indicateurs sont utilisés pour surveiller l’équilibre sylvo-cynégétique. Un indicateur peut cesser d'être valable au cours du temps (par exemple, dans le cas de plantes indicatrices qui se raréfient dans le milieu), dans ce cas il est concevable que les indicateurs ne fassent pas partie intégrante des objectifs eux-mêmes (Morellet et al., 2007).
56C’est pourquoi les indicateurs concernant la régénération sont intéressants puisqu’ils sont directement en lien avec les objectifs sylvicoles. Par exemple, le nombre de tiges permet de connaitre la densité de régénération potentielle présente dans le milieu, alors que la hauteur moyenne et l’indice d’abroutissement mesurent la proportion de dégâts due au cerf sur cette régénération potentielle. Ces observations débouchent sur une évaluation du risque encouru quant au renouvellement des peuplements concernés. La fréquence d’abroutissement des espèces ligneuses est également reflétée par l’indice de consommation (IC = nombre d’espèces abrouties sur nombre d’espèces présentes ; Morellet et al., 2001). Cet IC a fait l’objet d’une validation sur le chevreuil à partir de la méthode de l’indice kilométrique (IK : Morellet et al., 2001). La transposition de l’IC au cas du cerf est envisageable, mais n’a cependant pas encore été publiée.
57D’autres variables devraient être prises en compte dans l’interprétation ou l’analyse des indicateurs, notamment pour appréhender la répartition et la proportion des dommages liés au gibier : par exemple, la proportion de forêt, la fragmentation des habitats, le climat, les caractéristiques du sol à l'échelle du paysage, l’existence de points de nourrissage du gibier, les éléments infranchissables, les lieux de quiétude, etc. La compréhension de l’ensemble de ces variables est encore limitée. D’autres travaux seront nécessaires pour comprendre les relations entre ces variables et l’état d’équilibre sylvo-cynégétique en fonction du niveau d’échelle et du milieu étudié (Morellet et al., 2007 ; Hothorn et al., 2010).
58Remerciements
59La présente étude a été réalisée avec le financement du Service public de Wallonie (Direction générale opérationnelle de l’Agriculture, des Ressources naturelles et de l’Environnement, Département de la Nature et des Forêts) par le biais de l’Accord-Cadre de Recherche et Vulgarisation forestières 2009-2014.
Bibliographie
Aldous S., 1944. A deer browse survey method. J. Mammalogy, 25(2), 130-136.
Ammer C., 1996. Impact of ungulates on structure and dynamics of natural regeneration of mixed mountain forests in the Bavarian Alps. For. Ecol. Manage., 88, 41-53.
Barančeková M., Krojerová-Prokešová J. & Homolka M., 2007. Impact of deer browsing on natural and artificial regeneration in floodplain forest. Folia Zool., 56, 354-364.
Boulanger V. et al., 2009. Ranking temperate woody species along a gradient of browsing by deer. For. Ecol. Manage., 258, 1397-1406.
Braun-Blanquet J., 1964. Pflanzensoziologie. Wien: Springer.
Bruinderink G. et al., 2003. Designing a coherent ecological network for large mammals in northwestern Europe. Conserv. Biol., 17, 549-557.
Connell J. & Slatyer R., 1977. Mechanisms of succession in natural communities and their role in community stability and organization. Am. Nat., 111, 1119-1144.
Cromsigt J. & Kuijper D., 2011. Revisiting the browsing lawn concept: evolutionary interactions or pruning herbivores? Perspect. Plant Ecol. Evol. Syst., 13(3), 207-215.
Dale V. & Beyeler S., 2001. Challenges in the development and use of ecological indicators. Ecol. Indic., 1, 3-10.
Dumont B. et al., 2005. Seasonal variations of red deer selectivity on a mixed forest edge. Anim. Res., 54, 369-381.
Frerker K., Sonnier G. & Waller D., 2013. Browsing rates and ratios provide reliable indices of ungulate impacts on forest plant communities. For. Ecol. Manage., 291, 55-64.
Fuller R. & Gill R., 2001. Ecological impacts of deer in woodland. Forestry, 74, 189-192.
Garel M. et al., 2010. Are abundance indices derived from spotlight counts reliable to monitor red deer Cervus elaphus populations? Wildl. Biol., 16(1), 77-84.
Gebert C. & Verheyden-Tixier H., 2001. Variations of diet composition of red deer (Cervus elaphus L.) in Europe. Mammal Rev., 31, 189-201.
Gill R., 1992a. A review of damage by mammals in north temperate forests: 1. Deer. Forestry, 65, 145-169.
Gill R., 1992b. A review of damage by mammals in north temperate forests: 3. Impact on trees and forests. Forestry, 65, 363-388.
Gill R., 2000. The impact of deer on woodland biodiversity. Edinburgh: Forestry Commission, Information Note.
Gill R. & Beardall V., 2001. The impact of deer on woodlands: the effects of browsing and seed dispersal on vegetation structure and composition. Forestry, 74, 209-218.
Hofmann R., 1989. Evolutionary steps of ecophysiological adaptation and diversification of ruminants: a comparative view of their digestive system. Oecologia, 78, 443-457.
Hothorn T. & Müller J., 2010. Large-scale reduction of ungulate browsing by managed sport hunting. For. Ecol. Manage., 260, 1416-1423.
Iravani M. et al., 2011. Seed dispersal in red deer (Cervus elaphus L.) dung and its potential importance for vegetation dynamics in subalpine grasslands. Basic Appl. Ecol., 12(6), 505-515.
Ivlev V., 1961. Experimental ecology of the feeding of fishes. New Haven, CT, USA: Yale University Press.
Jacobs J., 1974. Quantitative measurement of food selection. A modification of the forage ratio and Ivlev's electivity index. Oecologia, 14, 413-417.
Jensen A., Götmark F. & Löf M., 2012. Shrubs protect oak seedlings against ungulate browsing in temperate broadleaved forests of conservation interest: a field experiment. For. Ecol. Manage., 266, 187-193.
Kramer K., Groen T. & van Wieren S., 2003. The interacting effects of ungulates and fire on forest dynamics: an analysis using the model FORSPACE. For. Ecol. Manage., 181(1), 205-222.
Krojerová-Prokesová J., Baranceková M., Sustr P. & Heurich M., 2010. Feeding patterns of red deer Cervus elaphus along an altitudinal gradient in the Bohemian Forest: effect of habitat and season. Wildl. Biol., 16, 173-184.
Kuijper D., 2011. Lack of natural control mechanisms increases wildlife–forestry conflict in managed temperate European forest systems. Eur. J. For. Res., 130(6), 895-909.
Kuijper D. et al., 2010a. Fluctuating ungulate density shapes tree recruitment in natural stands of the Białowieza Primeval Forest, Poland. J. Veg. Sci., 21, 1082-1098.
Kuijper D. et al., 2010b. Bottom-up versus topdown control of tree regeneration in the Białowieża Primeval Forest, Poland. J. Ecol., 98, 888-899.
Lehaire F., Morelle K., Licoppe A. & Lejeune P., 2013. Les enclos-exclos : une technique éprouvée pour l’évaluation et le monitoring de l’équilibre forêt-grande faune. For. Wallonne, 125, 3-14.
Licoppe A., 2008. Cervidés et biodiversité. For. Wallonne, 94, 3-17.
Ligot G. et al., 2013. Modeling recent bark stripping by red deer (Cervus elaphus) in South Belgium coniferous stands. Ann. For. Sci., 70(3), 309-318.
MelisC. et al., 2006. Impact of red deer Cervus elaphus grazing on bilberry Vaccinium myrtillus and composition of ground beetle (Coleoptera, Carabidae) assemblage. Biodivers. Conserv., 15, 2049-2059.
Milner J.M. et al., 2006. Temporal and spatial development of red deer harvesting in Europe: biological and cultural factors. J. Appl. Ecol., 43, 721-734.
Monzón A., Vaz da Silva S. & Manso F.T., 2012. Integrating the deer (Cervus elaphus) in the Portuguese forests: impacts and new challenges for forest certification. For. Ecol. Manage., 267, 1-6.
Morecroft M., Taylor M., Ellwood S. & Quinn S., 2001. Impacts of deer herbivory on ground vegetation at Wytham Woods, central England. Forestry, 74(3), 251-257.
Morellet N. et al., 2001. The browsing index: new tool uses browsing pressure to monitor deer populations. Wildl. Soc. Bull., 29(4), 1243-1252.
Morellet N. et al., 2007. Indicators of ecological change: new tools for managing populations of large herbivores. J. Appl. Ecol., 44, 634-643.
Motta R., 1996. Impact of wild ungulates on forest regeneration and tree composition of mountain forests in the Western Italian Alps. For. Ecol. Manage., 88, 93-98.
Motta R., 2003. Ungulate impact on rowan (Sorbus aucuparia L.) and Norway spruce (Picea abies (L.) Karst.) height structure in mountain forests in the Eastern Italian Alps. For. Ecol. Manage., 181, 139-150.
Oheimb G., Schmidt M., Kriebitzsch U. & Ellenberg H., 2005. Dispersal of vascular plants by game in Northern Germany. Part II. Red deer (Cervus elaphus). Eur. J. For. Res., 124, 55-65.
Pellerin M. et al., 2010. Impact of deer on temperate forest vegetation and woody debris as protection of forest regeneration against browsing. For. Ecol. Manage., 260, 429-437.
Pépin D. et al., 2006. Relative impact of browsing by red deer on mixed coniferous and broad-leaved seedlings–An enclosure-based experiment. For. Ecol. Manage., 222, 302-313.
Petrides G., 1975. Principal foods versus preferred foods and their relations to stocking rate and range condition. Biol. Conserv., 7, 161-169.
Prokešová J., 2004. Red deer in the floodplain forest: the browse specialist? Folia Zool., 53, 293-302.
Reimoser F. & Gossow H., 1996. Impact of ungulates on forest vegetation and its dependence on the silvicultural system. For. Ecol. Manage., 88, 107-119.
Renaud P.C., Verheyden-Tixier H. & Dumont B., 2003. Damage to saplings by red deer (Cervus elaphus): effect of foliage height and structure. For. Ecol. Manage., 181, 31-37.
Saïd S. et al., 2005. Assessment of forage availability in ecological studies. Eur. J. Wildl. Res., 51, 242-247.
Saint-Andrieux C., Wilmart D. & Bernard S., 1999. Impacts du cerf et du chevreuil sur la régénération naturelle de sapin pectiné. Bull. Mens. Off. Natl Chasse, 247, 12-21.
Shannon C. & Weaver W., 1949. The mathematical theory of communication. Urban, IL., USA: University of Illinois Press.
Storms D. et al., 2006. Influence of hurricane Lothar on red and roe deer winter diets in the Northern Vosges, France. For. Ecol. Manage., 237, 164-169.
Van Hees A., Kuiters A. & Slim P., 1996. Growth and development of silver birch, pedunculate oak and beech as affected by deer browsing. For. Ecol. Manage., 88, 55-63.
Williams B., Nichols J. & Conroy M., 2002. Analysis and management of animal populations. San Diego, CA, USA : Academic Press.






