- Home
- Volume 18 (2014)
- Numéro 1
- Impact du séchage sur la viabilité de Pseudomonas fluorescens (synthèse bibliographique)
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Impact du séchage sur la viabilité de Pseudomonas fluorescens (synthèse bibliographique)

Editor's Notes
Reçu le 26 septembre 2012, accepté le 20 aout 2013
Résumé
Le séchage de Pseudomonas fluorescens rend plus économique sa conservation, son transport et sa commercialisation. Il a pour but d’arrêter et de stabiliser toute activité biologique en vue d’une conservation optimale, compatible avec la préservation d’une viabilité maximale, mais la viabilité des bactéries après séchage dépend des conditions opératoires de ce dernier. L’un des critères les plus importants à considérer lors du séchage de produits biologiquement actifs est la qualité du produit final sec. La lyophilisation est la méthode de séchage la plus utilisée pour Pseudomonas. Après sa production, les bactéries sont récoltées par centrifugation et lyophilisées, mais les changements de température induits par la lyophilisation ne sont pas sans conséquence pour les cellules. Ils sont responsables des altérations cellulaires : une peroxydation des acides gras, une oxydation des protéines et de l’ADN. L’utilisation de composés protecteurs avant la lyophilisation permet de réduire les phénomènes d’oxydation, tout en maintenant une viabilité élevée au cours du stockage.
Abstract
Impact of drying on Pseudomonas fluorescens viability. A review. Drying Pseudomonas fluorescens makes for more economical storage, transportation and marketing. The aim of the drying process is to stop and to stabilize all biological activity for optimal storage, compatible with the conservation of the maximum desired viability of the microorganisms. However, the viability rate of the bacteria after drying depends on the operating conditions of the drying process. One of the most important criteria to consider during the drying of biologically active products is the quality of the final dried product. Freeze-drying is the drying method most commonly used for Pseudomonas fluorescens. After their production, the bacteria are harvested by centrifugation and are freeze-dried, but the changes in temperature induced by freeze-drying are not without consequence for the cells. The freeze-drying process induces cell damage: peroxidation of fatty acids and proteins and DNA oxidation. However, use of protective compounds during freeze-drying and during storage increases significantly the rate of cell viability.
Table of content
1. Pseudomonas fluorescens
1.1. Introduction
1Pseudomonas fluorescens est une bactérie Gram-, fermentant le glucose mais pas le lactose, oxydase positive en forme de bâtonnet avec des flagelles polaires qui lui assurent la mobilité. C’est une bactérie ubiquitaire rencontrée dans les sols, sur les racines des végétaux, sur les plantes, ainsi que dans les eaux douces et marines (Charan et al., 2011). Elle appartient à la classe des Gammaproteobacteria, famille des Pseudomonadaceae et au genre Pseudomonas. La fluorescence est due à la production d’un pigment fluorescent jaune-vert appelé pyoverdine, soluble dans l’eau et insoluble dans le chloroforme (Gao et al., 2012 ; Trögl et al., 2012). Sa température de croissance optimale se situe entre 25 et 30 °C.
1.2. Écologie
2Pseudomonas fluorescens est une espèce commensale chez les plantes, leur permettant d’atteindre les éléments nutritifs indispensables à leur croissance. Cette espèce est connue pour son aptitude à réduire l’incidence des maladies racinaires des plantes, ainsi qu’à inhiber la croissance d’un grand nombre d’agents phytopathogènes (Gao et al., 2012). Les modes d’action de P. fluorescens dans la suppression des maladies des plantes incluent la production de sidérophores (molécules de faibles poids moléculaires ayant une très forte affinité pour l’ion Fe2+) pour la compétition du fer disponible, l’antibiose, la production d’enzymes lytiques et le Système de Résistance Induit (ISR) (Ongena et al., 2005). Dans la plupart des cas d’inhibition, le facteur déterminant est la production d’antibiotiques agissant directement sur l’agent pathogène (Charde et al., 2010). Pseudomonas fluorescens fait partie de la flore d’altération des aliments, elle se développe également en biofilm, ce qui peut poser de sérieux problèmes dans de nombreux domaines (hospitalier et agro-alimentaire), car le biofilm protège les bactéries contre les agents désinfectants. Sa température optimale de croissance est de 29 ± 2 °C à un pH ± 7 (Sillankorva et al., 2008).
1.3. Métabolisme
3Pseudomonas fluorescens a des besoins nutritionnels simples et peut facilement se développer dans des milieux minéraux complétés par une variété de sources de carbone, certaines souches peuvent utiliser l’ion nitrate (NO3-) comme accepteur d’électrons en lieu et place de l’O2. Elle dégrade les polluants et produit des substances telles que :
4– la pyoverdine, l’un des sidérophores les plus importants, responsable de la chélation de fer (Bhattacharya, 2010),
5– certains antibiotiques (2,4-diacetylphloroglucinol, phenazines, pyrrolnitrine, HCN, etc.) qui contribuent à la protection contre les pathogènes (Slininger et al., 2009 ; Anand et al., 2010).
1.4. Caractéristiques de la bactérie Gram- : sa structure membranaire
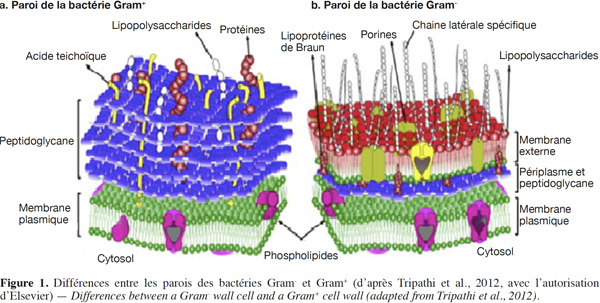
6La paroi cellulaire des bactéries Gram- est fine et élastique ; elle est couverte d’une membrane externe contenant les lipides liés de manière covalente à des polysaccharides, tandis que celle des bactéries Gram+ est épaisse et rigide (Coulibaly et al., 2008 ; Volodymyr, 2011). Les bactéries Gram- ont une couche de peptidoglycane d’environ 5 à 10 nm d'épaisseur entre les membranes plasmiques intérieure et extérieure, tandis que l'épaisseur de cette couche est d'environ 20 à 80 nm chez les bactéries Gram+ (Figure 1) (Beveridge, 1999 ; Tripathi et al., 2012). Les parois cellulaires des bactéries Gram-, avec une couche plus mince de peptidoglycane que celle des bactéries Gram+, ont tendance à se rompre plus facilement pendant les processus de dessiccation et de réhydratation (Pembrey et al., 1999). L’absence d’acide teichoïque chez les bactéries Gram- réduit encore leur résistance au séchage par rapport aux bactéries Gram+. Enfin, la plupart des bactéries Gram- ont des lipopolysaccharides sur leur surface, ces lipopolysaccharides peuvent piéger des molécules d'eau, entrainant une baisse des taux de survie au cours du stockage à long terme (Miyamoto-Shinohara et al., 2008).
1.5. Applications de Pseudomonas fluorescens
7Pseudomonas fluorescens a plusieurs applications, les plus connues concernent l’agriculture où elle est utilisée en lutte biologique et comme stimulateur de croissance des plantes PGPB (Plant Growth Promoting Bacteria) (Ongena et al., 2005 ; Anita et al., 2012 ; Gao et al., 2012). Pseudomonas fluorescens est également utilisée comme catalyseur dans la réaction de transestérification de l’huile de Jatropha pour la production de biodiesel (Devanesan et al., 2007). Pseudomonas fluorescens joue aussi un rôle dans la protection de l’environnement par la dégradation des hydrocarbures et d’autres types de polluants (Moneke et al., 2010). Elle est actuellement étudiée en médecine car elle produit un antibiotique particulier (mupirocine) qui a prouvé son efficacité dans le traitement de certaines maladies de la peau, des troubles oculaires et auditifs (Mazereeuw-Hautier, 2006).
2. Généralités sur le séchage des micro-organismes
2.1. Introduction
8Les souches microbiennes, qu’il s’agisse de bactéries, de levures ou de moisissures, nécessitent un conditionnement stable durant une longue période en vue de leur commercialisation (Zamora et al., 2006). Les cellules microbiennes se conservent rarement à l’état natif dans leur milieu de culture. Leur croissance est souvent réalisée en fermenteur dans un substrat liquide mais conservées dans ce milieu après leur croissance, les cellules y consomment les derniers nutriments disponibles et révèlent, pour la plupart, un métabolisme fermentaire qui nuit à la qualité du produit (modification du pH, émanation d’odeurs, etc.). De plus, les cellules, après avoir épuisé leurs réserves, meurent en grand nombre. Il est donc nécessaire de stabiliser la population microbienne et le séchage des cellules apparait comme une solution pratique (Zhao et al., 2005 ; Coulibaly et al., 2011).
9Le séchage des micro-organismes a pour but de leur assurer une conservation optimale, compatible avec la préservation d’une viabilité maximale et rendre ainsi plus économique leur stockage, leur transport et leur commercialisation (Demirhan et al., 2010). Il existe plusieurs techniques de séchage des micro-organismes appliquées à l’échelle industrielle, à savoir l’atomisation (Coulibaly et al., 2011), la fluidisation (Li et al., 2004) et la lyophilisation (Palmfeldt et al., 2003 ; Zhao et al., 2005 ; Coulibaly et al., 2009). Ces méthodes sont assez agressives vis-à-vis des micro-organismes puisqu’elles soumettent ces derniers à des variations plus ou moins importantes de température et ou de pression. Par ailleurs, des effets liés au flux d’eau à travers les membranes cellulaires peuvent également être déterminants sur la qualité du produit séché (Coulibaly et al., 2011). La littérature indique que de toutes ces techniques, la lyophilisation apparait la plus utilisée en dépit de son cout, pour le séchage et la conservation des bactéries en général et des Pseudomonas spp. en particulier, car elle est adaptée pour les souches sensibles à des températures élevées (Harrison et al., 1963 ; Palmfeldt et al., 2003).
2.2. Impact du séchage sur la viabilité des bactéries
10Les bactéries Gram+ résistent mieux à la lyophilisation, comme les bactéries lactiques (Castro et al., 1995 ; Selmer-Olsen et al., 1999 ; Nanasombat et al., 2007), tandis que leurs homologues Gram-, notamment Pseudomonas et Escherichia coli, sont très sensibles à toute forme de séchage, surtout en l’absence de composés protecteurs (Louis et al., 1994 ; Palmfeldt et al., 2003). Cette différence de résistance au séchage entre les bactéries Gram+ et Gram- est principalement due à la composition de leur paroi cellulaire. Les travaux réalisés par Palmfeldt et al. (2003) et Stephan et al. (2007) ont montré que le fait de récolter les cellules après la phase stationnaire leur permettait de s’adapter aux conditions de stress et d’améliorer leur viabilité après le séchage, tandis que Jørgensen et al. (1994) ont confirmé qu’il était essentiel pour la survie de P. fluorescens que la teneur en eau soit comprise entre 0,2 et 0,4. Ces techniques de séchage entrainent des dommages à la membrane cellulaire, comme une peroxydation lipidique, une dénaturation des protéines et de l'ADN conduisant à une perte de viabilité (Zhao et al., 2005). Les bactéries séchées sont exposées aux différentes réactions d’oxydation au cours de leur conservation. Les composants cellulaires les plus exposés pendant le séchage et la conservation de P. fluorescens sont : la membrane plasmique, les acides gras polyinsaturés, les protéines et le glutathion (Mputu et al., 2012a ; Mputu et al., 2012b).
2.3. Modifications de la structure membranaire
11La structure membranaire est la première cible de la détérioration de l’état physiologique des cellules lors d’une situation de stress (Béal et al., 2008), ce qui conduit à une rupture de la paroi cellulaire (Lievense et al., 1994). Le dommage subi par la membrane cytoplasmique est principalement dû à la déshydratation, ce qui a comme conséquence le relargage en solution des composants intracellulaires (cations, nucléotides, enzymes, protéines, etc.) des cellules lyophilisées au cours de leur réhydratation (Lievense et al., 1994). Les températures élevées modifient les propriétés des molécules hydrophobes (acides gras) de la membrane et les interactions solvant-protéines au cours du séchage. Cela se traduit, entre autres, par une diminution de la stabilité des interactions hydrophobes entre deux molécules apolaires (acides aminés) au sein des membranes, par une modification de la configuration des protéines membranaires pouvant entrainer leur dénaturation (Mazur, 1970) et par la modification de la composition lipidique de la membrane au cours du stockage (Coulibaly et al., 2011). Cette situation de stress pousse les cellules à utiliser leurs propriétés d’auto-défense contre ces phénomènes d’oxydation (productions du glutathion et de la superoxyde dismutate, etc.) (Leslie et al., 1995 ; Luqman et al., 2006). Le glutathion est un tripeptide utilisé comme marqueur du niveau de stress environnemental. Il protège les cellules contre les sous-produits générés par le métabolisme oxydatif en maintenant l’intégrité cellulaire et participe aux principaux processus cellulaires tels que la synthèse des protéines, la régulation de l’activité enzymatique, la synthèse de l’AND, tandis que la superoxyde dismutase détruit les radicaux toxiques aux systèmes biologiques (Leslie et al., 1995 ; Luqman et al., 2006). Chez P. fluorescens, la lyophilisation affecte plus l’intégrité membranaire que la conservation ; cette rupture membranaire se traduit par une perte de viabilité au cours du stockage (Mputu et al., 2012a ; Mputu et al., 2012b).
12Peroxydation lipidique. La peroxydation lipidique est un phénomène général qui se produit en présence d’oxygène. Tous les lipides contenant des acides gras insaturés sont concernés. Coulibaly et al. (2008) ont montré chez les bactéries Gram+ que les acides gras polyinsaturés étaient les premières cibles des attaques des radicaux libres au cours de leur stockage à l’état sec et génèrent des peroxydes lipidiques qui sont très réactifs. Ils ont également établi une relation entre la perte de la viabilité et la diminution du ratio acides gras polyinsaturés/ acides gras saturés (U/S) de cellules de Lactobacillus lyophilisées. Les résultats similaires ont été trouvés pendant la conservation (à 4 °C et 20 °C) et lors du test accéléré d’oxydation des poudres lyophilisées de Pseudomonas fluorescens ; comme pour le Lactobacillus, une relation est établie entre l’oxydation des acides gras polyinsaturés et la mortalité cellulaire (Mputu et al., 2012b ; Mputu, 2013).
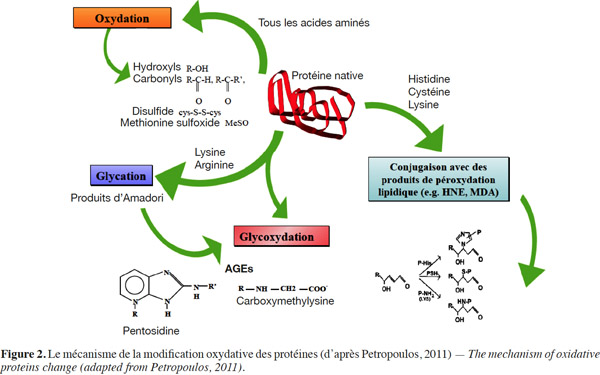
13L’oxydation des protéines. Comme pour les lipides, la lyophilisation et le stockage entrainent des dommages aux protéines, étant donné que leur structure dépend partiellement de l’eau. Ces protéines forment avec l’eau des liaisons qui sont rompues lors de la lyophilisation, conduisant ainsi à leur dénaturation. Les composés carbonyles réactifs tels que le ribose, le diacétyle et le pyruvate doivent être enlevés de la suspension cellulaire avant la lyophilisation parce qu’ils peuvent réagir avec les groupes aminés des composants cellulaires essentiels et rendre ainsi les protéines vulnérables aux phénomènes d’oxydation (Lievense et al., 1994). Les réactions d’oxydation des protéines modifient les résidus d’acides aminés (lysine, arginine, proline et hystidine) et génèrent des fragments carbonylés identifiés comme marqueurs de l’oxydation des protéines (Figure 2) (Luqman et al., 2006 ; Suzuki et al., 2010 ; Jha et al., 2011 ; Wong et al., 2011). Les protéines les plus sensibles aux attaques radicalaires sont surtout celles qui comportent un ou plusieurs groupements sulfhydryles (SH). Leslie et al. (1995) ont montré que les protéines modifiées par oxydation s’insolubilisent et deviennent beaucoup plus sensibles à l'action des protéases. Il a été démontré pour les poudres lyophilisées de Pseudomonas fluorescens que les protéines subissaient une insolubilisation et une oxydation pendant leur conservation à 4 °C comme à 20 °C. Cette oxydation des protéines est mise en évidence par la mesure des groupements carbonyles (Mputu et al., 2012a ; Mputu, 2013).
14Dommage de l’ADN. Bien que les dégâts subis par la membrane cellulaire pendant la lyophilisation jouent un rôle essentiel dans la perte de viabilité, les dommages des composants cellulaires (ADN et ARN) affectent considérablement la viabilité des cellules lyophilisées. L’ADN est très sensible au séchage, comme démontré chez E. coli (Santivarangkna et al., 2007). Les modifications observées après l’oxydation de l’ADN sont très nombreuses, il s’agit entre autres de la conversion des résidus thymine en thymine glycol et en 5-hydroxyméthyluracile, de la guanine en 8-hydroxyguanine, l’oxydation du désoxyribose entraine une coupure des brins.
3. La cryoprotection des bactéries
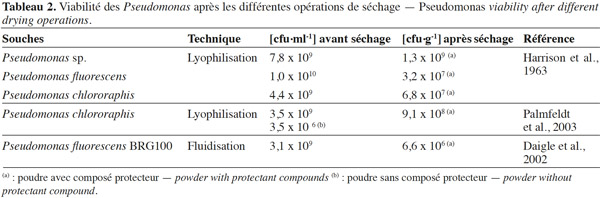
15La lyophilisation a longtemps été considérée comme la technique de déshydratation appropriée pour les bactéries (Palmfeldt et al., 2003 ; Morgan et al., 2006 ; Santivarangkna et al., 2007). Le choix d’un composé protecteur approprié est très important pour assurer une viabilité élevée des bactéries pendant la lyophilisation et au cours du stockage (Lievense et al., 1993 ; Leslie et al., 1995 ; Kawahara, 2008). Ces composés protecteurs doivent être peu volatils, solubles dans l’eau et n’avoir aucun caractère toxique au niveau cellulaire. Ils ont des origines diverses : polyols, sucres, protéines laitières, acides aminés, antioxydants ou macromolécules (Béal et al., 2008). Le tableau 1 nous donne les différentes classes des composés protecteurs. Yao et al. (2009) et Coulibaly et al. (2009) ont prouvé pour les bactéries Gram+ que plus l’activité d’eau est basse, mieux est la conservation des poudres lyophilisées. Dans ce système, l'activité de l’eau influence les réactions d’oxydation des lipides, car l'eau favorise la formation des substances pro-oxydantes. En général, une activité de l’eau (aw) comprise entre 0,2 et 0,3 correspond aux vitesses d’oxydation les plus faibles. Par contre, une aw comprise entre 0,6 et 0,8 correspond aux vitesses d’oxydation les plus grandes (Coulibaly et al., 2011). Mputu et al. (2012) et Mputu (2013) ont démontré que l’utilisation des composés protecteurs (glycérol et maltodextrine) avant la lyophilisation permet de maintenir une viabilité remarquable à la fin de la lyophilisation et au cours du stockage de Pseudomonas fluorescens. De nombreux auteurs dont Palmfeldt et al. (2003) et Stephan et al. (2007) ont mis en évidence l’apport des composés protecteurs sur la viabilité de Pseudomonas lors des opérations de séchage (Tableau 2).

4. Conclusion
16La lyophilisation reste, à ce jour, la technique la mieux adaptée pour le séchage et la conservation de P. fluorescens, car elle permet l’obtention d’une poudre ayant une viabilité assez élevée, comparativement à celle obtenue par atomisation ou par fluidisation. Les conditions opératoires d’obtention et de conservation d’une poudre ayant une meilleure activité métabolique sont relativement bien connues chez les bactéries Gram+, mais pas chez les Gram-. Cependant, les mécanismes de leur altération restent obscurs à ce jour. La connaissance de certains paramètres responsables de la perte de viabilité de P. fluorescens pendant leur lyophilisation et au cours de leur stockage permettra de résoudre le problème lié à leur conservation et aussi à leur transport. Dans le souci d’optimiser la conservation de la poudre lyophilisée de P. fluorescens, certaines techniques et voies de recherches doivent être explorées. Nous retenons, parmi elles, l’étude des modifications subies par les structures cellulaires au cours des traitements de séchage et de conservation (l’oxydation de l’ADN) ainsi que l’utilisation d’un emballage adéquat (imperméable à la lumière et à l’oxygène).
17Abréviations
18ADN : Acide Désoxyribonucléique
19aw : Activité d’eau
20CPE : Cryoprotecteur extracellulaire
21CPI : Cryoprotecteur intracellulaire
22ERO : Espèces Réactives d’Oxygènes
23HCN : Cyanure d’hydrogène
244-HNE : 4-hydroxynonénal
25ISR : Système de Résistance Induit
26MDA : Malondialdéhyde
278-oxodGuo : 8-oxo-7,8-dihydro-2’deoxyguanosine
28Remerciements
29Nous remercions très sincèrement la Coopération Technique Belge (CTB) et Wallonie Bruxelles International (WBI) pour leur soutien financier.
Bibliographie
Anand R. & Kulothungan S., 2010. Antifungal metabolites of Pseudomonas fluorescens against crown rot pathogen of Arachis hypogaea. Ann. Biol. Res., 1, 199-207.
Anita B. & Samiyappan R., 2012. Induction of systemic resistance in rice by Pseudomonas fluorescens against rice root knot nematode Meloidogyne graminicola. J. Biopesticides, 5, 53-59.
Béal C. et al., 2008. Production et conservation des ferments lactiques et probiotiques. In : Corrieu G. & Luquet F.-M., eds. Bactéries lactiques, de la génétique aux ferments. Paris : Tec & Doc Lavoisier, 661-785.
Beveridge T.J., 1999. Structures of Gram-negative cell walls and their derived membrane vesicles. J. Bacteriol., 181, 4725-4733.
Bhattacharya A., 2010. Siderophore mediated metal uptake by Pseudomonas fluorescens and its comparison to iron (iii) chelation. Ceylon J. Sci. (Biol. Sci.), 39, 147-155.
Castro H.P., Teixeira P.M. & Kirby R., 1995. Storage of lyophilized cultures of Lactobacillus bulgaricus under different relative humidities and atmospheres. Appl. Microbiol. Biotechnol., 44, 172-176.
Charan A.R. et al., 2011. Assessment of genetic diversity in Pseudomonas fluorescens using PCR-based methods. Biorem. Biodivers. Bioavailability, 5, 10-16.
Charde A. & Dawande A.Y., 2010. Purification and characterization of proteinaceous compound from Pseudomonas fluorescens (ATCC 948). Asiatic J. Biotechnol. Resour., 1, 20-22.
Coulibaly I., Dauphin D.R., Destain J. & Thonart P., 2008. Characterization of lactic acid bacteria isolated from poultry farms in Senegal. Afr. J. Biotechnol., 7, 2006-2012.
Coulibaly I., Yao A.A., Lognay G. & Fauconnier M.-L., 2009. Survival of freeze-dried of Leuconostoc mesenteroides and Lactobacillus plantarum related to their cellular fatty acids composition during storage. Appl. Biochem. Biotechnol., 157, 70-84.
Coulibaly I. et al., 2011. Techniques de séchage des starters lactiques et mécanismes affectant la viabilité cellulaire suite à la lyophilisation. Biotechnol. Agron. Soc. Environ., 15, 287-299.
Daigle D.J., Connick W.J. & Boyetcheko S.M., 2002. Formulating a weed-suppressive bacterium in "Pesta". Weed Technol., 16, 407-13.
Demirhan E. & Özbek B., 2010. Drying kinetics and effective moisture diffusivity of purslane undergoing microwave heat treatment. Korean J. Chem. Eng., 27, 1377-1383.
Devanesan M.G., Viruthagiri T. & Sugumar N., 2007. Transesterification of Jatropha oil using immobilized Pseudomonas fluorescens. Afr. J. Biotechnol., 6, 2497-2501.
Gao G. et al., 2012. Effect of biocontrol agent Pseudomonas fluorescens 2P24 on soil fungal community in cucumber rhizosphere using T-RFLP and DGGE. PlosOne, 7, e31806, doi:10.1371/journal.pone.0031806.
Harrison A.P. & Pelczar M.J., 1963. Damage and survival of bacteria during freeze-drying and during storage over a ten-year period. J . Gen. Microbiol., 30, 395-400.
Jha R. & Rizvi S.I., 2011. Carbonyl formation in erythrocyte membrane proteins during aging in humans. Biomed. Pap., 155, 1-4.
Jørgensen F., Nybroe O. & Knøchel S., 1994. Effect of starvation and osmotic stress on viability and heat resistance of Pseudomonas fluorescens AH9. J. Appl. Microbiol., 77, 340-347.
Kawahara H., 2008. Cryoprotectants and ice-binding proteins. In: Margesin R. et al., eds. Psychrophiles: from biodiversity to biotechnology. Berlin, Heidelberg, Germany: Springer-Verlag, 229-243.
Leslie S.B. et al., 1995. Trehalose and sucrose protect both membranes and proteins in intact bacteria during drying. Appl. Environ. Microbiol., 61, 3592-3597.
Li J. et al., 2004. Fluidized-bed drying of biological materials: two cases studies. Chin. J. Chem. Eng., 12, 840-842.
Lievense L.C. & van't Riet K., 1993. Convective drying of bacteria. The drying process. Adv. Biochem. Eng. Biotechnol., 50, 45-63.
Lievense L.C. & van't Riet K., 1994. Convective drying of bacteria. Factors influencing survival. Adv. Biochem. Eng. Biotechnol., 51, 71-89.
Louis P., Trüper H.G. & Galinski E.A., 1994. Survival of Escherichia coli during drying and storage in the presence of compatible solutes. Appl. Microbiol. Biotechnol., 41, 684-688.
Luqman S. & Rizvi S.I., 2006. Protection of lipid peroxidation and carbonyl formation in proteins by capsaicin in human erythocytes subjected to oxidative stress. Phytotherapy Res., 20, 303-306.
Mazereeuw-Hautier J., 2006. Formation médicale continue : impétigo. Ann. Dermatologie Vénéréologie, 133, 194-207.
Mazur P., 1970. The freezing of biological systems. Cryobiology, 168, 939-949.
Miyamoto-Shinohara Y., Sukenobe J., Imaizumi T. & Nakahara T., 2008. Survival of freeze-dried bacteria. J. Gen. Appl. Microbiol., 54, 9-24.
Moneke A.N., Okpala G.N. & Anyanwu C.U., 2010. Biodegradation of glyphosate herbicide in vitro using bacterial isolates from four rice fields. Afr. J. Biotechnol., 9, 4067-4074.
Morgan C.A., Herman N., White P.A. & Vesey G., 2006. Preservation of microorganisms by drying. J. Microbiol. Methods, 66, 183-193.
Mputu K. J.-N. et al., 2012a. Effects of glycerol on Pseudomonas fluorescens BTP1 freeze-dried. Int. J. Biotechnol. Biochem., 8, 245-258.
Mputu K. J.-N. et al., 2012b. Impact of protective compounds on the viability, physiological state and lipid degradation of freeze-dried Pseudomonas fluorescens BTP1 during storage. Int. J. Biotechnol. Biochem., 8, 17-26.
Mputu K. J.-N., 2013. Optimisation of production of Pseudomonas fluorescens. Accelerated study of storage and oxidation test. Saarbrücken, Germany: Lambert Academic Publishing.
Nanasombat S. & Sriwong N., 2007. Improving viability of freeze-dried lactic acid bacteria using lyoprotectants in combination with osmotic and cold adaptation. KMITL Sci. Technol. J., 7, 61-67.
Ongena M. et al., 2005. Isolation of an N-alkylated benzylamine derivative from Pseudomonas putida BTP1 as elicitor of induced systemic resistance in bean. Mol. Plant-Microbe Interact., 18, 562-569.
Palmfeldt J., Radström P. & Hahn-Hägerdal B., 2003. Optimisation of initial cell concentration enhances freeze-drying tolerance of Pseudomonas chlororaphis. Cryobiology, 47, 21-29.
Pembrey R.S., Marshall K.C. & Schneider R.P., 1999. Cell surface analysis techniques: what do cell preparation protocols do to cell surface properties? Appl. Environ. Microbiol., 65, 2877-2894.
Petropoulos I., 2011. Stress oxydant et vieillissement. Module de gérontologie fondamentale. Cours de Biologie cellulaire. Paris : Université Pierre et Marie Curie.
Santivarangkna C., Wenning M., Foerst P. & Kulozik U., 2007. Damage of cell envelope of Lactobacillus helveticus during vacuum drying. J. Appl. Microbiol., 102, 748-756.
Selmer-Olsen E., Birkeland S.-E. & Sorhaug T., 1999. Effect of protective solutes on leakage from and survival of immobilized Lactobacillus subjected to drying, storage and rehydration. J. Appl. Microbiol., 87, 429-437.
Sillankorva S., Neubauer P. & Azeredo J., 2008. Pseudomonas fluorescens biofilms subjected to phage phiIBB-PF7A. BMC Biotechnol., 8, 79-91.
Slininger P.J., Dunlap C.A. & Schisler D.A., 2009. Polysaccharide production benefits dry storage survival of the biocontrol agent Pseudomonas fluorescens S11:P:12 effective against several maladies of stored potatoes. Biocontrol Sci. Technol., 20(3), 227-244.
Stephan D., Bisutti I.L., Matos da Silva A.-P. & Covi J., 2007. Optimisation of the freeze-drying process of Pseudomonas fluorescens strains Pf 153 and CHA0. IOBC WPRS Bull., 30, 511-515.
Suzuki Y.J., Carini M. & Butterfield D.A., 2010. Protein carbonylation. Antioxid. Redox Signaling, 12, 323-325.
Tripathi P. et al., 2012. Towards a nanoscale view of lactic acid bacteria. Micron, 43, 1323-1330.
Trögl J. et al., 2012. Pseudomonas fluorescens HK44: lessons learned from a model whole-cell bioreporter with a broad application history. Sensors, 12, 1544-1571.
Volodymyr I., 2011. Bioagents of environmental and engineering bioprocesses. In: Environmental microbiology for engineers. Boca Raton, FL, USA: CRC Press, 89-98.
Wong W. et al., 2011. Spread of Pseudomonas fluorescens due to contaminated drinking water in a bone marrow transplant unit. J. Clin. Microbiol., 49, 2093-2096.
Yao A.A., Wathelet B. & Thonart P., 2009. Effect of protective compounds on the survival, electrolyte leakage and lipid degradation of freeze-dried Weissella paramesenteroides LC11 during storage. J. Microbiol. Biotechnol., 19, 810-817.
Zamora L.M., Carretero C. & Parés D., 2006. Comparative survival rates of lactic acid bacteria isolated from blood, following spray-drying and freeze-drying. Food Sci. Technol. Int., 12, 77-84.
Zhao G. & Zhang G., 2005. Effect of protective agents, freezing temperature, rehydration media on viability of malolactic bacteria subjected to freeze-drying. J. Appl. Microbiol., 99, 333-338.






