- Startpagina tijdschrift
- Volume 18 (2014)
- Numéro 1
- Caractérisation des phénomènes d’auto-floculation, de bio-floculation et de co-floculation des microalgues dans un chenal algal à haut rendement (synthèse bibliographique)
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Caractérisation des phénomènes d’auto-floculation, de bio-floculation et de co-floculation des microalgues dans un chenal algal à haut rendement (synthèse bibliographique)

Nota's van de redactie
Reçu le 8 janvier 2013, accepté le 20 aout 2013
Résumé
La récupération des microalgues est l'une des principales préoccupations technologiques et économiques dans un Chenal Algal à Haut Rendement du fait de leur petite taille, de leurs charges de surface négatives et de leur faible densité. Les techniques usuelles de récupération (par exemple, la centrifugation) ont des couts énergétiques prohibitifs au regard de la valeur des produits. Dans le contexte de la production des algues combinée aux traitements des eaux usées, il est souhaitable de récupérer ces algues à faible cout. L'auto-floculation, la bio-floculation et la co-floculation sont des processus de récupération des microalgues qui présentent l'avantage d'être peu couteux, efficaces, durables et fiables. Ces procédés (naturels) pourraient être une alternative aux problèmes rencontrés par les techniques habituelles de récolte des microalgues. Dans cet article, une revue de la littérature est effectuée sur la détermination des théories et des mécanismes de ces trois méthodes de récupération de microalgues, puis sur la caractérisation des conditions physico-chimiques nécessaires à leur réalisation. Cette synthèse pourrait faire progresser les connaissances sur certains des processus évoqués dans la littérature et servir de base pour une gestion optimale des réacteurs afin d’aboutir de façon efficace à ces méthodes.
Abstract
Auto-flocculation, bio-flocculation and co-flocculation of microalgae. A review. Recovery of microalgae is one of the main technological and economic concerns in a High Rate Algal Pond because of the small size, the negative surface charges and the low density of these microalgae. Usual recovery techniques (e.g. centrifugation) carry prohibitive energy costs with respect to the final value of products. Moreover, efficient recovery techniques (i.e., those that are natural, sustainable and low cost) are of great interest in waste water treatment processes. In this article, a literature review is conducted in order to identify the theories and mechanisms of three methods used for microalgae recovery (i.e. auto-flocculation, bio-flocculation and co-flocculation), and the characterization of physico-chemical conditions necessary for their implementation. This review could advance the current knowledge regarding some of the processes discussed in the literature and provide a basis for the optimal management of reactors in order to achieve efficient results using these methods.
1Le Chenal Algal à Haut Rendement (CAHR) est un système biologique de traitement des eaux usées basé sur la symbiose entre microalgues et bactéries (Gutzeit et al., 2005). Les caractéristiques particulières dans ce système telles que la faible profondeur, le faible temps de séjour et l’agitation mécanique, combinées à la présence d’énergie lumineuse et d’ions inorganiques dans l’effluent, sont les principaux facteurs favorisant le développement intensif de microalgues (Lavoie et al., 1984 ; Borowitzka, 1986 ; El Halouani, 1990 ; Dekayir, 2008). Le rejet de l’effluent issu du CAHR sans récupération préalable des microalgues est nuisible à l’ensemble des écosystèmes naturels en général, et plus particulièrement aux ressources biologiques terrestres et aquatiques. En effet, la dégradation des microalgues mortes entraine une diminution de la teneur en oxygène dissous, facilitant ainsi l’établissement de conditions d’anaérobiose (Rance-Bare et al., 1975 ; Friedman et al., 1977). Dans ce contexte, la récolte des microalgues issues du CAHR constitue un enjeu majeur. En outre, cette récupération permettrait non seulement une réutilisation plus simple de la fraction liquide en irrigation (Lavoie et al., 1984 ; El Halouani, 1990 ; Grima et al., 2002 ; Pulz et al., 2004 ; Spolaore et al., 2006), mais également leur revalorisation à des fins alimentaires ou d’extraction de sous-produits à valeurs ajoutées (Bouarab et al., 2004 ; Bouarab et al., 2005 ; Cadoret et al., 2008 ; Ahmad et al., 2011 ; Chen et al., 2011 ; Christenson et al., 2011 ; Wu et al., 2012 ; Zheng et al., 2012). Toutefois, leur petite taille, leurs faibles densités et concentrations rencontrées dans le CAHR, comparées à celles de bioréacteurs industriels, soulève un problème de rentabilité économique pour leur récupération (Lavoie et al., 1984 ; Lavoie et al., 1987 ; Pieterse et al., 1997 ; Grima et al., 2002). Différentes techniques de récupération des microalgues, aussi bien physiques (filtration, centrifugation, flottation, décantation) que chimiques (coagulation, floculation) existent. Bien qu’efficaces, ces techniques s’avèrent être économiquement moins rentables, avec des couts énergétiques prohibitifs et parfois une contamination des microalgues récoltées (Golueke et al., 1965 ; Lavoie et al., 1987 ; Sim et al., 1988 ; Grima et al., 2002). Plusieurs études ont en outre montré que la récolte des microalgues représente plus de 30 % du cout total dans les systèmes de production algale (Zittelli et al., 2006 ; Salim et al., 2010). Dans ce cadre, le rassemblement spontané de flocs de microalgues photosynthétiquement actives (auto-floculation), l’adsorption entre les molécules organiques et les cellules algales (bio-floculation) et l’agrégation entre les cellules algales et les cellules bactériennes (co-floculation) se présentent comme des solutions prometteuses de récupération des microalgues (Sukenik et al., 1984 ; Sukenik et al., 1985 ; Gutzeit et al., 2005 ; Salim et al., 2010). Pourtant, compte tenu des difficultés de caractérisation, peu d'études, à notre connaissance, ont été menées pour une vérification plus systématique de ces méthodes. Dans cet article, une synthèse bibliographique est effectuée sur :
2– l’identification des théories et mécanismes qui gouvernent ces trois méthodes biologiques de récupération des microalgues,
3– la détermination et l’analyse des conditions physico-chimiques nécessaires à leur réalisation.
4Cette étude pourrait faire progresser les connaissances sur certains des processus évoqués dans la littérature. En outre, elle présente certaines limites des méthodes biologiques et ouvre la voie à des recherches pour optimiser davantage ces méthodes. En ce sens, cet article de synthèse pourrait être une première étape dans la gestion optimale des réacteurs afin d’aboutir de façon efficace à ces méthodes biologiques de récolte des microalgues.
5Le lagunage dont fait partie le Chenal Algal à Haut Rendement (CAHR) est un système d’épuration très répandu de traitement biologique des eaux usées. Il s’agit de bassins, exposés à l’air libre et destinés aux traitements biologiques des eaux domestiques usées. Il stimule, en l’amplifiant, l’action auto-épuratrice des étangs et lacs (Edeline, 1997). Le CAHR est un bassin rectangulaire subdivisé en plusieurs pistes de faible profondeur dans lesquelles l’eau circule grâce à une agitation mécanique permanente pour obtenir une vitesse moyenne de 0,15 m·s-1 à 0,3 m·s-1 (Figure 1) (Craggs, 2005). Le CAHR est un système qui, en plus de l’épuration des eaux usées, en raison de l’importante efficacité d’assimilation de l’azote et du phosphore par les microalgues (Sukenik et al., 1984 ; El Halouani, 1990), permet une production importante de biomasse algale (El Halouani, 1990 ; Dekayir, 2008).
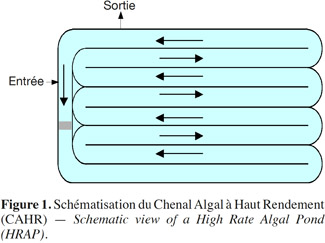
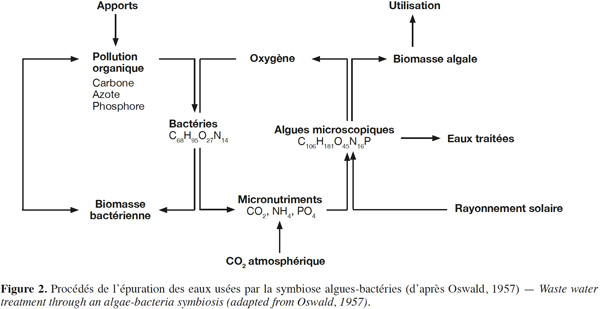
6Ce système d’épuration repose essentiellement sur la symbiose qui s’établit entre algues photo-autotrophes et bactéries hétérotrophes (Gutzeit et al., 2005). La figure 2 donne un aperçu des procédés d'épuration des eaux usées par la symbiose algues-bactéries. L'épuration aérobie est assurée essentiellement par les bactéries hétérotrophes. Ces bactéries hétérotrophes dégradent la matière organique pour la transformer en dioxyde de carbone (CO2), en azote ammoniacal et en phosphates nécessaires au développement des microalgues (Gutzeit et al., 2005). Grâce à la fonction chlorophyllienne, les microalgues synthétisent la matière organique à partir de l’énergie solaire, du gaz carbonique et des sels dissous en libérant de l'oxygène qui peut être consommé par les bactéries minéralisantes (Gutzeit et al., 2005).
7Les techniques physico-chimiques de récupération des microalgues ont des couts énergétiques prohibitifs au regard de la valeur des produits. Dans le contexte de la production des algues combinée avec un traitement des eaux usées, il est souhaitable de récupérer ces algues à faible cout. L'auto-floculation, la bio-floculation et la co-floculation, qui présentent l'avantage d'être peu couteux, efficaces, durables et fiables, pourraient être une alternative aux problèmes rencontrés par les techniques habituelles.
8Théories et mécanismes. Dans le CAHR, le principal processus qui gouverne l’auto-floculation est la précipitation et l’adsorption de sels inorganiques à la surface des microalgues suite à l'augmentation de pH liée à la consommation du CO2 pendant l’activité photosynthétique des microalgues (Sukenik et al., 1985 ; Benemann et al., 1996 ; Christenson et al., 2011). Les précipités formés ont une charge de surface positive qui permet leur adsorption et la neutralisation stœchiométrique des charges négatives à la surface des microalgues (Sukenik et al., 1984 ; El Halouani, 1990 ; Baya, 2012). Toutefois, les précipités impliqués dans l’auto-floculation varient selon les auteurs. Il s’agit entre autres des phosphates, des carbonates de magnésium et de calcium (Benemann et al., 1980), des phosphates de calcium et formes substituées (Sukenik et al., 1984 ; Sukenik et al., 1985 ; Lavoie et al., 1987 ; Baya, 2012) et des hydroxydes de magnésium (Vandamme et al., 2011 ; Smith et al., 2012 ; Wu et al., 2012). Les phosphates de calcium et leurs formes substituées, d’une part, et les hydroxydes de magnésium, d'autre part, sont cependant les composés les plus fréquemment cités dans la littérature. Par ailleurs, la théorie de Ostwald-Gay Lussac, généralement admise, établit que la forme thermodynamique la moins stable, donc la plus soluble, est souvent la plus facilement précipitable (Molle, 2003). Dans ces conditions, l'ordre de formation de précipités de phosphate de calcium serait d’abord la formation de phosphate dicalcique, puis celle du phosphate tricalcique et du phosphate octacalcique, et enfin celle de l’hydroxyapatite. Cependant, en milieu complexe, les apatites substituées, de mêmes structures que les apatites pures, peuvent se former (Heughebaert et al., 1990 ; Zawacki et al., 1990 ; Baya, 2012). En outre, une augmentation du pH entrainerait également une diminution de la concentration en Mg2+ dans le milieu de culture et une augmentation des teneurs de magnésium dans les flocs de microalgues (Vandamme et al., 2011 ; Smith et al., 2012). Ces auteurs ont montré que le Mg2+ présent dans le milieu pourrait s’hydrolyser pour former un précipité d'hydroxyde de magnésium de charge positive, qui neutralise les charges négatives de microalgues et provoque la formation de flocs de microalgues.
9Conditions physico-chimiques de l’auto-floculation. Plusieurs études ont montré que la précipitation des phosphates de calcium constituait le moteur de l’auto-floculation (Sukenik et al., 1984 ; Sukenik et al., 1985 ; Lavoie et al., 1987 ; Baya et al., 2009 ; Baya, 2012). Cependant, les concentrations en ions Ca2+ et PO43- ainsi que les plages de pH diffèrent d’un auteur à un autre. Le tableau 1 présente une synthèse des concentrations en Ca2+, PO43-, pH auxquels apparait le phénomène d’auto-floculation, de même que les taux de récupération des microalgues qui y sont liés.
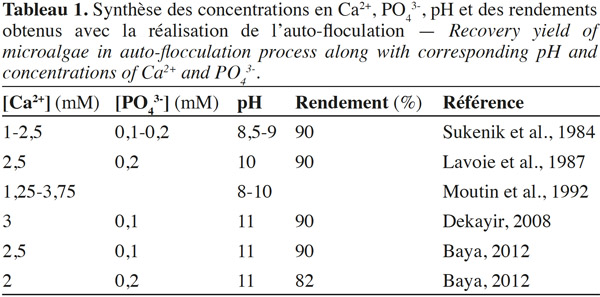
10Les conditions alcalines (pH variant entre 8,5 et11) résultantes de la forte activité photosynthétique et des plages de concentration variant entre 0,1 mM et 0,2 mM pour le PO43-, et 1 mM et 3 mM en Ca2+ (Tableau 1), causent une précipitation de phosphates de calcium (ou formes substituées) et affectent les charges négatives des microalgues (Sukenik et al., 1985 ; Moutin et al., 1992 ; Baya, 2012).
11Baya et al. (2013) ont montré que des ratios optimums de 0,33 Ca5(PO4)OH·g-1 MVS algal à pH 10, 0,11 Ca4H(PO4)·3 g-1 MVS algal à pH 7 et 0,23 Ca3(PO4)2·g-1 MVS algal à pH 9 sont requis pour la réalisation de l’auto-floculation des microalgues dans un CAHR. Ces résultats ont été obtenus pour une suspension algale (MES : 380 mg·l-1) constituée à 99,2 % de Chlorella vulgaris, 0,3 % de Chlamydomonas sp. et 0,5 % de Scenedesmus sp. Toutefois, les conditions expérimentales, la nature, l’âge et l’état physiologique des microalgues (par exemple, pour des microalgues d’eau douce, des interférences dues aux exo-polysaccharides peuvent inhiber l’auto-floculation pendant la phase stationnaire de croissance) sont des facteurs qui pourraient influencer fortement le processus d’auto-floculation (Lavoie et al., 1987).
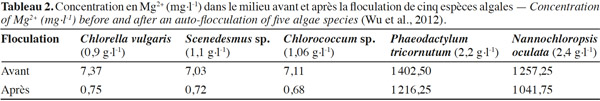
12Vandamme et al. (2011), Smith et al. (2012) et Wu et al. (2012) ont identifié par contre l’hydroxyde de magnésium, Mg(OH)2, comme responsable de la floculation des microalgues. Des rendements de récolte de l’ordre de 90 % sont obtenus à pH > 9,5 pour les microalgues marines (Phaeodactylum tricornutum, 1,8 g·l-1 ; Nannochloropsis oculata, 1,6 g·l-1) et à pH > 10,5 dans le cas des microalgues d’eau douce (Chlorella vulgaris, 0,68 g·l-1 ; Scenedesmus sp., 0,75 g·l-1 ; Chlorococcum sp., 0,77 g·l-1). L’auto-floculation se produit donc, pour les microalgues marines, à un pH inférieur que celui des microalgues d’eau douce en raison de la forte concentration de Mg2+ en milieu marin. La chute considérable des concentrations en Mg2+ (Tableau 2) dans le milieu de culture indique bien que cet ion joue un rôle important dans le processus d’auto-floculation. Toutefois, une concentration minimale de 0,1 mM en Mg2+ (Vandamme et al., 2010) dans l’eau et des pH aux alentours de 10,5 sont nécessaires pour la formation de Mg(OH)2. Celle-ci est pratiquement complète à un pH de 11 à 11,5 (Dziubek et al., 1984), contrairement aux phosphates de calcium et leur forme substituée qui précipitent pour des pH de l’ordre de 8 (Moutin et al., 1992 ; Baya, 2012). La précipitation des phosphates de calcium et formes substituées avec les microalgues serait à cet effet favorisée, n’excluant pas toutefois la possibilité de précipitation de Mg(OH)2 avec l’augmentation du pH.
13En résumé, pour les microalgues d’eau douce, à des pH inférieurs à 10,5, la précipitation de Mg(OH)2 ne serait pas responsable de leur auto-floculation. Pour des pH > 10,5, il pourrait néanmoins avoir une compétition entre Mg(OH)2 et les phosphates de calcium (ou formes substituées). Dans le cas des microalgues marines, cette compétition pourrait avoir lieu à partir du pH 9,5.
14Théories et mécanismes. Une seconde méthode proposée pour induire naturellement la floculation des microalgues est la bio-floculation (Lavoie et al., 1984 ; Bhaskar et al., 2005). La bio-floculation est un processus comparable à la floculation chimique en termes d’efficacité de récolte et de temps de sédimentation (Salim et al., 2010). Ce processus est basé sur la sécrétion de biopolymères (polysaccharides, polymères exo-cellulaires [PEC], protéines, acides nucléiques, lipides) par les microalgues qui, produites en grandes quantités en phase de croissance exponentielle, agissent comme des floculants et provoquent la formation de flocs de microalgues (Lavoie et al., 1984 ; Bhaskar et al., 2005). Par ailleurs, les microalgues peuvent établir des ponts entre elles par l’intermédiaire de protéines spécifiques ou de certaines espèces de cations. En effet, certains cations majeurs (Ca2+, Mg2+) sont fortement impliqués dans la structure des flocs (Bhaskar et al., 2005). Parmi ceux-ci, le calcium est considéré comme le cation ayant la plus forte influence dans le processus de bio-floculation, notamment du fait de sa forte affinité pour les PEC (Sanin et al., 2000). Salim et al. (2010) mentionnent deux théories pouvant expliquer la bio-floculation : le pontage et le piégeage. Par pontage, les biopolymères s’adsorbent à la surface des cellules algales, inversant localement les charges négatives de celles-ci en charges positives. De ce fait, d’autres cellules algales peuvent s’y adsorber, créant des flocs de plus grande taille. Par ailleurs, les biopolymères chargés positivement peuvent s’adsorber partiellement à la surface d’une cellule algale et se lier à d’autres cellules algales créant des amas de microalgues liés par l’intermédiaire de ces biopolymères (piégeage). Cependant, une grande accumulation de biopolymères peut agir comme écran protecteur de la surface des cellules algales et réduire ainsi leur capacité de bio-floculation.
15Conditions physico-chimiques. Plusieurs facteurs tels que la carence en azote (Williams et al., 1977 ; Williams et al., 1978), le pH, la salinité, la température, la physiologie et l’âge des cultures, peuvent influencer la production des biopolymères (Benemann et al., 1996). Par ailleurs, la nature des biopolymères conditionne l’efficacité de la bio-floculation (Bhaskar et al., 2005). De plus, des cations tels que Ca2+ et Mg2+ sont fortement impliqués dans le processus de bio-floculation (Bhaskar et al., 2005). Malgré ces informations, les conditions physico-chimiques nécessaires à la réalisation de la bio-floculation ont été très peu étudiées à notre connaissance. Des études supplémentaires sont souhaitables pour fournir plus de précisions quant aux conditions d’obtention de ce phénomène (par exemple, charge organique, rapport [algues]/[biopolymères], [Ca2+], etc).
16Théories et mécanismes. La troisième méthode proposée pour une récolte biologique des microalgues est la formation de flocs stables entre bactéries et microalgues (Gutzeit et al., 2005 ; Lee et al., 2008). Pour ces auteurs, la présence de biopolymères joue un rôle important dans la formation de flocs entre bactéries et microalgues. Ces polymères développent une grande surface d’échange par unité de volume et permettent des pontages favorables à la floculation. En outre, l’interaction entre les biopolymères accumulés à la surface des cellules algales et ceux des cellules bactériennes par des mécanismes de pontage permet la formation d’agrégats (Eisenberg et al., 1981). Ces biopolymères, chargés négativement, pourraient également interagir par le biais de protéines ou de certaines espèces de cations (Costerton et al., 1978). La prolifération de bactéries filamenteuses liée soit à l’excès de substrat préférentiel (i.e. soufre réduit) ou à la carence relative en divers substrats (O2, C, N, P, oligo-éléments) peut également servir de matrice à la formation de flocs (Eisenberg et al., 1981 ; Duchene et al., 1998 ; Madoni et al., 2000 ; Lee et al., 2008). En effet, ces bactéries filamenteuses s’attaquent aux algues mortes, ainsi qu’aux biopolymères extracellulaires ou intracellulaires libérés lors de la lyse de cellules âgées. Elles contribuent ainsi à l’augmentation de la capacité des cellules algales à floculer et à la formation de flocs entre les bactéries et les cellules algales (Eisenberg et al., 1981 ; Gutzeit et al., 2005 ; Papazi et al., 2010). De ce fait, les flocs formés sont composés de cellules algales incorporées dans une matrice de bactéries filamenteuses (Eisenberg et al., 1981 ; Schenk et al., 2008). Pour Gutzeit et al. (2005), les flocs entre algues et bactéries, dont la taille des principaux flocs varie entre 400 et 800 µm, sont stables et peuvent être éliminés par simple sédimentation gravitaire.
17Conditions physico-chimiques. Les conditions physico-chimiques de réalisation de la bio-floculation ont été très peu étudiées. Gutzeit et al. (2005) ont montré que sous certaines conditions expérimentales (DCO: 471 mg·l-1 ; MES :1-1,5 g·l-1, un faible temps de séjour [2 jours et des âges de boues de 20 à 25 jours]), il était possible d’obtenir la formation de flocs stables (400 µm – 800 µm) entre algues et bactéries. Par ailleurs, Eisenberg et al. (1981) ont pu obtenir des rendements de récolte des microalgues de l’ordre de 88 %, avec les conditions expérimentales suivantes : DBO5 (250 mg·l-1), DCO (450 mg·l-1), un temps de séjour (2 à 3 jours), MES (200 mg·l-1). Cependant, les propriétés de surface, les biopolymères et d’autres facteurs, notamment la teneur en calcium, influencent la formation et la stabilité des flocs formés entre les bactéries et les microalgues (Gutzeit et al., 2005). Dans un CAHR soumis à une forte charge organique, le faible temps de séjour dans le système ne favorise pas l’accumulation de biopolymères. Également, pour une forte charge organique, compte tenu des faibles teneurs en oxygène, il y a un ralentissement au niveau de la sécrétion de biopolymères bactériens. Ces différents éléments limitent fortement la réalisation de la co-floculation dans le CAHR (Gutzeit et al., 2005).
18Dans cette synthèse, trois méthodes biologiques (naturelles) de récolte des microalgues dans le CAHR ont été présentées. L’auto-floculation est un phénomène dépendant de l’activité photosynthétique, de la nature, de l’âge, de l’état physiologique des microalgues et de la présence d’ions (Ca2+, PO43- et Mg2+). En présence d’ions Ca2+ et PO43- disponibles dans les eaux usées, l’augmentation du pH due à l’activité photosynthétique des microalgues provoque la nucléation d’un précipité de phosphates de calcium ou de formes substituées chargées positivement qui vont s’adsorber à la surface des microalgues et neutraliser les charges négatives de celles-ci. Néanmoins, cette neutralisation des charges algales peut être aussi due à la précipitation de Mg(OH)2. En ce qui concerne la charge de ce précipité, la mesure du potentiel zêta indique qu’il porte une charge positive, ce qui lui permet de précipiter avec les cellules algales (Smith et al., 2012).
19Par ailleurs, la bio-floculation liée à la sécrétion de grandes quantités de biopolymères par les microalgues en phase de croissance exponentielle et à la présence de protéines spécifiques ou de certaines espèces de cations (Ca2+, Mg2+), joue un rôle important dans la réalisation de l’auto-floculation. Elle contribue, par sa complémentarité avec l’auto-floculation, à augmenter les rendements de récolte des microalgues. De plus, la co-floculation due, d’une part, à la prolifération de bactéries filamenteuses servant de matrice à la fixation des microalgues et, d’autre part, à la présence de polymères permettant des pontages favorables à la floculation, est un phénomène qui peut être complémentaire aussi de l’auto-floculation des microalgues. En outre, la disponibilité des ions Ca2+, PO43- et Mg2+ dans les eaux usées est un facteur non négligeable à prendre en compte dans la réalisation de l’auto-floculation. Cependant, plusieurs facteurs tels que la carence en azote, le pH, la salinité, la température, la physiologie et l’âge des cultures peuvent influencer la production des biopolymères et avoir une incidence sur la floculation des microalgues. Toutefois, malgré ces limites, ces trois méthodes biologiques semblent être des pistes prometteuses pour la récolte des microalgues. Elles pourraient permettre de pallier les inconvénients des méthodes classiques. En effet, elles présentent l’avantage d’être simples et aussi efficaces que la floculation chimique. De plus, elles sont durables et rentables puisqu’aucune addition de floculant n’est nécessaire. Cependant, afin d’optimiser ces méthodes biologiques, des études supplémentaires devront être réalisées pour :
20– déterminer leurs conditions d’inhibition ;
21– quantifier la contribution réelle de la co-floculation et de la bio-floculation dans le rassemblement des microalgues ;
22– déterminer la composition, la quantité des PEC produits par les microalgues aux différentes phases de croissance algale ;
23– caractériser davantage les groupements fonctionnels qui ont une influence sur ces méthodes.
24Cette synthèse bibliographique sur les méthodes biologiques de récolte des microalgues peut permettre de faire progresser les connaissances sur certains des processus relatés dans la littérature pour la récupération des microalgues. En outre, elle met en évidence certaines limites de ces méthodes et ouvre la voie à des améliorations qui pourraient être faites pour les optimiser. Par ailleurs, cette synthèse peut être une première étape dans une gestion efficace des réacteurs afin d’aboutir de façon efficace à ces méthodes biologiques de récolte des microalgues.
25Remerciements
26Ce travail a été réalisé au Département Sciences et Gestion de l’Environnement de l’Université de Liège et s’inscrit dans le cadre du projet de recherche doctorale du premier auteur. Ce projet de recherche doctorale a été financé par l’État de Côte d’Ivoire et le Laboratoire Assainissement et Environnement de l’Université de Liège. Nos remerciements à Hugues Jupsin et à Saïd Dekayir pour leur assistance technique. Merci également à Louis Kouadio pour les différentes critiques et suggestions.
Bibliographie
Ahmad A.L., Mat Yasin N.H., Derek C.J.C. & Lim J.K., 2011. Optimization of microalgae coagulation process using chitosan. Chem. Eng. J., 173(3), 879-882.
Baya D.T., 2012. Étude de l'auto-floculation dans un chenal algal à haut rendement. Thèse de doctorat : Université de Liège (Belgique).
Baya D.T., Effebi K.R., Dekayir S. & Vasel J.-L., 2009. Évolution des paramètres physico-chimiques et nycthéméraux dans le chenal algal à haut rendement en condition d'auto-floculation. In : Actes du 8e Congrès international du GRUTTEE, Ressources en eau : quels outils scientifiques pour une gestion durable de leur qualité ?, 26-28 octobre 2009, Nancy, France, 197-200.
Baya D.T. et al., 2013. Effect of hydroxyapatite, octacalcium phosphate and calcium phosphate on the auto-flocculation of the microalgae in a High Rate Algal Pond (HRAP). Environ. Technol., 34(16), 2407-2414.
Beneman J., Kopman B., Weissman J. & Goebel R., 1980. Developpment of microalgae harvesting and high rate pond technologies in California. In: Shelef G. & Soeder C.J., eds. Algal biomass. Amsterdam, The Netherlands: Elsevier, 457.
Benemann J. & Oswald W., 1996. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. Final report to the US Departement of Energy, Pittsbourgh Energy Technology Center, DOI 10.2172/493389.
Bhaskar P.V. & Bhosle N.B., 2005. Microbial extracellular polymeric substances in marine biogeochemical processes. Curr. Sci., 88, 45-53.
Borowitzka M.A., 1986. Microalgae as source of chemicals. Microb. Sci., 3, 372-375.
Bouarab L., Dauta A. & Loudiki M., 2004. Heterotrophic and mixotrophic growth of Micractinium pusillum Fresenius in the presence of acetate and glucose: effect of light and acetate gradient concentration. Water Res., 38, 2706-2712.
Bouarab L. et al., 2005. Composition en acides aminés libres et combinés et en vitamines de la microalgue Micratinium pusillum Fres. issue d'un lagunage naturel. Rev. Sci. Eau, 18, 471-483.
Cadoret J.-P. & Bernard O., 2008. La production de biocarburant lipidique avec des microalgues : promesses et défis. J. Soc. Biol., 202(3), 201-211.
Chen C.Y. et al., 2011. Cultivation, photobioreactor design and harvesting of microalgae for biodiesel production: a critical review. Bioresour. Technol., 102(1), 71-81.
Christenson L. & Sims R., 2011. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts. Biotechnol Adv., 29(6), 686-702.
Costerton J.W., Geesey G.G. & Cheng K.J., 1978. How bacteria stick. Sci. Am., 238, 86-95.
Craggs R.J., 2005. Advanced integrated wastewater ponds. In: Shilton A., ed. Pond treatment technology. London: IWA, 282-310.
Dekayir S., 2008. Gestion, récupération et valorisation de la biomasse produite dans une filière d'épuration des eaux usées par Chenal Algal à Haut Rendement. Thèse de doctorat : Université de Liège (Belgique).
Duchene P. & Cotteux E., 1998. La problématique des dysfonctionnements biologiques : bulking et moussage biologique en boues activées. Tribune Eau, 55, 59-66.
Dziubek A.M. & Kowal A.L., 1984. Effect of magnesium hydroxyde on chemical treatment of secondary effluent under alkaline conditions. In: Proceedings of Water Reuse Symposium III, August 26-31, 1984, San Diego, California. Denver, CO, USA: American Waterworks Association Research Foundation.
Edeline F., 1997. L'épuration biologique des eaux : théorie et technologie des réacteurs. Liège, Belgique : Cebedoc Éditeur.
Eisenberg D.M., Koopman B., Beneman J.R. & Oswald W.J., 1981. Algal bioflocculation in microbial sewage ponds. Biotechnol. Bioeng. Symp., 11, 429-448.
El Halouani H., 1990. Lagunage à haut rendement : caractérisation physico-chimique de l'écosystème. Étude de son aptitude à l'élimination de l'azote et du phosphate dans l'épuration des eaux usées. Thèse de doctorat : Université de Montpellier I (France).
Friedman A.A., Peaks D.A. & Nichols R., 1977. Algae separation from oxidation pond effluents. J. Water Pollut. Control Fed., 49, 111-119.
Golueke C.G. & Oswald W.J., 1965. Harvesting and processing sewage-grown planktonic algae. J. Water Pollut. Control Fed., 37, 471-498.
Grima E.M., Belardi E.H., Fernandez F.G.A. & Medina R., 2002. Recovery of microalgal biomass and metabolites options and economic. Biotechnol. Adv., 20, 491-515.
Gutzeit G. et al., 2005. Bioflocculent algal-bacterial biomass improves low-cost wastewater treatment. Water Sci. Technol., 52(12), 9-18.
Heughebaert J.C., Zawacki S.J. & Nancollas G.H., 1990. The growth of nonstoichiometric apatite from aqueous solution at 37°C: I. Methology and growth at pH 7.4. J. Colloid Interface Sci., 135(1), 20-32.
Lavoie A. & De la Noüe J., 1984. Récupération de microalgues en eaux usées : études comparatives de divers agents floculants. Can. J. Civil Eng., 11, 266-272.
Lavoie A. & De la Noüe J., 1987. Harvesting of Scenedesmus obliquus in wastewaters: auto- or bioflocculation? Biotechnol. Bioeng., 30(7), 852-859.
Lee A.K., Lewis D.M. & Ashman P.J., 2008. Microbial flocculation, a potentially low-cost harvesting technique for marine microalgae for the production of biodiesel. J. Appl. Phycol., 21, 559-567.
Madoni P., Davoli D. & Gibin G., 2000. Survey of filamentous microorganisms from bulking and foaming activated-sludge plants in Italy. Water Res., 34(6), 1767-1772.
Molle P., 2003. Filtres plantés de roseaux : limites hydrauliques et rétention du phosphore. Thèse de doctorat : Université de Montpellier II (France).
Moutin T. et al., 1992. Decrease of phosphate concentration in a high rate pond by precipitation of calcium phosphate: theoretical and experimental results. Water Res., 26(11), 1445-1450.
Oswald W., Gootaas H., Golueke C. & Kellen W.C., 1957. Algae in waste treatment. Sewage Ind. Wastes, 29(4), 437-457.
Papazi A., Makridis P. & Divanach P., 2010. Harvesting Chlorella minutissima using cell coagulants. J. Appl. Phycol., 22, 349-355.
Pieterse A.J.H. & Cloot A., 1997. Algal cells and coagulation, flocculation and sedimentation processes. Water Sci. Technol., 36(4), 111-118.
Pulz O. & Gross W., 2004. Valuable products from biotechnology of microalgae. Appl. Microbiol. Biotechnol. Adv., 65, 635-648.
Rance Bare W.F., Norman B. & Middlebrooks E.J., 1975. Algal removal using disolved air flottation. J. Water Pollut. Control Fed., 47(1), 153-169.
Salim S., Bosma R., Vermuë M.H. & Wijffels R.H., 2010. Harvesting of microalgae by bio-flocculation. J. Appl. Phycol., 23(5), 849-855.
Sanin D. & Vesilind P.A., 2000. Bioflocculation of activated sludge: the role of calcium ions and extracellular polymers. Environ. Technol., 21(12), 1405-1412.
Schenk P.M. et al., 2008. Second generation biofuels: high-efficiency microalgae for biodiesel production. Bioenergy Res., 1, 20-43.
Sim T.S., Goh A. & Becker E.W., 1988. Comparison of centrifugation, dissolved air flotation and drum filtration techniques for harvesting sewage-grown algae. Biomass, 16(1), 51-62.
Smith B.T. & Davis R.H., 2012. Sedimentation of algae flocculated using naturally-available, magnesium-based flocculants. Algal Res., 1(1), 32-39.
Spolaore P., Joannis-Cassan C., Duran E. & Isambert A., 2006. Commercial applications of microalgae. J. Biosci. Bioeng., 101, 87-96.
Sukenik A. & Shelef G., 1984. Algal autoflocculation-verification and proposed mechanism. Biotechnol. Bioeng., 26, 142-147.
Sukenik A. et al., 1985. Coprecipitation of microalgal biomass with calcium and phosphate ions. Water Res., 19(1), 127-129.
Vandamme D., Foubert I., Meesschaert B. & Muylaert K., 2010. Flocculation of microalgae using cationic starch. J. Appl. Physiol., 22(4), 525-530.
Vandamme D., Foubert I. & Muylaert K., 2011. Advantages and disadvantages of using pH-induced auto-flocculation for harvesting microalgae, https://lirias.kuleuven.be/handle/123456789/318886 (20/01/14).
Williams A.G. & Wimpenny J.W.T., 1977. Exopolysaccharide production by Pseudomonas NCIB 11264 grown in bacth culture. J. Gen. Microbiol., 102, 13-21.
Williams A.G. & Wimpenny J.W.T., 1978. Exopolysaccharide production by Pseudomonas NCIB 11264 grown in continuous culture. J. Gen. Microbiol., 104, 47-57.
Wu Z. et al., 2012. Evaluation of flocculation induced by pH increase for harvesting microalgae and reuse of flocculated medium. Bioresour. Technol., 110, 496-502.
Zawacki S.J., Heughebaert J.C. & Nancollas G.H., 1990. The growth of nonstoichiometric apatite from aqueous solution at 37°C: II. Effects of pH upon the precipated phase. J. Colloid Interface Sci., 135(1), 33-44.
Zheng H. et al., 2012. Harvesting of microalgae by flocculation with poly (γ-glutamic acid). Bioresour. Technol., 112, 212-220.
Zittelli G.C., Rodolfi L., Biondi N. & Tredici M.R., 2006. Productivity and photosynthetic efficiency of outdoor cultures of Tetraselmis suecica in annular columns. Aquaculture, 261, 932-943.






