- Accueil
- Volume 17 (2013)
- numéro 4
- Insectes ravageurs et propriétés biocides de Jatropha curcas L. (Euphorbiaceae) : synthèse bibliographique
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Insectes ravageurs et propriétés biocides de Jatropha curcas L. (Euphorbiaceae) : synthèse bibliographique

Notes de la rédaction
Reçu le 6 aout 2012, accepté le 27 juin 2013
Résumé
Jatropha curcas est un arbuste de la famille des Euphorbiacées, largement répandu dans les pays tropicaux. Ses graines sont riches d'une huile pouvant servir de biocarburant dans les moteurs Diesel modifiés. La plante est attaquée par divers insectes ravageurs appartenant principalement aux ordres des Hémiptères, Coléoptères et Orthoptères. Ils provoquent des dégâts sur les fruits, les inflorescences et les feuilles. Les ravageurs les plus fréquemment observés sur J. curcas sont des punaises du genre Pachycoris (Heteroptera : Scutelleridae), qui sont largement répandues au Mexique, en Australie, aux États-Unis, au Brésil et au Nicaragua. Ces punaises causent des dégâts importants sur les fruits et provoquent la malformation des graines, et avec elle une réduction de la teneur en huile. Même si les arbustes de Jatropha sont victimes d'infestations d'insectes, plusieurs études démontrent l'effet biocide de son huile notamment contre des insectes ravageurs importants tels que Busseola fusca (Fuller) (Lépidoptère : Noctuidae), Sesamia calamistis Hampson (Lépidoptère : Noctuidae), Aphis gossypii Glover (Homoptère : Aphididae) et Callosobruchus chinensis L. (Coléoptère : Bruchidae). Nous abordons les principaux insectes ravageurs de J. curcas et les effets insecticides démontrés de son huile.
Abstract
Insect pests and biocidal properties of Jatropha curcas L. (Euphorbiaceae). A review. Jatropha curcas is a Euphorbiaceae shrub widely distributed in many tropical countries. Its seeds are rich in oil that can be used as biofuel in modified diesel engines. Several insect species, mainly belonging to Hemiptera, Coleoptera and Orthoptera, have been referenced as insect pests of J. curcas. These insects attack the plant and cause damage to fruits, inflorescences and leaves. The most frequently observed pests belong to the genus Pachycoris (Heteroptera: Scutelleridae), which are widely distributed in Mexico, Australia, United States of America, Brazil and Nicaragua. Pachycoris spp. cause significant damage to the fruits, leading to the malformation of seeds and a reduction in their oil content. Although Jatropha shrubs are subjected to insect infestations, the oil has been shown to demonstrate biocidal activity, including insecticidal effects against several insect pests, including Busseola fusca (Fuller) (Lepidoptera: Noctuidae), Sesamia calamistis Hampson (Lepidoptera: Noctuidae), Aphis gossypii Glover (Homoptera: Aphididae) and Callosobruchus chinensis L. (Coleoptera: Bruchidae). In the present paper, we summarize the work carried out on inventories of J. curcas insect pests as well as on the biocidal activity of its oil.
Table des matières
1. Introduction
1Jatropha curcas L., aussi appelé pourghère, est un arbuste de 3 à 8 m de haut appartenant à la famille des Euphorbiaceae et originaire d'Amérique centrale (Figure 1). Le genre Jatropha est largement distribué dans les pays tropicaux (Heller, 1996). Les graines de J. curcas sont riches en huile actuellement utilisée comme biocarburant, ce qui a rendu cette plante importante dans les perspectives de recherche d’énergies renouvelables. L’histoire des biocarburants a commencé dès les années 1900 avec Rudolf Diesel, inventeur du moteur qui porte son nom, qui fonctionnait à l’huile végétale. L’intérêt porté à l’utilisation des huiles végétales a continué à se manifester au cours de la seconde guerre mondiale et s’est éteint dans les années 1970 suite à l’abondance de carburants fossiles. L’épuisement de cette ressource énergétique non renouvelable a amené les chercheurs et les États à réfléchir au développement de nouvelles sources d’énergie renouvelable. Parmi ces sources d’énergie, les biocarburants attirent particulièrement l’attention des responsables. En effet, il est admis que l’utilisation de l’éthanol pur à la place de l’essence permet de réduire les émissions de gaz à effet de serre (Hedegaard et al., 2008). Les biocarburants contribuent également à la réduction de la dépendance énergétique des pays n'ayant pas d'accès aux ressources pétrolières (Hedegaard et al., 2008).
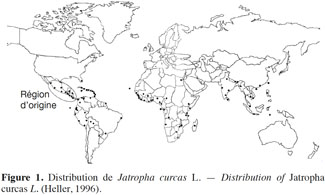
2Des insectes ravageurs de J. curcas ont été identifiés au Nicaragua, Brésil et Cap Vert, mais aussi dans plusieurs pays d'Afrique de l'Ouest.
3Cette synthèse bibliographique présente les principaux insectes ravageurs de J. curcas et dresse aussi le bilan des quelques travaux menés sur les effets biocides de son huile.
2. Insectes ravageurs de Jatropha curcas
2.1. Hétéroptères
4Jatropha curcas est l’hôte de divers insectes ravageurs ou pollinisateurs (Tableau 1) ainsi que de nombreuses espèces d’auxiliaires, parasitoïdes ou prédateurs. Le ravageur le plus fréquemment observé sur J. curcas au Nicaragua est Pachycoris klugii (Scutelleridae) (Grimm et al., 1997). Il passe tout son cycle sur J. curcas et il n’a été observé sur aucune autre plante (Peredo, 2002). Les dommages qu’il peut causer chez J. curcas sont, entre autres, la malformation des graines qui entraine une réduction de la teneur en huile. Une autre espèce du genre Pachycoris (Scutelleridae) est signalée au Nicaragua et au Brésil sur J. curcas : Pachycoris torridus (Foidl et al., 1996 ; Grimm et al., 1997). Il cause les mêmes dégâts que le précédent. Leptoglossus zonatus (Coreidae) est observé sur J. curcas au Nicaragua (Grimm et al., 1997). Il est polyphage et vit aussi bien sur le sorgho que sur le maïs ou la tomate. D’autres Hétéroptères ont été observés sur J. curcas en Inde. Parmi eux, citons Acrosternum marginatum et Nezara viridula (Pentatomidae), Chelysomidea variabilis, Scutellera nobilis, Chrysocoris purpureus (Westwood) et Agonosoma trilineatum (Scutelleridae), Hyalymenus tarsatus (Alydidae) et Hypselonotus lineatus (Coreidae). Ceux-ci sucent le contenu des fruits immatures, ce qui donne des graines mal formées (Prabhakar et al., 2008).
5Ferrao et al. (1984) et Münch et al. (1986) ont signalé la présence de Calidea stigmata (Scutelleridae) sur J. curcas au Cap Vert et à Sao Tomé. Les dommages causés par cet insecte provoquent souvent des malformations de fruits. Calidea panaethiopica (Scutelleridae) a été observé au Sénégal par Terren et al. (2009). Les larves et les adultes de cet insecte s’attaquent aux fleurs et aux capsules de J. curcas dont ils sucent la sève (Shanker et al., 2006). Les pertes liées à ces deux espèces de Calidea sont estimées à 18,5 % par an (Grimm et al., 1997).
2.2. Homoptères
6Ils sont moins nombreux sur J. curcas que les Hétéroptères. Münch et al. (1986) observent toutefois sur les branches de J. curcas, Ferrisia virgata (Pseudococcidae) et Pinnaspis strachani (Diaspididae) (Tableau 1), s'alimentant du phloème des arbustes. Ils collent aux feuilles, fruits et même aux racines de J. curcas et entrainent la chlorose, jaunissement des feuilles et la déformation des fruits. Pinnaspis strachani a été signalé dans les plantations de J. curcas au Cap Vert par Freitas (1906). Coccus hesperidum L. (Coccidae) se rencontre en Inde, en Australie et en Afrique du Sud. Il se nourrit du phloème de J. curcas, provoque la dépigmentation des feuilles et la perte de vigueur de la plante (Ranga Rao et al., 2010). Une autre cochenille Paracoccus marginatus Williams (Pseudococcidae) a été signalée sur J. curcas en Inde par Arif et al. (2011). Les dégâts causés par son attaque sont la perte de couleur verte des feuilles, la chlorose et le miellat sécrété réduit l’activité photosynthétique des feuilles.
2.3. Lépidoptères
7Les chenilles de Lépidoptères sont des ravageurs clés des nombreuses espèces végétales. Chez J. curcas, quelques chenilles appartenant aux familles des Pyralidae et des Noctuidae causent la dépigmentation des feuilles. Shanker et al. (2006) signalent la présence en Inde de la chenille du Lépidoptère Pempelia morosalis (Pyralidae) (Tableau 1). Elle provoque la chute des fleurs et des capsules de J. curcas. Les dommages causés par ce ravageur peuvent être repérés à distance grâce aux nervures squelettiques de l’arbre défolié. Quelquefois, les larves creusent des galeries dans le pédoncule et les fruits, ce qui assèche les inflorescences. Spodoptera litura (Noctuidae) est une autre chenille qui provoque des dégâts similaires sur les feuilles de J. curcas en Inde (Meshram et al., 1994). Stomphastis thraustica Meyerick (Gracillariidae) provoque la dépigmentation chlorophyllienne et une destruction de zones entières du limbe des feuilles par l’excavation de mines dans l’épaisseur de la feuille. Ce ravageur est cité dans les pays suivants : Inde, Malaisie, Madagascar, Nigeria et Afrique du Sud (Ranga Rao et al., 2010). Arif et al. (2011) ont observé en Inde sur J. curcas une chenille velue (non identifiée) capable de manger toutes les feuilles de l’arbre dans un court laps de temps.
2.4. Coléoptères
8Les principaux Coléoptères jusqu’alors observés sur J. curcas appartiennent aux familles des Cetoniidae, Chrysomelidae, Cerambycidae et Curculionidae. Oxycetonia versicolor (Cetoniidae) (Tableau 1) est signalé en Inde comme ravageur de fleurs de J. curcas par Shanker et al. (2006). Selon Grimm et al. (1997), le bois de J. curcas est attaqué par Bostrichus sp. (Bostrichidae) aux îles du Cap Vert. Tribolium castaneum Herbst (Tenebrionidae), ravageur classique et cosmopolite des denrées entreposées, a été trouvé dans un stock de graines de J. curcas aux Pays-Bas (Grimm et al., 1997). Lagocheirus undatus (Cerambycidae) est un parasite important de J. curcas au Nicaragua. Les larves de cet insecte creusent des galeries dans le bois de J. curcas et peuvent tuer des plants entiers. Peixoto (1973) signale la présence de Sternocolaspis quatuordecimcostata (Chrysomelidae) et de Coelosternus notaticeps (Curculionidae) au Brésil. Ces insectes causent d’importants dégâts sur les feuilles de J. curcas. Pantomorus femoratus (Curculionidae) a été observé sur les feuilles de J. curcas au Nicaragua par Grimm et al. (1997). Gagnaux (2009) signale plusieurs espèces au Mozambique comme agents défoliateurs de J. curcas dont une au moins a été déterminée comme Aphtona dilutipes Jacoby (Chrysomelidae).
2.5. Orthoptères
9Deux Orthoptères de la famille de Proscopiidae ont été observés par Saturnino et al. (2005) sur les feuilles et fleurs de J. curcas au Brésil : Corynorhynchus radula et Stiphra robusta. Ils provoquent la défoliation des arbustes de J. curcas. En Afrique, Oedaleus senegalensis (Acrididae) a été observé au Sénégal, provoquant des dégâts sur les jeunes plantules (Grimm et al., 1997) (Tableau 1).
2.6. Hyménoptères
10La majorité des espèces appartenant à l'ordre des Hyménoptères observées sur J. curcas sont des pollinisateurs. Saturnino et al. (2005) ont cependant observé la présence d’Atta sexdens rubropilosa (Formicidae) qui consomme les feuilles et les plantules au Brésil (Tableau 1). Cette espèce est signalée aussi par Alfonso (2007) en Honduras. Certaines espèces de Formicidae sont observées sur les fleurs de J. curcas par Solomon et al. (2002) et Regupathy et al. (2011) en Inde. Elles incluent Camponotus compressus, Crematogaster sp., Solenopsis geminata et Pheidole spathifer Forel. Ces insectes viennent chercher le nectar de la plante et contribuent aussi à sa pollinisation.
2.7. Thysanoptères
11Deux espèces appartenant à la famille de Thripidae sont signalées sur J. curcas. Peixoto (1973) signale la présence de Retithrips syriacus sur J. curcas au Brésil. Cet insecte provoque des dégâts sur les feuilles et les capsules de J. curcas. Saturnino et al. (2005) ont observé sur les fleurs de J. curcas au Brésil la présence de Selenothrips rubrocinctus. Il provoque la chute des fleurs.
2.8. Auxiliaires
12Plusieurs insectes ravageurs de Jatropha curcas sont sujets à la prédation ou au parasitisme. Parmi ceux-ci, la pyrale Pempelia morosalis Saalm Uller est parasitée à 85 % par Stomphastis thraustica Meyrick (Diptère) (Shanker et al., 2006). Quatre Hyménoptères sont recencés comme des parasitoïdes de Chrysocoris purpureus et Scutellera nobilis : Trathala flavo-orbitalis Cameron (Ichneumonidae), Bracon hebetor Say (Braconidae), Brachymeria nephantidis Gahan (Chalcidae), Podagrion hayati Narendran (Torymidae) et des Hétéroptères parasitoïdes des œufs : Aleurocanthus bangalorensis Dubey & Sundararaj (Hémiptère : Aleyrodae), Trissolcus sp. et Eurytoma sp. (Manoharan et al., 2006). Bien que moins référencés, des prédateurs tels que Cryptolaemus montrouzeri Mulsant, Spalgius epius Westwood et Chrysocoris stollii Wolff sont observés sur J. curcas se nourrissant des cochenilles (Hémiptères).
3. Méthodes de lutte contre les insectes ravageurs de Jatropha curcas
13La lutte contre les chenilles défoliatrices passe par une surveillance intensive des arbustes et l’utilisation de produits chimiques sélectifs lors d'infestations importantes. La surveillance permet d’éradiquer les jeunes chenilles dès leur apparition. L’utilisation d'insecticides à base de neem est recommandée afin de réduire la ponte des imagos (Ranga Rao et al., 2010). Les biopesticides présentent un réel avantage du fait de leur faible rémanence, leur faible toxicité pour l’homme et de leur mode d’action sur les ravageurs. Ils sont moins dangereux pour l’environnement et pour l’Homme.
14Afin de contrôler les insectes suceurs comme les punaises et même certains acariens, Ranga Rao et al. (2010) proposent l’application de carbosulfan (1 ml pour 3 l d’eau) et d'imidaclopride (1 ml pour 3 l d’eau). Les insecticides systémiques permettent de bien contrôler ces ravageurs qui sont peu sensibles à la toxicité par contact des bio-insecticides.
15Les produits chimiques et leurs doses d’applications proposés par Gagnaux (2009) dans la lutte contre les Chrysomèles incluent le Carbaril 50 % WP (500 g·l-1 de carbaryl) à la dose de 0,7 kg·ha-1, Cymbush 25 % EC (250 g·l-1 de cyperméthrine) à la dose de 0,2 l·ha-1, Basudine 60 % EC (600 g·l-1 de diazinon) à la dose de 0,7 l·ha-1, Dipterex 95 SP à la dose 0,4 g·ha-1, Azinphos 350 SC (azinphos-methyl 350 g·l-1) à la dose de 43,75 g·ha-1, Azinphos 200 SC (azinphos methyl 200 g·l-1) à la dose de 43,75 g·ha-1.
16Ces Lépidoptères sont naturellement contrôlés par plusieurs ennemis naturels. En effet, Telenomus remus Nixon (Hyménoptère : Scelionidae) est un parasitoïde des œufs de P. morosalis. Il peut être aussi parasité par Stegodyphus sp. (Arachnida : Eresidae). Les larves de Spodoptera litura (Lépidoptère : Noctuidae) sont parasitées par Microplitis manilae Ash (Hyménoptère : Braconidae) (Ranga Rao et al., 2010).
17Pachycoris sp. et Leptoglossus zonatus peuvent être contrôlés par les champignons entomopathogènes tels que Beauveria bassiana (Bals.) Vuill et Metarhizium anisopliae (Metsch.) Sorok (Shanker et al., 2006).
18L’installation de pièges lumineux tout autour de la parcelle peut réduire le nombre de femelles gravides sur les plants. Cette méthode est non sélective car on remarque le plus souvent une destruction des insectes non ciblés ou axillaires.
19Une méthode de contrôle mécanique, consistant à collecter les masses d'œufs et les larves jeunes en vue de leur destruction, permet de réduire les populations de ravageurs, moyennant d'importants efforts humains.
4. Propriétés biocides de l’huile de Jatropha curcas
4.1. Propriétés insecticides
20Solsoloy et al. (1997) ont testé des émulsions d'huile de J. curcas contre des insectes nuisibles aux stocks de grains de maïs, Sitophilus zeamais (Coleoptera : Curculionidae) et de haricot mungo, Callosobruchus chinensis (Coleoptera : Bruchidae) (Tableau 2). Les concentrations testées d’huiles au sein des émulsions étaient de 0,5 ; 1 ; 2,5 et 10 %. Les semences étaient pulvérisées puis séchées. Après deux mois, les dommages aux graines ont été réduits de 90 % par rapport au témoin avec un dosage à 10 % d'huile pour S. zeamais et un dosage de 5 % pour C. chinensis. En 2000, Solsoloy et al. se sont intéressés à la lutte contre les ravageurs du cotonnier. Les doses de 800 et 1 250 ml·ha-1 d'huile de J. curcas ont été comparées au profenofos à 400 g·ha-1 et à la deltamétrine à 12,5 g·ha-1. Trois ravageurs étaient concernés : Amrarsca biguttula, Aphis gossypii (Homoptère : Aphididae) et Helicoverpa armigera (Lépidoptère : Noctuidae). Aphis gossypii a mieux été contrôlé avec l'huile de J. curcas qu'avec la deltamétrine, ce qui n'est pas le cas avec A. biguttula. Au début des traitements, les insecticides de synthèse ont été plus efficaces que l'huile de J. curcas sur H. armigera ; l'huile ayant un effet sur la croissance des insectes, son effet est plus lent que les produits de synthèse. Les parcelles traitées avec les produits de synthèse ont donné des rendements supérieurs.
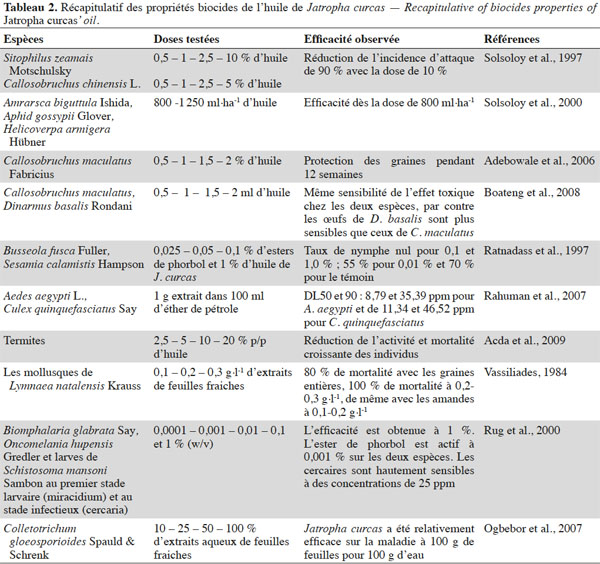
21Boateng et al. (2008) ont mis en évidence l’effet insecticide de l’huile de J. curcas sur Callosobruchus maculatus (Coleoptera : Bruchidae) et son parasitoïde, Dinarmus basalis (Hymenoptera : Pteromalidae). En effet, les adultes de C. maculatus et D. basalis ont la même sensibilité par rapport aux concentrations de 0,5 ; 1 ; 1,5 et 2 ml d’huile de J. curcas, par contre les œufs de C. maculatus sont plus sensibles que ceux de D. basalis à cause de la protection que leur procure les graines.
22Adebowale et al. (2006) ont mené une expérience similaire en laboratoire sur Callosobruchus maculatus Fabricius (Coleoptera : Bruchidae), insecte nuisible des graines de niébé. Ils ont observé une réduction significative des pontes pour toutes les concentrations de 0,5 ; 1 ; 1,5 et 2 % d’huile de J. curcas testées et une inhibition totale des œufs et des larves. Ces auteurs observent que les grains sont ainsi protégés pendant 12 semaines et avancent que l'effet insecticide pourrait avoir pour origine les stérols et les alcools terpènes contenus dans l'huile qui peuvent se dégrader dans le temps par le phénomène d’oxydation.
23Les travaux menés par Ratnadass et al. (1997) ont montré des résultats satisfaisants pour l'efficacité insecticide d'extraits de J. curcas sur Busseola fusca (Lepidoptera : Noctuidae) et Sesamia calamistis (Lepidoptera : Noctuidae), foreurs des tiges de sorgho causant de nombreux dégâts au Nigeria et au Burkina Faso. L'efficacité de l'huile de J. curcas (1 % du milieu nutritif) a été comparée à celle d'esters de phorbol à 0,025 ; 0,05 et 0,1 % incorporé au milieu nutritif pour S. calamistis et 0,01 ; 0,1 et 1 % du milieu nutritif pour B. fusca. Les taux de nymphose ont été nuls pour S. calamistis pour tous les traitements ayant reçu un produit, comme pour B. fusca pour les traitements à 0,1 et 1,0 % d'huile, alors qu'il était de 55 % sur le traitement supplémenté à 0,01 % et de 70 % sur le témoin.
24Rahuman et al. (2007) ont testé des extraits d’écorce et de feuilles de J. curcas sur Aedes aegypti et Culex quinquefasciatus (Diptera : Culicidae). Ils ont réalisé des extraits de plantes à l’aide d’acétate de méthyle, de butanol et d’éther de pétrole. Après 24 h, l’extrait de Jatropha dilué dans l’éther de pétrole est le seul à avoir eu une efficacité notable sur les deux espèces étudiées. Les DL50 et DL90 mesurées sont respectivement de 8,79 et 35,39 ppm pour A. aegypti et de 11,34 et 46,52 ppm pour C. quinquefasciatus.
25Acda (2009) montre que l’huile de J. curcas a des effets répulsifs et anti-appétant contre les termites. Des concentrations de 2,5 ; 5 ; 10 et 20 % (p/p) ont entrainé une réduction de la formation de galeries dans les planches traitées.
4.2. Propriétés molluscicides
26Les principaux essais réalisés dans ce domaine concernent les mollusques d’eau douce qui sont des hôtes intermédiaires des vers parasites de l’homme du genre Schistosoma, responsables de la bilharziose. Vassiliades (1984) a étudié les propriétés molluscicides de deux Euphorbiacées, dont J. curcas, sur Lymnaea natalensis (hôte intermédiaire de Fasciola gigantea ou douve du foie) et Bulinus guernei Dautzenberg (hôte intermédiaire de Schistosomes sp. et de Paramphistomes sp., similaires à la douve). Des tests ont été réalisés en 1982 et 1983, non publiés alors qu'ils ont donné des résultats satisfaisants (Vassiliades, 1984). Dans un aquarium contenant de l'eau pure, on introduisait les plantes hachées ou écrasées à des concentrations différentes. En même temps que les mollusques, on plaçait des Guppys pour vérifier la toxicité du traitement. Parallèlement, l'eau de l'aquarium a été donnée à boire à des souris.
27Les feuilles fraiches à la concentration de 0,1 à 0,3 g·l-1 ont provoqué la mort de tous les mollusques de L. natalensis en sept jours. Avec des tiges hachées, la mortalité a atteint 80 % des mollusques, avec les graines entières, 100 % de mortalité à 0,2-0,3 g·l-1, de même avec les amandes à 0,1-0,2 g·l-1. Dans tous les cas, il n’y a eu aucun effet sur les Guppys. Aucun trouble n’a été observé chez les souris ayant bu l’eau traitée. Un effet similaire a été observé sur B. guernei (Vassiliades, 1984).
28Rug et al. (2000) ont testé les concentrations de 0,0001 ; 0,001 ; 0,01 ; 0,1 et 1 % (w/v) d'huile de J. curcas sur les mollusques Biomphalaria glabrata (Gastropoda : Basommatophora) et Oncomelania hupensis (Gastropoda : Risooidea), hôtes des larves de Schistosoma. La plupart des extraits ont une efficacité totale à des concentrations voisines de 0,1 %, sauf pour l'extrait aqueux dont l’efficacité est obtenue à 1 %. L’efficacité de l'huile de J. curcas est sans doute due à la concentration en esters de phorbol. L'ester de phorbol est actif à 0,001 % sur les deux espèces. Par la suite, ces auteurs montrent que les Cercaria (larves de Schistosoma mansoni au stade infectieux) sont hautement sensibles à des concentrations de 25 ppm, 10 fois plus sensibles que les miracidia (larves de Schistosoma mansoni au premier stade). L'extrait aqueux nécessite une concentration 10 fois plus élevée pour être aussi efficace. En présence d'extrait au méthanol, les larves de Schistosoma mansoni développent des vésicules en surface conduisant à leur mort à plus ou moins long terme.
4.3. Propriétés antifongiques
29Ogbebor et al. (2007) ont étudié les propriétés antifongiques des feuilles de 21 plantes pour lutter contre Colletotrichum gloeosporioides, agent pathogène de l'hévéa. Des concentrations de 10, 25, 50 et 100 % des extraits des feuilles de ces plantes sont comparées dans un premier test in vitro. Les feuilles de J. curcas figurent ainsi parmi les cinq plantes les plus efficaces. Des infestations ont alors été réalisées au sein de pépinières dont les plants ont été traités par des extraits de broyat de feuilles de J. curcas à différentes concentrations. Jatropha curcas a été relativement efficace sur la maladie à la concentration la plus forte (100 g de feuilles pour 100 g d'eau) avec un indice d'infestation des feuilles un peu plus faible que le témoin, trois semaines après l'infestation.
5. Conclusion
30Beaucoup d'espoir a été placé dans le pourghère, considéré il y a peu comme une source d'énergie renouvelable pour de nombreux pays en développement grâce à son huile utilisable dans les moteurs Diesel. Cet arbuste peu exigeant en eau est visité par des insectes dont certains sont des ravageurs et d’autres, des pollinisateurs ou des auxiliaires.
31Des insectes appartenant aux ordres des Hétéroptères, Coléoptères, Lépidoptères et Orthoptères sont signalés comme ravageurs de J. curcas au Nicaragua, au Brésil, en Inde, en Australie et en Afrique. Ils se nourrissent des fleurs ou de fruits de J. curcas et provoquent soit l’avortement des fleurs ou la malformation de fruits. Certains de ces insectes consomment les feuilles des jeunes plants et peuvent entrainer un mauvais développement des jeunes plants. Plusieurs espèces appartenant aux ordres des Hyménoptères et Diptères jouent un rôle important dans la pollinisation de la plante.
32De nombreuses études ont montré l’efficacité des extraits des différentes parties de cette plante, ainsi que son huile dans la lutte contre les ravageurs d’autres cultures et des études futures devraient s'intéresser à l'identification des composés insecticides de son huile, aux variétés de J. curcas particulièrement riches en ces composés, aux méthodes de formulation et d'application des extraits sur les plantations souffrant d'infestations d'insectes, ainsi qu'aux risques de résidus potentiels pour la santé humaine.
Bibliographie
Acda M.N., 2009. Toxicity, tunneling and feeding behavior of the termite, Coptotermes vastator, in sand treated with oil of the physic nut, Jatropha curcas. J. Insect Sci., 9, 1-8.
Adebowale K.O. & Adedire C.O., 2006. Chemical composition and insecticidal properties of the underutilized Jatropha curcas seed oil. Afr. J. Biotechnol., 5(10), 901-906.
Alfonso J., 2007. Reporte final sobre los modulos de viveros y establecimiento de parcellas experimentales de pinon, higuerilla y girasol en el proyecto piloto de producion de biocombustibles gota verde. La Lima, Cortes, Honduras: Fundación Hondureña de Investigación Agrícola (FHIA).
Arif M. & Ahmed Z., 2011. Occurrence of insect pests in Jatropha curcas (physic nut). J. Exp. Zool. India, 15(1), 199-200.
Boateng B.A. & Kusi F., 2008. Toxicity of Jatropha seed oil to Callosobruchus maculatus (Coleoptera: Bruchidae) and its parasitoid, Dinarmus basalis (Hymenoptera: Pteromalidae). J. Appl. Sci. Res., 4(8), 945-951.
Ferrao J.E.M. & Ferrao A.M.B.C., 1984. Contribuiçao para o estudo da semente de purgeira (Jatropha curcas L.) de S. Tomé e Principe. Garcia de Orta. Serie Estudos Agronomicos, 2(1/2), 23-31.
Foidl N. et al., 1996. Jatropha curcas L. as a source for production of biofuel in Nicaragua. Bioresour. Technol, 58, 77-82.
Freitas B.D., 1906. A Purgueirae o seu oleo. Lisboa: Typographia “a Editora”.
Gagnaux P., 2009. Entomofauna associada à cultura da Jatrofa (Jatropha curcas L.) em Moçambique. Projecto final. Maputo, Mozambique: Universidade Eduardo Mondlane, Faculdade de Agronomia e Engenharia Florestal.
Grimm C. & Maes J.M., 1997. Arthropod fauna associated with Jatropha curcas L. in Nicaragua: a synopsis of species, their biology and pest status. In: Gübitz G.M., Mittelbach M. & Trabi M., eds. Symposium on biofuel and industrial products from Jatropha curcas, February 23-27, 1997, Managua, Nicaragua. Graz, Austria: Technische Universität Graz.
Hedegaard K., Thyr K.A. & Wenzel H., 2008. Life cycle assessment of an advanced bioethanol technology in the perspective of constrained biomass availability. Environ. Sci. Technol., 42, 7992-7999.
Heller J., 1996. Physic nut: Jatropha curcas L. Promoting the conservation and use of underutilized and neglected crops. Roma: International Plant Genetic Resources Institute.
Manoharan T., Ambika S., Natarajan N. & Senguttuvan K., 2006. Emerging pest status of Jatropha curcas (L.) in south India. Indian J. Agroforestry, 8, 66-79.
Meshram P.B. & Joshi K.C., 1994. A new report of Spodoptera litura (Fab.) Boursin (Lepidoptera: Noctuidae) as a pest of Jatropha curcas Linn. Indian Forester, 120(3), 273-274.
Münch E. & Kiefer J., 1986. Le pourghère (Jatropha curcas L.). Botanique, écologie, culture (1ère partie). Produits de récolte, filières de valorisations, réflexions économiques (2è partie). Stuttgart, Allemagne : Université de Hohenheim.
Ogbebor N.O., Adekunle A.T. & Enobakhare D.A., 2007. Inhibition of Colletotrichum gloeosporioides (Penz) Sac. Causal organism of rubber (Hevea brasiliensis Muell. Arg.) leaf spot using plant extracts. Afr. J. Biotechnol, 6(3), 213-218.
Peixoto A.R., 1973. Plantas oleaginosas arboreas. Sao Paulo, Brazil: Livraria Nobel.
Peredo L.C., 2002. Description, biology, and maternal care of Pachycoris klugii (Heteroptera: Scutelleridae). Florida Entomol., 85(3), 464-473.
Prabhakar M., Prasad Y.G., Rao G.R. & Ramakrishna D., 2008. Pests of economic importance on Jatropha curcas L., a biodiesel plant in Andhra Pradesh, India. J. Entomon, 33(1), 83-86.
Rahuman A.A., Gopalakrishnan G., Venkatesan P. & Geetha K., 2007. Larvicidal activity of some Euphorbiaceae plant extracts against Aedes aegypti and Culex quinquefasciatus (Diptera: Culicidae). Parasitol. Res., 102(5), 867-873.
Ranga Rao G.V., Marimuttu S., Wani S.P. & Rameshwar Rao V., 2010. Insect pests of Jatropha curcas L. and their management. Information Bulletin. Patancheru, India: International Crops Research Institute for the Semi-Arid Tropics (ICRISAT).
Ratnadass A. et al., 1997. Perspectives de gestion bio-intensive des foreurs des tiges de sorgho en Afrique de l'Ouest. Insect Sci., 17(2), 227-233.
Regupathy A. & Ayyasamy R., 2011. Ants in biofuel, Jatropha ecosytem: pollination and phoresy. Hexapoda, 18(2), 168-175.
Rug M. & Ruppel A., 2000. Toxic activities of the plant Jatropha curcas against intermediate snail hosts and larvae of schistosomes. Trop. Med. Int. Health, 5(6), 423-430.
Saturnino H.M. et al., 2005. Cultura do pinhao-manso (Jatropha curcas L.). Cultivation of Jatropha curcas L. Informe Agropecuario, 26(229), 44-78.
Shanker C. & Dhyani S.K., 2006. Insect pests of Jatropha curcas L. and the potential for their management. Curr. Sci., 2(91), 162-163.
Solomon Raju A.J. & Ezradanam V., 2002. Pollination ecology and fruiting behaviour in a monoecious species, Jatropha curcas L. (Euphorbiaceae). Curr. Sci., 11(83), 1395-1398.
Solsoloy A.D. & Solsoloy T.S., 1997. Pesticidal efficacy of formulated product Jatropha curcas oil on pests of selected field crops. In: Gübitz G.M., Mittelbach M. & Trabi M., eds. Symposium on biofuel and industrial products from Jatropha curcas, February 23-27, 1997, Managua, Nicaragua. Graz, Austria: Technische Universität Graz.
Solsoloy A.D., Domingo E.O., Cacayorin M.D. & Damo M.C., 2000. Chemical insecticides for cotton pest control. In: Proceedings of Regional Research and Development Symposia, Jul.-Sep. 1999. Los Banos, Laguna, Philippines: Philippine Council for Agriculture, Forestry and Natural Resources Research and Development.
Terren M. et al., 2009. Nouveaux ennemis de Jatropha curcas L. identifiés au Sénégal. Poster. In : Dixième animation scientifique régionale du Réseau BIOVEG de l’AUF, 10 au 13 nov. 2009, Dakar, Sénégal.
Vassiliades G., 1984. Note sur les propriétés molluscicides de deux Euphorbiacées : Euphorbia tirucalli et Jatropha curcas. Essais en laboratoire Sénégal. Rev. Élevage Méd. Vét. Pays Trop., 37(1), 32-34.
Pour citer cet article
A propos de : Zakari Abdoul Habou
Univ. Liège - Gembloux Agro-Bio Tech. Unité d'Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : fverheggen@ulg.ac.be – Université Abdou Moumouni. Faculté d’Agronomie. BP 10960. Niamey (Niger).
A propos de : Éric Haubruge
Univ. Liège - Gembloux Agro-Bio Tech. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Toudou Adam
Université Abdou Moumouni. Faculté d’Agronomie. BP 10960. Niamey (Niger).
A propos de : François J. Verheggen
Univ. Liège - Gembloux Agro-Bio Tech. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






