- Home
- Volume 17 (2013)
- numéro 3
- Interactions des antibiotiques ituriniques avec la membrane plasmique. Apport des systèmes biomimétiques des membranes (synthèse bibliographique)
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Interactions des antibiotiques ituriniques avec la membrane plasmique. Apport des systèmes biomimétiques des membranes (synthèse bibliographique)

Editor's Notes
Reçu le 15 octobre 2012, accepté le 8 mai 2013
Résumé
Les antibiotiques ituriniques, produits par Bacillus subtilis, représentent une famille qui comprend l’iturine A, la mycosubtilline, les bacillomycines D, F et Lc. Ce sont des lipopeptides cycliques possédant des acides gras β-aminés reliés à un peptide formé par sept acides α-aminés avec une séquence chirale invariable dont la configuration type est LDDLLDL. Ils possèdent tous en commun les trois premiers acides α-aminés incluant le résidu tyrosyl. Ils sont connus essentiellement par leur pouvoir antifongique et ils ont également des propriétés antibactériennes et hémolytiques. Ces propriétés proviennent de leur nature amphiphile qui leur permet d’interagir avec différents constituants membranaires. Les stérols, qui se trouvent dans les membranes plasmiques, constituent le partenaire privilégié d’interaction de ces antibiotiques. Aussi, le groupement phénol du résidu tyrosine des antibiotiques est supposé avoir un rôle important pour la fixation des antibiotiques au niveau de la membrane plasmique. La finalité de cette fixation est souvent la lyse cellulaire. Il existe, au sein de la membrane plasmique, des régions particulières contenant une forte concentration en stérol. Ces microdomaines membranaires diffèrent du reste de la membrane plasmique par leur composition ; ils sont également enrichis en certains lipides et en certaines protéines. Les microdomaines interviennent dans divers processus cellulaires clés, leur perturbation peut donc engendrer de nombreuses conséquences. Du fait de leur composition, ces microdomaines peuvent constituer la cible des activités biologiques des antibiotiques ituriniques. Cette revue a pour but de faire la synthèse des travaux réalisés sur les antibiotiques ituriniques au niveau de leurs activités biologiques en focalisant sur la compréhension de celles-ci à l’échelle moléculaire avec une discussion sur leurs groupements chimiques clés et sur le potentiel des microdomaines membranaires en tant que cible privilégiée pour ces molécules.
Abstract
Interactions of iturinic antibiotics with plasma membrane. Contribution of biomimetic membranes. Iturinic antibiotics are produced by Bacillus subtilis strains and constitute a family including iturin A, mycosubtilin and bacillomycins D, F and Lc. These are cyclic lipopeptides with β-amino fatty acids linked up to a peptide constituted by seven α-aminoacids with an invariable LDDLLDL chiral sequence. The first three α-aminoacids containing the tyrosyl residue are the same for all members. They are well known for their strong antifungal activities but they also have antibacterial and hemolytic properties. These biological properties are due to their amphiphilic nature, allowing interactions with different membrane components. Sterols found in plasma membranes are the privileged interaction partners of these lipopeptides. Moreover, the tyrosyl residue of the iturinic antibiotics seems to play an important role during their fixation to the plasma membrane, the result of which is often cellular lysis. Within plasma membranes, there are particular regions with a high sterol content. These microdomains have a different composition compared to the rest of the membrane; they are rich in certain lipids and proteins and are involved in many key cellular processes. The perturbation of these microdomains could therefore have an important impact on the cell. Due to their composition, these microdomains may constitute the preferential target of iturin antibiotics. This review aims to summarize the studies relating to the biological activities of iturinic antibiotics. It focuses in particular on the existing knowledge regarding iturin antibiotics at the molecular level and discusses both the key chemical groups of these drugs and the potentiality of microdomains to constitute a target for these molecules.
Table of content
1. Introduction générale
1La membrane plasmique et les membranes délimitant les différents organites cellulaires possèdent une composition et une organisation plus ou moins bien définies. Le modèle général se repose sur une bicouche lipidique mosaïque dotée d’un caractère fluide (Singer et al., 1972). Cependant, ce modèle ne semble pas être satisfaisant pour l’ensemble de la structure des membranes depuis que Simons et al. (1997) ont mis en évidence les microdomaines dans les membranes plasmiques.
2Ces microdomaines, qui n’ont été mis en évidence que chez les eucaryotes, présentent une composition qui n’est pas similaire au reste de la membrane. Ils se présentent comme des clusters de lipides qui se trouvent dans un état très organisé et compact et qui sont assimilés à l’heure actuelle aux radeaux lipidiques (Pike, 2009). Ils sont enrichis en stérols (cholestérol chez les animaux), en sphingolipides et en certaines protéines comme celles présentant une ancre glycosylphosphatidylinositol (GPI) (Legler et al., 2005).
3L’importance des microdomaines provient des fonctions qui leur sont attribuées. Ces microdomaines sont considérés comme des plateformes de signalisation du fait des protéines qu’ils contiennent. Bien que plusieurs études soient en cours, il a été avancé qu’ils interviennent dans des phénomènes de reconnaissance antigènes-anticorps, dans des voies de signalisation conduisant à l’apoptose et même au cours de la reconnaissance du virus d’immunodéficience humaine (HIV) par les récepteurs des lymphocytes T (Lorizate et al., 2006 ; Boscher et al., 2012).
4La différence de composition des microdomaines leur confère des propriétés physico-chimiques différentes du reste de la membrane cytoplasmique. Les études réalisées permettent d’affirmer que ces microdomaines sont plus rigides par rapport au reste de la membrane et qu’ils ne sont pas solubles dans des détergents non ioniques (Triton X -100) à froid (Dorahy et al., 1996 ; Mirre et al., 1996 ; Bonnin et al., 2003).
5Ainsi, leur purification à partir d’un tissu repose sur cette propriété. À l’issue des purifications, on obtient des membranes résistantes aux détergents (en anglais DRM). Il existe alors une controverse entre les radeaux lipidiques et les DRM car l’isolement des DRM à partir des cellules ne prouve pas la coexistence de domaines plus ordonnés qui sont assimilés aux radeaux lipidiques et de domaines moins ordonnés (London, 2005 ; Young et al., 2005). Cependant, cette coexistence a été démontrée à l’aide des modèles membranaires mais reste ambigüe pour les membranes cellulaires car in vivo, les domaines riches en stérol et en sphingolipides peuvent avoir une taille très petite et une stabilité limitée (London, 2005). Donc in vitro, il est plus correct de parler de DRM (Domon et al., 2011). Les propriétés physico-chimiques différentes de ces DRM proviennent en grande partie de la présence du cholestérol. Le cholestérol s’insère dans la membrane grâce à sa partie hydrophobe composée de quatre cycles carbonés et une chaine hydrocarbonée ramifiée. Il interagit avec des molécules d’eau et d’autres molécules hydrophiles à l’extérieur de la bicouche lipidique par son groupement hydroxyle porté par le 3è carbone se trouvant au sein du premier cycle.
6L’altération du fonctionnement ainsi que l’intégrité cellulaire due à la perturbation des microdomaines membranaires demeure une hypothèse importante. Cette perturbation peut être générée en déstabilisant le cholestérol qui se trouve ancré dans des microdomaines.
7Ce point a attiré l’attention des chercheurs étudiant les mécanismes d’activités biologiques des antibiotiques ituriniques puisque ces molécules ont tendance à interagir préférentiellement avec les stérols.
8Ces antibiotiques sont produits par Bacillus subtilis et présentent une activité hémolytique et une forte activité antifongique (Maget-Dana et al., 1994). C’est cette propriété qui a permis d’isoler le premier composé de cette famille à partir d’une souche de B. subtilis découverte dans une des forêts de la province d’Ituri du Congo belge (actuellement République Démocratique du Congo) qui lui a donné le nom.
2. Historique des antibiotiques ituriniques
9Le premier antibiotique iturinique, l’iturine A, a été découvert en 1950 (Delcambe et al., 1950) à partir du milieu de culture d’une souche de B. subtilis présentant une activité antifongique. La détermination de sa séquence a permis de montrer que l’iturine A est un lipopeptide cyclique renfermant un acide gras β-aminé (Peypoux et al., 1978 ; Isogai et al., 1982). Par la suite, différentes souches de B. subtilis ont été cultivées afin de rechercher une activité antifongique dans leur milieu de culture. C’est ainsi que quatre nouveaux composés antifongiques de nature lipopeptidique et renfermant un acide gras β-aminé ont été découverts et forment, avec l'iturine A, la famille des antibiotiques ituriniques : ce sont la mycosubtiline (Walton et al., 1949), la bacillomycine Lc (Landy et al., 1948), la bacillomycine F (Mhammedi et al., 1982) et la bacillomycine D (Raubitschek et al., 1950). À côté de ceux-ci, d’autres composés ayant des activités antifongiques sont produits par B. subtilis mais n’appartiennent pas à la famille des ituriniques (Vanittanakom et al., 1986).
10Cette synthèse bibliographique se focalisera uniquement sur les cinq composés biologiquement actifs formant la famille des antibiotiques ituriniques.
11La structure des différentes isoformes de l’iturine A, qui ne diffèrent que par la nature des acides gras β-aminés, a été proposée d’abord par Peypoux et al. en 1978. Ces travaux ont été complétés par la découverte d’autres homologues de longueur de chaine différente (Isogai et al., 1982). La démarche a été quasiment similaire pour les autres antibiotiques ituriniques cités ci-dessus. En effet, la difficulté pour déterminer la structure des antibiotiques ituriniques provenait du fait que la liaison entre l’acide α-aminé en position 7 et l’acide gras β-aminé résistait à l’hydrolyse classiquement employée pour couper des liaisons peptidiques (Hourdou et al., 1994).
12Les études concernant l’activité biologique de ces antibiotiques ont été effectuées durant de longues années. Les résultats, qui seront présentés et discutés ultérieurement dans cette bibliographie, ont permis d’affirmer l’existence des activités hémolytique, antibactérienne et bien évidemment antifongique. L’activité antibactérienne reste limitée aux genres Micrococcus et Sarcina, tandis que l’activité antifongique présente un large spectre contre différents types de levures et de champignons (Besson et al., 1976 ; Besson et al., 1979a ; Hourdou et al., 1994).
13La cible cellulaire des antibiotiques ituriniques a été identifiée comme étant la membrane plasmique (Besson et al., 1978a ; Besson et al., 1978b ; Besson et al., 1979a ; Besson et al., 1979b ; Besson et al., 1984 ; Besson et al., 1989). L’analyse des mécanismes selon lesquels ces activités s’exercent met en avant une forte préférence de ces antibiotiques vis-à-vis des stérols comme partenaire d’interaction. Comme les stérols entrent dans la composition de la membrane cytoplasmique des levures, l’activité antifongique pourrait s’expliquer par la perturbation de l’organisation de cette membrane probablement via des interactions avec les stérols (Thimon et al., 1995). Les stérols peuvent se trouver dans des microdomaines mais aussi en dehors de ceux-ci au sein de la membrane plasmique.
14Cependant, la question principale réside dans le fait que les antibiotiques ituriniques pourraient perturber l’environnement du stérol se trouvant au sein des microdomaines membranaires.
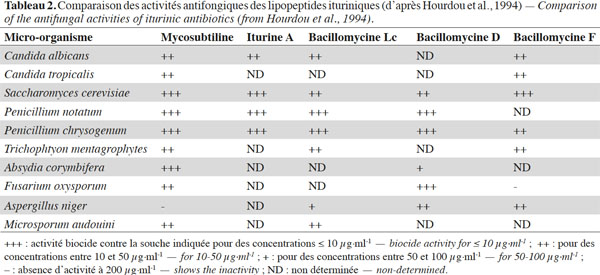
3. Structure originale des antibiotiques ituriniques : de la séquence à la conformation
15Les antibiotiques ituriniques sont des composés pourvus d’une structure originale puisqu’ils renferment des acides α-aminés de série D dont la synthèse n’est possible que chez les bactéries.
16Le premier antibiotique iturinique dont la structure a été décrite dans sa totalité est l’iturine A (Peypoux et al., 1978 ; Isogai et al., 1982) (Figure 1).
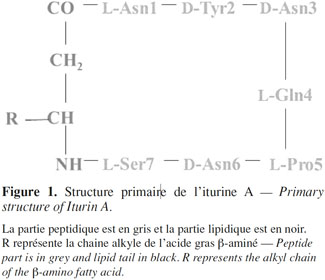
17La structure de la mycosubtiline a été décrite pour la première fois en 1976 puis révisée en 1986 (Peypoux et al., 1976 ; Peypoux et al., 1986). La séquence peptidique est la suivante : L-Asn-D-Tyr-D-Asn-L-Gln-L-Pro-D-Ser-L-Asn. Ainsi, les résidus D-Asn-6 et L-Ser-7 de l’iturine A sont remplacés par les résidus D-Ser-6 et L-Asn-7 dans la mycosubtiline.
18Les structures des bacillomycines D et F ont été déterminées ensuite (Peypoux et al., 1981 ; Peypoux et al., 1985). La particularité des bacillomycines est qu’elles contiennent des résidus L-Glu et L-Thr dans leur séquence peptidique.
19Enfin, le dernier antibiotique de la famille des ituriniques qui sera mentionné dans cette synthèse bibliographique est la bacillomycine L qui a été identifiée ultérieurement à la bacillomycine Lc. En effet, une première séquence peptidique a été décrite pour la bacillomycine L en 1977 (Besson et al., 1977). Cet antibiotique a été dénommé ainsi jusqu’au moment où Volpon et al. (2007) ont révisé cette séquence en réalisant une analyse méthodique de la séquence par RMN (Tableau 1). La séquence définitive de cette bacillomycine est : L-Asn-D-Tyr-D-Asn-L-Ser-L-Glu-D-Ser-L-Thr. Cette séquence correspond à celle de la bacillomycine Lc décrite par Eshita et al. (1995).
20À l’issue de ces études structurales, une généralité a été mise en évidence concernant la chaine peptidique des antibiotiques ituriniques. La configuration des acides aminés constituant cette chaine est LDDLLDL et tous les lipopeptides ituriniques ont en commun la séquence suivante d’acides aminés : Acide gras β-aminé- L-Asn-D-Tyr-D-Asn.
21La nature des acides gras β-aminés a aussi été analysée. Les acides gras varient d’un antibiotique iturinique à l’autre et contiennent de 14 à 17 atomes de carbone. Leur caractérisation a permis de distinguer deux groupes d’antibiotiques ituriniques. Le premier groupe comprend l’iturine A, les bacillomycines Lc et D avec des acides gras β-aminés de 14 à 16 carbones (majoritairement une chaine à nombre pair de carbones), tandis que le deuxième groupe inclut la mycosubtiline et la bacillomycine F avec 15 à 17 carbones (majoritairement une chaine de nature iso à 16 carbones) (Hourdou et al., 1989) (Tableau 1).
22Lorsque la nature de la chaine carbonée de l’acide gras est n, les groupements –CH2 sont enchainés les uns à la suite des autres et à la fin de la chaine, il y a un groupement –CH3. Dans le cas de la nature iso, l’antépénultième carbone (le groupement-CH) porte deux groupements -CH3 identiques, tandis que dans le cas de la nature anteiso, l’antépénultième carbone porte un groupement –CH3 d’une part et un groupement CH2 suivi d’un groupement CH3 d’autre part.
23Ensuite, l’iturine A, la mycosubtiline, la bacillomycine Lc et la bacillomycine D ont fait l’objet d’études conformationelles par spectroscopie FT-IR et RMN (Marion et al., 1986 ; Genest et al., 1987 ; Besson et al., 1996 ; Besson et al., 1997 ; Volpon et al., 2007 ; Nasir et al., 2012b). Ces lipopeptides cycliques contenant un nombre restreint d’acides aminés sont stabilisés par des structures de type coude avec des liaisons hydrogène impliquant la chaine peptidique. Ils peuvent être stabilisés soit par des coudes β impliquant 4 résidus, soit par des coudes γ impliquant 3 résidus (Nasir et al., 2013 ; Vass et al., 2003). Dans le cas des coudes γ, il y a une liaison hydrogène entre le groupement CO du premier résidu (i) et le groupement NH du résidu i+2 tandis que dans le cas des coudes β, la liaison hydrogène se forme entre le groupement CO du résidu i et le groupement NH du résidu i+3. Le résidu i varie d’un composé à l’autre.
24Le cycle de l’iturine A est stabilisé par des liaisons hydrogène impliquant une interaction du groupement CO (de la chaine principale) de la Gln avec le groupement NH de la Ser ainsi que le groupement NH de l’acide gras β-aminé. Ce type de stabilisation correspond à des coudes de type β. Par conséquent, la région de l’iturine A comprenant la séquence L-Pro5D-Asn6 présente une certaine rigidité, tandis que les chaines latérales des L-Asn1D-Tyr2D-Asn3 sont plus flexibles. Cette flexibilité semble rendre favorable leur interaction avec l’environnement (Marion et al., 1986).
25La mycosubtiline diffère de l’iturine A au niveau de sa séquence peptidique par l’inversion des deux derniers acides aminés (Tableau 1). Cette différence, bien que minime, confère à la mycosubtiline une conformation différente. La mycosubtiline est stabilisée par des structures de type C7, qui sont considérées équivalentes à des coudes γ impliquant des liaisons hydrogène entre le groupement CO (de la chaine principale) de la Gln et le groupement NH de la Ser et entre le groupement CO de la Pro et le groupement NH de l’Asn7. Par conséquent, la région de la Pro est plutôt rigide, tandis que le voisinage de la Tyr est flexible (Genest et al., 1987).
26Dans le cas de la bacillomycine Lc, une stabilisation de la structure par des coudes β, semblables à ceux de l’iturine A, a été observée. Les liaisons hydrogène impliquent le groupement CO de Glu et le groupement NH de l’acide gras β-aminé. Toutefois, il pourrait exister une population restreinte de la bacillomycine Lc qui serait stabilisée par des structures de type coude γ (Volpon et al., 2007) (Figure 2).
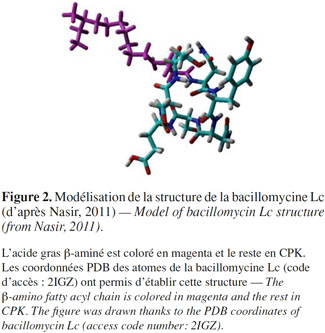
27L’acide gras β-aminé est coloré en magenta et le reste en CPK. Les coordonnées PDB des atomes de la bacillomycine Lc (code d’accès : 2IGZ) ont permis d’établir cette structure.
28La bacillomycine Lc présente donc une rigidité structurale importante. Pourtant, les chaines latérales des résidus Asn et Tyr sont flexibles. À partir des données RMN, la structure de la bacillomycine Lc, la bacillomycine D a pu être modélisée par homologie car les deux lipopeptides ne diffèrent qu’au niveau du 4e acide aminé par le remplacement de Ser par Pro et présentent donc un taux d’identité de l’ordre de 85 % (Nasir et al., 2012a). Le modèle montre que malgré des similitudes de séquences, le repliement dans l’espace est différent pour la bacillomycine D comparé à Lc. Cependant, on retrouve également une flexibilité du résidu Tyr et de la chaine lipidique.
4. Activités biologiques des antibiotiques ituriniques
29Les antibiotiques ituriniques présentent une multitude d’activités biologiques au niveau de différentes espèces. Certes, leur activité antifongique reste la plus importante, mais leurs activités hémolytique et antibactérienne ne sont pas négligeables. De plus, ils sont suspectés d’avoir une activité antiproliférative. Toutes ces activités biologiques leur confèrent un potentiel d’application dans le domaine médical ou phytosanitaire.
4.1. Activité antifongique
30L’activité antifongique des antibiotiques ituriniques a fait l’objet de nombreuses publications scientifiques. Ceci peut s’expliquer par la découverte de ces antibiotiques grâce à leur activité forte et efficace contre différents champignons et levures (Tableau 2).
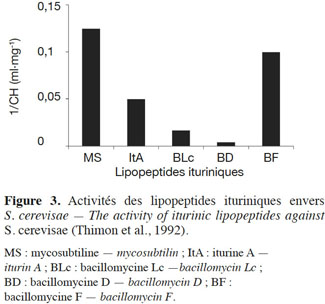
31Les travaux consistaient en grande partie à tester l’effet des antibiotiques ituriniques vis-à-vis des organismes unicellulaires eucaryotes comme la levure S. cerevisiae et à comprendre leurs modes d’action. Ainsi, les concentrations inhibitrices minimales (CMI) pour les différents antibiotiques ont pu être obtenues (Besson et al., 1979a). La figure 3 représente l’inverse de la CMI qui est reliée à l'activité du lipopeptide (Thimon et al., 1992). Pour un lipopeptide donné, plus 1/CMI est élevé, plus le lipopeptide est actif. La mycosubtiline est le lipopeptide le plus actif parmi les ituriniques puisque sa 1/CMI est la plus élevée.
32Il a aussi été démontré que les antibiotiques ituriniques lysent des sphéroplastes de S. cerevisiae et ont un effet inhibiteur sur la synthèse de macromolécules biologiques (Besson et al., 1984 ; Latoud et al., 1987). L’interaction de l’iturine A avec la membrane de la levure a été confirmée en suivant en parallèle les sorties d’ions et de macromolécules induites par l’iturine A. Ces sorties augmentent avec la concentration de l’iturine A.
33La quantité de stérol présente au sein de la membrane plasmique influence considérablement leur action. Parmi les différents stérols, l’interaction la plus forte a été trouvée pour le cholestérol (Latoud et al., 1990).
4.2. Activité hémolytique
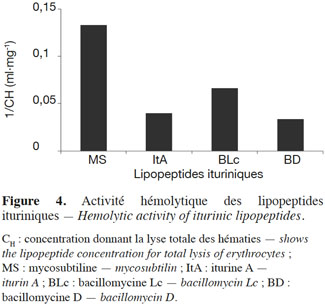
34Les antibiotiques ituriniques sont dotés d’une activité lytique envers les cellules humaines de globules rouges. La lyse des hématies dépend de la concentration de l’antibiotique et s’accompagne le plus souvent de la sortie d’ions K+ vers le milieu extérieur (Quentin et al., 1982). La concentration donnant la lyse totale des hématies (CH) a été déterminée pour chaque lipopeptide iturinique, sauf la bacillomycine F, et a été calculée pour le même nombre de cellules (Quentin et al., 1982 ; Tenoux et al., 1991). La figure 4 montre l’inverse de la CH, qui est reliée à l’activité hémolytique, pour différents lipopeptides. Pour un lipopeptide donné, plus 1/CH est élevée, plus le lipopeptide est hémolytique. La mycosubtiline est de loin le lipopeptide qui possède l’activité hémolytique la plus élevée.
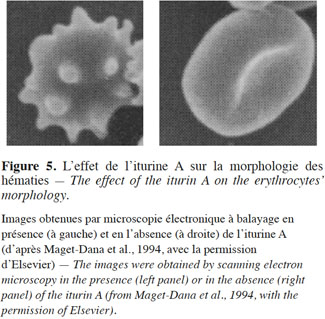
35Thimon et al. (1994) ont démontré que la morphologie des hématies subit des modifications importantes suite à l’action de l’iturine A (Figure 5).
36Aranda et al. (2005) ont suggéré la formation d’un pore après l’action de l’iturine A. Pour cela, les auteurs ont essayé d’empêcher l’action de l’iturine A en ajoutant dans le milieu des osmoprotecteurs comme le saccharose et le polyéthylèneglycol. Le diamètre de l’osmoprotecteur s’est avéré fondamental pour son action préventive. Plus le diamètre était important, plus la prévention d’hémolyse était efficace. Par conséquent, il a été avancé que l’osmoprotecteur venait combler « le trou » créé au niveau de la membrane plasmique par l’action de l’iturine et empêchait les ions K+ de sortir de la cellule.
4.3. Activité antibactérienne
37L’activité antibactérienne des antibiotiques ituriniques est réduite à deux genres de bactéries, Micrococcus et Sarcina (Besson et al., 1978a). Concernant Micrococcus luteus, la présence d’iturine A dans le milieu prévient la croissance bactérienne et, à partir d’une certaine concentration, provoque la lyse des protoplastes des bactéries. La façon dont interagissent les antibiotiques ituriniques avec la membrane cytoplasmique a été précisée en ajoutant du MgCl2 au milieu d’incubation des protoplastes. MgCl2 inhibe l’action de l’iturine A. Cette inhibition peut s’expliquer par la perturbation des interactions polaires entre la partie peptidique de l’antibiotique et les composants polaires de la membrane (Besson et al., 1978a ; Besson et al., 1978b).
4.4. Activité antiproliférative
38L’activité antiproliférative de l’iturine A a été mise en évidence sur des ovocytes des étoiles de mer (Tsuchimori et al., 1986). Un blocage de la séparation des membranes cytoplasmique des cellules à la fin de la division survient lorsqu’elles sont traitées avec de l’iturine A. Donc, l’iturine A semble agir durant la télophase de la mitose. En effet, en présence de l’iturine A, on observe un nombre important de noyaux dans « une cellule ».
5. Relations structure-activité
39Après avoir déterminé les particularités structurales des antibiotiques ituriniques (conservation d’une alternance LDDLLDL pour les acides aminés, présence de la séquence acide gras β-aminé – L-Asn –D-Tyr – D-Asn dans tous les lipopeptides ituriniques) ainsi que leurs spécificités biologiques (spectre antifongique étendu et très forte activité), il s’est avéré intéressant de déterminer la relation structure-activité de ces antibiotiques afin d’identifier les groupements nécessaires et de comprendre leur mode d’action.
40La chaine hydrocarbonée semble jouer un rôle important au moment de l’insertion du lipopeptide iturinique au sein de la membrane plasmique des cellules cibles. Les lipopeptides ituriniques dépourvus de cette chaine restent inactifs (Bland et al., 1991). La nature et la longueur des chaines hydrocarbonées des acides gras β-aminés jouent également un rôle dans les activités biologiques des antibiotiques ituriniques. Plus la chaine acyle est longue, plus le lipopeptide est actif. La ramification de type iso augmente aussi l’activité par rapport à la forme n pour le même nombre d’atomes de carbone (Bland et al., 1991 ; Maget-Dana et al., 1994).
41Le blocage de la fonction alcool des résidus séryles par acétylation ou méthylation diminue l’activité biologique par rapport à l’état natif. Cependant, l’effet n’est pas aussi drastique que dans le cas de la méthylation ou l’acétylation de la fonction –OH phénolique du résidu tyrosyle (Besson et al., 1979a). L’hydroxyle phénolique du résidu tyrosyle est indispensable pour l’activité biologique. En effet, le blocage de cette fonction par une méthylation ou une acétylation diminue très fortement l’activité biologique des lipopeptides ituriniques testés (mycosubtiline, iturine A, bacillomycine Lc) (Besson et al., 1979a).
42D’autre part, afin de comprendre la nature des interactions impliquant la fonction –OH phénolique, les structures résolues par RMN et modélisées de la bacillomycine Lc native ou méthylée sur la tyrosine ont été comparées. Ces modèles montrent que la formation d’une liaison hydrogène impliquant la fonction –OH phénolique de la forme native est possible, alors qu’elle ne l’est pas dans le cas de la bacillomycine Lc méthylée (Volpon et al., 1999).
6. Microdomaines membranaires et antibiotiques ituriniques
6.1. Rôle supposé des microdomaines sur l’action des antibiotiques ituriniques
43In vivo, la membrane plasmique renferme des zones riches en stérols et en sphingolipides représentant des structures sous forme de micro-assemblages. Bien que la plus grande partie des stérols réside au niveau de ces microdomaines, il ne faut pas oublier que des stérols existent en dehors de ces zones (Simons et al., 1997). Afin de caractériser et de purifier ces structures, on se base sur l’insolubilité de celles-ci dans des détergents non ioniques à froid. Cependant, les questions suivantes se posent pour la communauté scientifique : « Est-ce que la fraction purifiée ne contient que des microdomaines membranaires ? » ou « Des zones représentant une composition similaire contenant des stérols et des sphingolipides se sont-elles assemblées par action du détergent ? »
44Comme décrit précédemment, l’interaction des antibiotiques ituriniques avec la membrane plasmique perturbe sa composition. Après l’incubation des cellules de levures avec de l’iturine A, d’importantes modifications au niveau de la membrane plasmique ont été observées (Latoud et al., 1987). Ces modifications se traduisent par une augmentation du taux des acides gras associée à une diminution du taux de phospholipides. Parallèlement, on observe que certains composants cellulaires sont relargués du cytoplasme vers l’extérieur. Ainsi, ces modifications de la membrane cytoplasmique s’expliquent par une éventuelle activation des phospholipases par les antibiotiques ituriniques (Latoud et al., 1990).
45D’une part, l’effet de l’iturine A dépend de sa fixation sur la membrane cytoplasmique et l’intensité de la perturbation induite par cet antibiotique dépend de la présence de stérols dans la membrane (Besson et al., 1979a). Les stérols semblent donc être des partenaires d’interaction privilégiés des antibiotiques ituriniques.
46D’autre part, étant donné que les stérols sont enrichis dans les microdomaines membranaires, l’étude des mécanismes d’action des antibiotiques ituriniques sur ces zones particulières de la membrane cytoplasmique devrait permettre de mieux comprendre la structure et la fonction de ces microdomaines.
6.2. Apport des membranes biomimétiques
47Actuellement, la compréhension de l’assemblage supramoléculaire des microdomaines membranaires ainsi que l’étude de l’effet d’un composé sur ceux-ci passent par des méthodes de reconstitution in vitro de systèmes biomimétiques tels que les liposomes, des bicouches planes ou des monocouches de Langmuir (pour une revue générale, voir Eeman et al., 2010).
48Les bicouches planes (black lipid membrane, BLM) sont largement utilisées en tant que modèle afin de déterminer la perméabilité ionique de différentes membranes après action des antibiotiques ituriniques (Maget-Dana et al., 1994). Tous les antibiotiques ituriniques induisent la perméabilité des BLM formées par des phospholipides (Maget-Dana et al., 1985a ; Maget-Dana et al., 1985b). Cette perméabilisation se fait de manière progressive, sauf dans le cas de la mycosubtiline (Maget-Dana et al., 1985a ; Maget-Dana et al., 1990) pour laquelle elle se fait de manière brusque. Ces résultats suggèrent que les molécules de mycosubtiline s’associent entre elles avant d’interagir avec des lipides constitutifs des BLM, tandis que les molécules d’iturine A interagissent avec les lipides des BLM sous forme de monomères. À l’issue de ces études, l’iturine A et la mycosubtiline ont été identifiées comme deux membres de la famille des antibiotiques ituriniques induisant plus de perméabilité des BLMs. Afin d’avoir plus d’information à l’échelle moléculaire concernant les associations des antibiotiques ituriniques avec les lipides des membranes plasmiques, les mêmes auteurs ont utilisé les monocouches de Langmuir comme modèle. Le modèle de monocouche permet de faire des mesures thermodynamiques plus précises (Suzuki et al., 1985 ; Maget-Dana, 1999). Le comportement de l’iturine A et la mycosubtiline a été alors testé en présence des monocouches lipidiques. Ces deux antibiotiques ituriniques sont miscibles avec des phospholipides mais interagissent très fortement avec les monocouches de cholestérol et d’ergostérol (Maget-Dana et al., 1989 ; Maget-Dana et al., 1990). Ils interagissent aussi fortement avec des monocouches mixtes phospholipides/stérol. Ces études ont réellement ouvert la voie de la compréhension des mécanismes d’interactions à l’échelle moléculaire des antibiotiques ituriniques avec leur cible biologique. Cependant, à cette époque, il était difficile de faire une analyse systématique et complète des monocouches comme à l’heure actuelle, du fait du manque des technologies et des outils adaptés. D’autres études ont alors été menées sur la mycosubtiline, le composé le plus actif d’un point de vue antifongique et hémolytique des antibiotiques ituriniques, en utilisant des monocouches de Langmuir ainsi que les liposomes et des outils d’analyse plus performants. Avec ces nouveaux outils, il a été montré que lors des interactions avec les phospholipides, la nature de ceux-ci n’intervenait pas de façon particulière, que ce soient des glycéro- ou sphingolipides, indiquant que ce sont des interactions peu ou pas spécifiques. Au niveau moléculaire, les techniques spectroscopiques ont montré que les chaines alkyles des phospholipides jouaient un rôle important lors de ces interactions. Les interactions mycosubtiline-phospholipides sont plutôt hydrophobes et semblent faire intervenir la chaine carbonée de l’acide gras β-aminé du lipopeptide (Nasir et al., 2010). Ceci est en accord avec des études précédentes montrant que l’absence d’une chaine carbonée donne un composé biologiquement inactif (Bland et al., 1991).
49Cependant, en accord avec les travaux montrant un antagonisme du cholestérol pour l’activité antifongique de la mycosubtiline (Besson et al., 1979a) et avec les études présentant l’inhibition de l’activité hémolytique du lipopeptide en présence des vésicules lipidiques contenant du cholestérol (Besson et al., 1989), les études les plus récentes (Nasir et al., 2011 ; Nasir et al., 2012a ; Nasir et al., 2012b) ont montré un rôle important des stérols lors des interactions de la mycosubtiline avec des systèmes biomimétiques. Plus particulièrement, la fonction alcool secondaire des stérols semble primordiale vu que son blocage par acétylation diminue considérablement les interactions (Nasir et al., 2011 ; Nasir et al., 2012b).
50Les résultats décrits dans la littérature constituent donc une base solide de l’hypothèse selon laquelle la mycosubtiline interagit préférentiellement avec les stérols des membranes plasmiques des cellules cibles. Les études menées sur les interactions de la mycosubtiline avec différentes monocouches lipidiques supportent cette hypothèse (Tableau 3). Ces études ont déterminé « la pression d’exclusion », un paramètre qui informe sur le pouvoir d’interaction d’une molécule avec une monocouche lipidique donnée. Au sein des membranes biologiques, la pression latérale est estimée à 30-35 mN·m-1 (Marsh, 1996). Bien que la composition des membranes soit complexe et variée, une valeur de pression d’exclusion obtenue à partir des expériences menées sur les monocouches et supérieure à la pression latérale des membranes biologiques est considérée comme une situation favorable pour l’insertion d’une molécule donnée dans les membranes. L’augmentation de la valeur de la pression d’exclusion d’une monocouche à une autre indique une meilleure insertion de la molécule. En résumé, il peut être avancé que plus la valeur de la pression d’exclusion est importante, plus l’interaction est favorable.
51Les stérols ne se trouvent jamais seuls dans les membranes plasmiques ; ils sont entourés d’autres lipides. Il a été alors adopté une stratégie consistant à constituer des systèmes biomimétiques de plus en plus complexes afin d’approcher le plus possible la composition lipidique de la membrane plasmique des cellules cibles du lipopeptide (Tableau 3). L’analyse des interactions de la mycosubtiline avec de tels systèmes montre que le lipopeptide s’insère aussi bien dans des monocouches constituées de DPPC/sphingomyéline/cholestérol que dans des monocouches formées uniquement de cholestérol. De plus, le lipopeptide s’insère plus facilement dans des monocouches de DPPC/sphingomyéline/cholestérol (1/1/1, mole/mole/mole) que dans des monocouches de DPPC/cholestérol (7/3, mole/mole) malgré la teneur quasi-identique en cholestérol de ces deux types de monocouches. Ces données suggèrent que les interactions de la mycosubtiline avec les stérols sont plus fortes lorsque les stérols sont en présence de sphingomyéline et de DPPC, ce qui correspond à une monocouche dans un état plus ordonné (Nasir et al., 2011).
52La figure 6 montre les images obtenues par la microscopie à l’angle de Brewster des monocouches de DPPC/sphingomyéline/cholestérol (1/1/1, mole/mole/mole) en absence et en présence de la mycosubtiline. Des changements morphologiques importants de la monocouche ont été observés après insertion de la mycosubtiline. La monocouche lipidique en absence de la mycosubtiline présente une organisation homogène tandis qu’en présence de la mycosubtiline, une organisation hétérogène est observée avec l’apparition des domaines au sein de la monocouche mixte. Cette apparition peut être liée à la coexistence de domaines formés soit par les différents lipides entre eux après action de la mycosubtiline, soit par un mélange de la mycosubtiline et des lipides, soit par des molécules de mycosubtiline seules entre elles (Nasir et al., 2011).

53De plus, le modèle membranaire constitué de DPPC/sphingomyéline/cholestérol utilisé lors de ces études peut être considéré comme un modèle membranaire mimant la composition de certains microdomaines membranaires. Comme la mycosubtiline semble montrer une préférence pour les stérols qui se trouvent incorporés dans des systèmes composés de phosphatidylcholine à chaine acyle saturée, de sphingomyéline et de cholestérol, une hypothèse serait qu’elle agit au niveau des radeaux lipidiques se trouvant au sein des membranes plasmiques des cellules sensibles. Il existe deux arguments majeurs en faveur de cette hypothèse : l’existence de tels radeaux au sein des membranes plasmiques des érythrocytes (Koumanov et al., 2005) et le fait que les lipopeptides ituriniques sont actifs sur les érythrocytes. De plus, dans le cas de l’iturine A, qui ne diffère de la mycosubtiline que par l’inversion de deux acides aminés, il a été démontré que ce lipopeptide lyse les globules rouges en libérant dans le milieu des vésicules riches en stérol, sphingomyéline et phosphatidylcholine (Thimon et al., 1994). Ces deux arguments suggèrent donc que l’action des antibiotiques ituriniques peut avoir lieu au niveau des radeaux lipidiques.
7. Conclusion et perspectives
54Les antibiotiques ituriniques sont des molécules dotées de propriétés antimicrobiennes. La cible de leur activité biologique est la membrane plasmique des cellules sensibles. Cet article avait pour but de rassembler les travaux sur les propriétés biologiques des antibiotiques ituriniques mais surtout ceux qui essayent de « décortiquer » les mécanismes moléculaires de cette activité. Bien qu’une revue rédigée il y a vingt ans (Maget-Dana et al., 1994) existe sur le sujet, une mise au point était nécessaire vu le développement des outils dans le domaine permettant d’accéder à des informations plus précises. Ainsi, à l’heure actuelle, nous savons que les microdomaines membranaires enrichis en stérol pourraient constituer la cible privilégiée de ces molécules et que l’alcool secondaire des stérols ainsi que la fonction phénol du résidu tyrosine semblent jouer un rôle essentiel.
55Des études complémentaires sur des cellules sensibles en purifiant et en analysant les microdomaines membranaires en absence et en présence d’action de lipopeptides ituriniques sont nécessaires pour confirmer cette hypothèse.
56Remerciements
57Mehmet Nail Nasir remercie l’Université de Liège pour son poste de chercheur postdoctoral. Magali Deleu remercie le F.N.R.S. pour son poste de chercheur qualifié.
Bibliographie
Aranda F.J., Teruel J.A. & Ortiz A., 2005. Further aspects on the hemolytic activity of the antibiotic lipopeptide iturin A. Biochim. Biophys. Acta, 1713, 51-56.
Besson F., Peypoux F., Michel G. & Delcambe L., 1976. Characterization of iturin A in antibiotics from various strains of Bacillus subtilis. J. Antibiot., 29, 1043-1049.
Besson F., Peypoux F., Michel G. & Delcambe L., 1977. The structure of bacillomycin L, an antibiotic from Bacillus subtilis. FEBS, 77, 61-67.
Besson F., Peypoux F., Michel G. & Delcambe L., 1978a. Mode of action of iturin A, an antibiotic isolated from Bacillus subtilis, on Micrococcus luteus. Biochem. Biophys. Res. Commun., 81, 297-304.
Besson F., Peypoux F. & Michel G., 1978b. Action of mycosubtilin and of bacillomycin L on Micrococcus luteus cells and protoplasts: influence of the polarity of the antibiotics upon their action on the bacterial cytoplasmic membrane. FEBS Lett., 90, 36-40.
Besson F., Peypoux F., Michel G. & Delcambe L., 1979a. Antifungal activity upon Saccharomyces cerevisiae of iturin A, mycosubtilin, bacillomycin L and of their derivatives; inhibition of this antifungal activity by lipid antagonists. J. Antibiot., 32, 828-833.
Besson F., Peypoux F. & Michel G., 1979b. Interactions between bacterial membranes and peptidolipids: lysis of Micrococcus luteus protoplasts by derivatives of peptidolipidic antibiotics from Bacillus subtilis. Biochim. Biophys. Acta, 552, 558-562.
Besson F., Peypoux F., Quentin M.J. & Michel G., 1984. Action of antifungal peptidolipids from Bacillus subtilis on the cell membrane of Saccharomyces cerevisiae. J. Antibiot., 37, 172-177.
Besson F. & Michel G., 1989. Action of mycosubtilin, an antifungal antibiotic of Bacillus subtilis, on the cell membrane of Saccharomyces cerevisiae. Microbios, 59, 113-121.
Besson F., Raimbault C., Hourdou M.L. & Buchet R., 1996. Solvent-induced conformational modifications of iturin A: an infrared and circular dichroic study of a L,D-lipopeptide of Bacillus subtilis. Spectrochim. Acta Part A, 52, 793-803.
Besson F. & Buchet R., 1997. Solvent-induced conformational changes of a cyclic l,d-lipopeptide mycosubtilin and of its O-methyltyrosine derivative. A search for hydrogen bonds by FTIR spectroscopy. Spectrochim. Acta Part A, 53, 1913-1923.
Bland J.M., Lax A.R. & Klich M.A., 1991. Structure activity studies of the iturins. not GLP. In: Giralt D. & Andreu D., eds. Peptides. Leiden, The Netherlands: Escom Science Publishers, 426-427.
Bonnin S. et al., 2003. Protein and lipid analysis of detergent-resistant membranes isolated from bovine kidney. Biochimie, 85, 1237-1244.
Boscher C. & Nabi I.R., 2012. Caveolin-1: role in cell signaling. Adv. Exp. Med. Biol., 729, 29-50.
Delcambe L. & Welsch M., 1950. L’iturine, nouvel antibiotique produit par un Bacillus subtilis. C.R. Soc. Biol. Belg., 144, 1431-1434.
Domon M. et al., 2011. Annexins as organizers of cholesterol- and sphingomyelin-enriched membrane microdomains in Niemann-Pick type C disease. Cell Mol. Life Sci., 69, 1173-1785.
Dorahy D.J., Lincz L.F., Meldrum C.J. & Burns G.F., 1996. Biochemical isolation of a membrane microdomain from resting platelets highly enriched in the plasma membrane glycoprotein CD36. Biochem. J., 319, 67-72.
Eeman M. & Deleu M., 2010. From biological membranes to biomimetic model membranes. Biotechnol. Agron. Soc. Environ., 14, 719-736.
Eshita S.M. et al., 1995. Bacillomycin Lc, a new antibiotic of the iturin group: isolations, structures, and antifungal activities of the congeners. J. Antibiot., 48, 1240-1247.
Genest M., Marion D., Caille A. & Ptak M., 1987. Modelling and refinement of the conformation of mycosubtilin in solution from two-dimensional NMR data. FEBS, 169, 389-398.
Hourdou M.L., Besson F., Tenoux I. & Michel G., 1989. Fatty acid and beta-amino acid syntheses in strains of Bacillus subtilis producing iturinic antibiotics. Lipids, 24, 940-944.
Hourdou M.L. & Besson F., 1994. Surfactine et antibiotiques ituriniques : structure, propriétés et biosynthèse des lipopeptides de Bacillus subtilis. Regard Biochim., 1, 35-42.
Isogai I., Takayama S., Murakoshi S. & Suzuki A., 1982. Structures of β-amino acids in antibiotics iturin A. Tetrahedron Lett., 23, 3065-3068.
Koumanov K.S. et al., 2005. Comparative lipid analysis and structure of detergent-resistant membrane raft fractions isolated from human and ruminant erythrocytes. Arch. Biochem. Biophys., 434, 150-158.
Landy M. & Warren G.H., 1948. Bacillomycin; an antibiotic from Bacillus subtilis active against pathogenic fungi. Proc. Soc. Exp. Biol. Med., 67, 539-541.
Latoud C., Peypoux F. & Michel G., 1987. Action of iturin A, an antifungal antibiotic from Bacillus subtilis, on the yeast Saccharomyces cerevisiae: modifications of membrane permeability and lipid composition. J. Antibiot., 40, 1588-1595.
Latoud C., Peypoux F. & Michel G. 1990. Interaction of iturin A, a lipopeptide antibiotic, with Saccharomyces cerevisiae cells: influence of the sterol membrane composition. Can. J. Microbiol., 36, 384-389.
Legler D.F. et al., 2005. Differential insertion of GPI-anchored GFPs into lipid rafts of live cells. FASEB J., 19, 73-75.
London E., 2005. How principles of domain formation in model membranes may explain ambiguities concerning lipid raft formation in cells. Biochim. Biophys. Acta, 1746, 203-220.
Lorizate M. et al., 2006. Recognition and blocking of HIV-1 gp41 pre-transmembrane sequence by monoclonal 4E10 antibody in a raft-like membrane environment. J. Biol. Chem., 281, 39598-39606.
Maget-Dana R., 1999. The monolayer technique: a potent tool for studying the interfacial properties of antimicrobial and membrane-lytic peptides and their interactions with lipid membranes. Biochim. Biophys. Acta, 1462, 109-140.
Maget-Dana R. et al., 1985a. Bacterial lipopeptides induce ion-conducting pores in planar bilayers. Biochem. Biophys. Res. Commun., 129, 965-971.
Maget-Dana R., Ptak M., Peypoux F. & Michel G., 1985b. Pore-forming properties of iturin A, a lipopeptide antibiotic. Biochim. Biophys. Acta, 815, 405-409.
Maget-Dana R., Harnois I. & Ptak M., 1989. Interactions of the lipopeptide antifungal iturin A with lipids in mixed monolayers. Biochim. Biophys. Acta, 981, 309-314.
Maget-Dana R. & Ptak M., 1990. Iturin lipopeptides: interactions of mycosubtilin with lipids in planar membranes and mixed monolayers. Biochim. Biophys. Acta, 1023, 34-40.
Maget-Dana R. & Peypoux F., 1994. Iturins, a special class of pore-forming lipopeptides: biological and physicochemical properties. Toxicology, 87, 151-174.
Marion D. et al., 1986. Conformational study of bacterial lipopeptides: refinement of the structure of iturin A in solution by two-dimensional 1H-NMR and energy calculations. Biopolymers, 25, 153-170.
Marsh D., 1996. Lateral pressure in membranes. Biochim. Biophys. Acta, 1286, 183-223.
Mhammedi A., Peypoux F., Besson F. & Michel G., 1982. Bacillomycin F, a new antibiotic of iturin group: isolation and characterization. J. Antibiot., 35, 306-311.
Mirre C. et al., 1996. Detergent-resistant membrane microdomains from Caco-2 cells do not contain caveolin. Am. J. Physiol., 271, C887-894.
Nasir M.N., 2011. Caractérisation biophysique des interactions de la mycosubtiline, agent antimicrobien, avec des systèmes membranaires biomimétiques. Thèse de doctorat : Université Claude Bernard Lyon 1 (France).
Nasir M.N., Thawani A., Kouzayha A. & Besson F., 2010. Interactions of the natural antimicrobial mycosubtilin with phospholipid membrane models. Colloids Surf. B, 78, 17-23.
Nasir M.N. & Besson F., 2011. Specific interactions of mycosubtilin with cholesterol-containing artificial membranes. Langmuir, 27, 10785-10792.
Nasir M.N. & Besson F., 2012a. Conformational analyses of bacillomycin D, a natural antimicrobial lipopeptide, alone or in interaction with lipid monolayers at the air-water interface. J. Colloid Interface Sci., 387, 187-193.
Nasir M.N. & Besson F., 2012b. Interactions of the antifungal mycosubtilin with ergosterol-containing interfacial monolayers. Biochim. Biophys. Acta, 1818, 1302-1308.
Nasir M.N. et al., 2013. Analysis of calcium-induced effects on the conformation of fengycin. Spectrochim. Acta Part A, 110, 450-457.
Peypoux F., Michel G. & Delcambe L., 1976. The structure of mycosubtilin, an antibiotic isolated from Bacillus subtilis. FEBS, 63, 391-398.
Peypoux F. et al., 1978. Structure of iturine A, a peptidolipid antibiotic from Bacillus subtilis. Biochemistry, 17, 3992-3996.
Peypoux F., Besson F., Michel G. & Delcambe L., 1981. Structure of bacillomycin D, a new antibiotic of the iturin group. FEBS, 118, 323-327.
Peypoux F. et al., 1985. Structure of bacillomycin F, a new peptidolipid antibiotic of the iturin group. FEBS, 153, 335-340.
Peypoux F. et al., 1986. Revised structure of mycosubtilin, a peptidolipid antibiotic from Bacillus subtilis. J. Antibiot., 39, 636-641.
Pike L.J., 2009. The challenge of lipid rafts. J. Lipid Res., 50, 323-328.
Quentin M.J., Besson F., Peypoux F. & Michel G., 1982. Action of peptidolipidic antibiotics of the iturin group on erythrocytes. Effect of some lipids on hemolysis. Biochim. Biophys. Acta, 684, 207-211.
Raubitschek F. & Dostrovsky A., 1950. An antibiotic active against dermatophytes derived from Bacillus subtilis. Dermatologica, 100, 45-49.
Simons K. & Ikonen E., 1997. Functional rafts in cell membranes. Nature, 387, 569-572.
Singer S.J. & Nicolson G.L., 1972. The fluid mosaic model of the structure of cell membranes. Science, 175, 720-731.
Suzuki A. & Cadenhead D.A., 1985. Mixed monolayers of straight-chain/branched-chain phospholipids. I. Mixed monolayers of distearoyl phosphatidylcholine and diisoeicosanoyl phosphatidylcholine. Chem. Phys. Lipids, 37, 69-82.
Tenoux I., Besson F. & Michel G., 1991. Studies on the antifungal antibiotics: bacillomycin D and bacillomycin D methylester. Microbios, 67, 187-193.
Thimon L. et al., 1992. Interactions of bioactive lipopeptides, iturin A and surfactin from Bacillus subtilis. Biotechnol. Appl. Biochem., 16, 144-151.
Thimon L., Peypoux F., Exbrayat J.M. & Michel G., 1994. Effect of iturin A, a lipopeptide from Bacillus subtilis on morphology and ultrastructure of human erythrocytes. Cytobios, 79, 69-83.
Thimon L., Peypoux F., Wallach J. & Michel G., 1995. Effect of the lipopeptide antibiotic, iturin A, on morphology and membrane ultrastructure of yeast cells. FEMS Microbiol. Lett., 128, 101-106.
Tsuchimori N. et al., 1986. Development of fertilized starfish eggs in which cytokinesis is prevented by iturin A2. Dev. Growth Differ., 28, 619-627.
Vanittanakom N., Loeffler W., Koch U. & Jung G., 1986. Fengycin – a novel antifungal lipopeptide antibiotic produced by Bacillus subtilis F-29-3. J. Antibiot., 39, 888-901.
Vass E., Hollosi M., Besson F. & Buchet R., 2003. Vibrational spectroscopic detection of beta- and gamma-turns in synthetic and natural peptides and proteins. Chem. Rev., 103, 1917-1954.
Volpon L., Besson F. & Lancelin J.M., 1999. NMR structure of active and inactive forms of the sterol-dependent antifungal antibiotic bacillomycin L. FEBS, 264, 200-210.
Volpon L. et al., 2007. NMR structure determination of a synthetic analogue of bacillomycin Lc reveals the strategic role of L-Asn1 in the natural iturinic antibiotics. Spectrochim. Acta Part A, 67, 1374-1381.
Walton R.B. & Woodruff H.B., 1949. A crystalline antifungal agent, mycosubtilin, isolated from subtilin broth. J. Clin. Invest., 28, 924-926.
Young R.M., Zheng X., Holowka D. & Baird B., 2005. Reconstitution of regulated phosphorylation of Fcepsilon RI by a lipid raft-excluded protein-tyrosine phosphatase. J. Biol. Chem., 280, 1230-1235.
To cite this article
About: Mehmet Nail Nasir
Univ. Liège - Gembloux Agro-Bio Tech. Centre de Biophysique Moléculaire Numérique. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
About: Françoise Besson
Université de Lyon. Villeurbanne. F-69622 (France) – Université Lyon 1. Villeurbanne. F-69622 (France) – INSA de Lyon. Villeurbanne. F-69622 (France) – CPE Lyon. Villeurbanne. F-69616 (France) – CBMS CNRS UMR 5246. Villeurbanne. F-69622 (France).
About: Magali Deleu
Univ. Liège - Gembloux Agro-Bio Tech. Centre de Biophysique Moléculaire Numérique. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : magali.deleu@ulg.ac.be






