Influence de l’environnement et des pratiques culturales sur la productivité de Jatropha curcas L. en Afrique subsaharienne (synthèse bibliographique)
Reçu le 10 juin 2013, accepté le 12 novembre 2013
Résumé
Dans la plupart des pays de l’Afrique subsaharienne, la mise en place des plantations de Jatropha curcas L. a précédé les recherches scientifiques nécessaires à l’optimisation de la production de cette espèce. En conséquence, le développement des plantes a été faible et les rendements obtenus au cours des premières années de culture ont le plus souvent été décevants. Les faibles niveaux de rendement obtenus en conditions marginales ont amené à considérer que la culture du Jatropha ne pouvait être rentable que dans des zones aux sols et au climat les plus propices, ce qui la mettrait en concurrence directe avec la production alimentaire. Le présent article analyse les connaissances scientifiques disponibles concernant les facteurs écologiques et techniques qui influencent la productivité de J. curcas et propose des pistes de solutions pour l’amélioration de son rendement en Afrique subsaharienne.
Abstract
Influence of environment and cropping practices on the productivity of Jatropha curcas L. in Sub-Saharan Africa. A review. In most sub-Saharan African countries, the establishment of Jatropha curcas L. plantations preceded the scientific investigations necessary to optimize the production of this species. Consequently, the development of the plants was low and yields during the first years of cultivation were mostly disappointing. The low yields obtained in marginal conditions led to the belief that the cultivation of Jatropha could only be profitable in areas with fertile soils and sufficiently humid climates, which would place the plants in direct competition with food production. This article analyzes the available scientific knowledge regarding the ecological and technical factors influencing the productivity of J. curcas and suggests possible solutions for improving its performance in sub-Saharan Africa.
1. Introduction
1Jatropha curcas L., ci-après dénommé Jatropha, est un arbuste de la famille des Euphorbiaceae. Il est couramment utilisé dans les zones tropicales comme plante médicinale et dans la mise en place de haies vives utiles pour délimiter les parcelles, empêcher la circulation des animaux divagants et lutter contre l’érosion (Domergue et al., 2008). La durée de vie productive de l'arbuste a été estimée à 30 ans (Brittaine et al., 2010). Les graines sont riches en une huile qui peut être utilisée directement comme carburant dans des moteurs diesel à injection indirecte ou servir de matière première pour la production de biodiesel par transestérification. L’huile contient des principes toxiques qui la rendent non comestible. Parmi ces substances, les esters de phorbol présentent des propriétés biocides et pro-carcinogènes (Grimm et al., 1997). Sur la base des qualités supposées du Jatropha concernant notamment sa résistance à la sècheresse, sa capacité de bien produire dans des sols très pauvres et sa faible sensibilité aux attaques de bio-agresseurs (Heller, 1996 ; Francis et al., 2005), des plantations industrielles ont été installées dans presque toutes les régions tropicales du globe à partir du début des années 2000. En 2011, la superficie des plantations de Jatropha en Afrique était estimée à 95 300 ha (Wahl et al., 2012). Il existe cependant jusqu’à présent très peu de données scientifiques pour étayer la plupart des affirmations concernant les qualités quasi « miraculeuses » du Jatropha. Ceci est en grande partie dû au fait que la mise en place des plantations a précédé la conduite des recherches agronomiques indispensables pour assurer une production durable de la plante. L’introduction du Jatropha dans les systèmes agraires a soulevé de vives polémiques concernant les menaces que faisait peser la production d’agro-carburants sur la sécurité alimentaire (Souza et al., 2013). Les conséquences de l’accaparement de terres aux dépens de la petite agriculture familiale pour installer de grandes plantations industrielles de Jatropha ont été dénoncées par de nombreuses organisations de la société civile (Les Amis de la Terre, 2010). Le présent article analyse les connaissances scientifiques disponibles concernant les facteurs écologiques et techniques qui influencent la production du Jatropha. Il propose des pistes de solutions pour l’amélioration de son rendement en Afrique subsaharienne.
2. Facteurs écologiques et techniques influençant la production
2.1. Facteurs écologiques
2Les contraintes abiotiques (climat et sol) et biotiques (adventices et bio-agresseurs) ont une influence sur le potentiel de rendement en graines du Jatropha (Wen et al., 2012).
3Contraintes abiotiques
4Le climat. Le Jatropha est cultivé dans les régions tropicales et subtropicales entre 30ºN et 35ºS (Brittaine et al., 2010). Les zones les plus propices à la culture de la plante sont celles où la température moyenne annuelle varie entre 18 et 29 °C, avec des valeurs optimales de 26-27 °C (Trabucco et al., 2010). La température moyenne du mois le plus froid doit dépasser 8-9 °C, tandis que la température moyenne idéale du mois le plus chaud est entre 35 et 45 °C. Les températures inférieures à 25 °C pendant le semis sont responsables de l’allongement du temps nécessaire à la levée des grains, mais aussi du faible taux de levée pour certains écotypes. D’après Münch et al. (1986), la bonne germination des graines de Jatropha est obtenue dans les conditions de températures de 25 à 30 °C. Les précipitations annuelles de 300 mm permettent d’assurer la survie de la plante (Orwa et al., 2009) et un minimum de 500 mm par an est nécessaire pour la production des graines (Jongschaap et al., 2007). À partir de ce seuil, les rendements augmentent très fortement avec la pluviosité annuelle totale pour atteindre un optimum à 1 500 mm avant de diminuer lentement à mesure que les précipitations annuelles augmentent (Trabucco et al., 2010 ; Rajaona et al., 2011). L’existence d’une saison sèche est favorable à la production. En Afrique, les zones les plus favorables à la culture du Jatropha entourent la région de forêt tropicale humide située au cœur du continent (Trabucco et al., 2010). Dans les régions semi-arides, la pratique de l’irrigation pendant la saison sèche ne permet pas nécessairement la production de fruits durant toute l’année car la température nocturne tombe en dessous du seuil à partir duquel la plante perd son feuillage (Terren et al., 2012a ; Everson et al., 2013).
5Le sol. Le Jatropha préfère des sols profonds, de texture sableuse, à structure grumeleuse et bien drainants où son système racinaire peut se développer de manière optimale. Les sols argileux ne lui conviennent pas (Gour, 2006). Un pH élevé se traduit par un risque de production de petites graines à faible teneur en huile (Wen et al., 2012). Une bonne teneur en carbone organique du sol est favorable à la culture du Jatropha car elle favorise les propriétés physiques et la fertilité chimique du substrat. Le Jatropha est modérément tolérant à la salinité. Cette dernière peut entrainer, en cas de concentrations élevées, la réduction de la surface foliaire et retarder le développement normal des tiges (Patel et al., 2010). Le Jatropha permet de protéger le sol de l’érosion des eaux de pluies grâce à ses racines pivotantes et de l’érosion éolienne par la réduction de la vitesse du vent lorsqu’il est planté en haie (Henning, 2004). Par ses racines pivotantes, J. curcas permet de réhabiliter les terres dégradées par l’extraction des minéraux lessivés en profondeur en les remontant à la surface du sol par la production d’une litière (Brittaine et al., 2010). Le Jatropha améliore également l’infiltration de l'eau de pluie lorsqu'il est planté en lignes pour former des diguettes.
6Contraintes biotiques
7Les adventices. Le Jatropha est particulièrement sensible à la concurrence des adventices, surtout au moment de l’installation de la culture (Sinkala et al., 2012). En l’absence de désherbage adéquat, les jeunes plantes restent chétives et finissent par être étouffées par les mauvaises herbes. Une fois les plantations installées, l’absence de désherbage se traduit par une chute drastique du rendement (Andersson et al., 2013). De plus, la présence d’une importante végétation herbacée dans les parcelles pendant la saison sèche favorise l’occurrence des feux de brousse et les dégâts causés aux plantes par le bétail à la recherche de fourrage (Barbier et al., 2012).
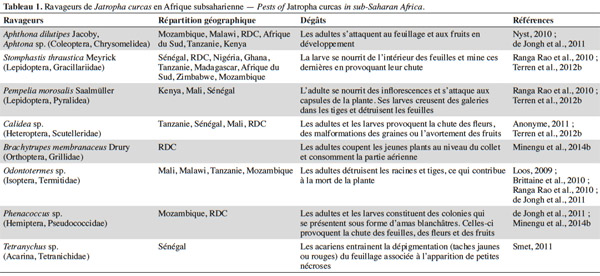
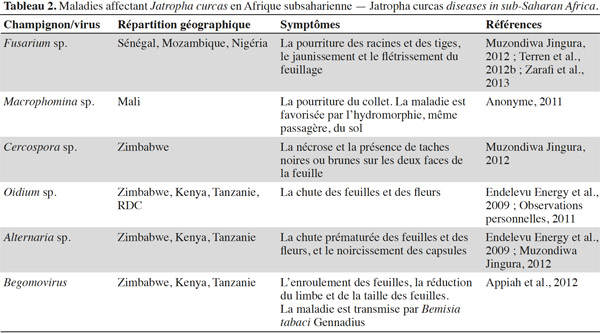
8Les bio-agresseurs. En Afrique subsaharienne, de nombreux bio-agresseurs s’attaquent au Jatropha. Parmi les arthropodes ravageurs (Tableau 1), l’altise Aphthona dilutipes Jacoby est particulièrement dommageable dans les zones les plus humides (République Démocratique du Congo, Mozambique, Angola) où elle peut empêcher totalement la croissance des plantes si elle n’est pas contrôlée par l’application d’insecticides (Nyst, 2010 ; Minengu et al., 2014a). La mineuse de feuilles Stomphastis thraustica Meyrick est signalée dans quasi toutes les zones de culture (Nyst, 2010 ; Öhman, 2011 ; Terren et al., 2012b). De plus, des attaques de punaises des capsules (Calidea sp.) sont également mentionnées dans de nombreux endroits. Différents champignons et virus sont responsables des maladies affectant le Jatropha (Tableau 2). Les dégâts les plus importants rapportés jusqu’à présent concernent les attaques de la fusariose (Terren et al., 2012b ; Zarafi et al., 2013). Le Jatropha est plus sensible aux ravageurs et maladies quand il est cultivé seul que quand il est associé à d’autres cultures (Shanker et al., 2006). Les données concernant l’évaluation de l’importance exacte des dégâts causés par les bio-agresseurs font encore défaut, mais il est probable que l’ampleur de ceux-ci augmentera avec les surfaces cultivées à cause de la croissance de la disponibilité de la ressource alimentaire pour les ravageurs.
2.2. Facteurs techniques : pratiques culturales
9Les itinéraires techniques les plus adéquats à appliquer à une culture varient fortement en fonction des conditions du milieu naturel, des moyens de production (matériel de plantation, intrants, force de travail) et des débouchés existant.
10Modalités d’installation des plantations. Il est important de noter qu’en agriculture familiale, la production du Jatropha n’est réservée qu’aux agriculteurs propriétaires des terres car l’installation de plantes a une implication sur le contrôle du foncier à long terme. Le Jatropha est généralement multiplié par graines ou par bouturage. Les agriculteurs mozambicains et maliens préfèrent utiliser des boutures à cause de leur facilité de propagation et parce qu’elles donnent des plantes qui produisent plus tôt que celles provenant de graines (de Jong et al., 2011). La plantation par boutures concerne généralement l’installation des haies. Toutefois, les plantes provenant de boutures montreraient une plus faible longévité et possèderaient une moins bonne résistance à la sècheresse et aux maladies par rapport à celles qui sont issues de graines car elles ne développent pas de racines pivotantes (Heller, 1996 ; de Jong et al., 2011). Les boutures, comme les graines, peuvent être utilisées pour produire des plants en pépinière ou être directement plantées en plein champ. La vigueur des plants obtenus en pépinières à partir de graines varie peu, selon qu’ils ont été produits directement en pleine terre (plants en racines nues) ou dans des vases de végétation en polyéthylène (Barbier et al., 2012). Le développement végétatif des plantes varie, en revanche, fortement en fonction des caractéristiques du sol et du climat (Singh et al., 2013). En conséquence, les densités de plantation à recommander varient en fonction du système de production et des conditions écologiques de la région. En cas d’associations permanentes du Jatropha avec d’autres cultures, les écartements sont plus importants par rapport à la culture pure. Les densités en culture pure les plus couramment relevées dans la littérature sont de 2 500 pieds par ha (2 m x 2 m), 2 000 pieds par ha (2,5 m x 2,5 m), 1 667 pieds par ha (3 m x 2 m) et 1 111 pieds par ha (3 m x 3 m) (Wahl et al., 2012). Au Kenya et au Sénégal, les écartements de 4 m x 4 m et de 8 m x 2 m (625 pieds par ha) ont été appliqués pour des associations avec des cultures vivrières annuelles (Endelevu Energy et al., 2009 ; Barbier et al., 2012). Il est actuellement admis que la densité de 2 500 pieds par ha (2 m x 2 m) est trop dense, surtout dans les sols pauvres où l’on doit augmenter l’espacement des plants à cause de la faible disponibilité de nutriments (Öhman, 2011 ; Whal et al., 2012). Les matériaux organiques qui résultent du désherbage peuvent être disposés au pied des arbustes (mulching), ce qui maintient l’humidité du sol, améliore sa structure et réduit les besoins en sarclage autour des plantes (Holl et al., 2007) ainsi que les risques d’érosion. Dans des sols à faible capacité de rétention d’eau, le paillis réduit sensiblement l’avortement des fruits provoqué par le stress hydrique (Minengu et al., 2014a).
11Fertilisation. Le Jatropha répond généralement bien à l’application de fertilisants organiques et minéraux (Francis et al., 2005). Un essai sur l’effet d’amendements organiques sur Jatropha dans des sols dégradés au Burkina Faso a ainsi montré qu’ils améliorent la croissance et le rendement (Kwetche Sop et al., 2012). Une enquête réalisée au Kenya en 2009 montre que 50 % des petits agriculteurs utilisent principalement les engrais organiques (fumier + compost) à raison de 1,87 kg par pied (Öhman, 2011). Une étude menée en Thaïlande sur J. curcas (Suriharn et al., 2011) montre que l’application annuelle de la fertilisation minérale (15 kg N·ha-1, 15 kg P2O5·ha-1, 15 kg K2O·ha-1) combinée à la taille des plantes contribue efficacement à l'augmentation du rendement. Chez les cultures pérennes, l’effet des engrais minéraux varie souvent en fonction des caractéristiques du sol et de l’âge de la plante. Aucune publication n’est encore disponible concernant l’influence de l’application d’une fumure minérale (fréquence d’application, formule et dose) sur les performances du Jatropha en Afrique subsaharienne. Bien que les intrants chimiques permettent d’augmenter les rendements, leur cout élevé les rend inaccessibles pour les petits agriculteurs. Ils peuvent conduire à la pollution du sol et de l'eau et à l’augmentation des émissions de gaz à effet de serre, et rendre le bilan carbone de la culture du Jatropha moins favorable. L’application de fertilisants devrait au moins compenser les exportations en nutriments causées par les récoltes des fruits et les pertes par érosion. La quantité d’éléments nutritifs exportés par le Jatropha suite à la récolte de l’équivalent en fruits de 1 t·ha-1 de graines sèches est estimée à 14,4-34,3 kg N, 0,7-7,0 kg P et 14,3-31,6 kg K (Jongschaap et al., 2007). Elle est nettement inférieure à celle exportée par une tonne de cacao marchand, évaluée à 45 kg N, 5,67 kg P et 53,93 kg K (Barrel et al., 2002). La valorisation du tourteau (3,82 % N, 1,75 % P et 1,44 % K) généré par le pressage mécanique des graines de Jatropha comme engrais organique (Jongschaap et al., 2007 ; Srinophakun et al., 2012) répond en partie à la problématique de gestion de la fertilité des sols, qui constitue un enjeu majeur avec l’abandon progressif de la jachère dans la plupart des pays d’Afrique subsaharienne.
12Taille des plantes. Dans les plantations commerciales d'arbres fruitiers, la taille constitue l'un des moyens de contrôler la hauteur des arbres, leur structure et leur productivité (Marini et al., 2000). Différents types de taille peuvent être pratiqués sur le Jatropha (Achten et al., 2008). L’ablation plus ou moins drastique du sommet des branches latérales favorise la production de nouvelles ramifications. Les inflorescences apparaissant au sommet des branches et la production d’un grand nombre de nouvelles pousses grâce à la taille devraient dès lors se traduire par une amélioration du rendement (King et al., 2009). Cet effet bénéfique de la taille n’est cependant pas automatique. Plusieurs auteurs rapportent un retard de l’entrée en production en cas de taille précoce et une diminution importante de la production un an sur deux une fois que les plantes sont installées (Everson et al., 2013 ; Singh et al., 2013). Un autre effet bénéfique de la taille concerne la limitation de la hauteur des plantes, ce qui se traduit par une réalisation plus aisée des récoltes (Achten et al., 2008). On parle de « taille de régénération » pour désigner l’opération qui consiste à rabattre les arbustes à une hauteur de 45 cm quand ils ont atteint un trop grand développement (Achten et al., 2008). Il est recommandé de réaliser la taille des arbustes au début de la période la plus sèche de l’année, après la perte des feuilles (Gour, 2006). La réalisation de celle-ci au début ou en pleine saison des pluies retarde ou annule la production. La taille du Jatropha est rarement pratiquée par les petits agriculteurs africains (Öhman, 2011 ; Diedhiou et al., 2012). Beaucoup d’entre eux considèrent que couper des branches a un effet négatif sur le développement des arbustes (Barbier et al., 2012).
13Cultures intercalaires. De nombreuses cultures annuelles ou pérennes, vivrières, fourragères, industrielles, ou ayant simplement pour but de couvrir le sol et de l’enrichir en carbone organique et en éléments nutritifs, peuvent être associées au Jatropha. Le système d’association du Jatropha avec les cultures vivrières annuelles permet aux agriculteurs d’exploiter le même terrain pour la production alimentaire et énergétique tout en générant des revenus pour l’entretien du champ avant la pleine production de la culture pérenne (Diedhiou et al., 2012). Le haricot (Phaseolus vulgaris L.), l’arachide (Arachis hypogaea L.), le maïs (Zea mays L.), le bananier (Musa sp.), le sorgho (Sorghum bicolor [L.] Moench), la patate douce (Ipomoea batatas [L.] Lam.), le mil (Pennisetum glaucum [L.] R. Br.), le niébé (Vigna unguiculata [L.] Walp.) et les cultures maraichères sont associées au Jatropha dans différentes zones de production en Afrique subsaharienne (Loos, 2009 ; Öhman, 2011 ; Diedhiou et al., 2012). La culture du Jatropha, en association avec d'autres plantes, n'est possible que lorsque les nutriments et l'eau sont suffisamment disponibles (Öhman, 2011). Dans des endroits secs, sans irrigation, la culture intercalaire n'est pas possible en raison de la compétition pour l'eau (Singh et al., 2007). Dans les sols pauvres en éléments nutritifs, la culture intercalaire est seulement possible avec un supplément de fertilisation. L’association du Jatropha avec une autre Euphorbiacée comme l’hévéa (Hevea brasiliensis [Willd. ex A.Juss.] Müll.Arg.) ou le manioc (Manihot esculenta Crantz) est déconseillée du fait de leur sensibilité aux mêmes agents pathogènes. L’installation de plantes de couverture entre les lignes de Jatropha devrait permettre une meilleure gestion de la fertilité du sol, du contrôle des adventices dans les plantations en culture pure en zones tropicales humides et de l’érosion des sols. On peut supposer que certaines des espèces cultivées classiquement à cette fin dans d’autres plantations industrielles (Elaeis guineensis Jacq., H. brasiliensis, etc.) devraient convenir, mais aucune recherche ne semble avoir déjà été entreprise sur ce sujet. Dans une étude réalisée au plateau des Batéké dans la banlieue de Kinshasa en RDC (plantation de 4 ans), la rentabilité de l’association du Jatropha avec les cultures vivrières était meilleure que celle de la culture pure du Jatropha (Minengu et al., 2014a). La contribution au revenu agricole familial de l’association était de 1 102 USD·ha-1, alors qu’il y avait une perte de 6 USD·ha-1 en culture pure de Jatropha, sans application d’engrais. La culture pure du Jatropha présente des problèmes spécifiques, allant de la pullulation de ravageurs à la gestion des maladies et à une rentabilité économique incertaine (Achten et al., 2010). Les facteurs à prendre en compte pour le développement des associations culturales sont la morphologie et la phénologie des cultures associées, la densité de plantation, le calendrier de plantation, la fertilité du sol et la disponibilité en eau. Le Jatropha est utilisé comme haie vive dans beaucoup de pays au sud du Sahara. Sa diffusion à grande échelle sous forme de haie vive dans le paysage agraire permettrait d’améliorer la gestion de l’espace rural soudano-sahélien du fait du mode d’élevage et des pratiques culturales (Muzondiwa Jingura, 2012). En protégeant les terres, la haie permet à l’agriculteur d’entreprendre des améliorations foncières et des spéculations de longue durée qu’il n’aurait pu envisager sur des terres ouvertes à la libre pâture (Yossi et al., 2006). La production du Jatropha en haies vives est observée au Mali, au Kenya, en Tanzanie, en Afrique du Sud et au Sénégal (Endelevu Energy et al., 2009 ; Barbier et al., 2012 ; Muzondiwa Jingura, 2012). Ces haies peuvent jouer un rôle protecteur contre la divagation des animaux (haies défensives) et l’érosion du sol (haies antiérosives), le rôle de bornes naturelles pour la délimitation foncière et un rôle ornemental. La plupart des types de haies incorporent également à divers degrés la fonction de production (Yossi et al., 2006).
14Le contrôle des bio-agresseurs et adventices. La méthode de contrôle des adventices la plus souvent pratiquée est le désherbage manuel (sarclage). Ce dernier constitue, dans la plupart des plantations paysannes en Afrique, l’une des activités qui mobilise le plus de main-d’œuvre. Il faut compter 50 à 80 hommes-jours par ha par an pour le sarclage (Bruggeman et al., 2010 ; Minengu et al., 2014a). Aucune donnée concernant l’emploi d’herbicides n’est mentionnée jusqu’à présent pour la culture du Jatropha en Afrique. Quand leurs dégâts sont importants, le contrôle des ravageurs du Jatropha se fait avec des pesticides chimiques (Nyst, 2010 ; Ranga Rao et al., 2010). Ces derniers ne sont généralement utilisés que pour la réalisation d’expérimentations ou en production agro-industrielle. Des essais ont été réalisés par Nyst (2010) concernant l’efficacité du diméthoate, de l’endosulfan et de la deltaméthrine contre Aphtona sp. et S. thraustica dans la région de Kinshasa. Les résultats obtenus ont montré l’impossibilité de production du Jatropha sans l’application de 2 ou 3 traitements insecticides. Le cout très élevé de ces produits (20 à 30 USD par litre en RDC) et l’absence de données sur la dynamique des populations de ces ravageurs au cours de l’année rendent difficile la mise en place d’une stratégie de protection de la culture.
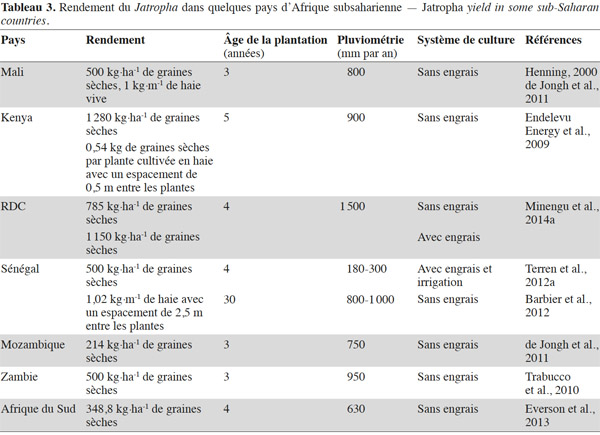
15Techniques de récolte et rendement. La collecte des graines se réalise en deux étapes : la récolte des capsules puis l’égrenage de celles-ci pour séparer les graines des parois du fruit. La maturité physiologique des fruits est atteinte quand ils se colorent en jaune. À ce stade, le décorticage manuel des capsules est aisé et, dans ce cas, il faut faire sécher les graines. Du fait de l’étalement de la production des fruits dans le temps et du manque de disponibilité en main-d’œuvre pour réaliser des passages réguliers dans les plantations, ce sont généralement des capsules aux carpelles totalement desséchés et de couleur noire qui sont récoltées. À ce stade de maturation, le décorticage manuel des fruits est une opération fastidieuse. La durée de développement des fruits de la fécondation à la maturité est en moyenne de 90 jours (Brittaine et al., 2010). Elle varie en fonction des conditions écologiques et culturales des sites et des écotypes utilisés. Elle est continue en climat humide. On compte généralement un pic de récolte en zone soudano-sahélienne et deux pics de récolte en zones à pluviométrie bimodale. La maturité échelonnée des fruits représente un frein pour la récolte mécanique et explique que toutes les opérations de récolte des capsules se font manuellement. La quantité de capsules récoltées par personne et par jour dépend de la hauteur et du port des arbustes, de la méthode de ramassage des fruits, du nombre de fruits portés par arbuste et de la densité de plantation (Domergue et al., 2008). Le mode de décorticage des capsules (manuel ou mécanisé) influence fortement la quantité de graines susceptible d’être obtenue par journée de travail. La diversité des facteurs qui influencent les temps de collecte et de décorticage des capsules peut expliquer que les chiffres avancés concernant la productivité des collecteurs de graines vont de 16 kg à plus de 30 kg par personne et par jour (Rijssenbeek et al., 2010). La collecte des graines est l’un des facteurs critiques qui conditionne la rentabilité économique de la culture du Jatropha car, une fois les plantations installées, une bonne partie du temps de travail nécessaire à la production est consacrée aux opérations de récolte et de décorticage des capsules. La possibilité d’une récolte mécanique à l’aide d’un vibreur pourrait être envisagée si l’on arrive à obtenir une maturation groupée des fruits et si la rentabilité économique le permet. Le rendement d’une culture pérenne dépend des caractéristiques du milieu naturel, du matériel de plantation utilisé, de son âge et des techniques de production appliquées. La diversité de ces facteurs se traduit par une grande variabilité des rendements atteints par le Jatropha en Afrique subsaharienne. Ceux-ci sont nettement plus faibles (Tableau 3) que les plafonds de 4 à 8 t·ha-1 de graines cités par Heller (1996), Francis et al. (2005) et Jongshaap et al. (2007). Les délais mentionnés pour l’entrée en pleine production des plantes de Jatropha sont souvent plus longs que les 5 ans annoncés dans la littérature (Achten et al., 2008). Les faibles niveaux de rendement obtenus en conditions marginales (Singh et al., 2013) ont amené certains auteurs à considérer que la culture du Jatropha ne pouvait être rentable que dans des zones aux sols et au climat propices (Segerstedt et al., 2013) qui devraient être réservées à la production alimentaire.
3. Diversité génétique et disponibilité en matériel de plantation amélioré
16Le Jatropha n’est pas originaire d’Afrique. Il y a été introduit au 16e siècle par les Portugais (Heller, 1996). La diversité génétique des écotypes africains évaluée au moyen de marqueurs moléculaires est nettement plus faible que celle des écotypes collectés en Amérique centrale, le centre d’origine supposé de l’espèce (Diedhiou et al., 2012). Paradoxalement, cette diversité génétique limitée ne se traduit pas par une faible variabilité phénotypique. Ce paradoxe pourrait s’expliquer par un contrôle épigénétique de nombreux caractères. Dans des essais comparatifs d’écotypes originaires d’une dizaine de régions différentes du Sénégal et au Cap Vert, Heller (1996) a montré qu’il existe une interaction importante entre le génotype et l’environnement. Une étude réalisée en Malaisie sur des populations de J. curcas provenant de Malaisie, d’Inde, d’Indonésie et des Philippines (Biabani et al., 2012) indique des différences significatives entre ces populations en ce qui concerne la précocité de floraison, le nombre d'inflorescences, le nombre de fruits par plante, le nombre de graines par plante, le rendement en graines et en huile par hectare. A priori, l’Amérique centrale constitue un réservoir de variabilité important à partir duquel il devrait être possible de sélectionner un matériel végétal aux qualités supérieures. En effet, la plupart des plantations de Jatropha ont été réalisées avec des semences récoltées sur des arbustes subspontanés n’ayant fait l’objet d’aucune sélection préalable ou des semences sélectionnées pour leur productivité dans des zones géographiques ne présentant pas les conditions environnementales du site de mise en culture (Wahl et al., 2012). Cela explique en grande partie les faibles performances de ces plantations et la très grande variabilité des rendements obtenus, d’un champ à l’autre et entre plantes au sein d’une même parcelle (Jongschaap et al., 2007). Des programmes de sélection et d’amélioration génétique du Jatropha existent depuis plusieurs années en Afrique, notamment dans les iles du Cap Vert (Société Quinvita), au Ghana (Bionic Palm Ltd), au Bénin (Ahoton et al., 2012) et au Sénégal (Diedhiou et al., 2012). À notre connaissance, aucune publication comparant les performances de variétés de Jatropha ayant atteint leur plein potentiel de production n’est déjà disponible. Le Jatropha est une plante monoïque dicline fortement allogame. Diverses méthodes d’amélioration génétique (sélection massale, sélection récurrente, mutation, hybridation interspécifique, etc.) peuvent être appliquées pour l’exploitation de la variabilité génétique de la plante (Divakara et al., 2010). La société Bionic Palm Ltd (Riemann, 2013) mentionne des résultats très prometteurs concernant la production d’hybrides F1.
4. Conclusion et pistes d’amélioration des rendements
17Peu de travaux scientifiques ont été publiés jusqu’à présent concernant l’influence des conditions de l’environnement et des pratiques culturales sur le rendement de la culture du Jatropha en Afrique subsaharienne. Les données disponibles permettent cependant d’affirmer que la diffusion de cette culture s’est heurtée à de fortes contraintes. En premier lieu, malgré sa toxicité et ses propriétés biocides, la plante n’est pas épargnée par les attaques de nombreux bio-agresseurs dont certains peuvent avoir une incidence extrêmement négative sur son développement. D’autre part, si la plante peut pousser dans des conditions marginales en termes de disponibilité en eau et en nutriments au niveau du sol, les rendements obtenus dans ces conditions sont généralement plus faibles que ce qui était attendu. Les plantations ont été installées avec un matériel végétal non amélioré et les connaissances concernant les techniques de production les mieux adaptées aux contextes locaux font le plus souvent défaut. Les expériences menées jusqu’à présent montrent qu’avec le matériel de plantation actuellement disponible, la culture du Jatropha ne peut se faire qu’en conditions favorables. L’ensemble de ces facteurs explique sans doute les faibles niveaux de rendement rapportés jusqu’à présent. Les résultats obtenus dans la plupart des plantations de Jatropha en Afrique subsaharienne contrastent avec ce qui était annoncé par certains auteurs tant du point de vue de l’adaptation à l’environnement que des pratiques culturales à appliquer. Pour améliorer le rendement de la culture du Jatropha en Afrique subsaharienne, d’importantes recherches sont nécessaires dans les différentes zones de production. Il sera question :
18– de développer les programmes d’amélioration de la plante en fonction des zones agro-écologiques en se basant sur les critères comme la précocité d’entrée en pleine production, la résistance aux contraintes abiotiques et biotiques, le rendement, la facilité de récolte, la vitesse de maturation des fruits et la teneur en huile (cette activité vient en tête des priorités dans toutes les zones de culture) ;
19– d’étudier l’influence des contraintes abiotiques et biotiques sur le développement et la production du Jatropha en fonction des zones agro-écologiques ;
20– de développer les méthodes de lutte intégrée pour contrôler les bio-agresseurs et les adventices, ceci est particulièrement important en Afrique centrale où l’extension durable de la culture du Jatropha ne peut se réaliser sans la mise au point de méthodes de lutte intégrée permettant de contrôler les principaux ravageurs de la plante ;
21– d’étudier la rentabilité des différentes méthodes de fertilisation et d’analyser le rapport cout/bénéfice de l’utilisation du tourteau de Jatropha comme amendement ;
22– de déterminer les meilleures modalités de réalisation de tailles sur le Jatropha en fonction des caractéristiques de l’environnement naturel, des variétés cultivées et du niveau d’intensification de la production ;
23– de déterminer les performances des systèmes de cultures associées (agriculture de conservation et agroforesterie) ainsi que les effets qu’ils induisent (concurrence vis-à-vis du Jatropha, impact sur les ravageurs et maladies, infiltration de l’eau, contrôle de l’érosion, effet brise-vent, etc.) ;
24– d’évaluer la rentabilité économique des plantations familiales et industrielles existantes.
25Remerciements
26Nous tenons à remercier la Coopération Technique Belge (CTB) et la Commission Universitaire pour le Développement (CUD) pour l’appui financier apporté à la réalisation de nos recherches.
Bibliographie
Achten W.M.J. et al., 2008. Jatropha bio-diesel production and use. Biomass Bioenergy, 32, 1063-1084.
Achten W.M.J. et al., 2010. Jatropha: from global hype to local opportunity. J. Arid Environ., 74, 164-165.
Ahoton L.E. & Quenum F., 2012. Floral biology and hybridization potential of nine accessions of physic nut (Jatropha curcas L.) originating from three continents. Tropicultura, 30(4), 193-198.
Andersson C.E.F., Everson T.M. & Everson C.S., 2013. Management of oil producing Jatropha curcas silvopastoral system: risk of herbivory by indigenous goats and competition with planted pastures. Biomass Bioenergy, 59, 50-58.
Anonyme, 2011. Évaluation et optimisation du potentiel de développement d’une culture oléagineuse à haute performance énergétique et environnementale pour la production de biodiesel, le Jatropha curcas. Cirad, Enerbio, Fondation Tuck, http://www.fondation-tuck.fr/resultats/projets/2008/documents-projet-01/2008-P01-rapport-final.pdf, (13/03/2013).
Appiah A.S. et al., 2012. Spread of African cassava mosaic virus from cassava (Manihot esculenta Crantz) to physic nut (Jatropha curcas L.) in Ghana. J. Phytology, 4(1), 31-37.
Barbier J. et al., 2012. Intérêts de mettre en place une filière courte basée sur la culture du Jatropha (Jatropha curcas L.) dans la Communauté Rurale de Dialacoto Sénégal. Document de synthèse de recherche, http://orbi.ulg.ac.be/bitstream/2268/130282/1/20120703%20document%20synth%C3%A8se%20jatropha%20vf.pdf, (24/04/2013).
Barrel M. et al., 2002. Les plantes stimulantes, le cacaoyer. In : Mémento de l’agronome. Paris : Ministère des Affaires étrangères, CIRAD, GRET, 1051-1078.
Biabani A. et al., 2012. Phenotypic and genetic variation of Jatropha curcas L. populations from different countries. Maydica, 57, 164-174.
Brittaine R. & Lutaladio N., 2010. Jatropha: a smallholder bioenergy crop. The potential for pro-poor development. Roma: FAO, Integrated Crop Management, Vol. 8, http://www.fao.org/docrep/012/i1219e/i1219e.pdf, (06/05/2012).
Bruggeman P.G., Fakambi K., Fauveaud S. & Liagre L., 2010. Les filières agrocarburants de proximité à base de Jatropha : opportunités, acquis et points de vigilance pour un accès à l’énergie en faveur des populations rurales d’Afrique de l’Ouest. SudSciences Technol., 19-20, 107-108.
de Jongh J. & Nielsen F., 2011. Lessons learned: Jatropha for local development. Wageningen, The Netherlands: Fact Foundation, http://fact-foundation.com/library/bioenergy-feedstock/jatropha/lessons-learned-jatropha-local-development, (20/05/14).
Diedhiou I. et al., 2012. Diversity, farming systems, growth and productivity of Jatropha curcas L. in the Sudano-Sahelian Zone of Senegal, West Africa. In: Carels N. et al., eds. Jatropha, challenges for a new energy crop. Volume 1: farming, economics and biofuel. New York, USA: Science+Business Media, 281-295.
Divakara B.N., Upadhyaya H.D., Wani S.P. & Laxmipathi Gowda C.L., 2010. Biology and genetic improvement of Jatropha curcas L.: a review. Appl. Energy, 87, 732-742.
Domergue M. & Pirot R., 2008. Jatropha curcas L. Rapport de synthèse bibliographique. Montpellier, France : Cirad.
Endelevu Energy, World Agroforestry Centre & Kenya Forestry Research Institute, 2009. Jatropha reality check: a field assessment of the agronomic and economic viability of Jatropha and other oilseed crops in Kenya. Nairobi: GTZ–Regional Energy Advisory Platform.
Everson C.S., Mengistu M.G. & Gush M.B., 2013. A field assessment of the agronomic performance and water use of Jatropha curcas in South Africa. Biomass Bioenergy, 59, 59-69.
Francis G., Edinger R. & Becker K.A., 2005. A concept for simultaneous wasteland reclamation, fuel production, and socio-economic development in degraded areas in India: need, potential and perspectives of Jatropha plantations. Nat. Resour. Forum, 29, 12-24.
Gour V.K., 2006. Production practices including post-harvest management of Jatropha curcas. In: Proceedings of the biodiesel conference toward energy independence. Focus of Jatropha, June 9-10, Hyderabad, India, 223-251.
Grimm C. & Maes J.-M., 1997. Arthropod fauna associated with Jatropha curcas L. in Nicaragua: a synopsis of species, their biology and pest status. In: Gubitz G.M., Mittelbach M. & Trabi M., eds. Biofuels and industrial products from Jatropha curcas. Proceedings from the symposium “Jatropha 97”, February, 23-27, Managua, Nicaragua. Graz, Austria: Dbv-Verlag, 31-39.
Heller J., 1996. Physic nut. Jatropha curcas L. Promoting the conservation and use of underutilised and neglected crops. 1. Gatersleben, Germany: Institute of Plant Genetics and Crop Plant Research; Roma: International Plant Genetic Resources Institute.
Henning R.K., 2000. The Jatropha booklet. A guide to the Jatropha system and its dissemination in Zambia. Weissensberg, Germany: Bagani GbR.
Henning R.K., 2004. Jatropha curcas L. in Africa. Case study. Weissenberg, Germany: Bagani.
Holl M.A., Gush M.B., Hallowes J. & Versfeld D.B., 2007. Jatropha curcas in South Africa: an assessment of its water use and bio-physical potential. WRC Report No 1497/1/07. Pretoria: Water Research Commission.
Jongschaap R.E.E., Corre W.J., Bindraban P.S. & Brandenburg W.A., 2007. Claims and facts on Jatropha curcas L.: global Jatropha curcas evaluation, breeding and propagation programme. Wageningen, The Netherlands: Plant Research International.
King A.J. et al., 2009. Potential of Jatropha curcas as source of renewable oil and animal feed. J. Exp. Environ. Bot., 60(10), 2897-2905.
Kwetche Sop T. et al., 2012. Effects of organic amendment on early growth performance of Jatropha curcas L. on a severely degraded site in the Sub-Sahel of Burkina Faso. Agroforestry Syst., 86, 387-399.
Les Amis de la Terre, 2010. Afrique : terre(s) de toutes les convoitises. Ampleur et conséquences de l'accaparement des terres pour produire des agrocarburants. Rapport. Bruxelles : Les Amis de la Terre Europe.
Loos T.K., 2009. Socio-economic impact of a Jatropha-project on smallholder farmers in Mpanda, Tanzania, case study of a public-private-partnership project in Tanzania. Master thesis related to the module: University of Hohenheim, Institute for Agricultural Economics and Social Sciences in the Tropics and Subtropics (Germany), https://www.uni-hohenheim.de/fileadmin/einrichtungen/troz/Documents/Bioenergy/M.Sc.Loos_Tansania.pdf, (12/02/2012).
Marini R.P. & Sowers D.S., 2000. Peach tree growth, yield, and profitability as influenced by tree form and tree density. HortScience, 35, 837-842.
Minengu J.D.D., Mobambo P. & Mergeai G., 2014a. Analyse des performances technico-économiques de quatre systèmes de culture basés sur la production de Jatropha curcas L. dans la région de Kinshasa (République Démocratique du Congo). Tropicultura, 32(4).
Minengu J.D.D, Verheggen F. & Mergeai G., 2014b. Dynamique et impact des principaux insectes ravageurs de Jatropha curcas L. dans deux systèmes de culture aux caractéristiques contrastées de la province de Kinshasa (République Démocratique du Congo). Tropicultura, 32(4).
Münch E. & Kiefer J., 1986. Le pourghère (Jatropha curcas L.) : botanique, écologie, culture (1ère partie), produits de récolte, filières de valorisations, réflexions économiques (2è partie). Mémoire de fin d’études : Université de Stuttgart-Hohenheim (Allemagne).
Muzondiwa Jingura R., 2012. Socio-economy, agro-ecological zones, agronomic practices and farming system of Jatropha curcas L. in Sub-Saharan Africa. In: Carels N. et al., eds. Jatropha, challenges for a new energy crop. Volume 1: farming, economics and biofuel. New York, USA: Science+Business Media, 53-69.
Nyst J., 2010. Contribution à l’étude des possibilités de culture de Jatropha curcas L. sur le Plateau des Batéké, RDC. Travail de fin d’études présenté en vue de l’obtention de diplôme de master bioingénieur en sciences agronomiques, orientation agronomie tropicale : Université de Liège-Gembloux Agro-Bio Tech (Belgique).
Öhman J., 2011. Cultivation and management of Jatropha curcas L. by smallholder farmers in the Kenyan districts Baringo and Koibatek. Thesis: Yrkshocskolan Novia University of Applied Sciences (Finland).
Orwa C. et al., 2009. Agroforestry database: a tree reference and selection guide, version 4.0: Jatropha curcas, http://www.worldagroforestry.org/treedb/AFTPDFS/Jatropha_curcas.pdf, (21/05/2014).
Patel A.D., Panchal N.S., Pandey I.B. & Pandey A.N., 2010. Growth, water status and nutrient accumulation of seedlings of Jatropha curcas L. (Euphorbiaceae) in response to soil salinity. An. Biol., 32, 59-71.
Rajaona A.M., Brueck H. & Asch F., 2011. Effect of pruning history on growth and dry mass partitioning of Jatropha on a plantation site in Madagascar. Biomass Bioenergy, 35, 4892-4900.
Ranga Rao G.V., Marimuttu S., Wani S.P. & Rameshwar Rao V., 2010. Insects pests of Jatropha curcas L. and their management. Information bulletin. Patancheru, India: International Crops Research Institute for the Semi-Arid Tropics, http://oar.icrisat.org/5582/1/Insectpest_InfoBull_2010.pdf, (05/06/2012).
Riemann U., 2013. The bionic Jatropha breeding platform in 2013, http://jatropha.bionic-enterprises.com/the-bionic-jatropha-breeding-platform-in-2013/, (15/10/2013).
Rijssenbeek W. & Galema T., 2010. Harvesting. In: The Jatropha handbook. From cultivation to application. Eindhoven, The Netherlands: Fact Foundation, 29-37.
Segerstedt A. & Bobert J., 2013. Revising the potential of large-scale Jatropha oil production in Tanzania: an economic land evaluation assessment. Energy Policy, 57, 491-505.
Shanker C. & Dhyani S.K., 2006. Insect pests of Jatropha curcas L. and the potential for their management. Curr. Sci., 91, 162-163.
Singh R.A., Munish K. & Ekhlaq H., 2007. Synergistic cropping of summer groundnut with Jatropha curcas. A new two-tier cropping system for Uttar Pradesh. SAT ejournal, 5(1), 1-2, http://www.icrisat.org/journal/volume5/Groundnut/gn9.pdf, (10/10/2013).
Singh B. et al., 2013. Agro-technology of Jatropha curcas for diverse environmental conditions in India. Biomass Bioenergy, 48, 191-202.
Sinkala T. & Johnson F.X., 2012. Small-scale production of Jatropha in Zambia and its implications for rural development and national biofuel policies. In: Janssen R. & Rutz D., eds. Bioenergy for sustainable development in Africa. Springer, 41-51.
Smet J., 2011. Bilan et perspective des premières campagnes de plantation de Jatropha curcas L. en agriculture pluviale au niveau du Groupement de Bambougar, dans le cadre du Programme Énergie Eau Solidarité Foundiougne, Sénégal. Travail de fin d’études Master Bioingénieur en Sciences Agronomiques, orientation Agronomie Générale : Université de Liège-Gembloux Agro-BioTech (Belgique).
Souza A.C. et al., 2013. Intercropping of physic nut and bean: alternative to family farm. Dourados, 6(9), 36-42.
Srinophakun P., Titapiwatanakun B., Sooksathan I. & Punsuvon V., 2012. Prospect of deoiled Jatropha curcas seedcake as fertilizer for vegetables crops – A case study. J. Agric. Sci., 4(3), 211-226.
Suriharn B., Sanitchon J., Sangsri P. & Kesmala T., 2011. Effets of pruning levels and fertilizer rates on yield of physic nut (Jatropha curcas L.). Asian J. Plant Sci., 10(1), 52-59.
Terren M. et al., 2012a. Attempted cultivation of Jatropha curcas L. in the Lower Senegal River Valley: story of a failure. Tropicultura, 30(4), 204-208.
Terren M. et al., 2012b. Principal disease and insect pests of Jatropha curcas L. in the Lower Valley of the Senegal River. Tropicultura, 30(4), 222-229.
Trabucco A. et al., 2010. Global mapping of Jatropha curcas yield based on response of fitness to present and future climate. Global Change Biol. Bioenergy, 2, 139-151.
Wahl N. et al., 2012. Insights into Jatropha projects worldwide. Key facts & figures from a global survey. Report. Lüneburg, Germany: Centre for Sustainability Management.
WenY. et al., 2012. Influence of climatic factors and soil types on seed weight and oil content of Jatropha curcas in Guangxi, China. Procedia Environ. Sci., 12, 439-444.
Yossi H. et al., 2006. Les haies vives au Sahel. État des connaissances et recommandations pour la recherche et le développement. ICRAF Occasional Paper No. 6. Nairobi: World Agroforestry Centre, http://www.worldagroforestry.org/downloads/publications/PDFs/OP14457.PDF, (24/06/2012).
Zarafi A.B. & Abdulkadir I.D., 2013. The incidence and severity of Jatropha dieback disease in Zaria, Nigeria. Arch. Phytopathol. Plant Prot., 46, 952-961.

