- Home
- Volume 87 - Année 2018
- Articles
- Contribution à l’étude du pouvoir antifongique des graines du Chénopodium quinoa Wild vis-à-vis de deux champignons phytopathogène de l’orge : Pyrenophora tritici-repentis et Rhynchosporium secalis
View(s): 3435 (15 ULiège)
Download(s): 645 (13 ULiège)
Contribution à l’étude du pouvoir antifongique des graines du Chénopodium quinoa Wild vis-à-vis de deux champignons phytopathogène de l’orge : Pyrenophora tritici-repentis et Rhynchosporium secalis
Contribution to the study of the antifungal potency of the seeds of Chenopodium quinoa wild against two phytopathogenic fungi of the barley: Pyrenophora tritici-repentis and Rhynchosporium secalis

Attached document(s)
original pdf fileRésumé
Le présent travail a pour objectif de tester le pouvoir antifongique des différents extraits éthanoliques, méthanoliques, hexaniques et sous reflux de la semence du Chénopodium quinoa Wild sur deux souches fongiques phytopathogènes de l’orge « Pyrenophora tritici- repentis et Rhynchosporium secalis ». Nous avons utilisé la méthode d’incorporation des produits dans un milieu gélosé PDA, pour déterminer les taux d’inhibition, en comparant leur action à diverses concentrations sur la croissancemycélienne.
Après préparation d’une série de dilution, un millilitre de chaque dilution est ajouté aseptiquement à 19 ml de milieu de culture PDA maintenu liquide à 45°C. Après solidification, chaque boite est inoculée à l’aide d’un disque mycélien de 6mm de diamètre provenant d’une culture âgée d’une semaine. Les boites sont incubées à 25°C ± 1°C pendant sept jours pour les isolats. Le PDA sans extrait a servi de témoin pour chaque souche.
L’expérimentation réalisée in vitro, montre une activité antifongique remarquable et hautement significative vis-à-vis des deux cryptogames étudiés. Une concentration en extrait de l’ordre de 10 mg/ml à inhibée l’extension mycélienne de Pyrenophora tritici-repentis et Rhynchosporium secalis. Le taux d’inhibition de ces derniers varie de 68,42% à 91,17% le 7ème jour d’incubation. Le test positif des saponines suggère que ces molécules sont à l’origine du pouvoir antifongique doté pour cette plante. Ce qui a été confirmé par plusieurs auteurs.
L’efficacité des molécules testées pourrait être le sujet d’une investigation et une exploitation dans la lutte intégrée contre les deux champignons testés qui causent beaucoup de dégâts pour la culture de l’orge.
Abstract
The present work aims to test the antifungal power of the different ethanolic, methanolic, hexane and aqueous extracts of the Chenopodium quinoa Wild seed on two phytopathogenic fungi strains of barley "Pyrenophora tritici-repentis and Rhynchosporium secalis". Using the product incorporation method into an agar medium (PDA potato dextrose agar), to determine the inhibition rates, comparing their action at different concentrations on mycelial growth.
After the preparation of a serial dilution, one milliliter of each dilution is added aseptically to 19 ml of PDA culture medium kept liquid at 45°C. After solidification, each Petri box is inoculated with a 6 mm diameter mycelial disc goes a week-old culture. The dishes are incubated at 25°C ± 1°C for seven days for the isolates. PDA medium without extract served as a control for each strain.
The experiment carried out in vitro, shows a remarkable antifungal activity and highly significant vis-à-vis the two cryptogams studied. An extract concentration of 10 mg / ml inhibited the mycelial extension of Pyrenophora tritici-repentis and Rhynchosporium secalis. The inhibition rate of these latter varies from 68.42% to 91.17% on the seventh day of incubation. The positive test of saponins suggests that these molecules are at the origin of the antifungal power endowed for this plant. This has been confirmed by several authors.
The efficiency of the tested molecules could be the subject of investigation and exploitation in the integrated fight against the two fungi tested which cause a lot of damage for barley cultivation.
Table of content
1. Introduction
1Les substances naturelles issues des végétaux ont des intérêts multiples mis à profit dans l'industrie : en alimentation, en cosmétologie et en dermopharmacie [1].
2D’autre part, la biodiversité est menacée, par les effets indésirables voire néfastes des produits phytosanitaires conventionnels sur la microflore, la microfaune des sols, et sur les insectes utiles. La situation s’aggrave de plus en plus, et la recherche des alternatifs aux produits chimiques devient primordiale.
3À cet égard, les scientifiques sont de plus en plus à la recherche d’alternatives moins dangereuses, comme l’exemple des pesticides d'origine végétale plus sécuritaires pour les humains en particulier les agriculteurs et pour l'environnement.
4Suite aux études réalisée par Stuardo et San Martín [2] et Woldemichael et Wink [3] qui ont montré que le quinoa est doté d’un pouvoir antifongique important et dans le but de rechercher les composés actifs portants de propriétés antifongiques, Il nous a semblé intéressant de tester le pouvoir antifongique de la semence du Chénopodium quinoa Wild afin de mieux cerner son effet sur les principaux champignons pathogènes de l’orge. A cet effet, les extraits éthanolique, méthanolique, hexanique et sous reflux ont été testés contre les deux champignons Pyrenophora tritici-repentis agent causal de la maladie d’helminthosporiose et Rhynchosporium secalis qui provoque la maladie du rhynchosporiose de l’orge.
2. Matériels et méthodes
2.1 Matériel végétal
5La semence du quinoa testée provient de l’institut technique des grandes cultures de Sidi
6Bel Abbes dont les coordonnées géographiques sont : 35°10'25.20"N - 0°40'22.32"O - Altitude: 490 mètres ».
7Un spécimen de cette plante a été déposé à l'herbier de la Faculté des Sciences de la nature et de la vie (Université Djillali Liabes de Sidi Bel Abbes, Algérie).
8Les graines récoltées en juin 2017 sont séchées à l’abri de l’humidité et de la lumière et à température ambiante, puis elles sont broyées dans un broyeur électrique jusqu’à l’obtention d’une poudre très fine, la poudre résultante a été conservée au réfrigérateur à 4°C dans un récipient hermétiquement fermé. La poudre sera ultérieurement utilisée pour la préparation des différents extraits [4].
2.2 Matériel fongique
9Les isolats utilisés au cours de notre travail Pyrenophora tritici-repentis et Rhynchosporium secalis proviennent des feuilles de l’orge (Hordeum vulgare), Ils ont été recueillis dans la station expérimentale de l’institut technique des grandes cultures de Sidi Bel Abbes durant la campagne agricole 2016-2017.
10Des fragments de feuilles infectés sont superficiellement désinfectés par trempage dans une solution d’hypochlorite de sodium (Eau de Javel) à 2%, puis rincés trois fois à l’eau distillée stérile. Après leurs séchage sur papier buvard stérile, les fragments de plants infectés par Pyrenophora tritici-repentis et Rhynchosporium secalis sont déposés dans des boites de Pétri contenant le milieu PDA (pomme de terre-dextrose-agar). Les boites sont incubées à 25°C pendant sept jours. Après purification par des repiquages successifs sur PDA,les champignons sont isolés puis conservés à 4°C.
11Les souches phytopathogénes testées dans notre étude ont été identifiées et approuvées par le laboratoire phytopathologie de l’institut national de la recherche agronomique « INRAA ».
3. Préparation des extraits végétaux
12Les extraits bruts ont été obtenus par extractions successives avec des solvants en fonction de l’ordre croissant de leur polarité.
13L’extraction a été faite par la méthode de Harbone [5], une quantité de 10 g de poudre végétale a été extraite au soxhlet par 150 ml d’éthanol, méthanol, hexane durant 3 heures. L’extrait aqueux a été extrait selon la méthode élaborée par Applebaun et al [6]. Le broyat de 10 g a été mis sous reflux par 150 ml d’eau distillée pendant 2 heures. Les extraits éthanolique, méthanolique, hexanique et aqueux ont été ensuite évaporé sous vide à 60°C par un Buchi Rotavapor R-200. Le résidu a été conservé a une température de 2°c jusqu’au jour de manipulation.
4. Calcul du rendement
14Le rendement Rd est déterminé par le rapport du poids de l’extrait sec après évaporation sur le poids de matière végétale sèche utilisée pour l’extraction, multiplié par 100 [7].
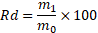
15Où :
16m1: masse en gramme de l’extrait sec.
17m0 : masse en gramme de la matière végétale sèche.
5. Screening phytochimique
18Les tests de détection des grands groupes de composés chimiques ont porté sur les résidus (R1-R4). Nous nous sommes servis des techniques analytiques décrites dans les travaux de
[8-12]. Nous avons visé la détection des stérols et polyterpènes par la réaction de Liebermann, des tannins par le réactif de Stiasny, des flavonoïdes par la réaction à la cyanidine, des quinones par le réactif de Borntraëger, des saponines par le test de mousse, des sucres réducteurs par le réactif de Fehling, des coumarines par la réaction sur le cycle lactonique et des alcaloïdes avec les réactifs de Burchard.
6. Test de l’activité antifongique
6.1 Choix du solvant de récupération des différents extraits
19Les extraits séchés ont été dissouts dans le DMSO, sachant que le solvant ne devrait pas empêcher le procédé biologique [13].
20Pour cela, nous avons choisi le diméthylesulfoxyde « DMSO » qui est le solvant utilisé par la majorité des auteurs, notamment Alavi et al. [14], Mohammedi [15] et Ownagh et al. [16] qui ont prouvé que le DMSO n'a aucun pouvoir antifongiquepuissant.
6.2 Essai antifongique
21L’activité antifongique des différents extraits a été réalisée sur deux souchesphytopathogènes
22Pyrenophoratritici-repentisetRhynchosporiumsecalis,quiontététestéesinvitroparla méthode du contact direct sur milieu gélosé « PDA » pour déterminer les taux d’inhibition, en comparant leur action à diverses concentrations sur la croissance mycélienne [17].
6.3 Préparation des dilutions des différents extraits
23En se basant sur des essais préalables, la gamme de concentration de l’extrait végétal a été préparée dans des tubes à essais par la méthode d’une dilution selon une progression géométrique à raison de 2 avec des concentrations allant de 200 mg/ml à 25 mg/ml. Une concentration initiale de 200 mg/ml a été filtrée à travers un filtre millipore stérile de 0.45 m de diamètre.
24Les concentrations finales des extraits utilisées ont été calculées à partir de l'équation suivante:
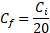
25Où :
26Cf : concentration finale de l’extrait dans 1ml du PDA.
27Ci : concentration initiale de l’extrait solubilisé dans le DMSO [15].
28Après préparation d’une série de dilution, un millilitre de chaque dilution est ajouté aseptiquement à 19 ml de milieu de culture PDA maintenu liquide à 45°C [18]. Ensuite, il est immédiatement coulé dans des boîtes de pétri de 90 mm (20 ml/boite) [19]. Après solidification, chaque boite est inoculée à l’aide d’un disque mycélien de 6mm de diamètre provenant du front de croissance des cultures âgées d’une semaine. Les boites sont incubées à 25°C ± 1°C pendant sept jours pour les isolats. Le PDA sans extrait a servi de témoin pour chaque souche [20-21].
7. Estimation de la croissance mycélienne
29La technique consiste à mesurer la croissance mycélienne des colonies durant sept jours, en utilisant la formule suivante [22-23] :
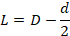
30Où :
31L : croissance mycélienne. D : diamètre de la colonie. d : diamètre de l’explant.
8. Action sur la croissancemycélienne
32Pour chaque espèce fongique et pour chaque concentration en extrait, le diamètre est mesuré selon deux directions perpendiculaires. L’inhibition de la croissance fongique est évaluée par le pourcentage de réduction de la croissance mycélienne, calculée pour chaque isolat selon la formule décrite par Doumbouya[24]:
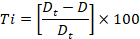
33Où:
34Ti : taux d’inhibition de la croissancemycélienne (en %).Dt : diamètre moyen de la croissance mycélienne en absence de l’extrait.
35D : diamètre moyen de la croissance mycélienne en présence de l’extrait.
9. Résultats et discussion
9.1 Rendement des extraits
36Le rendement est calculé par rapport au poids de la matière sèche des graines de Chénopodium quinoa Wild, l'extrait éthanolique représente (E.E) 8,16 %, méthanolique (E.M)9,65%,hexane(E.H)1,69%etaqueux(E.SR)quiaenregistréunrendementde 13,15 % (figure 1).
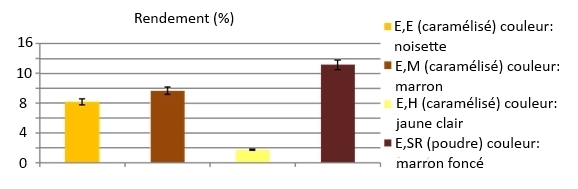
Fig. 1 : Représentation graphique des rendements des extraits des graines de Chénopodium quinoa Wild.
9.2 Screening phytochimique
37Les tests phytochimiques consistent à détecter les différentes familles de composés existantes dans la partie étudiée de la plante par des réactions de précipitation ou de coloration en utilisant des réactifs spécifiques à chaque famille de composés. L’étude phytochimique est résumée dans le tableau suivant :
Tableau 1 : Screening phytochimique de la semence de Chénopodium quinoa Wild.
|
Composés |
Réactions/ |
Résidus |
|||
|
phytochimiques |
Réactifs |
R1 (E.E) |
R2(E.M) |
R3 (E.H) |
R4 (E.SR) |
|
Stérols et polyterpènes |
RL |
++ |
++ |
+++ |
++ |
|
Tannoïdes |
RS |
+ |
+ |
- |
- |
|
Tannins vrais |
RS |
+ |
+ |
- |
- |
|
Flavonoïdes |
RC |
+++ |
+++ |
++ |
+++ |
|
Quinones |
RBG |
- |
- |
- |
- |
|
Saponines |
TM |
+++ |
+++ |
+++ |
+++ |
|
Sucres réducteurs |
LF |
++ |
++ |
+ |
++ |
|
Coumarines |
RSL |
++ |
++ |
+ |
+ |
|
Alcaloïdes |
RB |
- |
- |
- |
- |
38E.E= Extrait Ethanolique; E.M= Extrait Méthanolique; E.H= Extrait Hexanique; E.SR= Extrait Sous Reflux; RL = Réaction de Liebermann;
39RS = Réactif de Stiasny ; RC = Réaction à la Cyanidine ; RBG = Réactif de Borntraëger ; TM = Test de Mousse ; LF = Liqueur de Fehling ;
40RSL = Réaction sur Lactones ; RB = Réactif de Burchard ; (+) = présents ; (++) = abondants ; (+++) = très abondants ; (-) = absents
41LesrésultatsdutriphytochimiqueréalisésurlesextraitsdesemencesdeChénopodiumquinoaWild sont mentionnés dans le tableau 1. Les quinones et les alcaloïdes sont absents de tous les extraitsbruts.
42Les sucres réducteurs, les coumarines, les flavonoïdes et les stérols sont présents dans tous les extraits bruts. Par contre, les saponines sont présentes en abondance dans tous les extraits
(figure 2).
|
|
|
Fig 2 : Screening des saponines.
9.3 Activité antifongique
43L’activité antifongique des graines de Chénopodium quinoa Wild est testée contre la souche phytopathogéne Pyrenophora tritici-repentis, les résultats sont affichés en histogrammes
(figure 3).
|
|
|
Croissance mycélienne du Pyrenophora tritici-repentis en fonction des différentes concentrations d’E.E pendant 7jours |
|
|
|
Croissance mycélienne du Pyrenophora tritici-repentis en fonction des différentes concentrations d’E.M pendant 7jours |
|
|
|
Croissance mycélienne du Pyrenophora tritici-repentis en fonction des différentes concentrations d’E.H pendant 7jours |
|
|
|
Croissance mycélienne du Pyrenophora tritici-repentis en fonction des différentes concentrations d’E.SR pendant 7jours |
Fig 3 : Effet antifongique des différents extraits des graines de Chénopodium quinoa Wild sur la croissance mycélienne (mm) du Pyrenophora tritici-repentis en fonction du temps.
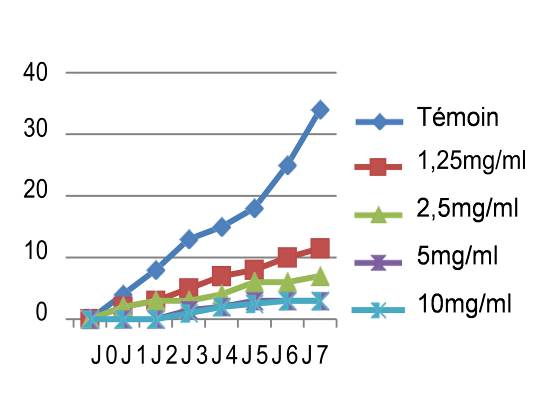
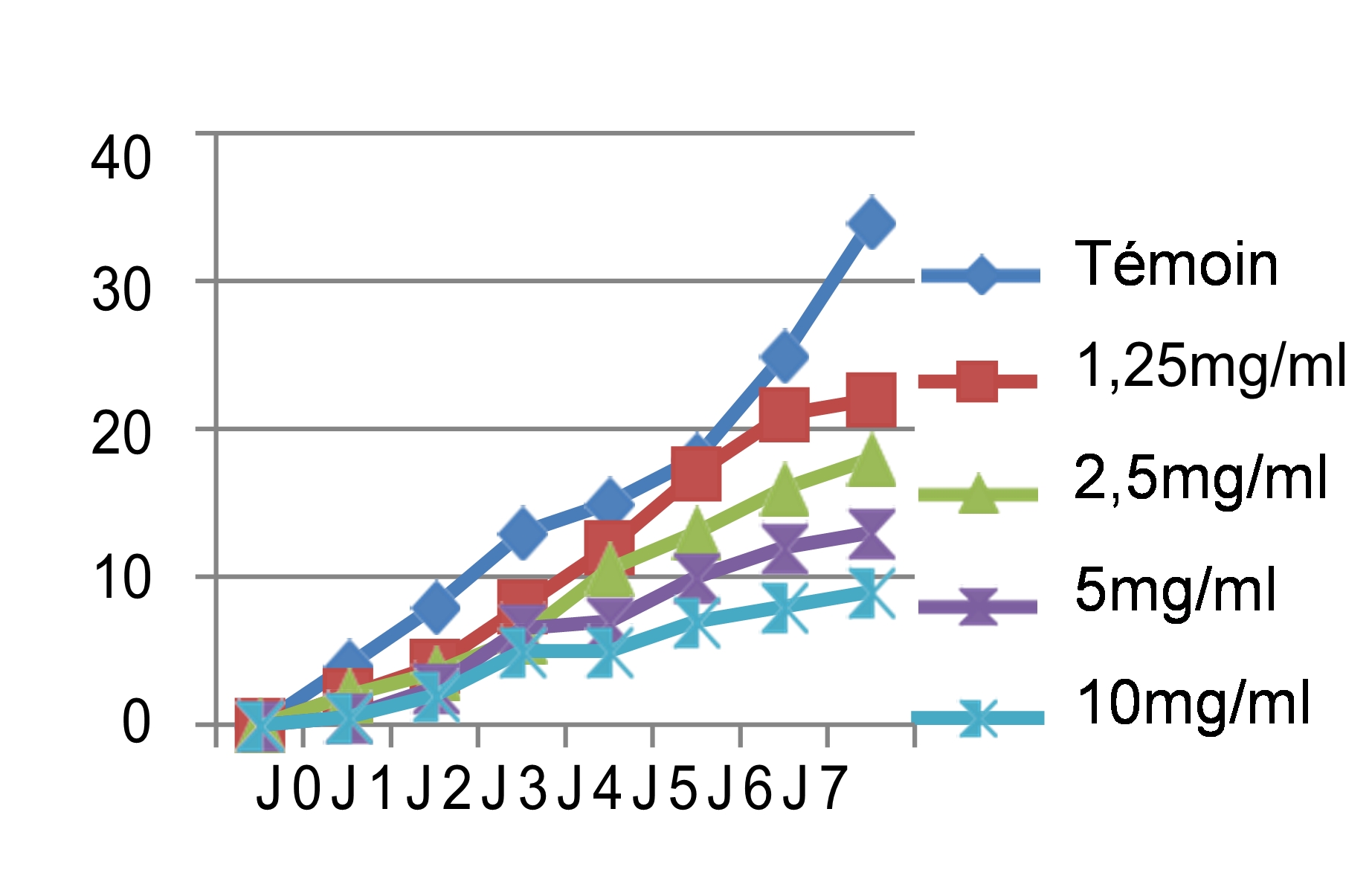
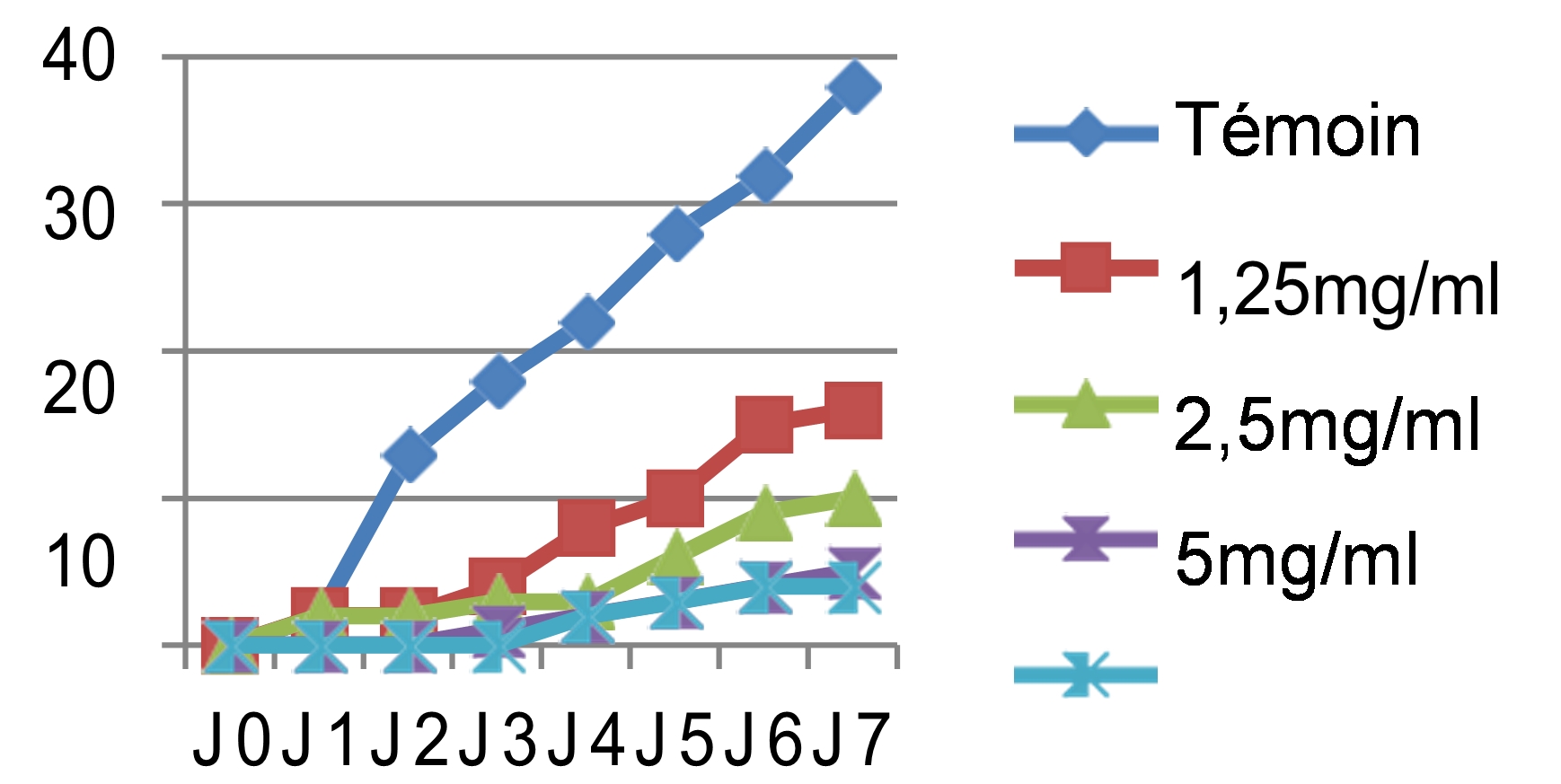
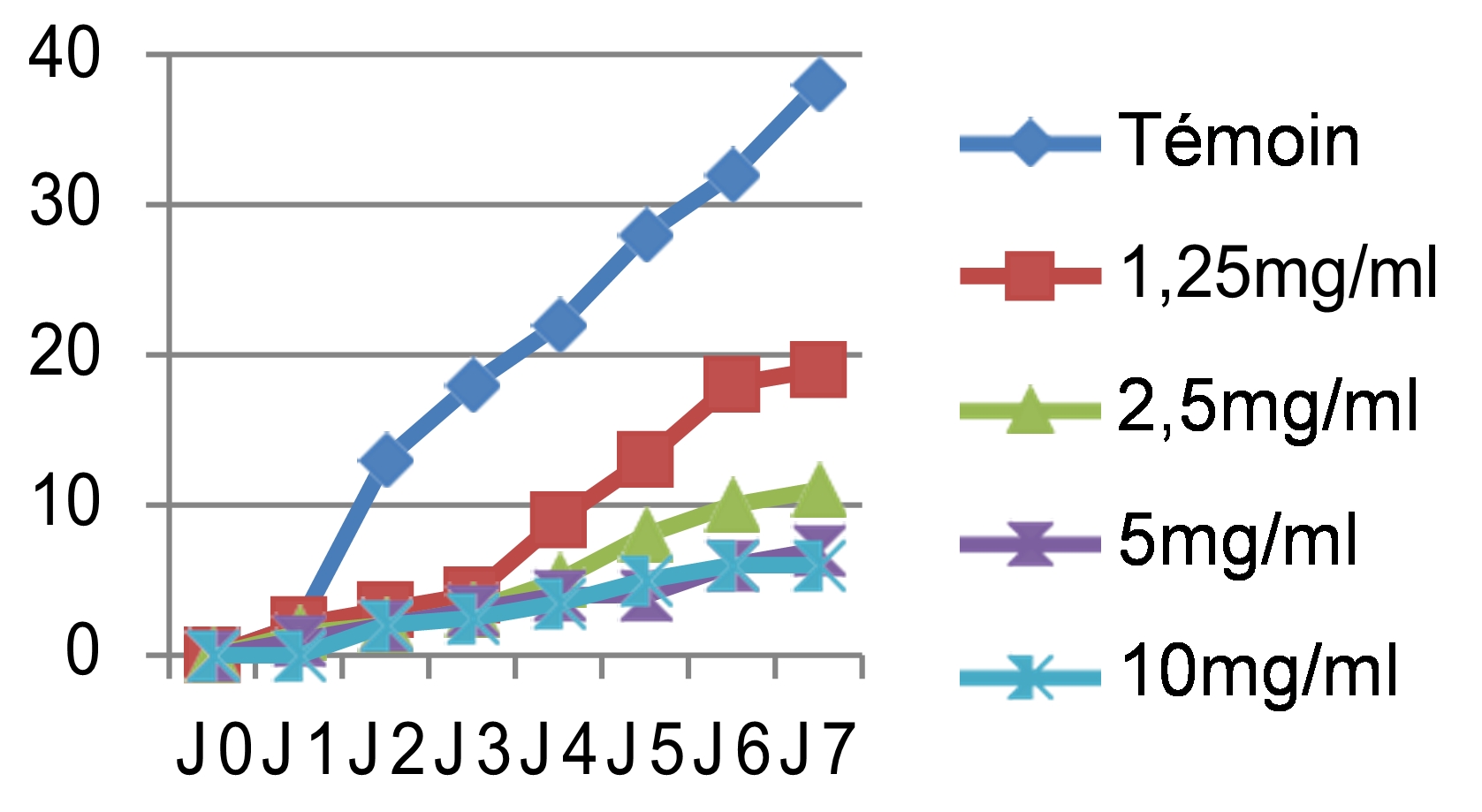
44Nous avons noté au cours des sept jours d’incubation que la croissance mycélienne a baissé avec l’augmentation des concentrations des quatre extraits testés, les meilleures performances sont enregistrées respectivement avec les extraits éthanolique, méthanolique, aqueux et hexanique. Ainsi nous avons noté que le démarrage de la croissance fongique n’a débuté qu’après le 4ème jour pour l’extrait méthanolique avec une concentration de 10 mg/ml, après le 3ème jour pour les extraits éthanolique et aqueux et avec les concentrations 5 et 10 mg/ml, tandis que pour l’extrait hexanique le mycélium commence à s’étaler dès le 1er jour. Si on compare nos résultats avec le témoin non traité qui a enregistré une croissance mycélienne de 37mm le 7ème jour d’incubation (figure 4), les extraits ont montré un pouvoir anti fongique important avec des taux d’inhibition hautement significatifs soit : 91,17% pour l’extrait éthanolique dès la concentration de 5 mg/ml, 89,7% pour l’extrait méthanolique avec une concentration de 10 mg/ml, 83,82% pour l’extrait aqueux sous reflux dès la concentration de 5 mg/ml. Cependant, l’extrait hexanique a enregistré un taux d’inhibition moyennement appréciable : soit 73,52% avec la concentration de 10 mg/ml.
|
(A) Control |
|
|
|
(B) 1.25 mg/ml |
|
|
|
(C) 5 mg/ml |
|
|
Fig. 4 : L’effet antifongique sur Pyrenophora tritici-repentis (B)+(C) par rapport au témoin (A).
45Le résultat du test antifongique des extraits des graines de Chénopodium quinoa Wild sur Rhynchosporium secalis se résume dans les courbes suivantes (figure 5) :
|
|
|
Croissance mycélienne du Rhynchosporium secalis en fonction des différentes concentrations d’E.E pendant 7jours |
|
|
|
Croissance mycélienne du Rhynchosporium secalis en fonction des différentes concentrations d’E.M pendant 7jours |
|
|
|
Croissance mycélienne du Rhynchosporium secalis en fonction des différentes concentrations d’E.H pendant 7 jours |
|
|
|
Croissance mycélienne du Rhynchosporium secalis en fonction des différentes concentrations d’E.SR pendant 7jours |
Fig. 5 : Effet antifongique des différents extraits des graines de Chénopodium quinoa Wild sur la croissance mycélienne (mm) du Rhynchosporium secalis en fonction du temps.
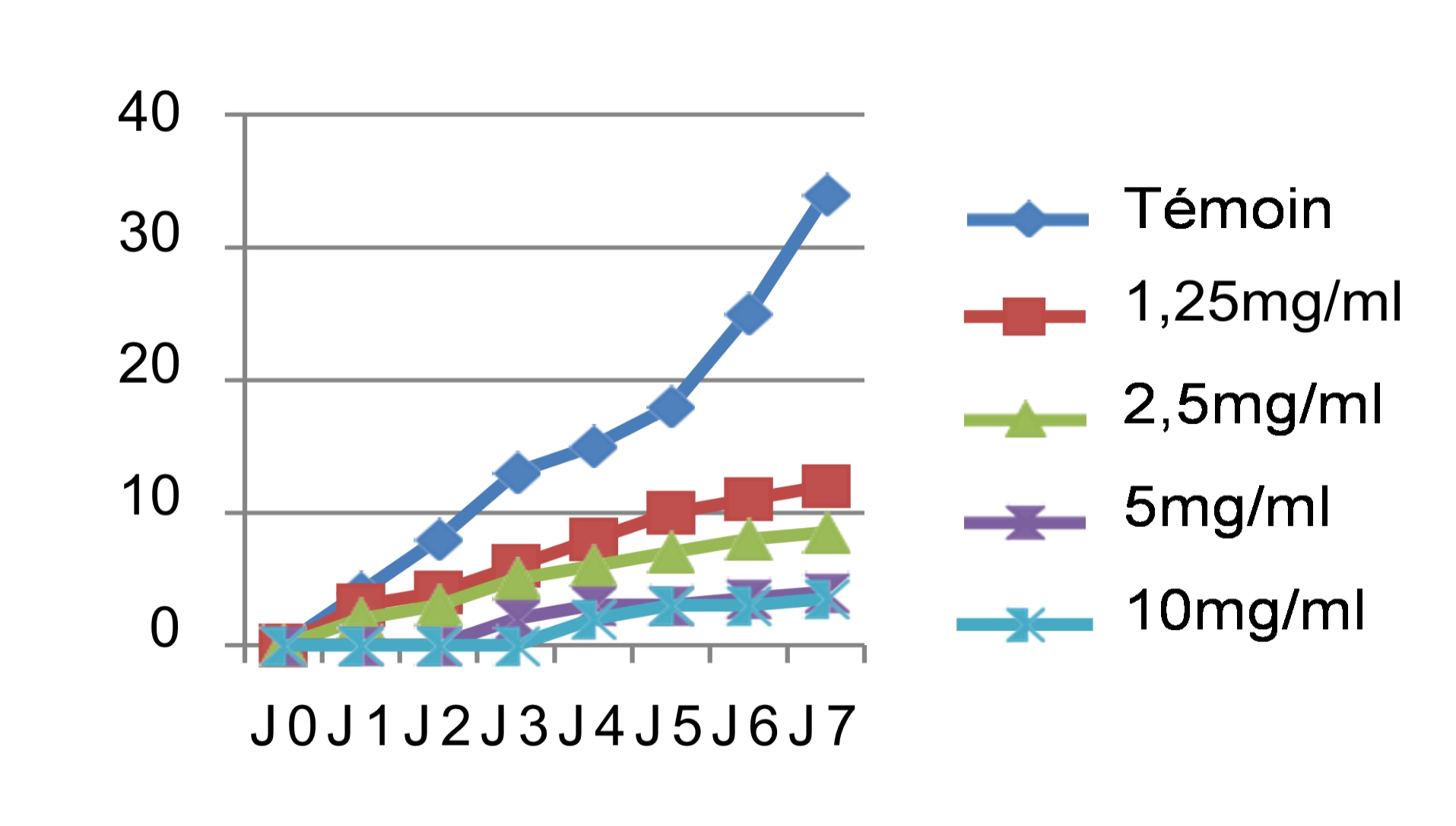
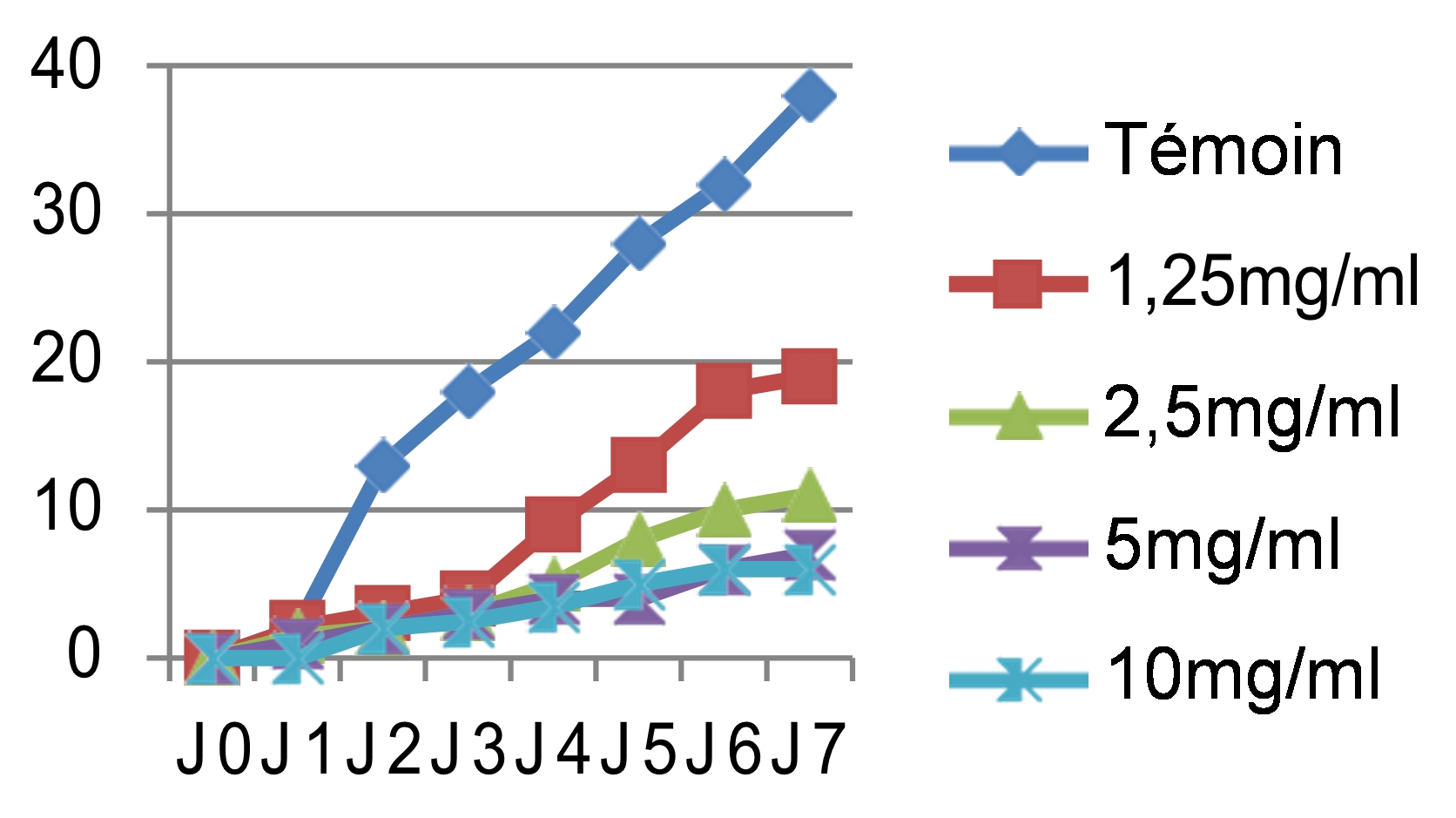
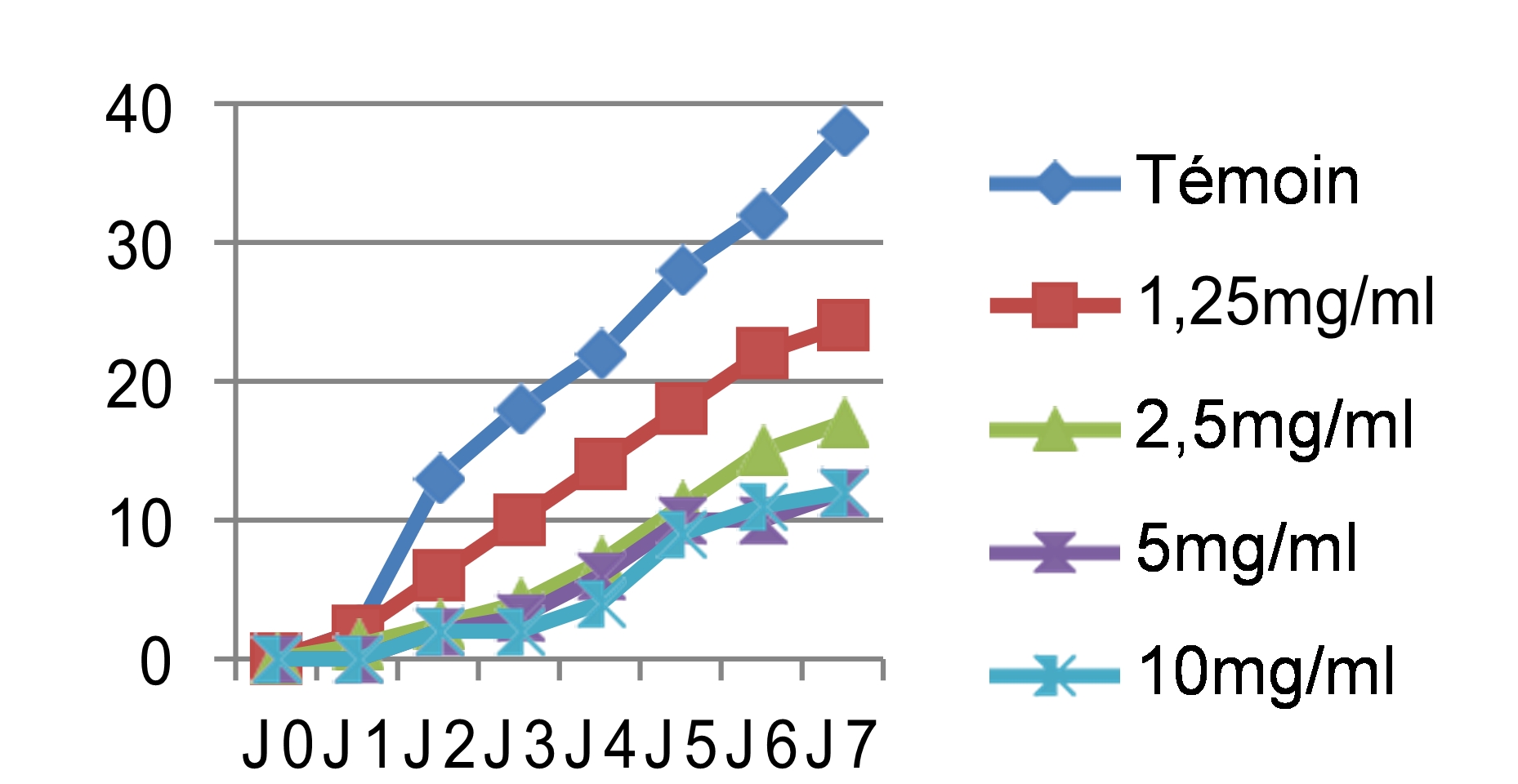
46Les mêmes observations ont été faites pour le cryptogame Rhynchosporium secalis pendant les sept jours d’incubation. Nous avons noté également une inhibition considérable de la croissance mycélienne par les différentes concentrations des quatre extraits testés, les extraits végétaux à caractère polaire ont donné les meilleures performances qui sont respectivement l’E.E avec un taux d’inhibition de 89,47%, l’E.M avec 86,84% et l’E.SR avec 84,21% (figure 5). Par contre, l’extrait hexanique apolaire n’a stoppé que les 2/3 de la croissance mycélienne si on le compare au témoin soit un taux d’inhibition de 68,42%. Le démarrage de la croissance fongique a débuté qu’après le 4èmejour pour l’extrait éthanolique, après le 3èmejour pour l’extrait méthanolique et le 2èmejour pour les extraits hexanique et aqueux sous reflux avec la même concentration 10 mg/ml. Si on compare les résultats avec le témoin non traité qui a enregistré une croissance mycélienne de 38mm le 7èmejour d’incubation (figure 6), les extraits ont montré un pouvoir anti fongique important avec des taux d’inhibitions hautement significatifs pour les extraits apolaires avec les concentrations 5 et 10mg/ml.
|
(A) Control |
|
|
|
(B) 1.25 mg/ml |
|
|
|
(C) 5 mg/ml |
|
|
Fig. 6 : l’effet antifongique sur Rhynchosporium secalis (B)+(C) par rapport au témoin (A).
10. Discussion
47L’analyse des résultats des tests antifongiques réalisés in vitro, montre une efficacité remarquable et hautement significative vis-à-vis des deux pathogènes étudiées (Figure 3 et 5)
48Une concentration en extrait de l’ordre de 10 mg/ml à inhibée l’extension mycélienne de Pyrenophora tritici-repentis et Rhynchosporium secalis. Le taux d’inhibition de ces derniers varie de 68,42% à 91,17% le 7ème jour d’incubation.
49L’activité antifongique trouvée dans cette expérimentation ainsi que le test positif des saponines confirment les résultats trouvés par plusieurs auteurs qui ont déclaré que les saponines contenues dans la semence du quinoa sont à l’origine du pouvoir antifongique doté pour cette espèce. À titre d’exemple, Woldemichael et Wink [3] montrent que Les saponines du quinoa présentent une activité antifongique importante puisqu’elles inhibent la croissance de Candida albicans à 50 µg/ml. Plus récemment, les saponines contenues dans l’enveloppe des graines de quinoa ont également montré une activité contre Botrytis cinerea, les extraits de saponines inhibent significativement la croissance mycélienne et la germination des conidies [2]. Ainsi, Kuljanabhagavad et al. [25] montrent que les saponines s’accumulent beaucoup plus dans le quinoa situé dans les régions les plus exposées à l’attaque des champignons.
11. Conclusion
50La quinoa est souvent surnommée par les chercheurs « la graine d’or des Andes » en raison de sa haute valeur nutritive et son potentiel thérapeutique [26]. Cette dernière a montré dans cette étude un pouvoir antifongique important contre les cryptogames les plus redoutables de la culture de l’orge.
51La recherche s’est focalisée sur l’examen approfondi des composés chimiques bioactifs contenus dans les graines. D’une part, certaines de ces substances ont montré des propriétés antifongiques qui laissent entrevoir une possible utilisation du quinoa comme source de principes actifs dans la formulation de produits fongicides. Les recherches effectuées sur les différents extraits révèlent la présence d’importants métabolites secondaires comme les saponines.
52En perspective, il est prévu de tester les graine du Chénopodium quinoa Wild sur différents agents phytopathogénes pour repérer le spectre d’action afin de développer une alternative par rapport à l‘utilisation des fongicides d‘origine synthétique dans le but de les remplacer par des traitements biologiques à base d‘extraits de plantes.
Références
53[1] Pietta P.G, (2000), Flavonoids as antioxidants, Journal of Natural Products, 63, p.1035.
54[2] Stuardo M., San Martin R. (2008). Antifungal properties of quinoa (Chenopodium quinoa Wild) alkali treated saponins against Botrytis cinerea. Ind. Crop Prod, 27(3).296-302.
55[3] Woldemichael G., Wink M. (2001). Identification and biological activities of tritrpenoid saponins from Chenopodium quinoa. J. Agric. Food Chem., 49(5),2327-2332.
56[4] Kanoun K. (2014). Etude de l'activité antibactérienne et antifongique des extraits végétaux bruts de PUNICA GRANATUM vis à vis de certaines souches bactériennes résistantes aux antibiotiques et antifongiques - thèse de doctorat en sciences - université Djilali Liabes Sidi Bel Abbès.240p.
57[5] Harborne, J.B. (1998) Textbook of Phytochemical Methods. A Guide to Modern Techniques of Plant Analysis. 5th Edition, Chapman and Hall Ltd, London,21-72.
58[6] Applebaum S, Marfo S, Birk Y (1969). Saponins as possible factors of resitance oflegume seeds to the attack of insects. J. Agric. Food Chem. 17, 618-620.
59[7] FallehH.,KsouriR.,ChaiebK.,Karray-bourawiN.,TrabelsiN.,BoulaabaM.,Abdelly
60C. (2008). Phenolic composition of CynaracardunculusL. organs, and their biological activities, C. R.Biologies. Vol. (331). 372-379.
61[8] Lazureskii G.V., Terenteva I.V. & Chamchurin A.A., (1966). Praticheskii raboti po khimii soedinienii. Édition Vischaya Chkola, Moscou (Russie); 334 pp.
62[9] Senov P. L., (1978). Farmatsevticheskaya chimia. Édition Moskva Medicina, Moscou (Russie); 480pp.
63[10] Longaga A. Otshudi, Vercruysse A. & Foriers A., (2000). Contribution to the ethnobotanical, phytochemical and pharmacological studies of traditionally used medicinal plants in the treatment of dysentery and diarrhoea in Lomola area, Democratic Republic of Congo (RDC). J. Ethnopharmacol. 71:411-423.
64[11] Melenteva G.A. & Antonova L.A., (1993). Farmatsevticheskaya khimia. Édition Moskva Medicina, Moscou (Russie); 574pp.
65[12] Tona L., Kambu K., Ngimbi N., Cimanga K. & Vlietinck A. J., (1998). Antiamoebic and phytochemical screening of some Congolese medicinal plants. J. Ethnopharm. 61:57-65.
66[13] Yrjönen T. (2004). Extraction and Planar Chromatographic Separation Techniques in the Analysis of Natural Products. Conference Room 513 at ViikkiInfocentre (Viikinkaari 11), Facultyof Pharmacy of the University of Helsinki:64.
67[14] Alavi S-H-R., Yassa N. et Fazeli M-R.(2005). Chemical constituents and antibacterial activity of essential oil of PeucedanumruthenicumM. Bieb. Fruits. SHR IJPS 1 (4):217-222.
68[15] Mohammedi Z. (2006). Etude du pouvoir antimicrobien et antioxydant des huiles essentielles et flavonoïdes de quelques plantes de la région de Tlemcen. Thèse magistère. Université de Tlemcen: 104P.
69[16] Ownagh A., Hasani A., Mardani K. et Ebrahimzadeh S. (2010). Antifungal effects of thyme, agastache and satureja essential oils on Aspergillus fumigatus, Aspergillus flavusand Fusarium solani. Veterinary Research Forum. 2:99-105.
70[17] Hussin N-M., Muse R., Ahmad S., Ramli J., Mahmood M., Sulaiman M-R, Shukor M-A- Y., Rahman M-F-A. et Aziz K-N-K. (2009). Antifungal activity of extracts and phenolic compounds from BarringtoniaracemosaL. (Lecythidaceae). African Journal of Biotechnology Vol. 8 (12):2835-2842.
71[18] Subrahmanyam M., Hemmady A. et Pawar S-G. (2001). Antibacterial Activity OfHoneyOn Bacteria Isolated From Wounds. Annals of Burns and Fire Disasters. XIV(I).
72[19] Satish S., Raghavendra M-P., Mohana D-C. et Raveesha K-A. (2010). In vitro evaluation of the antifungal potentiality of Polyalthialongifoliaagainst some sorghum grain moulds. Journal of Agricultural Technology. Vol.6(1):135-150.
73[20] Mishra A-K. et Dubey N-K. (1994). Evaluation of Some Essential Oils for Their Toxicity against Fungi Causing Deterioration of Stored Food Commodities. Applied and Microbiology. 60 (4):1101-1105.
74[21] Khallil A-R-M. (2001). Phytofungitoxic Properties in the aqueous extracts of some plants. Pakistan Journal of Biological Sciences. 4 (4):392-394.
75[22] Brewer D. (1960). Studies in Asochytapiri. Canadian Journal of botanic, 38:705-717.
76[23] Leach C. M. (1962). The quantitative and qualitative relationship ultraviolet and visible radiation in the induction of reproduction in Asochytapisi. Canadian Journal of botanic, vol. 40:1577-1602.
77[24] Doumbouya M. (2012). Activités comparées in vitro de deux fongicides de synthèse et deux huiles essentielles, Journal of Applied Biosciences 50:3520–3532.
78[25] Kuljanabhagavad T., Thongphasuk P., Chamulitrat W., Wink M. (2008). Triterpene saponins from Chenopodium quinoa Wild. Phytochemistry, 69(9),1919-1926.
79[26] Vega-Galvez, A., Miranda, M., Vergara J., Uribe E., Puente L., Martinez E.A. (2010). Nutrition facts and functional potential of quinoa (Chenopodium quinoa Wild), an ancient Andean grain : A review. J.Sci.Food Agric., 90(15),2541-2547.