- Home
- Volume 87 - Année 2018
- Articles
- Étude phytoécologique de la flore adventice des agrosystèmes céréaliers de la région de Tessala (Algérie nord-occidentale)
View(s): 5180 (18 ULiège)
Download(s): 687 (3 ULiège)
Étude phytoécologique de la flore adventice des agrosystèmes céréaliers de la région de Tessala (Algérie nord-occidentale)
Phytoecological study of the adventitious flora of cereal agrosystems in the Tessala region (North-western Algeria)

Résumé
La position géographique et la diversité climatique de l’Algérie lui confère une des flores les plus diversifiée et les plus originales du bassin méditerranéen. La connaissance de la composition floristique et la répartition des communautés d’adventices permet une bonne gestion de la parcelle.
À travers cette étude, la flore adventice s’avère très diversifiée dans la région de Tessala. Selon un gradient altitudinal, 83 espèces adventices sont recensées au niveau des 17 parcelles retenues. Leur classification met en évidence une dominance des monocotylédones (86,75 %) et particulièrement la famille des Asteraceae (15,67 %). Du point de vu biologique et biogéographique, ce sont respectivement les thérophytes (75,90 %) et l’élément méditerranéen (40,97 %) qui s’imposent. La caractérisation phytoécologique montre que la plupart des espèces ont une amplitude écologique importante ce qui leur confère une large plasticité écologique vis-à-vis de l’altitude qui pourrait s'expliquer par des variations génétiques et des adaptations locales des diverses populations. Quatre groupes écologiques ressortent et révèlent une répartition des espèces adventices obéissant au facteur altitude.
Abstract
The geographical position and the climate diversity of Algeria give it one of the most diverse and original flora of the Mediterranean basin. Knowledge of the floristic composition and the distribution of the weed communities allow good management of the plot.
Through this study, the adventitious flora is very diverse in the region of Tessala. According to an altitudinal gradient, 83 weed species are identified in the 17 selected plots. Their classification shows a dominance of monocotyledons (86.75%) and particularly the family Asteraceae (15.67%). From a biological and biogeographic point of view, therophytes (75.90%) and the Mediterranean element (40.97%) are the most important. Phytoecological characterization shows that most species have an important ecological amplitude, which gives them a large ecological plasticity with respect to altitude, which could be explained by genetic variations and local adaptations of the various populations. Four ecological groups emerged and revealed a distribution of adventitious species obeying the altitude factor.
Table of content
1. Introduction
1De par sa situation géographique, ses reliefs et la grande diversité de climats et de sols, l’Algérie possède une flore extrêmement riche et variée dans les régions côtières, les massifs montagneux, les hauts plateaux, la steppe et les Oasis sahariennes. Quezel et Santa [1-2] recensèrent 3.139 espèces dont 653 espèces endémiques. Le secteur phytogéographique oranais, à lui seul, conserve environ 1.780 espèces végétales du total de la flore algérienne soit environ 57% de la flore du pays. Ils rapportent que 250 espèces de la flore recensée, soit environ 14% restent strictement inféodées aux parcelles cultivées. L’Algérie, comme tout autre pays en voie de développement, connait une faiblesse importante des rendements en céréaliculture due essentiellement aux contraintes climatiques, techniques et phytosanitaires en particulier les adventices.
2En Algérie, les travaux réalisés sur les adventices sont peu nombreux et la plupart d’entre eux ont porté sur les mauvaises herbes des céréales et se sont limité principalement à l’algérois : Chevassut [3-4], Kiared [5], Chevassut et al. [6], Boulfekhar [7], Zermen [8] et Kadid [9]. D’autre travaux ont été réalisés sur les hautes plaines constantinoises : Fenni [10-11], Abdelkrim [12] ; Loubezda [13], Henni [14] et Benarab [15].
3Dans ce travail, deux aspects sont étudiés : dans le premier, une caractérisation floristique basée sur les caractéristiques taxonomique, biologique et phytogéographique est appréhendée et dans le deuxième, une étude phytoécologique est réalisée en tenant compte du facteur écologique ‶altitude″ et qui permettra de faire ressortir les groupes écologiquement semblables. Les résultats obtenus constituent un préalable indispensable aussi bien pour l’adoption d’une stratégie de lutte efficace et rentable que pour la conservation des espèces caractéristiques.
2. Matériel et méthodes
2.1. Cadre de l’étude
4La région retenue dans cette étude se situe dans la partie septentrionale de la wilaya de Sidi Bel Abbés. Géographiquement, elle appartient au Tell oranais qui rassemble des chaînes et des chaînons montagneux en un vaste bourrelet grossièrement parallèle aux chaînes sud-atlasiques, et qui se distingue par sa complexité structurale géologique. Elle s’étend entre 35°17'20,67'' et 35°20'31,04'' en latitude et 0°51'54,67'' et 0°42'54,96" en longitude. Elle est délimitée au nord par la commune de Sidi Boumediene et Oued Sebah, à l'ouest par la commune de Sehala, à l'est par la commune de Ain Trid et au sud par la commune de Sidi Lahcen [16].
5Dans la région de Tessala, les sols restent caractérisés par une faible profondeur, généralement inférieure à 50 cm, une texture où domine la fraction argileuse, avec une faible teneur en matière organique. Le taux de sable reste parfois important et prédispose les sols à une instabilité face à l’érosion avec toutes les conséquences sur la fertilité [17].
6Du point de vue climatique, la région de Tessala appartient à l’étage bioclimatique semi-aride caractérisé par un hiver pluvieux et assez froid et un été très chaud avec une période de sécheresse de six mois. Les températures annuelles moyennes sont comprises entre 8,33 °C et 26,11 °C. Les moyennes des minima du mois le plus froid varient de 2 °C à 4 °C et les moyennes des maxima du mois le plus chaud dépassent rarement les 30 °C [17].
2.2. Collecte des données
7Pour l’étude floristique et phytoécologique, la méthode phyto-sociologique dite stigmatiste est retenue [18]. Pour cela, ont été choisies 17 parcelles de céréale réparties sur la zone d’étude, en fonction d’un gradient altitudinal.
8Au niveau de chaque parcelle et pendant la période propice de végétation optimale (mars-fin mai), ont été réalisés cinq relevés phyto-sociologiques, soit au total quatre-vingt-cinq relevés. La superficie de chaque relevé est de 100 m², une surface floristiquement homogène et représentative permettant la collecte d’informations fiables [19]. Ozenda [20] signale que la valeur de l'aire minimale peut être appréciée assez facilement ; elle est sensiblement constante pour les divers relevés d'un groupement déterminé, mais varie beaucoup d'un groupement à l'autre.
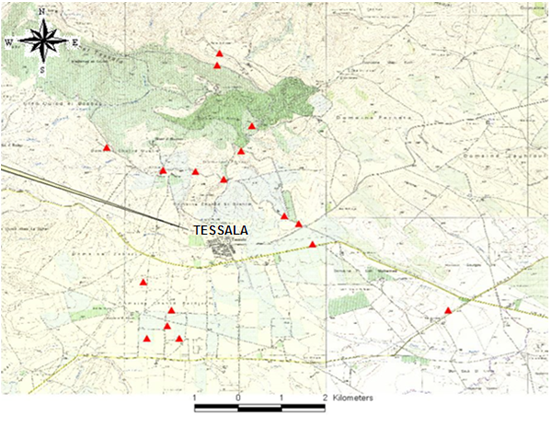
Figure 1 : Localisation () des parcelles retenues.
9Le choix de l’emplacement des relevés s’est fait d’une manière subjective en veillant au respect du critère d’homogénéité structurale floristique et écologique [21-22] à l’échelle de la parcelle. La méthode couramment utilisée consiste à récolter toutes les espèces végétales rencontrées et faire la liste des espèces sur une placette de surface 100 m2. Seules la présence (+) et l’absence (-) des espèces sont notées. Les caractères stationnels, à savoir l’altitude et les coordonnées géographiques sont notés. Au terme des 85 relevés, une liste regroupant toutes les espèces recensées est établie.
2.3. Caractérisation phytoécologique
10Pour la caractérisation phytoécologique de la flore adventice recensée, le facteur écologique ‶altitude″ est retenu comme paramètre déterminant. Selon ce descripteur, les relevés réalisés sont répartis en classes afin de mettre en évidence les groupes écologiques. Le nombre de relevés varie d’une classe à une autre et ceci en fonction de l’altitude (Tableau 1).
Tableau 1 : Classes de l’altitude
|
Classes |
Nombre de relevés par classe |
|
Classe 01 (500-600 m) |
15 |
|
Classe 02 (601-700 m) |
30 |
|
Classe 03 (701-800 m) |
20 |
|
Classe 04 (801-900 m) |
20 |
11Cette étude repose sur l’utilisation simultanée des critères floristiques et écologiques pour définir les groupements végétaux. Elle a pour but de caractériser la sensibilité des espèces aux conditions du milieu au moyen de profils écologiques aboutissant ainsi à la constitution de noyaux d’espèces à écologie semblable, ce qui revient à établir des groupes écologiques [23].
2.3.1. Les profils écologiques
12Cette méthode permet d’analyser la distribution des espèces dans les différentes classes du descripteur retenu (altitude) grâce aux profils de fréquences relatives (FR) et aux profils des fréquences corrigées (FC) qui sont calculées par les formules suivantes [24] :
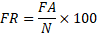
13Où :
14FA = Fréquence absolue ; N = Nombre de relevé par classe.
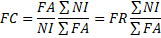
15Où :
16NI = nombre de relevés de la classe I ; NI = nombre total de relevés ; FA = somme des fréquences absolues (nombre total des présences de l’espèce).
2.3.2. Amplitude d’habitat (AH)
17Pour tirer le maximum d’informations des profils écologiques, nous avons utilisé le paramètre d'amplitude d'habitat (AH) pour chaque espèce afin de mieux mesurer la plasticité écologique vis-à-vis d’un descripteur de milieu. La formule suivante a été appliquée [25] :
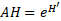
18Où :
19e= Base des logarithmes népériens ; H’= .Fonction de Shannon = -PI Ln PI ;
20P = Proportion des contacts de l’espèce dans chaque modalité de facteurs.
2.3.3. Barycentre écologique (G)
21Le barycentre mesure le centre de gravité de la distribution des présences de l’espèce le long d’un descripteur [25] et situe la position moyenne de chaque espèce le long d’un gradient [26]. Il permet de situer statistiquement et avec précision l’optimum écologique des espèces [27]. Il dépend étroitement de la définition à priori du nombre de classes de ressources [28].
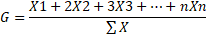
22Où :
23X1 = fréquence centésimale de l’espèce E dans la classe 1 du facteur considéré ; X2 = fréquence centésimale de l’espèce E dans la classe 2 du facteur considéré, etc…
24Lheritier et al. [28] mentionnent que l’amplitude d’habitat et le barycentre permettent de mieux cerner la façon dont chaque espèce se répartit le long de la succession écologique.
2.4. Analyses statistiques des résultats
25L’analyse floristique qualitative (famille, genre, espèces) est réalisée à partir de la liste floristique générale dressée à la suite des différents inventaires. Les espèces rencontrées sont également identifiées, classées par types biologiques et biogéographiques en utilisant la flore de Quézel & Santa [1-2].
3. Résultats
3.1. Composition floristique
26L’inventaire réalisé au niveau des 17 parcelles, soit 85 relevés, a permis de recenser 83 espèces végétales rattachées à 57 genres. Le nombre d’espèces par parcelle varie entre 46 et 29 espèces, soit une moyenne de 37 (parcelles 05 et 13) à 38 espèces (parcelle 01 et 15).
3.1.1. Spectre biologique
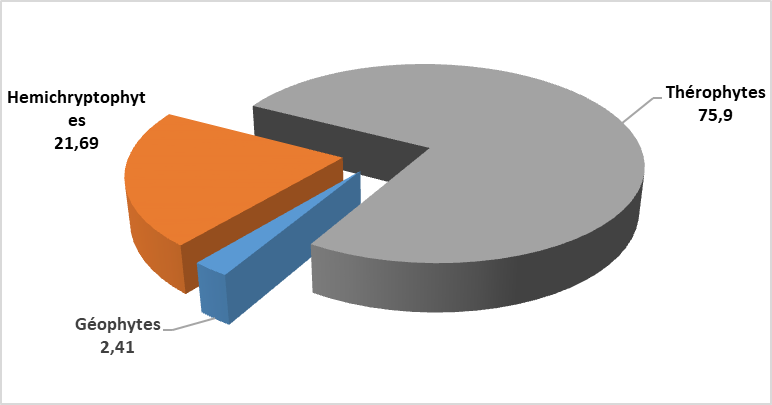
Figure 2 : Taux des différents types biologiques
27La classification des espèces rencontrées selon leur type biologique (figure 2) montre que les thérophytes constituent le type dominant (63 espèces soit 75,90%), suivies par les hémicryptophytes avec 18 espèces, soit 21,69 % et les géophytes avec 2 espèces, soit 2,41%.
3.1.2. Origine biogéographique
28La caractérisation phytogéographique montre que la recensée est très diversifiée et comprend plusieurs groupes phytochorologiques (figure 3).
29Les espèces rencontrées se caractérisent par la présence d’une espèce endémique algéro-marocaine, soit 1,20%. L'ensemble méditerranéen reste le plus représentatif avec 34 espèces, soit 40,97%. Successivement, se succèdent les éléments eurasiatiques (10 espèces, soit 12,05%), paléo-tempérés (9 espèces, soit 10,85%), euro-méditerranéens (7 espèces, soit 8,43%), cosmopolites (5 espèces, soit 6,03%), ouest-méditerranéens (04 espèces, soit 4,83%) et ibéro-mauritaniens (3 espèces, 3,62%). Les autres types biogéographiques sont pratiquement représentés uniquement par une à deux espèces.
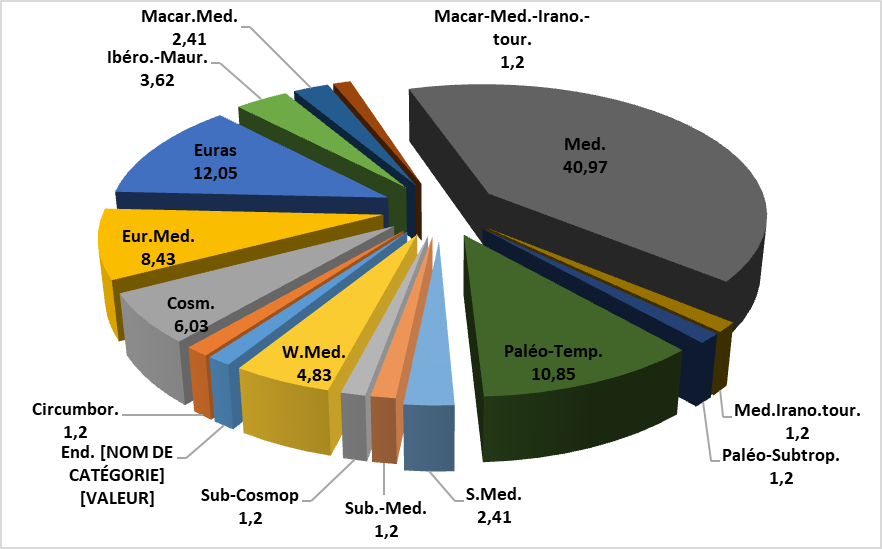
Figure 3 : Taux des types biogéographiques des espèces recensées
Med : méditerranéenne ; W-Med : ouest-méditerranéenne ; Euras : eurasiatique ; Eur-Med : euro-méditerranéenne ; Cosm : cosmopolite ; Ibero-Maur. : ibéro-mauritanique ; End. Alg-Maroc : endémique Algéro-Marocaine ; Circumbor : circum-boréale ; S.Med : Sud-méditerranéenne ; Macar-Med : macaronésienne méditerranéenne ; Macar-Med-Irano-Tour : macaronésienne méditerranéenne irano-touranienne ; Med.-Irano-Tour : méditerranéenne irano-touranienne ; Paleo-Subtrop : paléo-sub-tropicale ; Paleo-Temp : paléo-tempérée ; Sub-Cosmop : sub-cosmopolite ; Sub-méd. : sub-méditerranéenne.
3.1.3. Aspect systématique
30Les dicotylédones dominent la flore recensée (72 espèces, soit 86,75%), tandis que les monocotylédones ne représentent que 13,25% (soit 11 espèces)
31Les 83 espèces rencontrées se rattachent à 24 familles botaniques (figure 4).
32La famille la mieux représentée est celle des Astéraceae (13 espèces, soit 15,67%) suivies par les Fabaceae (14 taxons, soit 14,47%), ensuite viennent les Poaceae (10 espèces, soit 12,06%), puis les Brassicaceae (8 espèces, soit 9,65%), les Caryophyllaceae (7 espèces, soit 8,43%), les Apiaceae (6 espèces, soit 7,24%) et les Plantaginaceae (4 espèces, soit 4,82%). Les 17 familles restantes sont chacune représentées par une ou deux espèces.
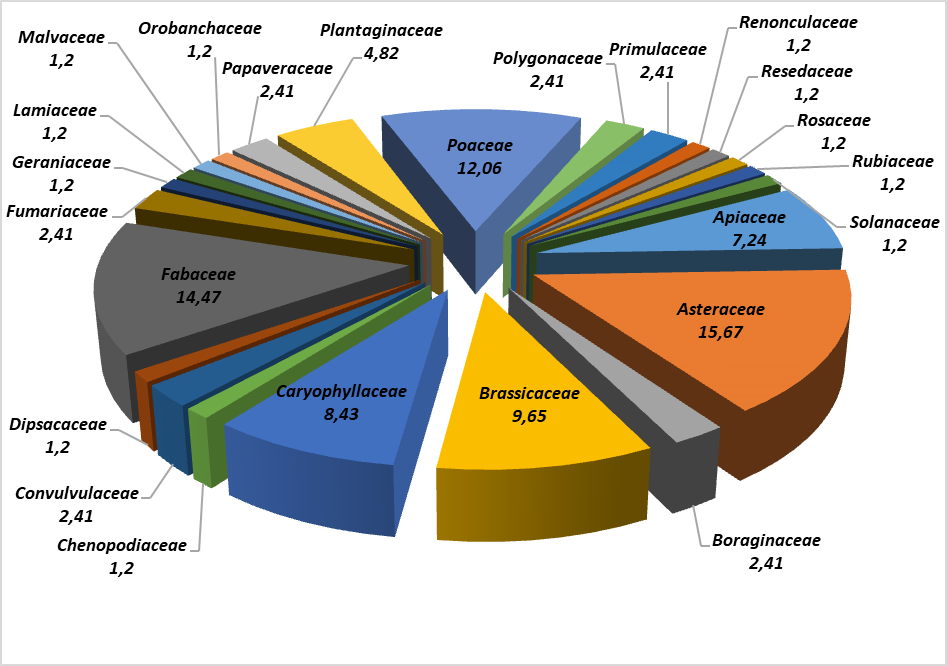
Figure 4 : Représentation graphiques de la taxonomie des espèces recensées
3.2. Caractérisation phytoécologique
3.2.1. Profils des fréquences relatives
33Selon le spectre des fréquences relatives (figure 5) de la flore adventice recensée, il apparaît clairement que c’est la classe 4 (801 et 900 m), soit 32,53% des espèces recensées, puis dans la classe 2 (601-700 m) avec 28,92%, la classe 3 (701-800 m) avec 20,48% et finalement, la classe 01 (500 – 600 m) avec 18,07%.
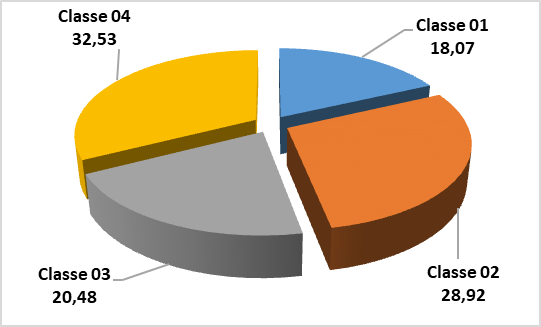
Figure 5 : Spectre des fréquences relatives des espèces recensées
3.2.2. Amplitude d’habitat et barycentre
34Le calcul de l’amplitude d’habitat (AH) et du barycentre écologique (G) montre que pour l’ensemble des espèces étudiées, il existe 15,67% d'espèces spécialistes, 45,78% d’espèces à valence intermédiaire et 38,55% d’espèces généralistes.
Tableau 2 : Espèces généralistes
|
Espèces |
AH |
G |
Espèces |
AH |
G |
|
Papaver rhoeas L. |
3,88 |
2,56 |
Lolium multiflorum Lamk. |
3,57 |
2,95 |
|
Hordeum murimum L. |
3,84 |
2,5 |
Convolvulus arvensis L. |
3,55 |
2,29 |
|
Vaccaria pyramidata Medik. |
3,82 |
2,42 |
Reseda alba L. |
3,48 |
2,9 |
|
Sinapis alba L. |
3,8 |
2,43 |
Cardius pycnocephalus L. |
3,45 |
2,35 |
|
Cichorium intybus L. |
3,8 |
2,56 |
Fumaria officinalis L. |
3,39 |
2,32 |
|
Anagalis monelli L. |
3,8 |
2,69 |
Silène muscipila L. |
3,38 |
2,84 |
|
Melilotus infesta Guss. |
3,79 |
2,47 |
Ridofolia segetum Moris |
3,38 |
1,74 |
|
Avena sterilis L. |
3,77 |
2,51 |
Convolvulus althaeoides L. |
3,36 |
1,97 |
|
Anacyclus clavatus Desf. |
3,75 |
2,65 |
Fumaria parviflora Lamk. |
3,33 |
1,88 |
|
Papaver hybridum L. |
3,71 |
2,34 |
Bifora testiculata Roth. |
3,26 |
2,3 |
|
Bromus sterilis L. |
3,69 |
2,4 |
Marubium vulgare L. |
3,25 |
1,79 |
|
Malva sylvestris L. |
3,69 |
2,29 |
Rhagadiolus stellatus (L.) Gaern. |
3,23 |
3,18 |
|
Phalaris canariensis L. |
3,62 |
2,28 |
Daucus carota L. |
3,22 |
2,09 |
|
Bupleurum lancefolium Horn. |
3,61 |
2,23 |
Torilis nodosa Gaertn. |
3,2 |
2,46 |
|
Diplotaxis erucoides (L.) DC. |
3,61 |
2,21 |
silene gallica L. |
3,15 |
3,02 |
|
Centaurea nicaeensis All. |
3,57 |
2,33 |
Centaurea diluta Ait. |
3,02 |
1,99 |
35Ce groupe est composé de 32 espèces dont l’amplitude d’habitat et le barycentre varient respectivement entre 3,88 - 3,02 et 1,74 - 3,18.
Tableau 3 : Espèces intermédiaires
|
Espèces |
AH |
G |
Espèces |
AH |
G |
|
Lathyrus ochrus L. |
3 |
2,22 |
Erodium muschatum (Burm.) L'Her. |
1,98 |
3,57 |
|
Chrysanthemum coronarium L. |
2,92 |
2,42 |
Filago pyramidata L. |
1,96 |
2 |
|
Sinapis arvensis L. |
2,91 |
2,96 |
Trifolium arvense L. |
1,96 |
3,6 |
|
Aegilops ventricosa Tausch |
2,89 |
3,2 |
Melilotus sulcata Desf. |
1,95 |
1,24 |
|
Orabanche crenata Forsk. |
2,87 |
3,15 |
Silene latifolia Poiret |
1,94 |
3,38 |
|
Plantago lagopus L. |
2,84 |
3,36 |
Chenopodium vulvaria L. |
1,94 |
1,48 |
|
Centaurea napifolia L. |
2,84 |
2,05 |
Bromus hordeaceus L. |
1,91 |
3,47 |
|
Silène rubella L. |
2,75 |
3,3 |
Caspella bursa-pastoris L. |
1,89 |
1,48 |
|
Scorpiurus muricatus L. |
2,74 |
3,36 |
Diplotaxis virgata DC. |
1,89 |
1,48 |
|
Silybum murianum (L.) Geartn. |
2,7 |
2,15 |
Mantisalca salmontica (L.) Brig.et Cavill. |
1,89 |
2,8 |
|
Foeniculum vulgare (Mill.) Gaertn. |
2,64 |
2,06 |
Rapistrum rugosum (L.) All. |
1,89 |
2,75 |
|
Echium plantagineum L. |
2,55 |
2,73 |
Trifolium tomentosum L. |
1,89 |
2,75 |
|
Polygonum aviculare L. |
2,4 |
1,68 |
Phalaris paradoxa L. |
1,88 |
1,51 |
|
Galium tricorne Witth. |
2,38 |
3,2 |
Anchusa azurea Mill. |
1,82 |
2,79 |
|
Bromus rubens L. |
2,33 |
2,29 |
Vicia villosa ssp. Desycarpa (Ten.) Cavil. |
1,8 |
1,57 |
|
Aegilops triuncialis L. |
2 |
2,6 |
Raphanus raphanistrum L. |
1,78 |
3,26 |
|
Brassica nigra (L.) Koch. |
2 |
2,29 |
Silene inflata (Salisb.) Sm. |
1,68 |
3,79 |
|
Trifolium angustifolium L. |
2 |
3,2 |
Centaurea eriophora L. |
1,46 |
3,88 |
|
Anagalis arvensis L. |
1,98 |
3,33 |
Linaria triphylla L. |
1,38 |
3,9 |
36Ce groupe est constitué par 38 espèces intermédiaires ayant une amplitude qui couvre deux ou trois classes d’altitude ; ce qui les place à un niveau intermédiaire entre les espèces franchement généralistes et spécialistes.
Tableau 4 : Espèces spécialistes
|
Espèces |
AH |
G |
Espèces |
AH |
G |
|
Datura stramonium L. |
1 |
1 |
Rumex bucephalophorus L. |
1 |
4 |
|
Lotus corniculatus L. |
1 |
4 |
Sanguisorba minor Scop. |
1 |
4 |
|
Medicago rigidula Desr. |
1 |
4 |
Scabiosa atropurpurea L. |
1 |
4 |
|
Medicago truncatula Gaertn. |
1 |
4 |
Scolymus hispanicus L. |
1 |
3 |
|
Plantago lanceolata L. |
1 |
4 |
Silene fuscata Link. |
1 |
4 |
|
Plantago psyllium L. |
1 |
4 |
Trifolium stellatum L. |
1 |
4 |
|
Ranunculus arvensis L. |
1 |
4 |
37Ce groupe inclut les espèces ayant une amplitude écologique limitée à une seule classe. Il regroupe 13 espèces dites ″spécialistes‶, assez exigeantes vis-à-vis de l’altitude.
3.2.3. Élaboration des groupes écologiques
38Les groupes écologiques ont été élaborés sur la base des profils de fréquences corrigées. Ainsi, quatre grands groupes d’espèces ressortent.
Tableau 5 : Groupe écologique des espèces de la classe des 500-600 m d’altitude
|
Espèces |
FC 01 |
FC 02 |
FC 03 |
FC 04 |
|
Brassica nigra (L.) Koch. |
2,83 |
0 |
0 |
2,13 |
|
Caspella bursa-pastoris L. |
2,03 |
1,89 |
0 |
0 |
|
Centaurea napifolia L. |
1,66 |
1,38 |
0 |
0,93 |
|
Chenopodium vulvaria L. |
1,89 |
1,76 |
0 |
0 |
|
Convolvulus althaeoides L. |
2,83 |
0,26 |
0,77 |
0,97 |
|
Datura stramonium L. |
5,67 |
0 |
0 |
0 |
|
Diplotaxis virgata DC. |
2,03 |
1,89 |
0 |
0 |
|
Filago pyramidata L. |
3,4 |
0 |
0 |
1,7 |
|
Fumaria parviflora Lamk. |
2,96 |
0,37 |
0,55 |
0,92 |
|
Lathyrus ochrus L. |
1,89 |
0,94 |
0 |
1,42 |
|
Marubium vulgare L. |
2,18 |
1,2 |
0,33 |
0,49 |
|
Melilotus sulcata Desf. |
3,49 |
1,09 |
0 |
0 |
|
Polygonum aviculare L. |
1,89 |
1,67 |
0 |
0,33 |
|
Ridofolia segetum Moris |
2,67 |
0,83 |
0,5 |
0,5 |
|
Sinapis alba L. |
1,13 |
1,09 |
0,71 |
1,06 |
39Ce groupe est composé de 15 espèces (tableau 5) dont 13 thérophytes (86,67%) et deux hémicryptophytes (13,33%).
Tableau 6 : Groupe écologique des espèces de la classe des 601-700 m d’altitude
|
Espèces |
FC 01 |
FC 02 |
FC 03 |
FC 04 |
|
Bifora testiculata Roth. |
1,18 |
1,39 |
0,24 |
1,04 |
|
Bromus rubens L. |
0,27 |
2,02 |
0,81 |
0,2 |
|
Bromus sterilis L. |
0,93 |
1,18 |
1,08 |
0,7 |
|
Bupleurum lancefolium Horn. |
1,17 |
1,27 |
0,88 |
0,59 |
|
Cardius pycnocephalus L. |
1,06 |
1,36 |
0,44 |
0,97 |
|
Centaurea diluta Ait. |
1,28 |
1,65 |
0,41 |
0,41 |
|
Centaurea nicaeensis All. |
1 |
1,33 |
0,75 |
0,75 |
|
Chrysanthemum coronarium L. |
0,4 |
1,65 |
1,09 |
0,4 |
|
Convolvulus arvensis L. |
1,11 |
1,33 |
0,58 |
0,83 |
|
Daucus carota L. |
1,34 |
1,49 |
0,34 |
0,67 |
|
Diplotaxis erucoides (L.) DC. |
1,21 |
1,28 |
0,81 |
0,61 |
|
Echium plantagineum L. |
0 |
1,74 |
0,82 |
0,82 |
|
Foeniculum vulgare (Mill.) Gaertn. |
1,34 |
1,64 |
0 |
0,78 |
|
Fumaria officinalis L. |
0,81 |
1,42 |
1,01 |
0,51 |
|
Hordeum murimum L. |
0,96 |
1,04 |
1,02 |
0,96 |
|
Malva sylvestris L. |
1,11 |
1,17 |
1,08 |
0,58 |
|
Phalaris canariensis L. |
1,12 |
1,29 |
0,77 |
0,71 |
|
Phalaris paradoxa L. |
1,84 |
1,91 |
0 |
0 |
|
Silène muscipila L. |
0,28 |
1,17 |
1,14 |
1,14 |
|
Silybum murianum (L.) Geartn. |
0,86 |
1,46 |
1,42 |
0 |
|
Sinapis arvensis L. |
0 |
1,29 |
1,16 |
1,16 |
|
Torilis nodosa Gaertn. |
0,52 |
1,55 |
0,9 |
0,64 |
|
Vaccaria pyramidata Medik. |
1,03 |
1,07 |
1,03 |
0,84 |
|
Vicia villosa ssp. Desycarpa (Ten.) Cavil. |
1,55 |
2,06 |
0 |
0 |
40Le groupe est composé de 24 espèces (tableau 6) et est également dominé par les thérophytes (66,67%) ; les hémicryptophytes et les géophytes représentent des taux respectifs de 29,17% et 4,16%.
Tableau 7 : Groupe écologiques des espèces de la classe des 701-800 m
|
Espèces |
FC 01 |
FC 02 |
FC 03 |
FC 04 |
|
Aegilops triuncialis L. |
0 |
1,42 |
2,13 |
0 |
|
Aegilops ventricosa Tausch |
0 |
0,63 |
1,89 |
1,42 |
|
Anacyclus clavatus Desf. |
0,69 |
1,03 |
1,16 |
1,03 |
|
Anchusa azurea Mill. |
0 |
0,81 |
3,04 |
0 |
|
Avena sterilis L. |
0,85 |
1,06 |
1,21 |
0,82 |
|
Cichorium intybus L. |
0,81 |
1,01 |
1,21 |
0,91 |
|
Lolium multiflorum Lamk. |
0,5 |
0,58 |
1,63 |
1,38 |
|
Melilotus infesta Guss. |
0,92 |
1,07 |
1,15 |
0,8 |
|
Papaver hybridum L. |
1,09 |
1,02 |
1,36 |
0,54 |
|
Raphanus raphanistrum L. |
0 |
0 |
3,13 |
1,12 |
|
Rapistrum rugosum (L.) All. |
0 |
0,94 |
2,83 |
0 |
|
Reseda alba L. |
0,63 |
0,42 |
1,89 |
1,26 |
|
Scolymus hispanicus L. |
0 |
0 |
4,25 |
0 |
|
silene gallica L. |
0,52 |
0,26 |
2,13 |
1,35 |
|
Silene latifolia Poiret |
0 |
0 |
2,66 |
1,59 |
|
Silène rubella L. |
0 |
0,44 |
1,96 |
1,63 |
|
Trifolium tomentosum L. |
0 |
0,94 |
2,83 |
0 |
41Ce groupe est composé de 17 espèces dont 13 thérophytes (76,47%), quatre hémicryptophytes (23,53%).
Tableau 8 : Groupe écologique des espèces de la classe des 801-900 m
|
Espèces |
FC 01 |
FC 02 |
FC 03 |
FC 04 |
|
Anagalis arvensis L. |
0 |
1,21 |
0 |
2,43 |
|
Anagalis monelli L. |
0,74 |
0,98 |
0,98 |
1,25 |
|
Centaurea eriophora L. |
0 |
0 |
0,53 |
3,72 |
|
Erodium muschatum (Burm.) L'Her. |
0 |
0 |
1,82 |
2,43 |
|
Galium tricorne Witth. |
0,65 |
0,65 |
0 |
2,78 |
|
Linaria triphylla L. |
0 |
0 |
0,43 |
3,83 |
|
Lotus corniculatus L. |
0 |
0 |
0 |
4,25 |
|
Mantisalca salmontica (L.) Brig.et Cavill. |
1,89 |
0 |
0 |
2,83 |
|
Medicago rigidula Desr. |
0 |
0 |
0 |
4,25 |
|
Medicago truncatula Gaertn. |
0 |
0 |
0 |
4,25 |
|
Orabanche crenata Forsk. |
0 |
1,13 |
0,85 |
1,7 |
|
Papaver rhoeas L. |
0,96 |
0,96 |
0,98 |
1,11 |
|
Plantago lagopus L. |
0 |
0,57 |
1,42 |
1,98 |
|
Plantago lanceolata L. |
0 |
0 |
0 |
4,25 |
|
Plantago psyllium L. |
0 |
0 |
0 |
4,25 |
|
Ranunculus arvensis L. |
0 |
0 |
0 |
4,25 |
|
Rhagadiolus stellatus (L.) Gaern. |
0,57 |
0,38 |
0,99 |
2,27 |
|
Rumex bucephalophorus L. |
0 |
0 |
0 |
4,25 |
|
Sanguisorba minor Scop. |
0 |
0 |
0 |
4,25 |
|
Scabiosa atropurpurea L. |
0 |
0 |
0 |
4,25 |
|
Bromus hordeaceus L. |
0 |
1 |
0 |
2,75 |
|
Scorpiurus muricatus L. |
0 |
0,42 |
1,73 |
1,89 |
|
Silene fuscata Link. |
0 |
0 |
0 |
4,25 |
|
Silene inflata (Salisb.) Sm. |
0 |
0 |
0,91 |
3,34 |
|
Trifolium angustifolium L. |
0 |
1,42 |
0 |
2,13 |
|
Trifolium arvense L. |
0 |
0 |
1,7 |
2,55 |
|
Trifolium stellatum L. |
0 |
0 |
0 |
4,25 |
42Il regroupe 27 espèces dont 13 thérophytes (77,78%), cinq hémicryptophytes (18,52%) et une géophyte (03,70%).
4. Discussion
43La distribution de la flore adventice recensée révèle que la répartition des espèces est homogène. Selon la classification de Daget et Poissonet [29-30], cette flore peut être qualifiée de riche pour les valeurs minimales des richesses spécifiques notées in situ (29 espèces) et très riche quand elle prend ses valeurs maximales (46 espèces). L'analyse de la richesse floristique des différentes parcelles, de leurs caractères biologiques et chronologiques permettrait de mettre en évidence leur originalité floristique et leur valeur patrimoniale. Elle révèle les formes d’adaptation des plantes et permet une meilleure appréciation des conditions écologiques dans lesquelles elles vivent.
44Au niveau des parcelles étudiées, La répartition par groupes biologiques, indique une dominance des thérophytes. Ceci a été signalé dans beaucoup d’autres travaux, à savoir, ceux de Loudyi [31], Taleb et Maillet [32], Boudhar et Taleb [33] dans les périmètres céréaliers du Maroc et de Guediri [34] et Lebba [35] dans la région de Hassi Ben Abdallah. Lonchamp et Barralis [36] ont également signalé la dominance et l’abondance des espèces annuelles en région de grande culture du Noyonnais (Oise). Cette prédominance d’espèces thérophytes s’explique par le cycle annuel de la majorité des plantes cultivées de grandes cultures, favorisant les espèces adventices annuelles présentant cette même spécificité dans ces systèmes de culture [37-38, 15]. L’augmentation du nombre des thérophytes semble se faire au détriment des vivaces
45Les adventices thérophytes prépondérantes (75,90%) se manifestent chaque année grâce à la redistribution du stock semencier par le labour. Cependant et malgré l’importance des annuelles, les hémicryptophytes maintiennent une place assez importante (21,70%) et les géophytes viennent au troisième rang et contribuent à hauteur de 02,41% de la flore recensée (monocotylédones et dicotylédones). Koechlin [39], signale que les types biologiques constituent des indices de la stratégie de vie des espèces.
46Les types biologiques suivent une répartition suivant le schéma : TH > HE > GEO, un résultat voisin de celui défini dans les cultures du Nord marocain [31, 40]. Les espèces Thérophytes sont à grand pouvoir infestant, grâce également à leur grande amplitude écologique et leur bonne aptitude à la compétition.
47Cette thérophytisation est favorisée par le pâturage qui enrichit le sol en nitrates et permet le développement des rudérales notamment annuelles [41]. Daget [42] et Barbero et al. [41] s’accordent pour présenter la thérophytie comme étant une forme de résistance à la sécheresse ainsi qu’aux fortes températures des milieux arides.
48Dans notre étude, la classification biogéographique des espèces montre une dominance des éléments méditerranéens sensu lato avec 40,97% (soit 34 espèces). Successivement, se succèdent les eurasiatiques, les paléo-tempérées, les euro-méditerranéennes, les cosmopolites et les ibéro-mauritaniennes et capitalisent avec les méditerranéennes 86,78%. Cette flore se distingue, également par la présence d’une espèce endémique à l’Algérie et au Maroc (Centaurea diluta Ait.) [2], ce qui fait son originalité. Les résultats obtenus sont en concordance avec ceux de Fenni [11], Benerab [15] et Kazi Tani [43] qui ont signalé, respectivement, la prédominance des espèces méditerranéennes dans les cultures de céréales d’hiver des hautes plaines constantinoises (96 espèces), des vergers de la région Nord de Sétif (85 espèces) et les communautés d’adventices de l’Oranais (245 espèces). Selon Marnotte [44], aucun facteur ne permet donc l’individualisation d’une flore adventice particulière à une culture donnée ; la localisation géographique et les pratiques culturales sont les seuls facteurs discriminants. Quézel [45] et Médail & Quézel [46] rapportent que sur le pourtour méditerranéen, les multiples événements paléogéographiques et les cycles climatiques contrastés ont aussi permis l’émergence de cette biodiversité inhabituellement élevée.
49La répartition systématique de la flore adventice totale par classes, a révélé la dominance des dicotylédones (15,67%) ; ceci confirme les résultats rapportés par Taleb & Maillet [32] et Boudhar & Taleb [33] dans les périmètres céréaliers du Maroc.
50Sur les 24 familles recensées, la famille des Asteraceae reste la plus représentée (15 espèces soit 15,67%) et capitalisent avec les Fabaceae, Poaceae, Brassicaceae, Caryophyllacées et Apiaceae) un taux de 67,52%.
51Les trois premières familles : Asteraceae, Fabaceae et Poaceae comptent à elles seules 35 espèces soit 42,20% de l’effectif global, ce qui confirme les résultats obtenus au niveau des communautés d’adventices de l’Oranais par Kazi Tani [43].
52Lebreton et Le bourgeois [47] signalent que les espèces de Poaceae, d’Asteraceae, de Brassicaceae et de Fabaceae font partie des adventices les plus dans la culture de lentille de Cilaos.
53Les Asteraceae occupent une place importante dans la flore algérienne avec 408 espèces réparties en 109 genres ; les Poaceae et les Fabaceae sont respectivement représentée dans la flore algérienne par 284 espèces et 55 genres [1-2].
54L’étude phytoécologique montre que sur l’ensemble des espèces recensées, existent :
5532 espèces généralistes, soit 38,56% de la flore recensée qui exploitent les quatre classes et présentent une forte plasticité écologique vis-à-vis de l’altitude. Parmi celles-ci, cinq trouvent leur optimum de développement au niveau de la deuxième classe, 25 au niveau de la troisième classe et deux dans la quatrième classe d’altitude. Le caractère de ces espèces dites généralistes dénote d’une large plasticité écologique vis-à-vis de l’altitude et serait dû, selon Feltzines [27], à la flexibilité de leur génome, à savoir à quelques adaptations écologiques ;
56par opposition aux espèces généralistes, un groupe d’espèces dites spécialistes s’individualise. Ces espèces montrent une amplitude qui s’étend sur une seule et unique classe d’altitude. Il est composé de 13 espèces, soit 15,66% ; elles sont plus ou moins exigeantes vis-à-vis de l’altitude. Leur faible valeur d’amplitude d’habitat (AH) traduit un degré élevé de spécialisation. Selon les valeurs de (G), 11 de ces espèces sont spécialistes strictes à la tranche d’altitude (801-900 m), une est spécialiste stricte des altitudes comprises entre 500-600 m et une autre aux altitudes comprises entre 701-800 m avec des barycentres respectifs égaux à 4, 1 et 3 ;
5738 espèces intermédiaires, soit 45,78% à exigences écologiques intermédiaires qui peuvent exploiter deux à trois classes d’altitude. Sept de ces espèces trouvent leur optimum de développement au niveau de la deuxième classe, 15 au niveau de la troisième classe et 16 autres espèces du groupe ont un développement optimal dans la quatrième classe.
58Sur la base des profils des fréquences corrigées, quatre groupes écologiques sont mis en évidence ; ce sont des groupes mono factoriels imbriqués en écailles.
59Le premier groupe est formé de 15 espèces (tableau 5), dont cinq exploitent les quatre classes d’altitude, trois exploitent trois classes d’altitude, six espèces se retrouvent dans deux classes d’altitude et une seule espèce (Datura stramonium L.) n’est rencontrée qu’au niveau de la première classe. Ce groupe est dominé par les thérophytes (86,67%) qui arrivent facilement à s’installer dans tous les milieux même quand les contraintes climatiques sont les plus importantes.
60Le deuxième groupe est constitué de 24 espèces (tableau 6), dont 18 exploitent les quatre classes d’altitude, quatre se retrouvent dans trois classes et deux chevauchent sur deux classes d’altitude. Ce groupe est également à dominance de thérophytes (66,67%) ; néanmoins les hémicryptophytes et les géophytes font leur apparition (avec respectivement de 29,17% et 4,16%). La coexistence des trois types biologiques témoigne d’une grande diversité des facteurs écologiques (climat, sol).
61Au niveau du troisième groupe composé de 17 espèces, huit exploitent toutes les classes d’altitude en présentant des fréquences maximales dans la classe 701-800 m, deux espèces exploitent trois classes d’altitude, six espèces chevauchent sur deux classes et une espèce se trouve uniquement au niveau de la classe d’altitude des 701-800m (tableau 7). Les thérophytes restent dominants et on enregistre une baisse du taux d’hémicryptophytes (23,53%) et une disparition des géophytes.
62Le quatrième groupe est constitué de 27 espèces, dont trois exploitent les quatre classes d’altitude, quatre exploitent trois classes d’altitude, neuf chevauchent sur deux classes et 11 espèces se limitent à la quatrième classe d’altitude. On note également la dominance des thérophytes (77,78%) au détriment des hémicryptophytes (18,52%). Par leur stratégie de type ‶r″, ces espèces thérophytes arrivent plus facilement à s’imposer dans les milieux les plus contraignants.
Conclusion
63Du point de vu floristique, la plaine de Tessala se caractérise par une phytodiversité importante qui varie significativement avec l'altitude. Les monocotylédones sont dominantes et la famille des Asteraceae s’exprime mieux par rapport aux autres familles grâce à ces facultés adaptatives multiples. Sur le plan biogéographique, on note une nette supériorité du taux d’espèces méditerranéennes, ce qui confirme bien l’appartenance de la flore recensée au territoire méditerranéen. La flore recensée se caractérise par une nette dominance des thérophytes.
64La caractérisation phytoécologique des adventices des céréales permet de constater que la composition floristique de ces communautés varie très peu avec l’altitude. La dominance du spectre thérophytes attribue à ces espèces de fortes possibilités d’adaptations aux différentes fluctuations climatiques actuelles.
65Le calcul de l’amplitude d’habitat et du barycentre, montre que cette flore est particulièrement dominée par des espèces généralistes (38,56 %) et intermédiaires (45,78 %) avec de larges amplitudes écologiques, ce qui leur permet de couvrir deux à quatre classes d’altitude avec un optimum de développement variant d’une espèce à une autre.
66Les profils des fréquences corrigées, laissent apparaitre quatre groupes écologiques où les thérophytes sont dominants et un grand nombre d’espèces chevauchent sur deux classes ou plus.
Références
67[1] Quézel P. & Santa S. (1962). Nouvelle flore de l’Algérie et des régions désertiques méridionales, édition CNRS, Tome I, Paris, 1091 p.
68[2] Quézel P. & Santa S. (1963). Nouvelle flore de l’Algérie et des régions désertiques méridionales, édition CNRS, Tome II, Paris, 1170 p.
69[3] Chevassut G. (1956). Les groupements végétaux des marais de la Rassauta. Bull. Soc. Hist. Nat. Afr. Nord, 47 (3-4), 59-73.
70[4] Chevassut G. (1971). Végétation spontannée hivernale des vignobles de la plaine littorale algéroise de la Mitidja. Bull. Soc. Hist. Nat. Afr. Nord, 62 (1-2), 77-102.
71[5] Kiared G. (1985). Approche phytososiologiques de quelques groupements méssicoles des grandes cultures de la plaine de la Mitidja. Mémoire d’Ingéniorat : Institut National d’Agronomie – El-Harrach, Alger, 54 p.
72[6] Chevassut G., Abdelkrim H. & Kiared G. (1988). Contribution à la connaissance des groupements de mauvaises herbes de la région d’El-Harrach. Ann. Inst. Agr. El-Harrach, 12(1), 690-702.
73[7] Boulfekhar M.N. (1989). Étude physiologique de certains groupements de mauvaises herbes dans la plaine de la Mitidja. Thèse de Magistère : Institut National d’Agronomie – El-Harrach, Alger, 104 p.
74[8] Zermen N. (1989). Étude phytososiologique de quelques groupements de mauvaises herbes dans la région de Medea (Atlas Tellien). Mémoire d’Ingénieur : Institut National d’Agronomie – El-Harrach, Alger, 62 p.
75[9] Kadid S. (1989). Étude phytososiologique de quelques groupements de mauvaises herbes dans la région de Ksar El-Boukhari (Piémont Sud de l’Atlas Bledéen). Mémoire d’Ingénieur : Institut National d’Agronomie – El-Harrach, Alger, 52 p.
76[10] Fenni M. (1991). Contribution à l’étude des groupements méssicoles des hautes plaines sétifiennes. Thèse Magistère : Université de Sétif - Farhat Abbes, Sétif, 185 p.
77[11] Fenni M. (2003). Étude des mauvaises herbes des céréales d'hiver des hautes plaines constantinoises. Ecologie, dynamique, phénologie et biologie des bromes. Thèse de doctorat : Université de Sétif - Farhat Abbes, Sétif, 165 p.
78[12] Abdelkrim H. (1995). Contribution à la connaissance de mauvaises herbes des cultures du secteur algérois : approches syntaxonomoque et morphologique. Thèse de doctorat : Université d’Orsay - Paris-Sud, 151 p.
79[13] Loubezda R. (2005). Étude de la germination et la répartition de du Bromus sp des céréales dans les hautes plaines sétifiennes. Thèse Magistère : Université de Sétif - Farhat Abbes, Sétif, 103 p.
80[14] Henni M. (2005). Étude de quelques graines des mauvaises herbes et la répartition des des importantes espèces dans les hautes plaines sétifiennes. Thèse Magistère : Université de Sétif - Farhat Abbes, Sétif, 143 p.
81[15] Benarab H. (2007). Contribution à l'étude des mauvaises herbes des vergers de la région nord de Sétif. Thèse Magistère : Université de Sétif - Farhat Abbes, Sétif, 73 p.
82[16] Kiekken R. (1962). Géologie et stratigraphie des monts de Tessala, édition Floquet, Oran, 220 p.
83[17] Cherifi K., Mehdadi Z., Latreche A. & Bachir Bouiadjara S.E. (2011). Impact de l’action anthropozoogène sur l’écosystème forestier du mont de Tessala (Algérie occidentale). Sécheresse 22, 197-206.
84[18] Braun-Blanquet J. (1951). Pflanzensoziologie Grundzuge der vegetations Kunde, deuxième édition Springer, Vienne, 631 p.
85[19] Gounot M. (1969). Méthodes d’études quantitatives de la végétation, éditions Masson et Cie, Paris, 314 p.
86[20] Ozenda P. (1982). Les végétaux dans la biosphère, éditions Doin. Paris, 432 p.
87[21] Gehu J.M. (1980). La phytosociologie d’aujourd’hui. Not. Fitosoc., 16, 1-16.
88[22] Gehu, J. M. & S. Rivas-Martinez (1981). Notions fondamentales de phytosociologie. In : Hartmurt Dierschke (éd.), Berichte der Intemationalen Symposien der Internationalen Vereinigung fur Vegetationkunde. Syntaxonomie. J. Cramer, Vaduz : 5-33.
89[23] M'hirit, O. (1982) Étude écologique et forestière des cédraies du Rif marocain : Essai sur une approche multidimensionnelle de la phytoécologie et de la productivité du cèdre. Thèse de Doctorat, Université d’Aix-Marseille, 435 p.
90[24] Guillerm J. (1971). Calcul de l’information fournie pour un profil écologique et valeur indicatrice des espèces. Oecol. Plant, 6, 209-225.
91[25] Blondel J. (1979). Biogéographie et écologie : synthèse sur la structure, la dynamique et l’évolution des peuplements de vertébrés terrestres, éditions Masson, Paris, 173 p.
92[26] Ramade, F. (1984). Éléments d’écologie, écologie fondamentale, éditions McGraw. Hill., Paris, 397 p.
93[27] Feltzines J.C. (1982). Étude dynamique, sociologique et écologique de la végétation des étangs du centre-Est de France. Importance de la compétition interspécifique dans l’organisation de la végétation et la distribution des espèces et des associations. Thèse de doctorat : Université de Lille 1- Sciences et Technologies, 498 p.
94[28] Lhéritier, J.N., De Bussche M. & Lepart J. (1979). L’avifaune nicheuse du reboisement de Pin noir du Causse Méjean. L’oiseau de la R.F, 49, 185-211.
95[29] Daget P. & Poissonet J. (1991). Prairies permanentes et pâturages : méthodes d’étude. Institut de botanique, Montpellier, 375 p.
96[30] Daget Ph. & Poissonet J. (1997). Biodiversité et végétation pastorale. Rev. Élev. Méd. Vét. Pays Trop., 50, 141-149.
97[31] Loudyi M.C. (1985). Étude botanique et écologique de la végétation spontanée du plateau de Meknès (Maroc). Thèse de troisième cycle : Université des Sciences et Techniques, Montpellier, 147 p.
98[32] Taleb A. & Maillet J. (1994). Mauvaises herbes des céréales de la Chaouia (Maroc).
II. Aspect écologique. Weed research, 34(5), 353-360.
99[33] Boudhar H. & Taleb A. (1995). Flore adventice des céréales dans le périmètre irrigué des Doukkala : aspects botanique, agronomique et écologique. In : Actes du 2e Congrès de l'Association Marocaine de la Protection des Plantes (AMPP), 6-7 décembre, Institut Agronomique et Vétérinaire Hassan II Rabat, Maroc, 102-112.
100[34] Guediri, K. (2007). Biodiversité des messicoles dans la région d’Ouargla : inventaire et caractérisation. Mémoire d’Ingéniorat : Université de Ouargla – Kasdi Merbah, Ouargla,
118 p.
101[35] Lebba S. (2007). Contribution à l’étude de la caractérisation des messicoles à la région d’Ouargla : cas des pivots abandonnés, Hassi Ben Abdallah. Mémoire d’Ingénieur, Université Kasdi Merbah, Ouargla, 43 p.
102[36] Lonchamp J.P. & Barralis G. (1988). Caractéristiques et dynamique des mauvaises herbes en région de grande culture : le Noyonnais (Oise), Agronomie, 8(9), 757-766.
103[37] Lososová Z., Chytrý M., Kühn I., Hájek O., HorákováV., PyšekP. & Tichý L. (2006). Patterns of plant traits in annual vegetation of man-made habitats in central Europe. Perspectives in Plant Ecology, Evolution and Systematics, 8(2), 69–81.
104[38] Fried G. (2007). Variations spatiale et temporelle des communautés adventices des cultures annuelles en France. Thèse de doctorat, INRA-Université de Bourgogne, Dijon,
357 p.
105[39] Koechlin J. (1961). La végétation des savanes dans le sud de la République du Congo (Brazzaville). Mémoire n°01, ORSTOM, Paris, 310 p.
106[40] Boulet C., Tanji A. & Taleb A. (1989). Index synonymique des taxons présents dans les milieux cultivés ou artificialisés du Maroc occidental et central. Actes Inst. Agron. Vét.,
9 (3 et 4), 65-98.
107[41] Barbero M., Loisiel R. & Quézel P. (1990). Les apports de la phyto-écologie dans l’interprétation des changements et perturbations induits par l’homme sur les écosystèmes forestiers méditerranéens. Forêts méditerranéennes, 2, 194-215.
108[42] Daget Ph. (1980). Sur les types biologiques en tant que stratégie adaptative, Cas des thérophytes. In : Barbault R, Blandin P, Meyer JA, éditions Recherches d’écologie théorique, les stratégies adaptatives, Paris : Maloine, 89-114.
109[43] Kazi Tani C., Le Bourgeois T. & Munoz F. (2010). Aspects floristiques de la flore des champs du domaine phytogéographique oranais (Nord-Ouest algérien) et persistance d’espèces rares et endémiques. Flora Mediterranea, 20, 5-22.
110[44] Marnotte P. (2000). La gestion de l’enherbement et l’emploie des herbicides dans les systèmes de culture en zone Soudano sahélienne en Afrique de l’Ouest et du Centre. Formation du CIRAD, CIRAD-CA-G.E.C.- AMATROP.
111[45] Quezel P. (1985). Definition of the Mediterranean region and the origin of its flora. In Gomez-Campo ed. Plant conservation in the Mediterranean area. W. Junk. Dordrecht, 9-24.
112[46] Médail F. & Quézel P. (1997). Hot-spots analysis for conservation of plant biodiversity in the Mediterranean basin. Ann. Missouri Bot. Gard., 84, 112-127.
113[47] Lebreton G. & Le Bourgeois T. (2005). Analyse de la flore adventice de la lentille à Cilaos. Cirad-Ca / 3P, UMR PVBMT, 9-10.
114Cet article contient une annexe à télécharger (au format PDF)