- Accueil
- Volume 86 - Année 2017
- Actes de colloques
- Deux siècles de sciences à l'Université de Liège
- Les bactéries résistantes : le retour ?
Visualisation(s): 1186 (10 ULiège)
Téléchargement(s): 82 (0 ULiège)
Les bactéries résistantes : le retour ?

Document(s) associé(s)
Version PDF originaleTable des matières
1Les antibiotiques ont révolutionné la médecine et ont sauvé un nombre remarquable de vies. Leur découverte a représenté un tournant dans l’histoire de l’humanité (1). Mais les phénomènes de résistance sont de plus en plus fréquents, ce qui a conduit l’OMS à lancer un cri d’alarme en 2014 : « La résistance aux antibiotiques n’est plus une projection dans l’avenir, mais c’est une réalité dans chaque région du monde et tout un chacun peut être touché. C’est un problème qui menace les réalisations de la médecine actuelle et on doit redouter une ère post-antibiotique où des infections courantes et blessures mineures pourraient tuer à nouveau » (Keiji Fubada, sous-directeur général de l’OMS pour la sécurité sanitaire, cité par Le Soir, 2 mai 2014). L’émergence des souches bactériennes résistantes aux antibiotiques n’est pas un phénomène nouveau. Dès 1950, des souches de Staphylococcus aureus résistantes à la benzylpénicilline se sont répandues dans les hôpitaux londoniens où l’utilisation de cet antibiotique « miracle » s’était généralisée après 1947. Elles produisaient un enzyme baptisé « pénicillinase » qui inactivait la pénicilline en hydrolysant son noyau -lactame. Le problème fut résolu par l’introduction de la méthicilline (obtenue par hémisynthèse) et des céphalosporines, composés très peu sensibles à l’action de cet enzyme. Mais comme on le verra plus bas, cette victoire n’a été que passagère.
2À l’heure actuelle, un grand nombre de souches bactériennes sont devenues résistantes aux antibiotiques de dernier recours comme les carbapénèmes et la colistine. La situation est d’autant plus inquiétante que très peu de nouveaux composés se retrouvent dans le « marketing pipeline ». En 2014, le Premier ministre britannique de l’époque, David Cameron, avait nommé une commission présidée par l’économiste Jim O’Neill pour analyser les conséquences de l’apparition continuelle de souches résistantes (AMR pour Antimicrobial Resistance) si les efforts pour lutter contre ce phénomène n’étaient pas significativement accrus. Les prédictions de la commission sont réellement effrayantes. En 2050, les infections causées par ces souches pourraient être responsables de plus de 8 500 000 morts par an, plus que toutes celles dues à toutes les formes de cancer réunies. Les coûts économiques seraient aussi astronomiques : un impact cumulé de 100 000 milliards de dollars américains sur l’économie mondiale, résultant de décès prématurés, de l’absentéisme au travail et d’un fardeau supplémentaire pour les systèmes de sécurité sociale dû à l’allongement des périodes d’hospitalisation. Il est donc urgent d’analyser les causes de la résurgence de l’AMR et de proposer des contre-mesures efficaces (2). En effet, la dispersion des souches résistantes représente un problème majeur de santé publique, non seulement dans la lutte contre les infections dans la communauté mais aussi vis-à-vis de pratiques hospitalières modernes comme la chirurgie invasive, la transplantation d’organes et la chimiothérapie anticancéreuse. Par exemple, alors que Pseudomonas areuginosa n’était au départ qu’un agent d’infection des tissus brûlés, cette espèce est maintenant devenue une menace nosocomiale majeure (1).
Les causes
3Celles-ci sont maintenant bien établies. En médecine humaine, la mauvaise utilisation ou la surutilisation des antibiotiques est un facteur déterminant (3). On sait, par exemple, que la majorité (70% ou plus) des infections des voies respiratoires supérieures sont dues à des virus contre lesquels les antibiotiques n’ont aucune efficacité. Dans beaucoup de pays, la vente libre d’antibiotiques est une pratique courante, ce qui conduit à une utilisation complètement anarchique. De plus, on trouve souvent sur le marché des médicaments falsifiés qui contiennent des quantités de composés actifs insuffisantes pour une thérapie efficace mais qui peuvent conduire à la sélection de souches résistantes. Notons aussi que l’ingestion d’antibiotiques modifie gravement la flore intestinale et certains auteurs rendent ces altérations responsables de beaucoup de pathologies comme l’asthme, l’eczéma, l’obésité et certaines formes de cancer (4). Mais ceci est une autre histoire…
4Dans le domaine vétérinaire, la situation est bien pire. En plus de pratiques purement thérapeutiques, l’utilisation d’antibiotiques est très répandue en élevage intensif à la fois pour des raisons prophylactiques mais aussi comme promoteurs de croissance. On peut noter que la frontière entre les utilisations thérapeutiques et prophylactiques est parfois très floue. L’administration d’antibiotiques comme promoteurs de croissance est maintenant interdite dans l’Union européenne et devrait l’être prochainement aux USA. Mais dans ce dernier pays, on peut douter de la mise en place d’un système de contrôle contraignant. Dans les autres pays où la demande de viande est en augmentation constante (en particulier les pays BRICS), aucune règlementation n’est en place et alors que l’utilisation d’antibiotiques en élevage est en diminution dans l’UE, elle augmente dans le reste du monde et on s’attend à la voir doubler au cours des vingt prochaines années (5,6). Un article récent a établi une corrélation claire entre la consommation de viande de volaille et les infections à salmonelles chez l’homme (7). De plus, comme beaucoup d’antibiotiques ne sont métabolisés ni par l’homme, ni par l’animal et qu’ils sont rapidement excrétés, ils polluent l’environnement et les centres de traitement des eaux usées et les eaux de surface s’enrichissent en souches résistantes. En Inde, on a ainsi retrouvé des souches produisant la -lactamase NDM-1 dans une grande proportion des eaux de surface et même dans l’eau de distribution (8). On trouvera une bonne analyse de la dispersion environnementale des molécules d’antibiotiques dans la référence 6. Il est donc surprenant de constater que le problème de l’AMR ait reçu peu d’attention de la part des organismes de financement. Selon la commission O’Neill, pendant la période 2006-2010 aux USA, ce domaine a seulement bénéficié de 1,6% de toutes les subventions du NIH, soit respectivement 15 et 8 fois moins que la recherche sur le cancer et le SIDA. Dans l’Union européenne, le cancer reçoit aussi au moins 10 fois plus de financement que l’AMR. C’est probablement au Royaume Uni que, proportionnellement, les plus grands montants sont consacrés à l’AMR avec 1% des fonds de recherche attribués par les quatre fonds de recherche principaux (9).
5En conséquence, les meilleurs centres de recherche sont peu enclins à centrer leurs activités sur cette problématique et les meilleurs chercheurs ont tendance à choisir des orientations plus à la mode et mieux financées. De même, beaucoup de compagnies pharmaceutiques ont abandonné la recherche de nouveaux antibiotiques et très peu de composés intéressants ont été commercialisés au cours des dernières années. De récentes exceptions sont l’Avibactame (AstraZeneca) et le BAL 29880 (Basilea) qui présentent des propriétés intéressantes comme inhibiteurs de -lactamases et la ceftaroline et le ceftobiprole qui sont actifs contre le SARM (Staphilococcus aureus résistant à la méthicilline). Les principales raisons de ce manque d’intérêt semblent être purement financières dans la mesure où des profits plus importants sont espérés pour des médicaments destinés à traiter le cancer ou des maladies chroniques comme le diabète et l’hypertension. En étant cynique, on pourrait dire que, d’un point de vue purement commercial, les antibiotiques présentent un désavantage majeur : ils guérissent généralement le patient en dix jours (ou celui-ci meurt) alors que dans les autres cas, le traitement peut s’étaler sur des mois, des années, voire même sur le reste de la vie du patient.
Les mécanismes de résistance (10)
6Pour tuer une bactérie ou l’empêcher de se reproduire, une molécule doit atteindre sa cible, le plus souvent une protéine, un organite comme le ribosome ou plus rarement la membrane bactérienne ou l’ADN. La bactérie peut se défendre en modifiant la cible pour qu’elle ne reconnaisse plus l’antibiotique, mais il faut que cette dernière conserve son activité physiologique, ce qui demande un réglage fin de la modification. La bactérie peut aussi rendre plus efficaces les barrières de perméabilité que constituent la membrane cytoplasmique ou, chez les espèces à Gram-négatif (et les mycobactéries), la membrane externe ou expulser, par un mécanisme de transport actif, la molécule d’antibiotique hors de la cellule ou du périplasme. Enfin, et c’est probablement le mécanisme le plus répandu, la bactérie peut produire un ou des enzymes capables d’inactiver la molécule d’antibiotique.
7L’histoire des antibiotiques à noyau -lactame propose des exemples où chacun de ces mécanismes a été caractérisé.
L’histoire des -lactames (10,11)
8Les -lactames (pénicillines, céphalosporines, carbapénèmes, figure 1) sont des agents bactériolytiques. Ils interfèrent avec la biosynthèse du peptidoglycane, un énorme polymère qui entoure complètement la cellule bactérienne et lui permet de résister à sa propre pression osmotique. Si la résistance mécanique du peptidoglycane n’est pas suffisante, la bactérie explose. La biosynthèse du polymère implique des enzymes, des DD-transpeptidases, liées à la membrane cytoplasmique et tournées vers l’extérieur. Ces enzymes conduisent à la formation de ponts peptidiques entre les chaînes polysaccharidiques du polymère, assurant ainsi une stabilité mécanique qui permet à la cellule de résister à une pression osmotique variant de 5 (chez les Gram -) à 20 (chez les Gram +) atmosphères.
9Les -lactames acylent le groupe OH essentiel d’un résidu de sérine des transpeptidases et inactivent ces enzymes de manière quasi irréversible (figure 2). Les deux grands avantages des -lactames sont :
101) qu’ils ne doivent pas pénétrer à l’intérieur du cytoplasme puisque leurs cibles sont exposées sur l’extérieur de la membrane cytoplasmique
112) que les cellules eucaryotes ne contiennent aucun enzyme semblable aux
DD-transpeptidases qui agissent spécifiquement sur des peptides se terminant par
D-Ala-D-Ala-OH, des structures qu’on ne rencontre jamais chez les eucaryotes.
12Chez les bactéries à Gram + et à l’exception des mycobactéries, l’accès aux cibles est direct. Il n’y a donc pas ou peu de problèmes de perméabilité. Comme mentionné plus haut, les premiers cas de résistance sont apparus suite à la production par certaines souches de staphylocoques d’un enzyme capable d’hydrolyser le noyau -lactame. Ces difficultés furent résolues par la modification de la chaîne latérale (méthicilline, figure 1) et la découverte des céphalosporines (figure 1).
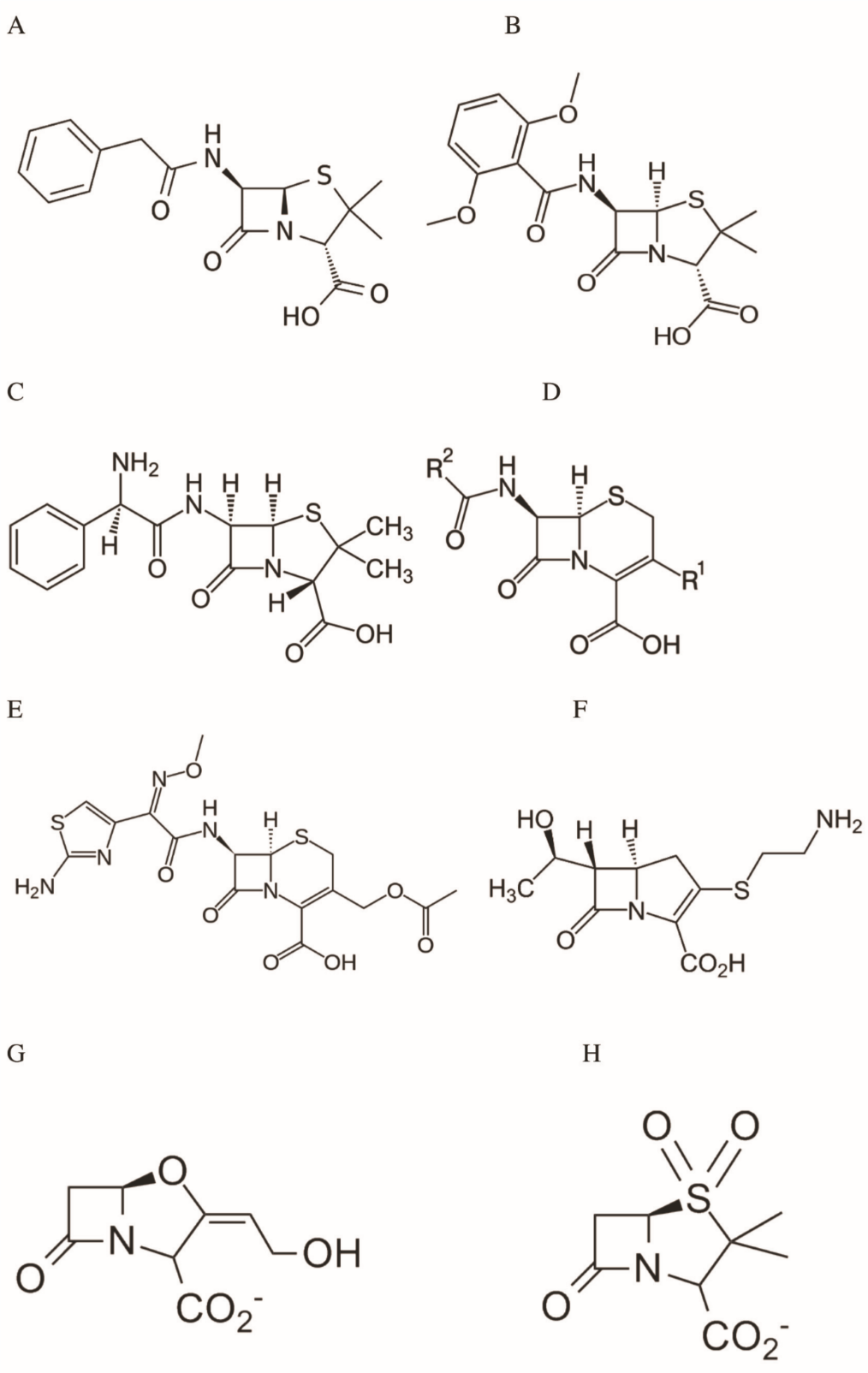
Figure 1 : Structures de quelques -lactames – Le noyau -lactame est le cycle à 4 pièces, commun à toutes les molécules et contenant la liaison amide CO-N.
A-C : pénicillines : benzylpénicilline (A) ; méthicilline (B) ; ampicilline (C) ; l’amoxycilline est un dérivé de l’ampicilline portant un groupement hydroxyle en para sur le cycle benzénique
D : structure générale des céphalosporines (la ceftaroline et le ceftobiprole font partie de cette famille)
E : la céfotaxime, une autre céphalosporine
F : exemple de carbapénème, la théramycine
G-H : inactivateurs de -lactamases : acide clavulanique (G) et sulbactame (H)
13Méthicilline et céphalosporines échappent largement à l’action de la pénicillinase (rebaptisée plus tard -lactamase) du staphylocoque. Pour des raisons inconnues et contrairement à beaucoup de bactéries à Gram -, le staphylocoque s’est révélé incapable de modifier sa -lactamase pour la rendre active sur ces composés ou d’importer un gène codant pour un enzyme pouvant les hydrolyser. Par contre, S. aureus a pu acquérir un gène provenant d’une espèce voisine non pathogène et naturellement résistante aux -lactames (probablement S. sciuri). Ce gène code pour une transpeptidase dont la sensibilité à la méthicilline est drastiquement réduite (vitesse de formation de EC* fortement diminuée, rapport k2/K très faible, figure 2), ce qui a conduit à l’émergence du SARM. Pendant de nombreuses années, les glycopeptides comme la vancomycine, qui empêchent aussi la transpeptidation mais en se liant au substrat peptidique, ont été l’arme de dernier recours contre le SARM, mais on a plus récemment découvert des céphalosporines capables d’acyler la DD-transpeptidase résistante du SARM, la ceftaroline et la ceftobiprole.
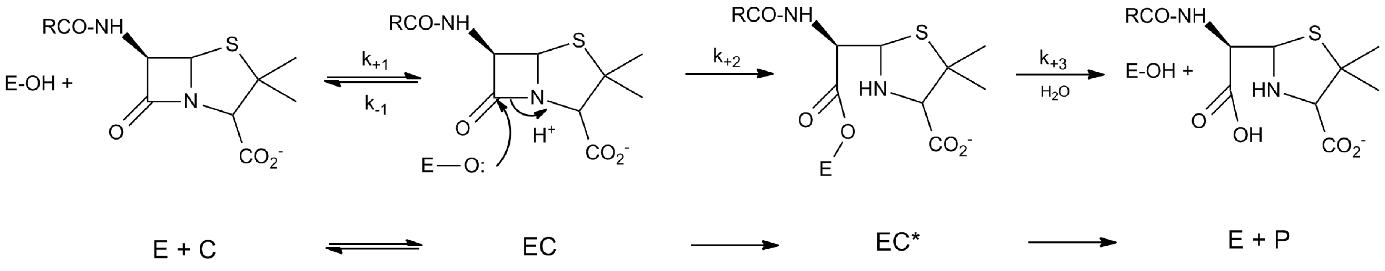
Figure 2 : Chemin réactionnel des interactions entre les -lactames (C) et les DD-transpeptidases ou les -lactamases à sérine (EOH)
14Un premier complexe non-covalent est formé (EC) qui évolue vers l’acylenzyme (EC*) par attaque de l’oxygène du groupe OH de l’enzyme sur le carbone de la liaison amide CO-N. Dans le cas des DD-transpeptidases, l’acylenzyme est très stable (k3 très faible) et le -lactame inactive l’enzyme. Dans le cas des -lactamases, l’acylenzyme est rapidement hydrolysé (k3 peut atteindre 2000 s-1) et l’enzyme inactive le -lactame qui se comporte comme un substrat. Notons cependant qu’il existe des couples -lactamase - -lactame pour lesquels la valeur de k3 est assez faible, le -lactame se comportant alors comme un inactivateur transitoire de l’enzyme. La vitesse de formation de l’acylenzyme (EC*) est plus souvent caractérisée par le rapport k2/K où K est la constante de dissociation du complexe non covalent EC.
15D’autres genres à Gram +, les pneumocoques et les entérocoques ne produisent pas de -lactamases et ont eux aussi acquis une résistance grâce à des DD-transpeptidases peu sensibles mais ils ont utilisé des stratégies un peu différentes. Streptococcus pneumoniae semble incapable d’exprimer un gène « importé » complet mais les souches résistantes ont fabriqué des gènes « mosaïques » en mélangeant des morceaux de leurs propres gènes (codant pour des enzymes très sensibles) et de gènes importés (codant pour des enzymes résistants). Diverses espèces d’entérocoques ont choisi une autre stratégie : elles surexpriment une DD-transpeptidase très peu sensible qui, dans les souches normales, n’est pas produite en quantité suffisante pour assurer un pontage adéquat du peptidoglycane.
16Chez les bactéries à Gram- (et les mycobactéries dont Mycobacterium tuberculosis), la membrane externe représente une barrière de perméabilité que les antibiotiques traversent en empruntant les canaux hydrophiles formés par les porines. Cette diffusion peut être sérieusement ralentie en fonction de la structure chimique des chaînes latérales des divers -lactames ainsi que par des mutations modifiant les propriétés des canaux des porines. D’autre part, les molécules d’antibiotique qui ont atteint le périplasme peuvent être expulsées contre le gradient de concentration par des mécanismes d’efflux actif. La surexpression de ces pompes d’efflux est responsable d’une augmentation très significative de la résistance de certaines souches de P. aeruginosa.
17Mais l’action des -lactamases reste, à l’heure actuelle, le mécanisme de résistance le plus préoccupant (12). Contrairement à la -lactamase de S. aureus qui diffuse dans le milieu, les -lactamases des bactéries à Gram - (et des mycobactéries) sont sécrétées dans le périplasme et travaillent de manière synergique avec le ralentissement de la diffusion dû à la membrane externe et l’expulsion de l’antibiotique par les pompes pour diminuer la concentration d’antibiotique disponible dans le périplasme pour réagir avec le DD-transpeptidases. Il y a deux familles de -lactamases : les -lactamases à sérine active, apparentées aux DD-transpeptidases (et dont fait partie la pénicillinase de S. aureus) et les -lactamases à Zn++.
18Les -lactamases à sérine ont été les premières à poser des problèmes cliniques graves. Les gènes codant pour les enzymes TEM et SHV sont portés par des plasmides et peuvent donc être facilement transférés de souche en souche même entre espèces différentes. Les enzymes TEM et SHV hydrolysent des pénicillines fort utilisées, comme l’ampicilline et les céphalosporines dites de première génération comme la céphalothine. Pour lutter contre les souches produisant ces enzymes, on a utilisé deux stratégies : le camouflage et l’inactivation. La stratégie du camouflage est celle qui avait été utilisée dans le cas de S. aureus : en modifiant les chaînes latérales des céphalosporines, on a obtenu les céphalosporines de deuxième (céfuroxime) et troisième génération (céfotaxime, ceftazidime) que TEM et SHV hydrolysaient très mal. Dans le cadre de la seconde stratégie, on a isolé, à partir de cultures bactériennes (surtout des actinomycètes) des composés comme l’acide clavulanique ou obtenu, par hémisynthèse, des sulfones comme le sulbactame. Quoique contenant le noyau -lactame, l’acide clavulanique et le sulbactame n’inactivent pratiquement pas les DD-transpeptidases. Par contre, ils réagissent très bien avec beaucoup de -lactamases en suivant le chemin réactionnel décrit à la figure 2. Mais au niveau de l’acylenzyme (EC*), un réarrangement se produit qui conduit à un second adduit covalent qui ne subit pratiquement pas l’hydrolyse. La -lactamase est alors immobilisée sous la forme de ce second adduit comme l’était la transpeptidase au niveau du premier. On a ainsi mis sur le marché des « fusils à deux coups », par exemple, l’Augmentin qui contient une pénicilline classique (l’amoxycilline), sensible à la plupart des -lactamases et l’acide clavulanique qui se charge d’inactiver beaucoup de ces dernières.
19Bien sûr, le monde bactérien a réagi. Dans le cas de la stratégie du camouflage, des mutants de TEM ou SHV sont apparus, dont le spectre d’activité était modifié, les rendant capables d’hydrolyser une ou plusieurs céphalosporine(s) de seconde ou troisième génération. De plus, d’autres -lactamases à serine capables d’hydrolyser ces mêmes composés et venues on ne sait d’où, ont été sélectionnées et se sont rapidement répandues grâce au fait que les gènes correspondants sont aussi portés par des plasmides (les -lactamases KPC et CTX-M). Des mutants sont aussi apparus qui résistent à l’action des inactivateurs mais il faut remarquer que, dès le début, certaines classes de -lactamases échappaient presque complètement à l’action de ces composés. La synthèse de l’avibactame (figure 3) qui ne contient pas de cycle -lactame a permis d’étendre le spectre d’activité des inactivateurs à beaucoup d’enzymes à sérine mais il faut maintenant faire face à l’apparition et la dissémination de l’autre famille de -lactamases, contre laquelle les inactivateurs disponibles sont totalement inefficaces : les -lactamases à Zn++.
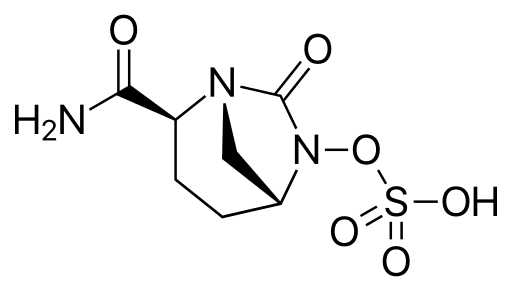
Figure 3 : Structure de l’avibactame
20Dès les années 50, on avait isolé une telle métallo--lactamase (MBL) produite par Bacillus cereus mais, comme cette espèce n’est pas très dangereuse, l’enzyme était plutôt considéré comme une curiosité biochimique. On a ensuite détecté des souches pathogènes produisant une MBL mais, au début, le gène était porté pas le chromosome et le problème restait limité. La situation a changé au début des années 90 quand des plasmides portant des gènes codant pour des MBL, comme les enzymes IMP et VIM et, très récemment NDM, se sont répandus. Pendant quelques années, les carbapénèmes (une sous-famille de -lactames, figure 1) ont été considérés comme les antibiotiques de dernier recours : ils échappaient à l’action de la plupart des -lactamases à sérine et inactivaient les DD-transpeptidases très efficacement. Malheureusement, ils sont hydrolysés par les MBL et, de plus, des « carbapénèmases » à sérine (KPC, par exemple) ont fait irruption.
21Si les carbapénèmases à sérine peuvent être sensibles à certains inactivateurs, en particulier l’avibactame qui réagit très bien avec les KPC, nous sommes tout à fait démunis vis-à-vis des MBL : aucun inhibiteur n’est actuellement dans le pipeline de développement des compagnies pharmaceutiques.
22Les plasmides qui portent les gènes codant pour les -lactamases sont d’autant plus préoccupants qu’ils ont accumulé des gènes de résistance à d’autres familles d’antibiotiques comme les aminoglycosides. La dispersion de ces plasmides est largement favorisée par l’utilisation d’antibiotiques à large spectre qui sélectionnent des souches pluri-résistantes.
23En résumé, l’efficacité de notre arsenal antimicrobien est très largement menacée si un effort considérable n’est pas réalisé dans deux directions.
24La première repose évidemment sur la recherche de composés nouveaux, agissant sur les voies métaboliques bactériennes aussi spécifiques que possible. La synthèse du peptidoglycane reste une cible de choix. Une meilleure connaissance de la physiologie bactérienne est absolument indispensable (mieux on connaît son ennemi, mieux on peut le combattre) et on ne peut que regretter l’absence d’attention dont a souffert ce domaine de la part des organismes de financement de la recherche.
25La seconde demande une restriction drastique de l’utilisation des antibiotiques, en particulier dans la pratique vétérinaire. En médecine humaine, une identification rapide de la bactérie responsable d’une infection et la caractérisation de ses propriétés permettraient l’administration de composés à spectre antibactérien aussi étroit que possible. Mais cette stratégie est en contradiction évidente avec les intérêts financiers de beaucoup de firmes pharmaceutiques.
Références
26(1) Davies J and Davies D (2010). Origin and evolution of antibiotic resistance
27Microbiology and Molecular Biology Reviews, 74, 417-433
28(2) Pour accéder aux rapports complets de la Commission O’Neill, tapez « Review on antimicrobial resistance » dans votre moteur de recherche
29(3) Reardon S. http://nature.com/new/dramatic-rise-seen-in-antibiotic-use-1.18383
30(4) Martin Blaser (2014), Missing Microbes, One World Publications
3110, Bloomsbury Street, London, WCIB 3SR, England
32(5) Van Boeckel TP et al. Global trends in antimicrobial use in food animals (2015). PNAS 112, 5649-5654
33(6) Silvera MA, Freitas AR, Peixe L. and Novais C (2009). Environmental spread of antibiotic molecules, antibiotic resistant bacteria and genes: jigsaw pieces of a public health problem. Revista da Faculdade de Ciências da Saude, Porto. 6, 244-253
34(7) Antunes P, Mourao J, Campos J and Peixe L (2016). Salmonellosis: the role of poultry meat. Clinical Microbiology and Infection. 22, 110-121, doi: 10.1016/j.cmi.2015.12.004
35(8) Kumarasamy KK et al (2010). Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study. Lancet Infect Dis. 10, 597-602.
36(9) Kelly R, Zoubiane G, Walsh D, Ward R and Goossens H (2015). Public funding for research on antibacterial resistance in the JPIAMR countries, the European Commission and related European Union agencies: a systematic observational analysis. The Lancet Infectious diseases. 16, 431-440, doi 10.1016/S1473-3099(15)00350-3
37(10) Jean-Marie Frère (2015), La résistance des bactéries aux antibiotiques, Académie Royale de Belgique ,Collection : L’Académie en poche
38(11) Frère JM and Rigali S (2016). The alarming increase in antibiotic-resistant bacteria, Drug Target Review, 3, 26-30
39(12) Frère JM, Sauvage E and Kerff F (2016). From “An enzyme able to destroy penicillin” to carbapenemases: 70 years of beta-lactamase misbehavior. Curr. Drug Targets, 17, 974-982.