- Startpagina tijdschrift
- Volume 91 - Année 2022
- Numéro 1
- De la paléohistologie osseuse à l’insularité
Weergave(s): 1965 (30 ULiège)
Download(s): 55 (0 ULiège)
De la paléohistologie osseuse à l’insularité
L’archive paléobiologique comme témoin de l’évolution insulaire

Documenten bij dit artikel
Version PDF originaleRésumé
Les îles ont toujours fasciné les scientifiques depuis leur vaste exploration et documentation. Elles reçurent même le titre de « laboratoire naturel » au vu de la réplication des expériences évolutives qu’elles permettent, tant par leur nombre que leur condition simplifiée comparés au continent. Malheureusement, aussi idylliques puissent-elles apparaître, les îles enregistrent des pertes de biodiversité majeures liées à l’activité anthropique depuis l’Holocène, défigurant les processus évolutifs qui y avaient cours auparavant. Dès lors, l’étude des espèces insulaires éteintes, dites « paléoinsulaires », devient incontournable afin de reconstituer les cadres évolutifs caractérisant ces environnements isolés. Pour ce faire, la paléohistologie osseuse est un outil de choix pour accéder aux archives paléobiologiques conservées au sein du tissu osseux et révéler les trajectoires évolutives amenant à l’apparition des curiosités biologiques qui peuplent les îles. Cet article porte un regard particulier sur les nains et géants insulaires avec un cas d’étude traitant des sauropodes nains de l’archipel européen du Crétacé supérieur, ceci afin de dégager des retombées scientifiques valorisables pour retracer les mondes passés, augmenter les champs de la connaissance du présent, et adopter des stratégies de conservation pour le futur.
Abstract
Islands have always fascinated scientists since their extensive exploration and documentation. They were even given the title of ‘natural laboratory’ in view of the replication of evolutionary experiments that they show both by their number and by their simplified condition compared to the mainland. Unfortunately, however idyllic they may appear, islands have suffered from major biodiversity losses due to human activity since the Holocene, disfiguring the evolutionary processes that used to take place locally. Consequently, the study of extinct island species known as ‘paleoinsular’ becomes essential to reconstruct the evolutionary framework characterising these isolated environments. To this end, bone palaeohistology is a tool of choice to access the palaeobiological archives preserved within bone tissue and to reveal the evolutionary trajectories that lead to the appearance of the biological curiosities populating islands. This article takes a particular look at island dwarfs and giants with a case study of dwarf sauropods from the Late Cretaceous European archipelago, in order to provide valuable scientific insights for tracing past worlds, increasing the fields of knowledge of the present, and adopting conservation strategies for the future.
Inhoudstafel
Manuscrit reçu le 29 mai 2022 et accepté le 4 novembre 2022
Publié selon les termes de la licence Creative Commons CC-BY 4.0
Cet article a reçu un des deux Prix Annuels 2022 de la Société Royale des Sciences de Liège. This paper was awarded one of the two Annual Prizes 2022 of the Société Royale des Sciences de Liège.
1. Introduction
1Des Caraïbes et Antilles à Hawaï en passant par la Réunion, les îles ont fasciné les scientifiques depuis leur vaste exploration et documentation au cours des 18e et 19e siècles. De ces objets simples et isolés, facilitant l’étude de phénomènes nettement plus complexes tant sur le continent que dans les océans, naquirent entre autres les bases de la théorie de l’évolution (MacArthur & Wilson, 1967 ; Losos & Ricklefs, 2010 ; Quammen, 2011 ; Lomolino et al., 2017). Ces « laboratoires naturels », abondants bien que vulnérables, offrent autant de réplications d’expériences évolutives rapides menant des espèces d’origines variées à suivre des trajectoires évolutives similaires sous des conditions insulaires comparables, fournissant nombre de curiosités biologiques (Darwin, 1860 ; Wallace, 1880 ; Grant, 1998 ; Palombo, 2009 ; Whittaker et al., 2017 ; Lomolino et al., 2017 ; Baeckens & Van Damme, 2020 ; Matthews & Triantis, 2021 ; Fernández-Palacios et al., 2021). En ce sens, le « syndrome insulaire » est certainement un des artisans les plus prolifiques de cette usine naturelle lorsque l’on s’attarde sur les divergences écologiques, comportementales et morphologiques entre des parents insulaires et continentaux, vertébrés comme invertébrés et incluant même les végétaux : gigantisme/nanisme insulaire, espérance de vie prolongée, bilan reproductif réduit, réduction des organes sensoriels, perte de l’aptitude au vol, modifications des membres, etc. (e.g., Adler & Levins, 1994 ; Grant, 1998 ; Denno et al., 2001 ; Lomolino, 2005 ; Köhler, 2010 ; Corfield et al., 2011 ; Wright et al., 2016 ; Lomolino et al., 2017 ; Biddick et al., 2018 ; Burns, 2019 ; Leihy & Chown, 2020 ; Rozzi et al., 2020 ; Baeckens & Van Damme, 2020 ; Hooft van Huysduynen et al., 2021 ; Benítez-López et al., 2021).
2De fait, les îles et archipels sont particulièrement connus pour héberger des organismes tantôt considérés insolites, tantôt des merveilles de la nature (Quammen, 2011). Certaines de ces engeances de l’évolution ont marqué les esprits à jamais, comme le colombiforme Raphus cucullatus de l’île Maurice plus connu sous le doux nom de dodo, dont la chair délicieuse et son odeur plus forte que ses cousins continentaux l’ont emporté à son corps défendant dans le sommeil éternel à la fin du 17e siècle (Burns, 2019). Si l’on déplace le curseur du temps sur quelques milliers à millions d’années en amont, l’on constate que le registre fossile insulaire regorge de bizarreries dépassant l’entendement : un lapin géant de Minorque atteignant les 12 kg (Quintana et al., 2011), une chèvre naine de Majorque à la stratégie de croissance la rapprochant des reptiles (e.g., Köhler, 2010), un perroquet géant néozélandais de 7 kg cloué au sol (Worthy et al., 2019), ou encore des éléphants nains peuplant diverses îles méditerranéennes et atteignant timidement un mètre au garrot à l’âge adulte (Larramendi & Palombo, 2015). C’est dire si les îles sont le musée des horreurs ou l’atelier d’un quelconque créatif doté d’une immense imagination.
3Mais pourquoi diable s’attarder sur des espèces éteintes ? Ce que nous voyons sur les îles de nos jours n’est-il pas suffisant ? Outre des raisons purement fondamentales (l’histoire de la vie, l’évolution de la biosphère) (Lethiers, 2001), pratiques (e.g., prospection de pétrole) (Adnet et al., 2013), ou encore d’ordre culturel et sociétal (mythes, folklore, place de l’Homme dans la nature) (e.g., Gould, 1998 ; Spalding & Sarjeant, 2012 ; Marshall, 2021), l’intérêt central des fossiles est de connaître ce qui nous a précédé afin d’entrevoir ce qui nous attend (Buffetaut, 2013) et de mieux comprendre le monde dans lequel nous vivons (Dodson, 1990 ; Clauss, 2011) pour le préserver efficacement. Et justement, parmi les divers enjeux écologiques qui nous préoccupent actuellement, les îles tiennent une place centrale eu regard de la vulnérabilité des écosystèmes insulaires aux impacts anthropiques, en cause notamment l’introduction de nouvelles espèces et de nouveaux prédateurs (Blackburn & Gaston, 2005 ; Simberloff, 2013 ; Russel & Kueffer, 2019 ; Baeckens & Van Damme, 2020 ; Fernández et al., 2021).
4Pour l’exemple, le dodu profil du dadais dodo couvre un triste dessein qu’on ne saurait voir : les oiseaux insulaires qui communient dans l’extinction par la main de l’Homme ne représentent pas moins de 20% de la diversité totale aviaire dans le monde, la plupart de ces espèces étant de grandes tailles, inaptes au vol et naïves, ce qui en faisait des cibles faciles (Quammen, 2011). Et plus globalement, l’installation des Hommes a marqué sans retour les environnements insulaires depuis l’Holocène, c’est-à-dire depuis les quelques derniers milliers d’années (e.g., Wright et al., 2016 ; Russel & Kueffer, 2019 ; Fromm & Meiri, 2021). Dès lors, il apparaît que la biodiversité ainsi que les phénomènes naturels et évolutifs insulaires locaux y ont été défigurés, rendant les îles non représentatives en l’état des processus qui y avaient libre cours auparavant (McNab, 2002 ; Lomolino et al., 2013 ; Boyer & Jetz, 2014 ; Faurby & Svenning, 2016 ; Sayol et al., 2020 ; Louys et al., 2021 ; Fernández-Palacios et al., 2021 ; Nogué et al., 2021 ; Irl et al., 2021 ; Castilla-Beltrán et al., 2021).
5Résultat, les espèces endémiques nagent dans un angle mort évolutif, ce qui limite la compréhension de ces organismes dans leur milieu ainsi que l’établissement de stratégies de conservation. Ainsi, l’exhumation d’espèces anciennes dites « paléoinsulaires », c’est-à-dire des espèces insulaires éteintes, est un besoin substantiel à l’observation des patterns évolutifs insulaires exprimés à leur paroxysme, vu qu’elles ont pu évoluer pendant des millions d’années dans l’isolement le plus total (e.g., Lomolino et al., 2013). L’idée est bien belle, cependant on tombe sur un os : l’identification d’individus nains ou géants est particulièrement compromise par l’abondance de spécimens fossiles incomplets, retrouvés dans un contexte paléoécologique flou, dont la lignée évolutive n’a pas atteint les temps récents ou pire, aux relations ancêtres-insulaires qui ne peuvent être établis avec certitude. Comment reconnaître alors un nain ou géant fossile dans un vide comparatif ? C’est un sujet qui prend de plus en plus d’ampleur ces dernières années et qui va nous occuper dans cet article avec le cas d’études des dinosaures sauropodes insulaires.
2. Le fossile au service de l’actuel
2.1. Problématique phylogénétique
6Comparer les formes insulaires et continentales est probablement l’approche la plus classique dans un cadre évolutionniste, et tant que l’on s’attarde sur des espèces actuelles pour lesquelles tous les outils nécessaires (observation directe, génétique, phylogénie, etc.) sont disponibles, rattacher une population insulaire à une population continentale source n’est pas insurmontable. Mais pour peu que l’on regarde des espèces paléoinsulaires récemment éteintes, il est déjà plus difficile d’identifier la population source au-delà du niveau de l’espèce, et ne parlons pas des insulaires aînés de plusieurs dizaines de millions d’années ! De fait, la qualité du registre fossile force une baisse exponentielle de la résolution d’identification (voir Lethiers, 2001), avec parfois une impossibilité concrète à identifier ne serait-ce que l’espèce ancestrale. Gros problème : si l’on se réfère à Lomolino (1985), un écart de ± 5% par rapport à la moyenne de la masse ancestrale définit nanisme ou gigantisme insulaire, information qui est plus rarement disponible qu’à son tour. Et comme diraient Gould & MacFadden (2004) : « Le gigantisme, le nanisme : rien n’a de sens en évolution sans une phylogénie. » ; dès lors, à défaut d’une phylogénie robuste des restes fossiles à disposition, il nous faut raisonner autrement qu’à travers l’ancestralité continentale directe.
7Une solution possible serait la détection de traits anatomiques « curieux » pour le taxon concerné. En effet, à l’opposé de la maquette construite dans la cave d’un passionné du chemin de fer, un nain ou géant insulaire n’est pas un simple modèle réduit/agrandit de son ancêtre (Sondaar, 1977 ; Lister, 1996 ; Weston & Lister, 2009 ; Lyras et al., 2010 ; Larramendi & Palombo, 2015 ; Lyras, 2018). Par exemple, les relations de taille entre le crâne et les dents d’animaux nanifiés sont complètement chamboulées dans les premières phases du nanisme insulaire, donnant une allure particulière à ces animaux avant de se rétablir ultérieurement (Marshall & Corruccini, 1978 ; Lister, 1996). D’autres modifications anatomiques suivent aussi pour parfaire l’adaptation au milieu comme des membres plus robustes ou des sens atténués en l’absence de prédation (e.g., Köhler & Moyà-Solà, 2004 ; Rozzi et al., 2020). Mais sachant que plus l’on part loin dans le passé, moins le matériel disponible est complet, on ne peut pas non plus décemment compter sur ces indices macroscopiques et morphologiques pour détecter du nanisme et gigantisme sans comparatif connu.
8Par contre, il est tout à fait possible d’estimer approximativement la masse corporelle de ces animaux fossiles mêmes fragmentaires grâce à une pléthore d’équations qui relient des mesures anatomiques (e.g., dents, condyles, métacarpes, hauteur à l’épaule, proportions des stylopodes, etc. [Scott, 1990 ; Delson et al., 2000 ; Palombo & Giovinazzo, 2005 ; Giovinazzo et al., 2006 ; Campione & Evans, 2012]) à la masse. Et sachant que cette masse est le carrefour de nombres de propriétés fondamentales d’un organisme donné (Nacarino-Meneses & Orlandi-Oliveras, 2021 et références citées ; Damuth & MacFadden, 1990), puisse-t-elle être entachée d’un intervalle de confiance substantiel, toute modification drastique détectable dans le registre fossile revient à la reconfiguration intégrale de l’animal. Or, et fort heureusement pour les paléontologues, l’archive qui enregistre le mieux ces modifications intimes et internes à l’animal se trouve être l’os lui-même, transcendant les âges jusqu’à nous et livrant ses secrets par le biais de la paléohistologie osseuse.
2.2. L’os et la paléohistologie osseuse
9L’histologie osseuse est l’étude du tissu osseux à l’échelle cellulaire (Huttenlocker et al., 2013), le préfixe paléo- renvoyant au monde fossile. Cette distinction dépasse la pure sémantique ; il s’agit de marquer la limite entre l’histologie qui se pratique sur du matériel « frais » et qui contient tissus mous, cellules, protéines, etc. qui ne peuvent se conserver qu’à titre exceptionnel à l’état fossile, bien que les limites de préservation soient continuellement repoussées (e.g., Schweitzer et al., 2013 ; Bailleul et al., 2020 ; voir Chinsamy-Turan, 2005 ; Houssaye et al., 2021). Par conséquent, la paléohistologie dont les fondamentaux modernes ont été posés courant années 60 (Padian, 2013 ; voir de Ricqlès, 2021 pour un historique détaillé) est basée sur l’histologie traditionnelle mais ne prétend pas être son égale. Les objectifs poursuivis ne sont et ne peuvent pas être les mêmes, ce qui se justifie par le degré de préservation différentiel du matériel fossile allant du parfaitement conservé à très altéré (fragments, poches de dissolutions, recristallisation, érosion, dégâts mécaniques lors de l’échantillonnage/préparation, etc.) qui peuvent drastiquement limiter la portée de cette approche. Toutefois, de l’impossibilité de pouvoir utiliser des marqueurs histologiques directs naît le développement d’indicateurs alternatifs utiles rétroactivement pour l’actuel et subactuel (e.g., Stein & Prondvai, 2014 ; Prondvai et al., 2014 ; Jentgen-Ceschino et al., 2020 ; Prondvai et al., 2022).
10L’intérêt de la paléohistologie osseuse est de pouvoir observer directement cette maçonnerie biologique qu’est l’os, couplage d’un matériau organique (collagène) et minéral (cristaux de calcium et phosphore) régulièrement transpercé par des canaux vasculaires. En fonction du degré de vascularisation de l’os, l’on distingue l’os cortical (ou compacta, en référence à l’aspect compact de la paroi osseuse, communément appelée cortex) de l’os spongieux (ou spongiosa, en référence à son aspect très vascularisé en comparaison – Fig. 1) (Chinsamy-Turan, 2005 ; Huttenlocker et al., 2013 ; Hallett & Wedel, 2016). De ces propriétés de base émerge une classification fine des tissus osseux selon la géométrie et la disposition des fibres de collagènes ainsi que du pattern de vascularisation cortical (Francillon-Vieillot et al., 1990 ; Sander et al., 2011). Ces derniers rendent compte des dynamiques de croissance de l’os (e.g., la loi d’Amprino qui lie un type de tissu à une gamme de vitesse de croissance [Amprino, 1947]), et donc de la croissance de l’animal en question. Enfin, l’os étant un organe vivant, il évolue au cours du temps, s’enrichit en minéraux, colmate les canaux vasculaires par des dépôts plus tardifs (formation d’ostéons primaires – Fig. 1), et est capable de s’autoréguler et de subvenir à ses propres besoins (Hallett & Wedel, 2016). En particulier, il se remodèle, c’est-à-dire que le tissu osseux primaire déposé lors de la croissance osseuse et de l’animal ne reste pas statique ad vitam aeternam mais se fait convertir progressivement vers de l’os secondaire (formation d’ostéons secondaires – Fig. 1). Cette conversion de l’os primaire avec l’âge se fait sous l’orchestration des ostéocytes, cellules emprisonnées dans le tissu osseux (Fig. 1), particulièrement pour réparer les microdégâts infligés au tissu osseux au cours de son activité biomécanique journalière (Allen & Burr, 2019 ; de Buffrénil & Quilhac, 2021). La progression du remodelage sert souvent d’indicateur du degré du vieillissement étant donné qu’il s’agit d’un processus lent par nature (voir Seeman, 2020).
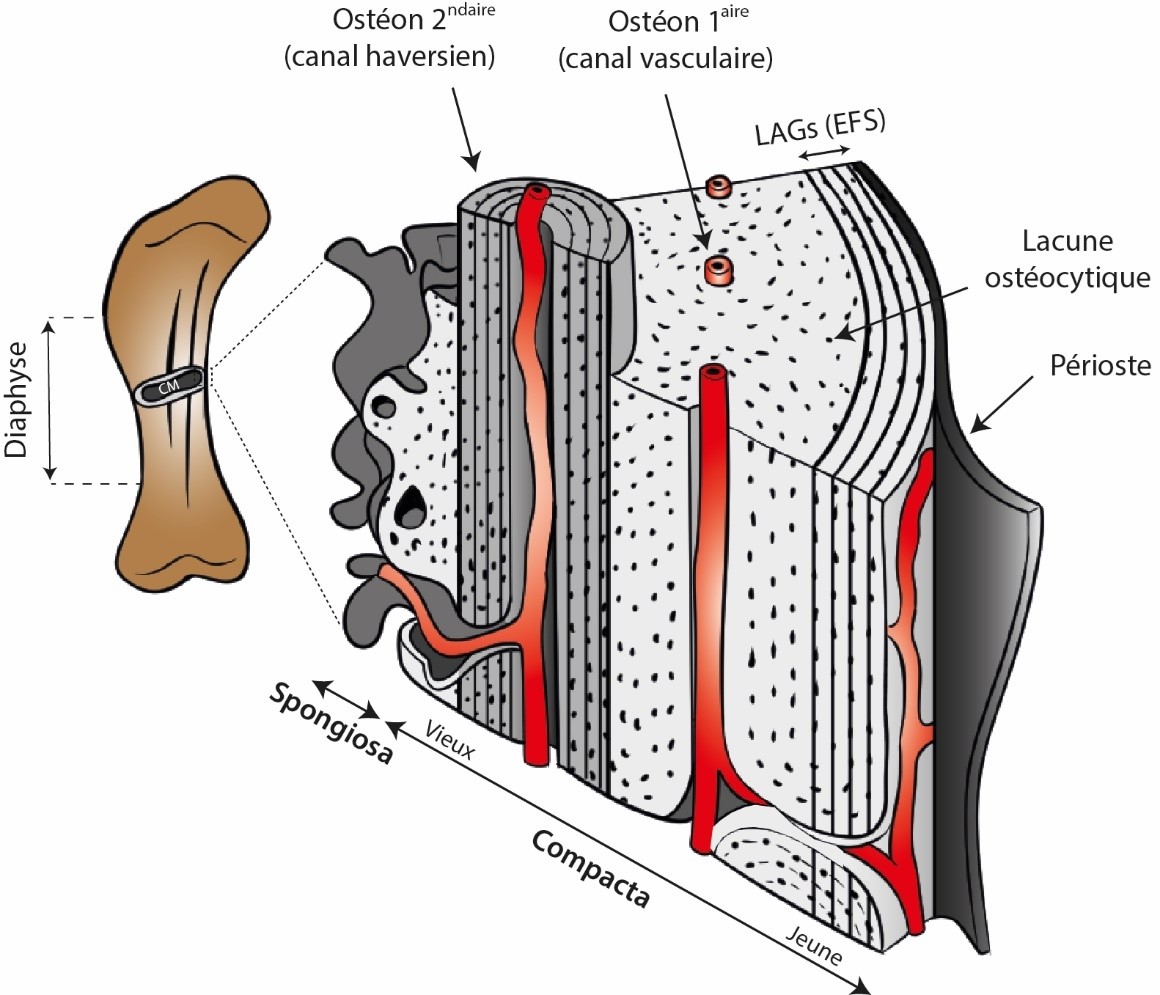
Figure 1. Bloc histologique schématique en 3D d'un os long typique (ici, un fémur de sauropode).
Le tissu primaire (gris clair) croit de manière centrifuge tout le long de la croissance radiale de l’os et mûrit avec l’âge, produisant entre autres des ostéons primaires. Des arrêts de croissance matérialisés par des LAGs peuvent selon les taxons se retrouver à travers l’entièreté du cortex ou seulement en périphérie (figuré ici). En fin de croissance, de tels arrêts densément groupés définissent l’EFS, marquant visuellement la maturité somatique. Le tissu secondaire (gris moyen) est typiquement représenté par les ostéons secondaires, dont la fonction majeure est la réparation du tissu osseux (tant primaire que secondaire plus anciens). Ce dernier est construit autour d’un canal dit haversien dans lequel des vaisseaux sanguins sont contenus. La position standard d’échantillonnage est le milieu de la diaphyse pour des raisons de croissance osseuse, afin de prélever la zone avec le plus grand enregistrement possible de l’os en question. La cavité médullaire (CM) est contenue au cœur de l’os long. Modifié de Hallett & Wedel (2016) avec permission (© John Hopkins University Press).
11Pour avoir accès à toutes ces informations, la pratique de la paléohistologie osseuse nécessite une destruction partielle du matériel étudié pour produire des tranches d’os à placer sous le microscope. Ces tranches sont produites soit de coupes d’os complètes soit de carottes obtenues par forage (Stein & Sander, 2009 ; Lamm, 2013) pour essentiellement se focaliser sur la partie corticale de l’os étudié. Assez souvent, ce sont les os longs des membres qui sont sacrifiés, c’est-à-dire ceux dont la diaphyse (la partie centrale de l’os à distance des extrémités articulaires – Fig. 1) est droite et qui accueille une cavité médullaire où les cellules sanguines sont produites. Ce choix n’est pas laissé au hasard ; la croissance périostale, autrement dit la croissance radiale ou centrifuge de l’os cortical sous l’action du périoste qui est le tissu entourant la diaphyse (Fig. 1), agit comme un archiviste qui encode différentes informations biologiques. Taux de croissance, arrêts cycliques de croissance prenant la forme de cernes (Lines of Arrested Growth - LAGs) dans le cortex et dont le principe rappelle la dendrochronologie, stade ontogénétique, pathologies, squelettochronologie, maturité sexuelle et/ou somatique (cette dernière matérialisée par l’External Fundamental System – EFS, Fig. 1), biomécanique, thermophysiologie, environnement, etc.) sont autant d’informations consignées dans ce tissu osseux au fil du temps (e.g., Chinsamy & Hillenius, 2004 ; Curry Rogers & Erickson, 2005 ; Chinsamy-Turan, 2005 ; Reid, 2012 ; Padian, 2013 ; Wiemann et al., 2022). De plus, ces os longs sont les plus abondants chez certains groupes, les moins déformés par les processus taphonomiques, et sont les éléments osseux les plus utiles pour estimer la taille de l’animal (Sander et al., 2011). Dit de manière plus pragmatique, on fait de notre mieux avec ce que Dame Nature a daigné nous laisser.
12Vous aurez donc compris que le pendant destructif de la paléohistologie osseuse est particulièrement apprécié des curateurs et musées, limitant son application systématique (Padian, 2013 ; Jentgen-Ceschino et al., 2020). Toutefois, le retour sur investissement est plus que rentable vu la véritable mine d’informations paléobiologiques conservée à l’intérieur du tissu osseux inaccessible à l’échelle macroscopique des os et squelettes. Par extension, la paléohistologie osseuse se révèle être un puissant outil d’investigation paléobiologique dans l’étude des taxons insulaires. La constitution et géométrie du tissu osseux traduisant des traits liés à l’histoire naturelle des organismes promeuvent l’approche histologique comme outil-clef pour détricoter le nanisme et gigantisme insulaire et s’attaquer à des questions de développement indépendantes de la masse corporelle typique des environnements insulaires (e.g., Bromage et al., 2002 ; Turvey et al., 2005 ; Bourdon et al., 2009 ; Köhler & Moyà-Solà, 2009 ; Jordana & Köhler, 2011 ; Sander et al., 2011 ; Dirks et al., 2012 ; Mitchell & Sander, 2014 ; Mitchell et al., 2017 ; Orlandi-Oliveras et al., 2018).
3. Cas d’étude : les sauropodes
3.1. Qu’est-ce qu’un sauropode ? Mode emploi
13Les sauropodes sont LE dinosaure par excellence (Wilson & Curry Rogers, 2012). Brachiosaurus, Diplodocus, Apatosaurus, Camarasaurus, Dicraeosaurus ou encore Brontosaurus ; des noms à en perdre son latin (heureusement, c’est du grec) mais qui ne vous sont certainement pas inconnus au vu de la célébrité de leur porteur sortis tout droit du Jurassique (Allain, 2012). Ces dinosaures à long cou parfois assimilés à des « aspirateurs » à nourriture (Brusatte, 2018) sont en effet bien connus et chéris du grand public tant dans les musées qu’au petit ou grand écran et même sur papier, s’ancrant un peu plus dans la conscience collective génération après génération. Ils forcent l’admiration, mais aussi des haussements de sourcils interrogateurs ; comment de tels géants ne se sont-ils pas effondrés sous leur propre poids ? Il faut dire qu’ils ont eu 150 millions d’années (Ma) sur les bras pour y penser et réinventer le quadrupède herbivore à l’abri des regards – enfin, du moins jusqu’à ce qu’ils ne puissent plus être cachés même par une forêt.
14De fait, de leur apparition au Trias supérieur (237 à 201 Ma) jusqu’à leur disparition il y a 66 Ma en passant par leur acmé au Jurassique supérieur (164 à 145 Ma) (Wilson, 2005 ; Upchurch & Barrett, 2005), l’histoire naturelle retient des sauropodes qu’ils n’ont jamais cessé de briser les records progressivement posés par leurs ancêtres avant eux. En effet, leur plan anatomique particulièrement optimisé pour supporter ce gigantisme terrestre n’a connu que peu d’écarts (Wilson & Curry Rogers, 2005 ; Sander, 2013), permettant l’évolution de tailles titanesques dépassant les 30 mètres de long et des masses colossales estimées à 70 tonnes (et peut-être même au-delà !) (Upchurch et al., 2004 ; Wilson & Curry Rogers, 2005 ; Curry Rogers & Erickson, 2005 ; Carballido et al., 2017). Les sauropodes devinrent ainsi les plus grands et massifs vertébrés à avoir foulé la terre ferme, et tout cela à partir d’un « petit » mètre de long et moins de 10 kg au sortir d’un œuf de 15 à 20 cm de diamètre seulement (Chiappe et al., 1998, 2001 ; Zelenitsky et al., 2012 ; Carpenter, 1999). Il a fallu un impact d’astéroïde marquant la célèbre limite Crétacé/Paléogène (K/Pg) associé à un ensemble de conditions défavorables incluant des dynamiques climatiques globales pour mettre fin à ce pan extraordinaire de l’histoire naturelle et graver dans la roche ces exploits toujours incontestés à ce jour, emportant avec les sauropodes tous les autres dinosaures non-aviens (e.g., Kaiho et al., 2016 ; Keller et al., 2018 ; Morgan et al., 2022).
15Parmi les dinosaures, les sauropodes sont particulièrement bien définis paléohistologiquement. Leur aspect « monolithique » tout du long de leur arbre phylogénétique comparé à d’autres clades dinosauriens plus variés morphologiquement (Wilson & Curry Rogers, 2005) offre un certain degré d’homogénéité et donc de réplication des observations paléohistologiques au sein de ce groupe. Cette observation permet une généralisation du schéma histologique sur un large échantillon de genres et d’espèces : les sauropodes sont globalement caractérisés par une croissance rapide et ininterrompue, qui apparaît conservative et linéaire des espèces les plus basales aux plus dérivées. Dans leurs os longs, le cortex est primairement constitué d’un échafaud tridimensionnel de faisceaux de fibres osseuses orientés aléatoirement et d’autres de manière plus organisée (Sander et al., 2011 ; Stein & Prondvai, 2014), le tout qui se fait progressivement remodeler et remplacer par de l’os secondaire à partir de l’âge adulte (Klein & Sander, 2008).
16La conjonction de ces deux grands types de tissus osseux a rendu possible chez les sauropodes l’estimation des taux et des trajectoires de croissance (Lehman & Woodward, 2008 ; Griebeler et al., 2013 ; Cerda et al., 2017), de créer sur base de critères histologiques une échelle précise des stades ontogénétiques atteint à la mort (Klein & Sander, 2008 ; Klein et al., 2012) mais aussi de mettre en lumière de subtiles différences entre stratégies de croissance (Mitchell & Sander, 2014) et entre divers degré de vieillesse (Mitchell et al., 2017). Il en découle que dans un tel contexte histologique phylogénétiquement contraint, il semble raisonnable de voir dans toute déviation à ce carcan soit des signaux non évolutifs (e.g., pathologiques ; de Souza Barbosa et al., 2016 ; García et al., 2017 ; Gonzalez et al., 2017 ; Jentgen-Ceschino et al., 2020) soit évolutifs (Sander et al., 2006 ; Stein et al., 2010 ; Company, 2011 ; Klein et al., 2009, 2012 ; Curry Rogers et al., 2016 ; Díez Díaz et al., 2018, 2021).
17Et c’est ici que les choses deviennent croustillantes.
3.2. Les sauropodes insulaires de l’archipel européen
18Selon le paradigme du « sauropode standard » présenté ci-dessus, il serait rationnel d’imaginer que ces béhémoths se soient contentés du continent où les forêts – et donc les garde-manger – se succèdent les unes les autres à perte de vue. Tous ? Non ! Quelque part sur l’île Ibéro-Armorique ont pu s’installer certains sauropodes suffisamment braves, certains défiant même la Mer de la Craie qui recouvrait l’Europe d’alors (Csiki-Sava et al., 2015) (Fig. 2) et colonisant de lointains horizons insulaires (Díez Díaz, 2022). Ils rencontrèrent un succès répété, et purent planter leur drapeau en plusieurs îles et domaines (Stein et al., 2010 ; Company, 2011 ; Díez Díaz et al., 2018, 2021) pour évoluer selon des règles très différentes du continent (voir Lomolino et al., 2017 ; Burns, 2019). En résulta une trajectoire évolutive non moins originale pour le groupe : un rapetissement opposé à la tendance au gigantisme des sauropodes continentaux, confirmant que ce n’est pas la taille qui compte. Ce rétrécissement permit d’éviter la saturation des populations locales et devenir des nains insulaires, en transitant de dizaines de mètres de longs et de tonnes à quelques mètres seulement et parfois même rester sous la barre symbolique de la tonne ; du gargantuesque au pygmée pour assurer la survie de tous.
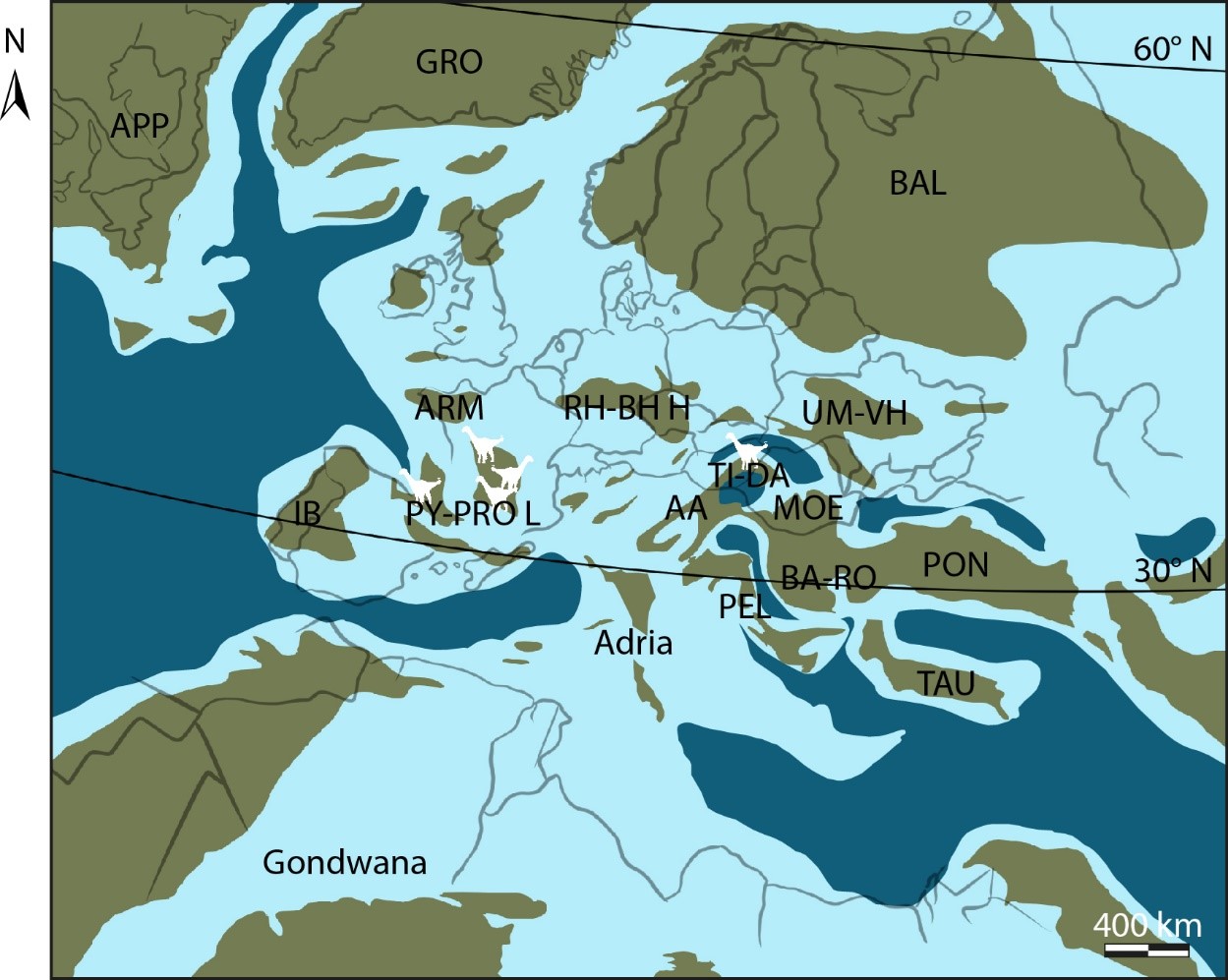
Figure 2. Paléogéographie de l'archipel européen de la fin du Crétacé supérieur (ca. 75 Ma).
AA : Domaine Austroalpin ; APP : Appalachia ; ARM : Massif Armoricain ; BA-RHO : Orogène Balkans-Rhodope ; BAL : masse continentale baltique ; GRO : Groenland ; IB : masse continentale ibérique ; MOE : Plateforme de Mésie ; PEL : Domaine de Pelagonie ; PON : Orogène Pontides ; PY-PRO L : masse continentale Pyrénéo-Provencale ; RH-BH H : Sommets Rhenan-Bohème ; TAU : Bloc Taurus ; TI-DA : Block Tisia-Dacia ; UM-VH Sommet du Massif-Voronezh Ukrainien. Notez que les contours des terres émergées sont approximatifs. Les silhouettes blanches représentent les sauropodes nains connus actuellement. Redessiné, de Csiki-Sava et al. (2015), sous licence Creative Commons CCBY4.0 (https://doi.org/10.3897/zookeys.469.8439 )
19Les chiens ne faisant pas des chats, c’était aussi l’occasion de briser de nouveaux records, mais de l’extrême opposé cette fois-ci. Le nanisme de ces sauropodes n’a jamais été égalé en valeurs absolues par aucun autre groupe insulaire qui a suivi leurs pas. Ce processus évolutif singulier a été particulièrement soutenu par les hauts niveaux marins du Crétacé supérieur (100-66 Ma) jusqu’à 120 mètres plus haut que l’actuel, isolant les populations locales au sein de l’archipel européen, configuration plus qu’idéale pour l’évolution insulaire (Aguilée et al., 2021). Ce n’est pas pour rien que l’archipel européen a été le témoin d’émergence de nouvelles espèces plutôt originales (Csiki et al., 2010 ; Csiki-Sava et al., 2018) ainsi que d’autres géants et nains insulaires (e.g., Buffetaut et al., 2002 ; Benton et al., 2010 ; Chiarrenza et al., 2021). Malheureusement pour ce qui nous occupe, les restes de ces sauropodes nains sont particulièrement fragmentaires, ce qui limite significativement la portée des interprétations. Et s’il s’agissait en vérité de juvéniles égarés ? De dimorphes sexuels (voir Díez Díaz et al., 2021) ? Et pourquoi pas des cas pathologiques de croissance, comme le cervidé géant de Crête atteint de gigantisme pituitaire (Palombo & Zedda, 2022) ? C’est ici que la paléohistologie osseuse vient à notre secours.
20Les sauropodes nains de l’archipel européen ne passent absolument pas inaperçus pour peu que l’on connaisse le sauropode standard. En effet, le tissu osseux de ces espèces montre à la fois une croissance moins rapide que celle des ancêtres continentaux (Stein et al., 2010 ; Klein et al., 2012) ainsi que des arrêts de croissance bien avant les balbutiements de la maturité somatique matérialisée par l’EFS (Company, 2011), à relier probablement aux mauvaises saisons (voir Curry Rogers & Kulik, 2018). Mais ça, c’est quand on a la chance de voir autre chose que des ostéons secondaires (Fig. 3) ; le remodelage démarrant très tôt dans la vie des individus nains bien avant le stade adulte habituel (voir Curry Rogers et al., 2016), il efface toutes les informations utiles au déchiffrage de la vie de l’animal (Stein et al., 2010 ; Díez Díaz et al., 2018, 2021), ce qui ne s’observait que chez les quelques plus grands sauropodes connus auparavant (Klein & Sander, 2008) ! Cette image paléohistologique vient même surclasser des échelles de remodelage établies pour le sauropodes standard (Mitchell et al., 2017 ; Díez Díaz et al., 2018), parfois avec des cas de remodelage excessivement avancés avant même la moitié de la taille adulte (e.g., Stein et al., 2010), soulignant la reconfiguration biologique que ces espèces ont subies dans isolement.
21Bref, l’on passe d’animaux à une croissance extraordinaire mais nécessaire pour atteindre en quelques années leur taille adulte à des animaux à la croissance modérée voire lente – toutes proportions gardées. Cette croissance ralentie est caractérisée par des « accidents histologiques » que sont des arrêts de croissance précoces ainsi qu’un remodelage extrême très tôt dans la vie de l’animal, ce qui n’est pas sans rappeler un nanisme parallèle chez un autre géant devenu nain (Mammuthus exilis - Curtin et al., 2012). Dès lors, la paléohistologie confirme bel et bien que la petitesse des individus retrouvés sur différentes îles et régions de l’archipel européen est bien le fait d’une réduction de taille qui a produit des nains insulaires dont la masse corporelle frôle dans certains cas les 2% des plus grand sauropodes continentaux (sur base de la limite inférieure de la masse maximale atteinte de 50 tonnes et de la masse minimale de ca. une tonne), proportions extrêmes uniquement retrouvées chez les éléphants nains des îles méditerranéennes (Athanassiou et al., 2019).
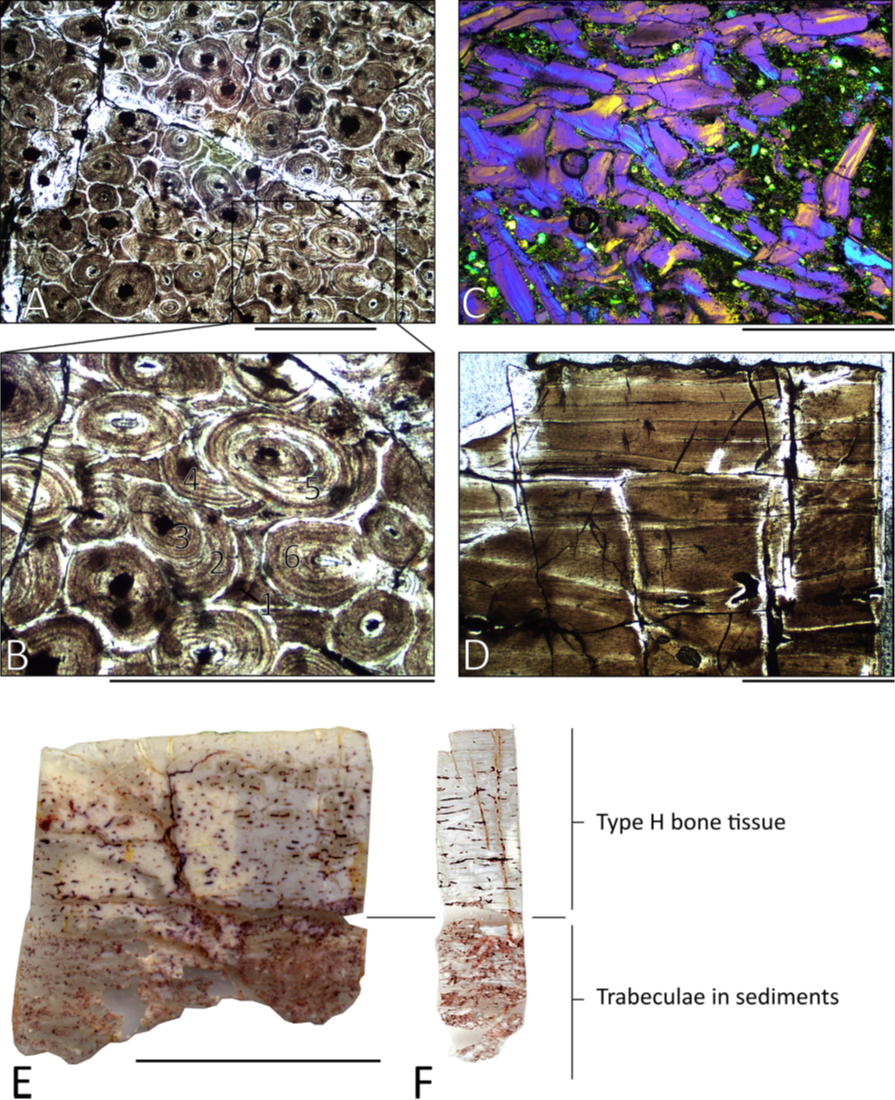
Figure 3. Paléohistologie osseuse d’un humérus (MMS/VBN.09.A.018) et d’un fémur (MMS/VBN.09.126) du sauropode nain Atsinganosaurus velauciensis.
A-C et E : sections transverses. D et F : sections longitudinales. (A) Remodelage intense du cortex (MMS/VBN.09.A.018). (B) zoom sur six générations multiples d’ostéons secondaires observables dans la figure A. (C) trabécules brisées emprisonnées dans des sédiments à la base de la carotte osseuse (MMS/VBN.09.A.018). (D) section longitudinale de MMS/VBN.09.126. (E-F) paléohistologie osseuse de MMS/VBN.09.126 en sections radiale et longitudinale, respectivement. Barres d’échelles : A-B = 0,5 mm ; C-D = 1,0 mm ; E-F = 1,0 cm. De Díez Díaz et al. (2018), avec permission de réutilisation (© Elsevier).
22Ces bouleversements paléobiologiques témoignent donc d’un changement de direction évolutive de géants continentaux vers des nains insulaires, probablement en lien avec une dynamique des ressources disponibles (Sondaar, 1977 ; Lomolino, 2005) ; je pense ne pas avoir besoin de vous faire un dessin du comment une bande de ratiboiseurs multitonnes pose problème dans un environnement limité, moyennant une trajectoire évolutive adéquate assurant sa pérennité. Il est toutefois intéressant de noter que certains auteurs estiment que le nanisme pourrait n’être qu’une mauvaise interprétation paléohistologique du matériel découvert jusqu’ici (Padian & Woodward, 2021). Ces auteurs indiquent des cas de LAGs empilés chez le titanosaure insulaire malgache Rapetosaurus krausei (voir Curry Rogers & Kulik, 2018) qui ressemblent à s’y méprendre à un EFS et qui donc peuvent agir comme de faux positifs de fin de croissance, biaisant les interprétations de nanisme. Bien que cet argument soit concret, il n’est toutefois pas universel chez les insulaires : ce pattern n’a pas été observé par Díez Díaz et al. (2021) et qu’occasionnellement par Company (2011) parmi les titanosaures nains de l’archipel européen pour lesquels des LAGs sont documentés. Ces EFS trompeurs semblent donc se limiter à des individus précis plutôt que d’être généraux pour les sauropodes de petite taille, mais appellent à la prudence de ne pas arrêter l’interprétation paléohistologique à un seul facteur.
4. Retombées de la paléohistologie osseuse
23Ces découvertes et observations paléohistologiques récentes mettent en perspective les processus de nanisme et gigantisme insulaires qui, le plus souvent, ne s’intéressent pas au message biologique interne des organismes concernés, pourtant gardé au chaud dans le tissu osseux pendant des millions d’années. Cet apport comble des trous majeurs dans la compréhension de ces espèces actuelles en danger, et les retombées scientifiques ne se sont pas fait attendre tant dans la reconstruction du passé, la construction de la science au moment présent, et les prédictions dans le futur.
4.1. Passé : le nanisme insulaire, pas qu’une question de taille
24De la même façon que la paléohistologie diffère de l’histologie traditionnelle, le nain revêt une définition fluctuante entre le monde (sub)actuel et ancien. Comme indiqué précédemment, certaines études traitant de la loi insulaire (voir plus bas) se basent sur une déviation de 5% entre l’ancêtre et l’insulaire (voir table 1 de Lomolino, 1985). Toutefois, une telle limite n’est pas réaliste à l’échelle des temps géologiques pour lesquels le million d’années n’est qu’un battement de cil pour la Terre et qui tomberait dans l’intervalle de confiance des estimations de masse et taille corporelles du registre fossile (Romano et al., 2021). Vu cette faible résolution inhérente aux mondes perdus, les paléontologues ne peuvent raisonnablement appliquer à la décimale près l’approche du nanisme ou gigantisme insulaire des écologistes et biologistes. Ce puzzle est davantage complexifié par le réel besoin d’une phylogénie robuste pour détricoter les changements de taille et masse, sans laquelle ce serait comme jouer en manquant certaines pièces (voir plus haut) ; si un clade était initialement petit et a évolué des tailles graduellement plus grandes au fil du temps, déterrer et décrire un petit taxon apparenté sur une paléoîle n’indiquerait pas du nanisme automatiquement (e.g., Ösi et al., 2012). La limite doit donc être revue à un niveau permettant de contourner la « compaction spatiotemporelle » sur des millions d’années et sur des centaines de kilomètres de la paléontologie. Du nanisme est dès lors invoqué pour des populations dont la taille est d’un demi ou d’un tiers celle de l’ancêtre, et inversement pour le gigantisme, du double au triple (Benton et al., 2010). Des changements de taille radicaux laissant peu de place au doute somme toute.
25Nuance est tout de même de mise, ces repères généraux ne faisant pas loi et excluant la paléohistologie. Par exemple, le sauropode Garrigatitan meridionalis montre un signal paléohistologique uniforme avec les autres sauropodes nains de l’archipel européen, rattaché à une diminution du taux de croissance bien que sa taille maximale leur soit sensiblement supérieure (Díez Díaz et al., 2021). S’arrêter à sa taille absolue aurait donc été trompeur, d’autant si l’on considère son cousin proche Atsinganosaurus velauciensis découvert sur le même site mais qui lui est inférieur en taille (Díez Díaz et al., 2018) ; une interprétation possible sans l’aide de la paléohistologie aurait été de considérer G. meridionalis comme l’ancêtre d’A. velauciensis.
26Après la reconnaissance des nains et géants en tant que tels dans le registre fossile se pose la question du nanisme/gigantisme dans un cadre évolutif plus large. C’est ce que la notion de phylétique et d’autapomorphique (Gould & MacFadden, 2004) sous-tend par l’apport d’un contexte évolutif nuancé au changement de taille. Par « phylétique », l’on entend un changement de taille qui caractérise une lignée évolutive (vision anagénétique, i.e., progressive du nanisme d’espèce en espèce) tandis que « autapomorphique » renvoie à un changement exclusif à un groupe (vision cladogénétique, tranchant avec les cousins proches). Le plus bel exemple du nanisme phylétique en milieu insulaire se retrouve dans la lignée des chèvres naines Myotragus des îles Baléares avec une réduction de taille de plus en plus proéminente ainsi que des modifications anatomiques de plus en plus marquées (Köhler, 2010), et du nanisme autapomorphique chez les éléphant nains Palaeoloxodon de Méditerranée qui montrent des tailles réduites différentes selon les îles colonisées (e.g., Athanassiou et al., 2019).
27Outre la détection de nains ou géants hors contexte phylogénétique, la pratique de la paléohistologie permet aussi d’éclaircir les dynamiques évolutives qui leur sont liés. Notamment, la vérification des reconstructions des tailles et masses des espèces éteintes en écartant systématiquement les individus qui n’ont pas atteint la maturité somatique permet d’éviter l’introduction d’erreurs entre la taille focale (i.e., du taxon considéré) et ancestrale. Ce faisant, il devient possible de retracer l’évolution du nanisme ou du gigantisme dans un clade donné. Par exemple, Ösi et al. (2012) ont pu confirmer un nanisme autapomorphique du petit rhabdodontidé Mochlodon et un gigantisme autapomorphique pour son cousin Rhabdodon, tout en rejetant l’hypothèse de nanisme pour le dernier de la bande, Zalmoxes. D’autres cas sont ambigus par l’échelle utilisée, comme dans le cas de l’hadrosauroïde Tethyshadros insularis (Chiarrenza et al., 2021). En effet, bien que l’analyse paléohistologique de ces auteurs pointe vers un individu probablement mature assurant l’estimation de la masse corporelle de l’animal, elle tombe dans la gamme des dinosaures hadrosauriformes, large groupe auquel appartient T. insularis. Pour cette raison, Chiarrenza et ses collègues lui réfutent le statut de nain insulaire. Cependant, il s’agit d’un groupe particulièrement large et au dernier ancêtre commun plutôt éloigné de T. insularis. En effet, si l’on zoome sur son environnement phylogénétique proche, il se situe sous la masse attendue pour son clade et dévie complètement de la tendance à l’augmentation de taille de ses cousins en milieu insulaire. Il en ressort qu’un cas clair de nanisme autapomorphique devrait donc être soutenu pour ce dinosaure insulaire.
28Quoi qu’il en soit, il faut garder à l’esprit que des phénotypes divergents pourraient être mal interprétés chez les fossiles en l'absence d'observations directes, de mesures et d'expériences. Des études récentes sur la plasticité phénotypique (e.g., Di Stefano & Petronio, 2021), qui comprend les adaptations locales non évolutives, tend à nous faire prendre de grandes précautions en la matière telles que merveilleusement illustré par les analyses génétiques de l'émeu insulaire du sud de l'Australie (Thomson et al., 2018). Celles-ci montrent que même un nanisme sévère (jusqu'à 45% de réduction de taille) n’est pas toujours le résultat d'événements de spéciation ! Autrement dit, les nains et géants insulaires ne seraient pas systématiquement des espèces biologiques – dans notre cas, paléontologiques – distinctes, ce qui complexifie encore plus le schéma insulaire (comme si on en avait vraiment besoin).
4.2. Présent : hétérochronies du développement
29La paléohistologie osseuse des sauropodes nains apporte entre autres un éclairage bienvenu sur une thématique actuelle de la compréhension des mécanismes de l’évolution, c’est-à-dire les hétérochronies du développement. Il s’agit des changements de timing et de taux de développement d’organes sensu lato qui peuvent produire un sous-développement (paedomorphose) ou sur-développement (péramorphose) en tout ou partie de l’organisme comparé à son ancêtre, et dont l’identification requiert une profonde connaissance de la phylogénie, ontogénie et du registre fossile de l’espèce concernée (McNamara, 2003 ; Benton & Harper, 2009 ; McNamara, 2012 ; Dobreva et al., 2021). Il va sans dire que cette approche est particulièrement ardue lorsqu’il s’agit d’organismes éteints.
30L’implication de processus hétérochroniques a été proposée depuis belle lurette pour les sauropodes nains de l’archipel européen. Le sauropode nain roumain Magyarosaurus dacus, lequel montre, outre une taille particulièrement réduite d’environ une tonne (Sander et al., 2011 ; Wilson & Curry Rogers, 2012), des huméri appartenant à des individus matures qui ressemblent morphologiquement à des huméri de juvéniles d’autres sauropodes. Ceci mène à considérer que M. dacus soit un nain paedomorphe, i.e., un nain devenu tel par rétention de caractères juvéniles à l’état adulte, conclusion soutenue par la position phylogénétique de ce sauropode (Jianu & Weishampel, 1999 ; Upchurch et al., 2004 ; Weishampel & Jianu, 2011 ; McNamara & Long, 2012). La paléohistologie accompagne ces modifications paedomorphiques en montrant un cliché drastiquement différent des attentes issues du sauropodes standard, dont un taux de croissance moindre (Stein et al., 2010 ; Benton et al., 2010). A l’opposé, l’interprétation hétérochronique du sauropode nain ibérique Lirainosaurus astibiae pourtant porteur d’une construction paléohistologique similaire vient contester le paedomorphisme proposé pour ces pygmées et apporte plutôt une explication péramorphique au remodelage extrême et autres particularités histologiques (Company, 2011).
31Et parce que la situation n’était pas encore assez circonvoluée, l’unique sauropode nain connu en dehors de l’archipel européen, à savoir Europasaurus holgeri du Jurassique supérieur d’Allemagne, vient semer la zizanie par l’exhibition d’un tissu osseux globalement standard (Sander et al., 2006) tout en ayant évolué plusieurs autres traits morphologiques par paedomorphose (Carballido et al., 2020). Le cas d’E. holgeri implique que la course au nanisme peut être le fruit de divers chemins évolutifs pour lesquels la recherche paléontologique et paléohistologique doit encore faire quelques percées pour défaire ce nœud gordien, et démontrant au passage qu’il y a encore du pain sur la planche avant d’envoyer les paléontologues pointer au chômage.
4.3. Futur : la loi insulaire
32La loi insulaire est une des « règles écologiques » les plus connues de l’évolution insulaire. Elle fut établie par Foster (1964) et représente le point pivot dans l’investigation des patterns évolutifs insulaires du gigantisme et nanisme insulaires, marquant un tournant majeur dans l’approche des changements de taille et masse corporelle de populations continentales et insulaires affiliées. Par comparaison des masses insulaires et ancestrales (continentales), Foster observa que certains taxons montraient une réduction de taille sur les îles tandis que d’autres grandissaient dans les mêmes conditions. De cette observation générale démarra non pas une étincelle mais une véritable déflagration d’études étalées sur plusieurs décennies qui remplissent encore actuellement les magazines spécialisés, chacun et chacune tentant d’apporter sa pierre à l’édifice. Absence de prédateurs et limitation des ressources (Sondaar, 1977), taille de l’île (Heaney, 1978), territorialité des organismes (Case, 1978), régime spécialiste ou généraliste (Lawlor, 1982) ; tous les paramètres insulaires possibles et imaginables étaient passé au crible et testés sur le terrain.
33L’épitome de cette nouvelle vague a été atteinte lorsque Lomolino (1985) redéfinit la loi insulaire comme étant « une tendance graduelle vers le gigantisme pour les petites espèces et le nanisme pour les grandes espèces », consacrant un pouvoir prédictif et contextuel en fonction de la masse corporelle ancestrale (Lomolino, 2005 ; Lomolino et al., 2012) (Fig. 4). Cette nouvelle formulation de la loi devint la pierre d’achoppement de l’étude du gigantisme et nanisme insulaires et suppose une tendance globale qui transcende la phylogénie (Lomolino et al., 2017). Toutefois, différents optima s’appliquent au clade considéré en fonction de divers facteurs évolutifs dès la phase d’immigration (sélection des immigrants) et post-colonisation (ressources disponibles, prédation, compétition, climat, etc.) (Lomolino et al., 2012). Nombre d’études validèrent cette nouvelle mouture de la loi insulaire (e.g., Lyras et al., 2006 ; van der Geer, 2014 ; Biddick & Burns, 2019 ; Athanassiou et al., 2019 ; Benítez-López et al., 2021), bien qu’une opposition substantielle (e.g., Meiri et al., 2004 ; Raia & Meiri, 2006 ; Meiri et al., 2008 ; Karagkouni et al., 2017 ; Itescu et al., 2018 ; Lokatis & Jeschke, 2018) ait scindé le débat en deux écoles majeures.
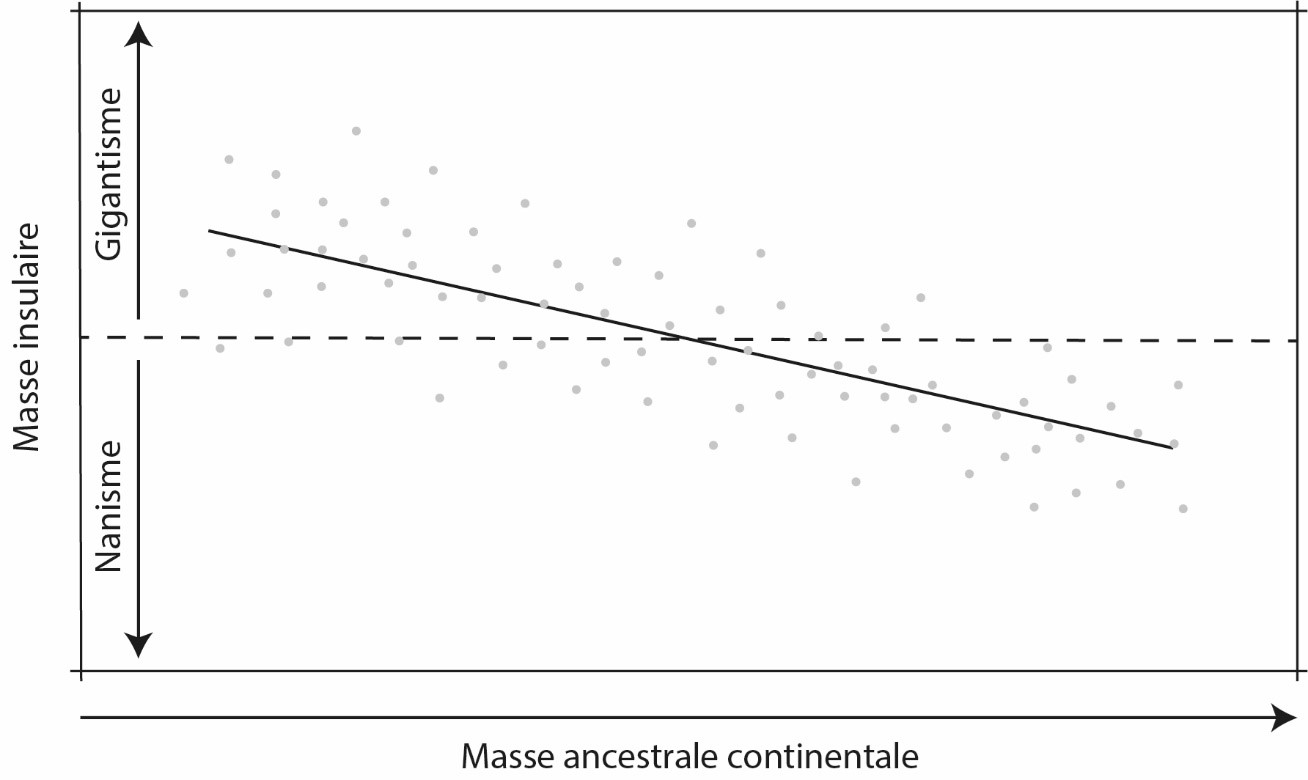
Figure 4. La loi insulaire.
La pente négative de la droite renvoie à la tendance générale selon laquelle les petites espèces deviennent géantes et les grandes deviennent naines sur les îles. Les points représentent des populations individuelles dont la distance à la droite reflète les contingences locales s’appliquant aux populations étudiées. Redessiné, de Lomolino (2005) avec permission de réutilisation (© Wiley).
34Une grande part de cette opposition s’explique par l’altération des conditions insulaires liées à l’activité anthropique ainsi qu’à la sélection des taxons. Par exemple, les mammifères carnivores qui occupent une place centrale chez les opposants de Lomolino colonisent les îles et évoluent selon d’autres standards que les herbivores (voir, e.g., Carbone et al., 1999). De plus, les îles actuelles sont dépourvues de représentants carnivores pré-Holocènes, ne laissant que des espèces récentes avec lesquelles travailler (Lyras et al., 2006, 2010). En prenant en compte toute une série de ce genre de biais analytiques, Benítez-López et al. (2021) parvinrent à démontrer la loi insulaire pour les mammifères, oiseaux et reptiles, scellant le concept de cette règle pour de bon.
35Malheureusement, se limiter au monde actuel revient à vouloir visiter une maison en ne regardant que par la serrure d’entrée : on ne peut en avoir qu’une vague idée de l’intérieur, et nous ne pouvons qu’imaginer le reste. L’introduction d’espèces paléoinsulaires naines et géantes dans la loi insulaire permet ainsi de prendre du recul et d’admirer la toile en entier, les représentants les plus extrêmes de la loi appartenant de facto au passé. Il est aujourd’hui essentiel d’augmenter son pouvoir prédictif en vue des défis qui attendent les îles, notamment le changement climatique qui change progressivement les règles du jeu au fur et à mesure de la submersion des îles les plus vulnérables à la montée des eaux, aux modifications des conditions écologiques (sécheresse, fréquence et intensité des événements météorologiques extrêmes, etc.), et à l’activité anthropique (Russel & Kueffer, 2019).
5. Conclusions et perspectives
36Les îles sont des environnements fascinants qui attirent l’attention des scientifiques depuis des siècles. Ces laboratoires naturels ont fourni et fournissent encore nombre de curiosités de l’évolution qui sont malheureusement vulnérables à l’activité anthropique, poussant ces espèces endémiques à l’extinction les unes après les autres. En l’état actuel, il apparaît donc que les îles ne sont plus que l’ombre d’elles-mêmes, nécessitant un regard avisé sur leur ancestralité afin de mieux cerner les processus naturels singuliers s’y produisant depuis des dizaines de millions d’années, dont les nains et géants insulaires occupent fièrement le rôle de porte-étendard. Bien qu’il soit évident aujourd’hui de relier de telles populations insulaires à leur lignée continentale entre autres grâce à des outils perfectionnés jusqu’à l’échelle moléculaire, il n’en va pas ainsi dès que l’on considère des espèces éteintes et ce d’autant plus que leur extinction nous est éloignée. L’identification d’individus nains ou géants est particulièrement compromise par la nature du registre fossile, c’est-à-dire des fossiles incomplets, retrouvés dans un contexte paléoécologique flou, sans filiation actuelle ou aux relations ancêtres-insulaires incertaines. La paléohistologie osseuse permet de s’y retrouver dans ce brouillard intrinsèque à la paléontologie et propose des reconstructions des îles du passé bénéfiques pour celles de demain.
37Les sauropodes nains insulaires sont un cas d’école vu le nanisme insulaire indubitable qu’ils ont évolué : rien que les dimensions absolues font foi, amenant ces sauropodes jusqu’à 2% de la masse ancestrale dans les cas les plus extrêmes. Ces nains, aussi discrets parmi les sauropodes que le nez au milieu du visage, ouvrent une porte sur l’analyse des tissus osseux traduisant les dynamiques et stratégies de croissance qui permettra une meilleure compréhension d’autres groupes pour lesquels le nanisme est bien moins flagrant. Les retombées sont variées et s’appliquent tant aux espèces éteintes qu’actuelles : avancement des connaissances (paléo)histologiques pour le besoin de la compréhension du signal contenu dans l’os, affinement de la loi insulaire et expansion de son champ d’application, révision du concept du nain insulaire ainsi que sa contextualisation évolutive, ou encore les processus évolutifs sous-jacents du nanisme au cas par cas.
38Les perspectives de la paléohistologie osseuse des taxons insulaires sont encourageantes pour l’avenir. L’identification des stratégies de développement de ces espèces permettra une meilleure détection et contextualisation tant évolutive qu’écologique de ces organismes fantastiques dans leur environnement naturel et fournira donc un réel outil prédictif de l’évolution de la biodiversité. Prévoir les changements ainsi que leur direction et intensité est un atout majeur lorsqu’il s’agit de conservation des espèces fragiles dans des milieux finis dans le temps et l’espace, et dont les écosystèmes perturbés ne vont pas en s’améliorant, le réchauffement climatique et ses conséquences directes sur les écosystèmes en tête de proue.
Remerciements
39Je remercie en premier lieu mes promoteurs Prof. Valentin Fischer et Prof. Philippe Claeys pour avoir parrainé et soutenu ma participation au Prix annuel de la Société Royale des Sciences de Liège. J’aimerais ensuite remercier chaleureusement mon frère Jérôme Jentgen (Khimaerai) pour son aide concernant l’élaboration des figures ainsi que ma fiancée Kelly Rensonnet et ma mère Esmeralda Ceschino pour leur aide logistique et leur soutien indéfectible. De manière plus large, j’adresse aussi mes remerciements à l’équipe internationale composée de Verónica Díez Díaz, Géraldine Garcia, Xabier Pereda Suberbiola, Koen Stein, Pascal Godefroit et Xavier Valentin pour m’avoir éveillé à la question des sauropodes nains insulaires et des mystères qui les entourent au cours de ma thèse de doctorat. Enfin, je remercie chaleureusement le reviewer anonyme dont les remarques et conseils constructifs ont significativement rehaussé la qualité du manuscrit.
Informations complémentaires
40Identifiant ORCID de l’auteur
41Benjamin Jentgen-Ceschino 0000-0002-8972-7569
42Contribution de chaque auteur
43BJ-C a conceptualisé, écrit et produit l’article dans son intégralité.
44Déclaration relative aux conflits d’intérêt
45L’auteur déclare l’absence de tout conflit d’intérêt.
Bibliographie
Adler, G.H. et Levins, R. (1994) The island syndrome in rodent populations. The Quaternary Review of Biology 69 (4), 473-490. https://doi.org/10.1086/418744
Adnet, S., Amiot, R., Claude, J., Clausen, S., Decombeix, A.-L., Fernandez, V., Métais, G., Meyer-Berthaud, B., Muller, S., Senut, B. & Tortosa, T. (2013) Principes de paléontologie. Dunod, Paris.
Aguilée, R., Pellerin, F., Soubeyrand, M., Choin, J. et Thébaud, C. (2021) Biogeographic drivers of community assembly on oceanic islands: the importance of archipelago structure and history. Journal of Biogeography 48 (10), 1-13. https://doi.org/10.1111/jbi.14228
Allain, R. (2012) Histoire des dinosaures. Perrin, Paris.
Allen, M.R. & Burr, D.B. (2019) Bone growth, modeling, and remodeling. In: Burr, D.B. et Allen, M.R. (Eds). Basic and applied bone biology, 2nd edition. London, Elsevier, 85-100. https://doi.org/10.1016/B978-0-12-813259-3.00005-1
Amprino, R. (1947) La structure du tissu osseux envisagée comme expression de différences dans la vitesse de l’accroissement. Archives de Biologie 58 (4), 315-330.
Athanassiou, A., van der Geer, A.A.E. et Lyras, G.A. (2019) Pleistocene insular Proboscidea of the Eastern Mediterranean: a review and update. Quaternary Science Reviews 218, 306-321. https://doi.org/10.1016/j.quascirev.2019.06.028
Baeckens, S. et Van Damme, R. (2020). The island syndrome, Current Biology 30 (8), R338-R339. https://doi.org/10.1016/j.cub.2020.03.029
Bailleul, A.M., Zheng, W., Horner, J.R., Hall, B.K., Holliday, C.M. et Schweitzer, M.H. (2020) Evidence of proteins, chromosomes and chemical markers of DNA in exceptionally preserved dinosaur cartilage. National Science Review 7 (4), 815-822. https://doi.org/10.1093/nsr/nwz206
Benítez-López, A., Santini, L., Gallego-Zamorano, J., Milá, B., Walkden, P., Huijbregts, M.A.J. et Tobias, J.A. (2021) The island rule explains consistent patterns of body size evolution in terrestrial vertebrates. Nature Ecology & Evolution 5 (6), 768-786. https://doi.org/10.1038/s41559-021-01426-y
Benton, M.J. et Harper, D.A.T. (2009) Introduction to paleobiology and the fossil record. Oxford, Blackwell.
Benton, M.J., Csiki, Z., Grigorescu, D., Redelstorff, R., Sander, P.M., Stein, K. et Weishampel, D.B. (2010) Dinosaurs and the island rule: the dwarfed dinosaurs from Haţeg Island. Palaeogeography, Palaeoclimatology, Palaeoecology 293 (3-4), 438-454. https://doi.org/10.1016/j.palaeo.2010.01.026
Biddick, M. et Burns, K.C. (2019) Reply to Brian and Walker-Hale: support for the island rule does not hide morphological disparity in insular plants. PNAS 116 (50), 24931-24932. https://doi.org/10.1073/pnas.1917767116
Biddick, M., Hutton, I. et Burns, K.C. (2018). An alternative water transport system in land plants. Proceedings of the Royal Society B 285, 20180995. https://doi.org/10.1098/rspb.2018.0995
Blackburn, T.M. et Gaston, K.J. (2005) Chapter 4: Biological invasions and the loss of birds on islands: insights into the idiosyncrasies of extinction. In: Sax, D.F., Stachowicz J.J. et Gaines, S.D. (Eds). Species invasions: insights into ecology, evolution, and biogeography. Sinauer Associates Inc., Sunderland, 85-110.
Bourdon, E., Castanet, J., de Ricqlès, A., Scofield, P., Tennyson, A., Lamrous, H. et Cubo J. (2009) Bone growth marks reveal protracted growth in New Zealand kiwi (Aves, Apterygidae). Biology Letters 5 (5), 639-642. https://doi.org/10.1098/rsbl.2009.0310
Boyer, A.G. et Jetz W. (2014) Extinctions and the loss of ecological function in island bird communities. Global Ecology and Biogeography 23 (6), 679-688. https://doi.org/10.1111/geb.12147
Bromage, T.G., Dirks, W., Erdjument-Bromage, H., Huck, M., Kulmer, O., Öner, R., Sandrock, O. et Schrenk, F. (2002) A life history and climate change solution to the evolution and extinction of insular dwarfs: a Cypriot experience. In: Waldren, W.H. et Ensenyat, J.A. (Eds). World islands in prehistory. Oxford, Archaeopress, 420-427.
Brusatte, S. (2018) The rise and fall of the dinosaurs: a new history of a lost world. William Morrow, New York.
Buffetaut, E. (2013) A quoi servent les dinosaures ? Manifeste le pommier !, Paris.
Buffetaut, E., Grigorescu, D. et Csiki, Z. (2002) A new giant pterosaur with a robust skull from the latest Cretaceous of Romania. Naturwissenschaften 89, 180-184. https://doi.org/10.1007/s00114-002-0307-1
Burns, K.C. (2019) Evolution in isolation, the search for an island syndrome in plants. Cambridge University Press, Cambridge. https://doi.org/10.1017/9781108379953
Campione, N.E. et Evans, D.C. (2012) A universal scaling relationship between body mass and proximal limb bone dimensions in quadrupedal terrestrial tetrapods. BMC Biology 10, 60. https://doi.org/10.1186/1741-7007-10-60
Carballido, J.L., Pol, D., Otero, A., Cerda, I.A., Salgado, L., Garrido, A.C., Ramezani, J., Cúneo, N.R. et Krause, J.M. (2017) A new giant titanosaur sheds light on body mass evolution among sauropod dinosaurs. Proceedings of the Royal Society B 284 (1860), 20171219. https://doi.org/10.1098/rspb.2017.1219
Carballido, J.L., Scheil, M., Knötschke, N. et Sander, P.M. (2020) The appendicular skeleton of the dwarf macronarian sauropod Europasaurus holgeri from the Late Jurassic of Germany and a re-evaluation of its systematic affinities. Journal of Systematic Palaeontology 18 (9), 739-781. https://doi.org/10.1080/14772019.2019.1683770
Carbone, C., Mace, G.M., Roberts, S.C. et Macdonald, D.W. (1999) Energetic constraints on the diet of terrestrial carnivores. Nature 402, 286-288. https://doi.org/10.1038/46266
Carpenter, K. (1999) Eggs, nests, and baby dinosaurs. Indiana University Press, Bloomington.
Case, T.J. (1978) A general explanation for insular body size trends in terrestrial vertebrates. Ecology 59 (1), 1-18. https://doi.org/10.2307/1936628
Castilla-Beltrán, A., de Nascimento, L., Fernández-Palacios, J.M., Whittaker, R.J., Willis, K.J., Edwards, M. et Nogué, S. (2021) Anthropogenic transitions from forested to human- dominated landscapes in southern Macaronesia. PNAS 118 (40), e2022215118. https://doi.org/10.1073/pnas.2022215118
Cerda, I.A., Chinsamy, A., Pol, D., Apaldetti, C., Otero, A., Powell, J.E. et Martínez, R.N. (2017) Novel insight into the origin of the growth dynamics of sauropod dinosaurs. PLoS ONE 12 (6), e0179707. https://doi.org/10.1371/journal.pone.0179707
Chiappe, L., Coria, R., Dingus, L., Jackson, F., Chinsamy, A. et Fox, M. (1998) Sauropod dinosaur embryos from the Late Cretaceous of Patagonia. Nature 396, 258–261. https://doi.org/10.1038/24370
Chiappe, L.M., Salgado, L. et Coria, R.A. (2001) Embryonic skulls of titanosaur sauropod dinosaurs. Science 293 (5539), 2444-2446. https://doi.org/10.1126/science.1063723
Chiarenza, A.A., Fabbri, M., Consorti, L., Muscioni, M., Evans, D.C., Cantalapiedra, J.L. et Fanti, F. (2021) An Italian dinosaur Lagerstätte reveals the tempo and mode of hadrosauriform body size evolution. Scientific Reports 11, 23295. https://doi.org/10.1038/s41598-021-02490-x
Chinsamy, A. et Hillenius, W.J. (2004) Physiology of nonavian dinosaurs. In: Weishampel, D.B., Dodson, P. et Osmólska, H. (Eds). The Dinosauria, 2nd edition. University of California Press, Berkeley, 643-659.
Chinsamy-Turan, C. (2005) The microstructure of dinosaur bone. Deciphering biology with fine-scale techniques. Baltimore, The Johns Hopkins University Press.
Clauss, M. (2011) Chapter 1: sauropod biology and the evolution of gigantism: what do we know? In: Klein, N., Remes, K., Gee, C.T. et Sander, P.M. (Eds). Biology of the sauropod dinosaurs. Indiana University Press, Bloomington, 3-7.
Company, J. (2011) Bone histology of the titanosaur, Lirainosaurus astibiae (Dinosauria: Sauropoda) from the latest Cretaceous of Spain. Naturwissenschaften 98, 67-78. https://doi.org/10.1007/s00114-010-0742-3
Corfield, J.R., Gsell, A.C., Brunton, D., Heesy, C.P., Hall, M.I., Acosta, M.L. et Iwaniuk, A.N. (2011) Anatomical specializations for nocturnality in a critically endangered parrot, the kakapo (Strigops habroptilus). PLoS ONE 6, e22945. https://doi.org/10.1371/journal.pone.0022945
Csiki, Z., Vremir, M., Brusatte, S.L. et Norell, M.A. (2010) An aberrant island-dwelling theropod dinosaur from the Late Cretaceous of Romania. PNAS 107 (35), 15357-15361. https://doi.org/10.1073/pnas.1006970107
Csiki-Sava, Z., Vremir, M., Meng, J., Brusatte, S.L. et Norell, M.A. (2018) Dome-headed, small-brained island mammal from the Late Cretaceous of Romania. PNAS 115 (19), 4857-4862. https://doi.org/10.1073/pnas.1801143115
Csiki-Sava, Z., Buffetaut, E., Ösi, A., Pereda-Suberbiola, X. et Brusatte S.L. (2015) Island life in the Cretaceous – faunal composition, biogeography, evolution, and extinction of land-living vertebrates on the Late Cretaceous European archipelago. ZooKeys 469, 1-161. https://doi.org/10.3897/zookeys.469.8439
Curry Rogers, K. et Erickson, G.M. (2005) Sauropod histology. In: Curry Rogers, K. et Wilson, J.A. (Eds). The sauropods: evolution and paleobiology. University of California Press, Berkeley, 303-326
Curry Rogers, K. et Kulik, Z. (2018) Osteohistology of Rapetosaurus krausei (Sauropoda: Titanosauria) from the Upper Cretaceous of Madagascar. Journal of Vertebrate Paleontology 38 (4), e1493689. https://doi.org/10.1080/02724634.2018.1493689
Curry Rogers, K., Whitney, M., D’Emic, M. et Bagley, B. (2016) Precocity in a tiny titanosaur from the Cretaceous of Madagascar. Science 352 (6284), 450-453. https://doi.org/10.1126/science.aaf1509
Curtin, A. J., Macdowell, A.A., Schaible E.G. et Roth, V.L. (2012) Noninvasive histological comparison of bone growth patterns among fossil and extant neonatal elephantids using synchrotron radiation x-ray microtomography. Journal of Vertebrate Paleontology 32 (4), 939–955. https://doi.org/10.1080/02724634.2012.672388
Damuth, J. et MacFadden, B.J. (1990) Body size in mammalian paleobiology: estimations and biological implication. Cambridge, Cambridge University Press.
Darwin, C. R. (1860) Journal of researches into the natural history and geology of the countries visited during the voyage of H.M.S. Beagle round the world. London, John Murray.
de Buffrénil, V. et Quilhac, A. (2021) Bone remodeling. In: de Buffrénil, V., de Ricqlès, A.J., Zylberberg, L. et Padian, K. (Eds). Vertebrate skeletal histology and paleohistology. CRC Press, Boca Raton, 229-246.
Delson, E., Terranova, C.J., Jungers, W.L., Sargis, E.J., Jablonski, N.G. et Dechow P.C. (2000) Body mass in Cercopithecidae (primates, mammalia), estimation and scaling in estimation and scaling in extinct and extant taxa. American Museum of Natural History, Antropological Papers 83, 1–159.
Denno, R.F., Hawthorne, D.J., Thorne, B.L. et Gratton, C. (2001) Reduced flight capability in British Virgin Island populations of a wing-dimorphic insect: the role of habitat isolation, persistence, and structure. Ecological Entomology 26 (1), 25-36. https://doi.org/10.1046/j.1365-2311.2001.00293.x
de Ricqlès, A.J. (2021) Paleohistology: An historical – bibliographical introduction. In: de Buffrénil, V., de Ricqlès, A.J., Zylberberg, L. et Padian, K. (Eds). Vertebrate skeletal histology and paleohistology. CRC Press, Boca Raton, 3-26.
de Souza Barbosa, F.H., da Costa Pereira, P.V.L.G., Bergqvist, L.P. et Rothschild, B.M. (2016) Multiple neoplasms in a single sauropod dinosaur from the Upper Cretaceous of Brazil. Cretaceous Research 62, 13–17. https://doi.org/10.1016/j.cretres.2016.01.010
Díez Díaz, V. (2022) Titanosaur boom. Nature Ecology and Evolution 6, 251-252. https://doi.org.10.1038/s41559-022-01677-3
Díez Díaz, V., Garcia, G., Pereda-Suberbiola, X., Jentgen-Ceschino, B., Stein, K., Godefroit, P. et Valentin, X. (2018) The titanosaurian dinosaur Atsinganosaurus velauciensis (Sauropoda) from the Upper Cretaceous of southern France: new material, phylogenetic affinities, and palaeobiogeographical implications. Cretaceous Research 91, 429-456. https://doi.org/10.1016/j.cretres.2018.06.015
Díez Díaz, V., Garcia, G., Pereda-Suberbiola, X., Jentgen-Ceschino, B., Stein, K., Godefroit, P. et Valentin, X. (2021) A new titanosaur (Dinosauria: Sauropoda) from the Upper Cretaceous of Velaux-La-Bastide Neuve (southern France). Historical Biology 33 (11). https://doi.org/10.1080/08912963.2020.1841184
Dirks, W., Bromage, T.G. et Agenbroad, L.D. (2012) The duration and rate of molar plate formation in Palaeoloxodon cypriotes and Mammuthus columbi from dental histology. Quaternary International 255, 79-85. https://doi.org/10.1016/j.quaint.2011.11.002
Di Stefano, G. et Petronio, C. (2021) Importance of the morphological plasticity of Cervus elaphus in the biochronology of the Middle and Late Pleistocene of the Italian peninsula. The Science of Nature 108 (5), 40. https://doi.org/10.1007/s00114-021-01753-x
Dobreva, M.P., Camacho, J. et Abzhanov, A. (2021) Time to synchronize our clocks: connecting developmental mechanisms and evolutionary consequences of heterochrony. Journal of Experimental Zoology Part B:Molecular and Developmental Evolution 338 (1-2), 87-106. https://doi.org/10.1002/jez.b.23103
Dodson, P. (1990) Dinosaur paleobiology. In: Weishampel, D.B., Dodson, P. et Osmólska, H. (Eds). The Dinosauria, 1st edition. University of California Press, Berkeley.
Faurby, S. et Svenning, J.-C. (2016) Resurrection of the island rule: human-driven extinctions have obscured a basic evolutionary pattern. The American Naturalist 187 (6), 812-820. https://doi.org/10.1086/686268
Fernández-Palacios, J. M., Kreft, H., Irl, S.D.H., Norder, S., Ah-Peng, C., Borges, P.A.V., Burns, K.C., de Nascimento, L., Meyer, J.-Y., Montes, E. et Drake, D.R. (2021) Scientists’ warning – the outstanding biodiversity of islands is in peril. Global Ecology and Conservation 31, e01847. https://doi.org/10.1016/j.gecco.2021.e01847
Foster, J.B. (1964) Evolution of mammals on islands. Nature 202, 234-235. https://doi.org/10.1038/202234a0
Francillon-Vieillot, H., de Buffrénil, V., Castanet, J., Geraudie, J., Meunier F.J., Sire, J.Y., Zylberberg, L. et de Ricqlès, A. (1990) Microstructure and mineralization of vertebrate skeletal tissue. In: Carter, J.G. (Ed.). Skeletal biomineralization patterns, processes and evolutionary trends. Van Nostrand Reinhold, New York, 471-548.
Fromm, A. et Meiri, S. (2021) Big, flightless, insular and dead: characterising the extinct birds of the Quaternary. Journal of Biogeography 48 (9), 2350-2359. https://doi.org/10.1111/jbi.14206
García, R.A., Cerda, I.A., Heller, M., Rothschild, B.M. et Zurriaguz, V. (2017) The first evidence of osteomyelitis in a sauropod dinosaur. Lethaia 50 (2), 227–236. https://doi.org/10.1111/let.12189
Giovinazzo, C., Altamura, S. et Palombo, M.R. (2006) Determinazione della massa corporea nei ruminanti di media e piccolo taglia: un nuovo approccio metodologico. In: Fonda G., Melis R. & Romano R. (Eds). Abstracts Giornate Paleontologia 2006, Trieste 8–10 giugno, 39.
Gonzalez, R., Gallina, P.A. et Cerda, I.A. (2017) Multiple paleopathologies in the dinosaur Bonitasaura salgadoi (Sauropoda: Titanosauria) from the Upper Cretaceous of Patagonia, Argentina. Cretaceous Research 79, 159–170. https://doi.org/10.1016/j.cretres.2017.07.013
Gould, S.J. (1998) La vie est belle : les surprises de l’évolution. Editions Points, Paris.
Gould, G.C. et MacFadden, B.J. (2004) Gigantism, dwarfism, and Cope’s Rule: “Nothing in evolution makes sense without a phylogeny. Bulletin of the American Museum of Natural History 2004 (285), 219-237. https://doi.org/10.1206/0003-0090(2004)285<0219:C>2.0.CO;2
Grant, P.R. (1998) Evolution on islands. Oxford University Press, Oxford.
Griebeler, E.M., Klein, N. et Sander, P.M. (2013) Aging, maturation and growth of sauropodomorph dinosaurs as deduced from growth curves using long bone histological data: an assessment of methodological constraints and solutions. PLoS ONE 8 (6), e67012. https://doi.org/10.1371/journal.pone.0067012
Hallett, M. et Wedel, M.J. (2016) The sauropod dinosaurs, life in the age of giants. Johns Hopkins University Press, Baltimore.
Heaney, L.R. (1978) Island area and body size of insular mammals: evidence from the tri-colored squirrel (Callosciurus prevosti) of Southeast Asia. Evolution 32 (1), 29-44. https://doi.org/10.2307/2407408
Hooft van Huysduynen, A., Janssens, S., Merckx, V., Vos, R., Valente, L., Zizka, A., Larter, M., Karabayir, B., Maaskant, D., Witmer, Y., Fernández-Palacios, J.M., de Nascimento, L., Jaèn-Molina, R., Caujapé Castells, J., Marrero-Rodríguez, Á., del Arco, M. et Lens, F. (2021) Temporal and palaeoclimatic context of the evolution of insular woodiness in the Canary Islands. Ecology and Evolution 11 (17), 12220-12231. https://doi.org/10.1002/ece3.7986
Houssaye, A., Davesne D. et Canoville, A. (2021) A methodological renaissance to advance perennial issues in vertebrate paleohistology. In: de Buffrénil, V., de Ricqlès, A.J., Zylberberg, L. et Padian, K. (Eds). Vertebrate skeletal histology and paleohistology. CRC Press, Boca Raton, 793-798.
Huttenlocker, A.K., Woodward, H. et Hall, B.K. (2013) The biology of bone. In: Padian K. & Lamm E.-T. (Eds). Bone histology of fossil tetrapods. Berkeley, University of California Press, 13-34.
Irl, S.D.H., Schweiger, A.H., Steinbauer, M.J., Ah-Peng, C., Arévalo, J.R., Beierkuhnlein, C., Chiarucci, A., Daehler, C.C., Fernández-Palacios, J.M., Flores, O., Kueffer, C., Madĕra, P., Otto, R., Schweiger, J.M.-I., Strasberg, D. et Jentsch, A. (2021) Human impact, climate and dispersal strategies determine plant invasion on islands. Journal of Biogeography 48 (8), 1889-1903. https://doi.org/10.1111/jbi.14119
Itescu, Y., Schwarz, R., Donihue, C.M., Slavenko, A., Roussos, S.A., Sagonas, K., Valakos, E.D., Foufopoulos, J., Pafilis, P.et Meiri, S. (2018) Inconsistent patterns of body size evolution in co-occuring island reptiles. Global Ecology and Biogeography 27 (5), 538-550. https://doi.org/10.1111/geb.12716
Jentgen-Ceschino, B., Stein, K. et Fischer, V. (2020). Case study of radial fibrolamellar bone tissues in the outer cortex of basal sauropods. Philosophical Transactions of the Royal Society B 375, 20190143. https://doi.org.10.1098/rstb.2019.0143
Jianu, C.-M. et Weishampel, D.B. (1999) The smallest of the largest: a new look at possible dwarfing in sauropod dinosaurs. Geologie en Mijnbouw 78, 335-343. https://doi.org/10.1023/A:1003855416962
Jordana, X. et Köhler, M. (2011) Enamel microstructure in the fossil bovid Myotragus balearicus (Majorca, Spain): implications for life-history evolution of dwarf mammals in insular ecosystems. Palaeogeography, Palaeoclimatology, Palaeoecology 300 (1-4), 59-66. https://doi.org/10.1016/j.palaeo.2010.12.008
Kaiho, K., Oshima, N., Adachi, K., Adachi, Y., Mizukami, T., Fujibayashi, M. et Saito, R. (2016) Global climate change driven by soot at the K-Pg boundary as the cause of the mass extinction. Scientific Reports 6, 28427. https://doi.org/10.1038/srep28427
Karagkouni, M., Sfenthourakis, S. et Meiri, S. (2017) The island rule is not valid in terrestrial isopods (Crustacea: Oniscidea). Journal of Zoology 301 (1), 11-16. https://doi.org/10.1111/jzo.12393
Keller, G., Mateo, P., Punekar, J., Khozyem, H., Gertsch, B., Spangenberg, J., Bitchong, A.M. et Adatte, T. (2018) Environmental changes during the Cretaceous-Paleogene mass extinction and Paleocene-Eocene Thermal Maximum: implications for the Anthropocene. Gondwana Research 56, 69-89. https://doi.org/10.1016/j.gr.2017.12.002
Klein, N. et Sander, M. (2008) Ontogenetic stages in the long bone histology of sauropod dinosaurs. Paleobiology 34 (2), 247-263. https://doi.org/10.1666/0094-8373(2008)034[0247:OSITLB]2.0.CO;2
Klein, N., Sander, M. et Suteethorn, V. (2009) Bone histology and its implications for the life history and growth of the Early Cretaceous titanosaur Phuwiangosaurus sirindhornae. Geological society, London, Special Publications 315 (1), 217-228. https://doi.org/10.1144/SP315.15
Klein, N., Sander, P.M., Stein, K., Le Loeuff, Jean, Carballido, J.L. et Buffetaut, E. (2012) Modified Laminar Bone in Ampelosaurus atacis and other titanosaurs (Sauropoda): implications for life history and physiology. PLoS ONE 7 (5), e36907. https://doi.org/10.1371/journal.pone.0036907
Köhler, M. (2010) Fast or slow? The evolution of life history traits associated with insular dwarfing. In: Pérez-Mellado, V. et Ramon, C. (Eds). Islands and evolution. Institut Menorqui d’Estudis, Recerca, 261-280.
Köhler, M. et Moyà-Solà, S. (2004) Reduction of brain and sense organs in the fossil insular bovid Myotragus, Brain. Behavior and Evolution 63 (3), 125-140. https://doi.org/10.1159/000076239
Köhler, M. et Moyà-Solà, S. (2009) Physiological and life history strategies of a fossil large mammal in a resource limited environment. PNAS 106 (48), 20354-20358. https://doi.org/10.1073/pnas.0813385106
Lamm, E.-T. (2013) Preparation and sectioning of specimens. In: Padian K. & Lamm E.-T. (Eds). Bone histology of fossil tetrapods. Berkeley, University of California Press, 55-160.
Larramendi, A. et Palombo, M.R. (2015) Body size, biology and encephalization quotient of Palaeoloxodon ex gr. P. falconeri from Spiganallo Cave (Hyblean plateau, Sicily), Hystrix. the Italian Journal of Mammology 26 (2), 102-109. https://doi.org/10.4404/hystrix-26.2-11478
Lawlor, T.E. (1982) The evolution of body size in mammals: evidence from insular populations in Mexico. The American Naturalist 119 (1), 54-72.
Lehman, T.M. et Woodward, H.N. (2008) Modeling growth rates for sauropod dinosaurs. Paleobiology 34 (2), 264-281. https://doi.org/10.1666/0094-8373(2008)034[0264:MGRFSD]2.0.CO;2
Leihy, R.I. et Chown, S.L. (2020) Wind plays a major but not exclusive role in the prevalence of insect flight loss on remote islands. Proceedings of the Royal Society B 287 (1940), 20202121. https://doi.org/10.1098/rspb.20202121
Lethiers, F. (2001) Evolution de la biosphère et événements géologiques. Gordon & Breach, Amsterdam.
Lister, A.M. (1996) Dwarfing in island elephants and deer: processes in relation to time of isolation. Symposia of the Zoological Society of London 69, 277-292.
Lokatis, S. et Jeschke, J.M. (2018) The island rule: an assessment of biases and research trends. Journal of Biogeography 45 (2), 289-303. https://doi.org/10.1111/jbi.13160
Lomolino, M.V. (1985) Body size of mammals on islands: the island rule reexamined. The American Naturalist 125 (2), 310-316. https://doi.org/10.1086/284343
Lomolino, M.V. (2005) Body size evolution in insular vertebrates: generality of the island rule. Journal of Biogeography 32 (10), 1683-1699. https://doi.org/10.1111/j.1365-2699.2005.01314.x
Lomolino, M.V., Sax, D.F., Palombo, M.R. et van der Geer, A.A. (2012) Of mice and mammoths: evaluations of causal explanations for body size evolution in insular mammals. Journal of Biogeography 39 (5), 842-854. https://doi.org/10.1111/j.1365-2699.2011.02656.x
Lomolino, M.V., van der Geer, A.A., Lyras, G.A., Palombo, M.R., Sax, D.F. et Rozzi, R. (2013) Of mice and mammoths: generality and antiquity of the island rule. Journal of Biogeography 40 (8), 1427-1439. https://doi.org/10.1111/jbi.12096
Lomolino, M.V., Riddle, B.R. et Whittaker, R.J. (2017) Biogeography: biological diversity across space and time, 5th edition. Sinauer Associates Inc., Sunderland.
Losos, J.N. et Ricklefs, R.E. (2010) The Theory of Island Biogeography revisited. Princeton, Princeton University Press.
Louys, J., Braje, T.J., Chang, C.-H., Cosgrove, R., Fitzpatrick, S.M., Fujita, M., Hawkins, S., Ingicco, T., Kawamura, A., MacPhee, R.D.E., McDowell, M.C., Meijer, H.J.M., Piper, P.J., Roberts, P., Simmons, A.H., van den Bergh, G., van der Geer, A., Kealy, S. et O’Connor, S. (2021) No evidence for widespread island extinctions after Pleistocene hominin arrival. PNAS 118 (20), e2023005118. https://doi.org/10.1073/pnas.2023005118
Lyras, G.A. (2018) Brain changes during phyletic dwarfing in elephants and hippos, Brain, Behavior and Evolution 92 (3-4), 167-181. https://doi.org/10.1159/000497268
Lyras, G.A., van der Geer, A.A.E., Dermitzakis, M.D. et de Vos, J. (2006) Cynotherium sardous, an insular canid (Mammalia: Carnivora) from the Pleistocene of Sardinia (Italy), and its origin. Journal of Vertebrate Paleontology 26 (3), 735-745. https://doi.org/10.1671/0272-4634(2006)26[735:CSAICM]2.0.CO;2
Lyras, G.A., van der Geer, A.A.E. et Rook, L. (2010) Body size of insular carnivores: evidence from the fossil record. Journal of Biogeography 37 (6), 1007-1021. https://doi.org/10.1111/j.1365-2699.2010.02312.x
MacArthur, R.H. et Wilson, E.O. (1967) The theory of island biogeography. Princeton University Press, Princeton.
Marshall, A. (2021) Dinosaures, animaux préhistoriques et … mythes grecs ! Mondes Antiques.
Marshall, L.G. et Corruccini, R.S. (1978) Variability, evolutionary rates, and allometry in dwarfing lineages. Paleobiology 4 (2), 101-119. https://doi.org/10.1017/S0094837300005790
Matthews, T.J. et Triantis, K. (2021) Island biogeography. Current Biology 31 (19), R1201-1207. https://doi.org/10.1016/j.cub.2021.07.033
McNab, B.K. (2002) Minimizing energy expenditure facilitates vertebrate persistence on oceanic islands. Ecology Letters 5 (5), 693-704. https://doi.org/10.1046/j.1461-0248.2002.00365.x
McNamara, K.J. (2003) Importance of heterochrony. In: Briggs, D.E.G. et Crowther, P.R. (Eds). Palaeobiology II. Oxford, Blackwell, 180-188.
McNamara, K.J. (2012) Heterochrony: the evolution of development. Evolution: Education and Outreach 5 (2), 203-218. https://doi.org/10.1007/s12052-012-0420-3
McNamara, K.J. et Long, J.A. (2012) The role of heterochrony in dinosaur evolution. In: Brett-Surman, M.K., Holtz, T.R. Jr et Farlow, J.O. (Eds). The complete dinosaur, 2nd edition. Indiana University Press, Bloomington, 761-784
Meiri, S., Dayan, T. et Simberloff, D. (2004) Body size of insular carnivores: little support for the Island Rule. The American Naturalist 163 (3), 469-479. https://doi.org/10.1086/382229
Meiri, S., Cooper, N. et Purvis, A. (2008) The island rule: made to be broken?. Proceedings of the Royal Society B 275 (1631), 141-148. https://doi.org/10.1098/rspb.2007.1056
Mitchell, J. et Sander, P.M. (2014) The three-front model: a developmental explanation of long bone diaphyseal histology of Sauropoda. Biological Journal of the Linnean Society 112 (4), 765-781. https://doi.org/10.1111/bij.12324
Mitchell, J., Sander, P.M. et Stein, K. (2017) Can secondary osteons be used as ontogenetic indicators in sauropods? Extending the histological ontogenetic stages into senescence. Paleobiology 43 (2), 321-342. https://doi.org/10.1017/pab.2016.47
Morgan, J.V., Bralower, T.J., Brugger, J., Wünnemann K. (2022) The Chicxulub impact and its environmental consequences. Nature Reviews Earth and Environment 3, 338–354. https://doi.org/10.1038/s43017-022-00283-y
Nacarino-Meneses, C. et Orlandi-Oliveras, G. (2021) The life history of European Middle Pleistocene equids, first insights from bone histology. Historical Biology 33 (5), 672-682. https://doi.org/10.1080/08912963.2019.1655011
Nogué, S., Santos, A.M.C., Birks, H.J.B., Connor, S., de Boer, E.J., de Nascimento, L., Fernández-Palacios, J.M., Froyd, C.A., Haberle, S.G., Ljung, K., Norder, S.J., Peñuelas, J., Prebble, M., Whittaker, R.J., Willis, K.J. et Wilmshurst, J.M. (2021) The human dimension of biodiversity changes on islands. Science 372 (6541), 488-491. https://doi.org/10.1126/science.abd6706
Orlandi-Oliveras, G., Nacarino-Meneses, C., Koufos, G.D. et Köhler, M. (2018) Bone histology provides insights into the life history mechanisms underlying dwarfing in hipparionins. Scientific Reports 8 (1), 17203. https://doi.org/10.1038/s41598-018-35347-x
Ösi, A., Prondvai, E., Butler, R. et Weishampel, D.B. (2012) Phylogeny, histology and inferred body size evolution in a new rhabdodontid dinosaur from the Late Cretaceous of Hungary. PLoS ONE 7 (9), e44318. https://doi.org/10.1371/journal.pone.0044318
Padian, K. (2013) Why study the bone microstructure of fossil tetrapods? In: Padian K. & Lamm E.-T. (Eds). Bone histology of fossil tetrapods. Berkeley, University of California Press, 1-11.
Padian, K. et Woodward, H.N. (2021). Archosauromorpha : Avemetatarsalia – dinosaurs and their relatives. In: de Buffrénil, V., de Ricqlès, A.J., Zylberberg, L. et Padian, K. (Eds). Vertebrate skeletal histology and paleohistology. CRC Press, Boca Raton, 511-549.
Palombo, M.R. (2009) Body size structure of Pleistocene mammalian communities: what support is there for the “island rule”?. Integrative Zoology 4 (4), 341-356. https://doi.org/10.1111/j.1749-4877.2009.00175.x
Palombo, M.R. et Giovinazzo, C. (2005) Elephas falconeri from Spinagallo Cave (southeastern Sicily, Hyblean Plateau, Siracusa): brain to body weight comparison. Monografies de la Societat d’Historia Natural de les Balears 12, 255–264.
Palombo, M.R. et Zedda, M. (2022) The intriguing giant deer from the Bate cave (Crete): could paleohistological evidence question its taxonomy and nomenclature. Integrative Zoology 17 (1), 54-77. https://doi.org/10.1111/1749-4877.12533
Prondvai, E., Stein, K.H.W., de Ricqlès, A. et Cubo, J. (2014) Development-based revision of bone tissue classification: the importance of semantics for science. Biological Journal of the Linnean Society 112 (4), 799–816. https://doi.org/10.1111/bij.12323
Prondvai, E., Kocsis, A.T., Abourachid, A., Adriaens, D., Godefroit, P., Hu, D.-Y. et Butler, R.J. (2022) Radial porosity profiles: a new bone histological method for comparative developmental analysis of diametric limb bone growth. Royal Society Open Science 9 (5), 211893. https://doi.org/10.1098/rsos.211893
Quammen, D. (2011) The song of the dodo, island biogeography in an age of extinction. Scribner, New York.
Quintana, J., Köhler, M. et Moyà-Solà, S. (2011) Nuralagus rex, gen. et sp. nov., an endemic insular giant rabbit from the Neogene of Minorca (Balearic Islands, Spain). Journal of Vertebrate Paleontology 31 (2), 231-240. https://doi.org/10.1080/02724634.2011.550367
Raia, P. et Meiri, S. (2006) The island rule in large mammals: paleontology meets ecology. Evolution 60 (8), 1731-1742. https://doi.org/10.1111/j.0014-3820.2006.tb00516.x
Reid, R.E.H. (2012) “Intermediate” dinosaurs: the case updated. In: Brett-Surman, M.K., Holtz, T.R. Jr et Farlow, J.O. (Eds). The complete dinosaur, 2nd edition. Indiana University Press, Bloomington, 873-921.
Romano, A., Séchaud, R. et Roulin, A. (2021) Evolution of wing length and melanin-based coloration in insular populations of a cosmopolitan raptor. Journal of Biogeography 48 (4), 961-973. https://doi.org/10.1111/jbi.14053
Rozzi, R., Varela, S., Bover, P. et Martin, J.M. (2020) Causal explanations for the evolution of low’ gear’ locomotion in insular ruminants. Journal of Biogeography 47 (10), 2274-2285. https://doi.org/10.1111/jbi.13942
Russel, J.C. et Kueffer, C. (2019) Island biodiversity in the Anthropocene. Annual Review of Environment and Resources 44, 31-60. https://doi.org/10.1146/annurev-environ-101718-033245
Sander, P.M. (2013) An Evolutionary Cascade Model for sauropod dinosaur gigantism –overview, update and tests. PLoS ONE 8 (10), e78573. https://doi.org/10.1371/journal.pone.0078573
Sander, P.M., Mateus, O., Laven, T. et Knötschke, N. (2006) Bone histology indicates insular dwarfism in a new Late Jurassic sauropod dinosaur. Nature 441 (7094), 739-741. https://doi.org/10.1038/nature04633
Sander, P. M., Klein, N., Stein, K. et Wings, O. (2011) Sauropod bone histology and its implications for sauropod biology. In: Klein N., Remes K., Gee C.T. & Sander P.M. (Eds). Biology of the sauropod dinosaurs. Understanding the life of giants. Indiana University Press, Bloomington, 276-302.
Sayol, F., Steinbauer, M.J., Blackburn, T.M., Antonelli, A. et Faurby, S. (2020) Anthropogenic extinctions conceal widespread evolution of flightlessness in birds. Science Advances 6 (49), eabb6095. https://doi.org/10.1126/sciadv.abb6095
Schweitzer, M.H., Zheng, W., Cleland, T.P. et Bern, M. (2013) Molecular analyses of dinosaur osteocytes support the presence of endogenous molecules, Bone 52 (1), 414-423. https://doi.org/10.1016/j.bone.2012.10.010
Scott, K.M. (1990) Postcranial dimension of ungulates as predictors of body mass. In: Damuth J. & MacFadden B.J. (Eds). Body size in mammalian paleobiology: estimations and biological implication. Cambridge, Cambridge University Press, 301–336.
Seeman, E. (2020) Modeling and remodeling: the cellular machinery responsible for bone’s material and structural strength during growth, aging, and drug therapy. In: Bilezikian J.P., Martin T.J., Clemens T.L. & Rosen C.J. (Eds). Principles of bone biology, 4th edition. Elsevier, Amsterdam, 245-274. https://doi.org/10.1016/B978-0-12-814841-9.00011-7
Simberloff, D. (2013) Invasive species: what everyone needs to know. Oxford University Press, Oxford.
Sondaar, P.Y. (1977) Insularity and its effect on mammal evolution. In: Hecht M.K., Goody P.C. & Hecht B.M. (Eds). Major patterns in vertebrate evolution. Plenum, New York, 671-707. https://doi.org/10.1007/978-1-4684-8851-7_23
Spalding, D.A.E. et Sarjeant, W.A.S. (2012) Dinosaurs: the earliest discoveries. The complete dinosaur, 2nd edition. 3-23.
Stein, K., Sander, M. (2009) Histological core drilling: a less destructive method for studying bone histology. In: Brown, M.A., Kane, J.F. et Parker, W.G. (Eds). Methods in Fossil Preparation: Proc. 1st Annual Fossil Preparation and Collections Symposium. Adama, AZ: Petrified Forest, 69–80. http://preparation.paleo.amnh.org/assets/FPCSvolume-Final.pdf
Stein, K. et Prondvai, E. (2014) Rethinking the nature of fibrolamellar bone: an integrative biological revision of sauropod plexiform bone formation. Biological Reviews 89 (1), 24-47. https://doi.org/10.1111/brv.12041
Stein, K., Csiki, Z., Curry Rogers, K., Weishampel, D.B., Redelstorff, R., Carballido, J.L. et Sander, P.M. (2010) Small body size and extreme cortical bone remodeling indicate phyletic dwarfism in Magyarosaurus dacus (Sauropoda: Titanosauria). PNAS 107 (20), 9258-9263. https://doi.org/10.1073/pnas.1000781107
Thomson, V.A., Mitchell, K.J., Eberhard, R., Dortch, J., Austin, J.J. et Cooper, A. (2018) Genetic diversity and drivers of dwarfism in extinct island emu populations. Biology Letters 14 (4), 20170617. https://doi.org/10.1098/rsbl.2017.0617
Turvey, S.T., Green, O.R. et Holdaway, R.N. (2005) Cortical growth marks reveal extended juvenile development in New Zealand moa. Nature 435 (7044), 940-943. https://doi.org/10.1038/nature03635
Upchurch, P. et Barrett, P.M. (2005) Phylogenetic and taxic perspectives on sauropod diversity. In: Curry Rogers, K. et Wilson, J.A. (Eds). The sauropods: evolution and paleobiology. University of California Press, Berkeley, 104-124.
Upchurch, P., Barrett, P.M. et Dodson, P. (2004) Sauropoda. In: Weishampel, D.B., Dodson, P. et Osmólska, H. (Eds). The Dinosauria, 2nd edition. University of California Press, Berkeley, 259-322.
van der Geer, A.A.E. (2014) Parallel patterns and trends in functional structures in extinct island mammals. Integrative Zoology 9 (2), 167-182. https://doi.org/10.1111/1749-4877.12066
Wallace, A. R. (1880) Island life, or the phenomena and causes of insular fauna and floras. London, McMillan.
Weishampel, D.B. et Jianu, C.-M. (2011) The Transylvanian dinosaur. The Johns Hopkins University Press, Baltimore.
Weston, E.M. et Lister, A.M. (2009) Insular dwarfism in hippos and a model for brain size reduction in Homo floresiensis. Nature 459 (7243), 85-88. https://doi.org/10.1038/nature07922
Whittaker, R.J., Fernández-Palacios, J.M., Matthews, T.J., Borregaard, M.K. et Triantis, K.A. (2017) Island biogeography: taking the long view of nature’s laboratories. Science 357 (6344), eaam8326. https://doi.org/10.1126/science.aam8326
Wiemann, J., Menéndez I., Crawford, J.M., Fabbri, M., Gauthier, J.A., Hull, P.M., Norell, M.A. et Briggs, D.E.G. (2022) Fossil biomolecules reveal an avian metabolism in the ancestral dinosaur. Nature. https://doi.org/10.1038/s41586-022-04770-6
Wilson, J.A. (2005) Overview of sauropod phylogeny and evolution. In: Curry Rogers, K. et Wilson, J.A. (Eds). The sauropods: evolution and paleobiology. University of California Press, Berkeley, 15-49.
Wilson, J.A. et Curry Rogers, K. (2005) Monoliths of the Mesozoic. In: Curry Rogers, K. et Wilson, J.A. (Eds). The sauropods: evolution and paleobiology. University of California Press, Berkeley, 1-14.
Wilson, J.A. et Curry Rogers, K. (2012) Sauropoda. In: Brett-Surman, M.K., Holtz, T.R. Jr et Farlow, J.O. (Eds). The complete dinosaur, 2nd edition. Indiana University Press, Bloomington, 445-481.
Worthy, T.H., Hand, S.J., Archer, M., Scofield, P. et De Pietri, V.L. (2019) Evidence for a giant parrot from the Early Miocene of New Zealand. Biology Letters 15 (8), 20190467. https://doi.org/10.1098/rsbl.2019.0467
Wright, N.A., Steadman, D.W. et Witt, C.C. (2016) Predictable evolution toward flightlessness in volant island birds. PNAS 113 (17), 4765-4770. https://doi.org/10.1073/pnas.1522931113
Zelenitsky, D.K., Horner, J.R. et Therrien, F. (2012) Dinosaur eggs. In: Brett-Surman, M.K., Holtz, T.R. Jr et Farlow, J.O. (Eds). The complete dinosaur, 2nd edition. Indiana University Press, Bloomington, 613-620.