- Home
- Volume 91 - Année 2022
- Numéro 1
- Évaluation de différents traits d’histoire de vie du charançon rouge Rhynchophorus ferrugineus (Olivier, 1790)
View(s): 4994 (30 ULiège)
Download(s): 125 (1 ULiège)
Évaluation de différents traits d’histoire de vie du charançon rouge Rhynchophorus ferrugineus (Olivier, 1790)

Attached document(s)
original pdf fileRésumé
Depuis la découverte du charançon rouge du palmier Rhynchophorus ferrugineus en Tunisie en décembre 2011, ce ravageur est devenu invasif et mortel pour les palmiers. L’apparition tardive des symptômes représente l’obstacle majeur qui entrave l’efficacité de la lutte. Afin de mieux contrôler ce ravageur, un élevage de masse a été réalisé pour étudier ses traits d’histoire de vie (THV). Allant de l’œuf à l’adulte sur milieu artificiel et dans les conditions de laboratoire, la durée d’incubation des œufs est de 5 jours, celle de développement larvaire est de 119 jours et la période nymphale est de 16 jours. La longévité totale de la femelle est de 74 jours, tandis que celle des mâles est de 94 jours. Treize stades larvaires ont été identifiés grâce au suivi des différents traits d’histoire de vie : la taille des individus (adultes et larves), la mue larvaire, la largeur de la capsule céphalique et le poids des larves. Cependant, l’analyse discriminante canonique ne peut pas séparer d’une manière statistique claire les différents stades larvaires ce qui montre que la forme larvaire de ces coléoptères est continue dans le temps. Un fort dimorphisme sexuel est associé au rostre des insectes adultes : les mâles ont un rostre significativement (p < 0.0001) plus court (8.03 ± 0.11 mm) que les femelles (9.71 ± 0.338 mm). Cela constitue un critère taxonomique intéressant auquel il faut lier, chez le mâle, la présence de soies sur la région dorsale apicale du rostre.
Abstract
Since the discovery of the red palm weevil Rhynchophorus ferrugineus in Tunisia in December 2011, this pest has been acting as a deadly invasive organism for palm trees. The late onset of symptoms is the major obstacle that hampers effective control. In order to manage some control strategies against this pest in Tunisia, a mass rearing of this pest on an artificial diet based on apples was carried out in the laboratory to study its life history traits (THV). Ranging from egg to adult on artificial diet and under laboratory conditions, the incubation period of eggs is 5 days, larval development is 119 days and the pupal period is 16 days. The total longevity of the female is 74 days, while that of the males is 94 days. Thirteen larvae were obtained and identified thanks to the monitoring of some THV life history traits: size of individuals (adults and larvae), molt of larvae, head capsule width and weight of larvae. However, the canonical discriminant analysis cannot statistically separate the different larval groups, which would show that the larval form of these beetles is continuous over time.
Table of content
1S. A. et N. A. sont deux co-premiers auteurs.
2Manuscrit reçu le 20 juin 2022 et accepté le 5 juillet 2022.
3Publié selon les termes de la licence Creative Commons CC-BY 4.
1. Introduction
Le charançon rouge du palmier CRP Rhynchophorus ferrugineus (Olivier, 1790) est un insecte tropical originaire d’Asie du sud qui représente une menace pour le secteur des dattes en Tunisie (Anonyme, 2017). Ce curculionidé envahissant s'est répandu au Moyen-Orient, en Afrique et dans tout le pourtour méditerranéen depuis 1980 (Rochat et al., 2017). Les échanges commerciaux et illégaux de palmiers ornementaux sont la cause principale du passage du charançon rouge du palmier en Europe. Dans les années 90, il est apparu sur Phoenix dactylifera L. en Iran puis en Egypte. Il est arrivé en Tunisie en 2011 dans la région de Carthage (Chebbi, 2011). Actuellement, cet insecte est présent sur le palmier d’ornement Phoenix canariensis (Hort. ex Chabaud, 1882 ) dans les 4 gouvernorats du grand Tunis (Tunis, Ariana, Ben Arous et Manouba) et dans les 3 gouvernorats limitrophes sur un rayon de 60 km (Bizerte, Nabeul et Zaghouan).
4Depuis 2015, une stratégie nationale de lutte contre le CRP a été élaborée par le Ministère de l’Agriculture. Elle repose sur quatre axes : (1) la surveillance et la détection précoce ; (2) le traitement chimique (douchage et endothérapie) ; (3) le piégeage par les phéromones et les kairomones et (4) l’assainissement mécanique (DGSVCIA, 2019).
Malgré tous les efforts produits, le CRP n’est pas encore éradiqué des régions du Nord et les risques d’introduction dans les oasis demeurent très élevés.
La biologie du ravageur a été largement étudiée de longue date en Asie (Nirula et al., 1953) et dans la région méditerranéenne (Dembilio & Jacas, 2011). Cependant, peu de travaux ont été réalisés en Tunisie, pour éclaircir particulièrement les traits biologiques de l’insecte pour mieux maitriser la lutte et éviter une propagation dans les oasis tunisiennes. Les œufs, les larves, ainsi que les nymphes de cet insecte vivent dans le stipe des palmiers ce qui rend difficile la détection précoce de l’infestation (Avand-Faghih, 2004 ; Suma et al., 2014) et par la suite le contrôle du ravageur. En effet, à l'éclosion, les larves commencent à se nourrir vers l'intérieur du bourgeon apical du palmier. Des encoches sur les palmes apparaissent, ce sont les premiers symptômes. Par la suite, sévèrement endommagées, les feuilles s’inclinent fortement pour retomber le long du stipe et la couronne s’affaisse complètement.
5Une étude systématique a été réalisée afin de comprendre les traits d’histoire de vie (THV) du CRP en Tunisie. Pour ce faire, un élevage sur milieu artificiel a été développé et des observations originales ont été entreprises. Elles sont détaillées dans le présent article.
2. Matériel et méthodes
2.1. Étude des paramètres biologiques de Rhynchophorus ferrugineus et élevage de l’insecte sur diète artificiel
L’élevage des adultes de R. ferrugineus a été conduit à l’obscurité dans les conditions ambiantes (T°C 28 ± 2ºC et 60-70% HR). Les individus des stades larvaires et adultes du CRP ont été collectés entre avril 2021 et mars 2022 dans la région de Tunis sur les déchets des palmiers infestés et exempts de traitement par les pesticides. De plus, d’autres adultes de CRP ont été collectés à partir de pièges à phéromones dans le jardin de l’INAT.
6Les adultes (n=73) ont été sexés en se basant sur la présence d'un tuf de poils fins sur l'extrémité dorsale du rostre chez les mâles et qui sont absents chez les femelles (Rochat et al., 2017) (figure 1).

Figure 1
Dimorphisme sexuel entre le mâle et la femelle du charançon rouge avec la présence de soies sur le rostre du male.
7Des individus de CRP préalablement sexés ont été mis dans des boites d’élevage (17*13cm) transparentes, scellées et ventilées afin de réaliser le comptage quotidien des œufs pondus tout en évitant la fuite des insectes.
8Au total, 25 couples ont été placés dans les boîtes et nourris sur des tranches de pommes trois fois par semaine (Dembilio et al., 2009). L’élevage a été renforcé quotidiennement en ajoutant dans les boites les mâles et les femelles du charançon rouge capturés le même jour dans les pièges.
9Après la ponte, les œufs obtenus ont été répartis en deux groupes :(1) un groupe utilisé pour déterminer la durée du stade œuf ; (2) un groupe conservé sur des tranches de pomme dans les mêmes conditions jusqu'à l’éclosion.
10Concernant l’élevage des larves néonates, ces dernières ont été immédiatement placées individuellement en présence de 25g de pomme pour assurer leur nutrition. Le poids des individus a été mesuré à l’aide d’une balance de précision 1/10 mg avec le système de mesure à diapason robuste EW-N/EG-NLe (Kern & Sohn Gmbh-Deutschland). Le suivi larvaire journalier a permis d’enregistrer le nombre de stades larvaires (nombre de mues larvaires) et la durée de chaque stade. A la fin de l’élevage, les nymphes ont été collectées et placées dans des récipients en plastique muni de couvercles contenant chacun un papier filtre imbibé d'eau. Le suivi journalier a permis de déterminer la durée du stade nymphal et l'émergence des adultes.
2.2. Biométrie
11Le charançon rouge est une espèce dont le dimorphisme sexuel est très remarquable pour les adultes, alors que la distinction entre les différents stades larvaires est très difficile. Pour effectuer les différentes mesures, les charançons (larves et adultes) ont été déposés sur un glaçon d’eau pour réduire leur mobilité.
12Concernant les adultes, la longueur du corps (L) a été mesurée de l'extrémité antérieure du pronotum jusqu’à l'extrémité postérieure du pygidium tandis que la largeur du corps (l) a été mesurée de la base des élytres à leur point le plus large. La longueur du pronotum (LP) a été mesurée dorsalement du milieu de la base au milieu du bord apical ; et la largeur du pronotum (lp), au point le plus large du pronotum ainsi que la longueur de rostre (LR) selon le protocole de (Tambe et al., 2013) (figure 2).

Figure 2
Différentes mesures prises sur l’adulte du CRP (L : longueur du corps, l : largeur du corps, LP : longueur du pronotum, lp : largeur du pronotum, LR : longueur de rostre (LR)
13L’élevage du CRP a permis de déterminer la taille (L), le poids et la largeur du capsule céphalique (CC) des larves (Faleiro et al., 2003). Généralement, après avoir effectué une mue, l’augmentation de la capsule céphalique est significative, elle permet de distinguer l’âge des différentes larves étudiées. Ces données ont été également confirmées par la règle de Dyar qui suppose une croissance géométrique de la capsule céphalique. La longueur du corps (L) a été calculée de l'extrémité antérieure de la capsule céphalique jusqu’à l'extrémité postérieure du pygidium (Figure 3).

Figure 3
Mesures prises sur les différents stades larvaires du charançon rouge du palmier. (L) : longueur du corps, (CC) : largeur de capsule céphalique.
14Toutes les mesures ont été effectuées sous loupe binoculaire associée à un ordinateur contenant le logiciel de biométrie (LAS version 4.12).
2.3. Analyse statistique
15L’analyse statistique a été réalisée par le logiciel SPSS® 16.0. Afin de discriminer les différents stades larvaires de l’insecte, l’analyse canonique discriminante (ACD) des variables : (i) la largeur de la capsule céphalique (CC) ; (ii) la taille du corps (L), et (iii) le poids a été utilisée. Les moyennes des différents paramètres biologiques et de la durée de développement de chaque stade larvaire de CRP ont été vérifiées pour la Normalité et l’égalité de la variance par le test de Shapiro–Wilk et de Levene respectivement avant analyse, puis, soumises à l’analyse de la variance et une comparaison multiple de moyenne par le test Tukey au seuil de signification P = 0,05. La comparaison de la taille des charançons adultes mâles et femelles a été effectuée par le test T de Student au seuil de signification 0,05.
3. Résultats
16L’élevage effectué au laboratoire a permis de mieux comprendre la biologie de de l’insecte. Cette étude montre que la durée de chaque stade de développement (de l’œuf à l’adulte) est différente d’un stade à l’autre (tableau 1).
3.1. Durée du cycle de vie
17Allant de l’œuf à l’adulte sur milieu artificiel et dans les conditions de laboratoire (T°C= 28 ± 2ºC et HR= 60-70%), la durée d’incubation des œufs est de 5 jours, celle du développement larvaire est de 119 jours et la période nymphale est de 16 jours. La longévité totale de la femelle de R. ferrugineus est de 74 jours, tandis que celle des mâles est de 94 jours (tableau 1).
Tableau 1.
Durée de développement des différents stades larvaires de CRP (L1-L13), de la nymphe et des adultes mâles et femelle sur pommes à l’obscurité (T : 28± 2ºC et H.R. 60-70%).
|
Stades de CRP |
durée de développement±S.E (jours) |
|
Œuf |
4.45±1.35 |
|
L1 L2 L3 L4 L5 L6 L7 L8 L9 L10 L11 L12 L13 |
11.60±2.03a* 5.40±1.39b 5.65±1.22b 7.15±1.08c 4.75±0.91d 6.50±1.82e 5.40±1.18b 5.95±2.08b 20.20±1.67f 20.60±2.01f 11.05±1.35a 8.35±0.98g 6.35±1.18e |
|
Nymphe |
16.35±2.03 |
|
Nymphe-adulte |
15.85±1.69 |
|
Adulte mâle |
94.50±6.34 |
|
Adulte femelle |
74.15±5.24 |
18*Les moyennes suivies de la même lettre ne sont pas significativement différentes selon test de Tukey au seuil de 5%.
3.2 Paramètres morphométriques
3.2.1 Stades larvaires de R. ferrugineus
19L’analyse canonique discriminante a donné trois axes factoriels. Le premier et le deuxième axe expliquent respectivement 96.3% et 2.6% de la dispersion totale, alors que le plan factoriel F1 x F2 explique dans l’ensemble 99% de la variabilité globale. L’axe 1 est corrélé positivement à la longueur du corps (R=0.88, p< 0.001) et au poids de l’insecte (R=0.80, p< 0.001) alors que le troisième axe est lié positivement à la largeur de la capsule céphalique (R=0.79, p< 0.001).
20Le plan factoriel F1 x F2 ne peut pas séparer d’une manière statistique claire les différents groupes larvaires ce qui prouve que la forme larvaire de CRP est continue dans le temps (Figure 4).
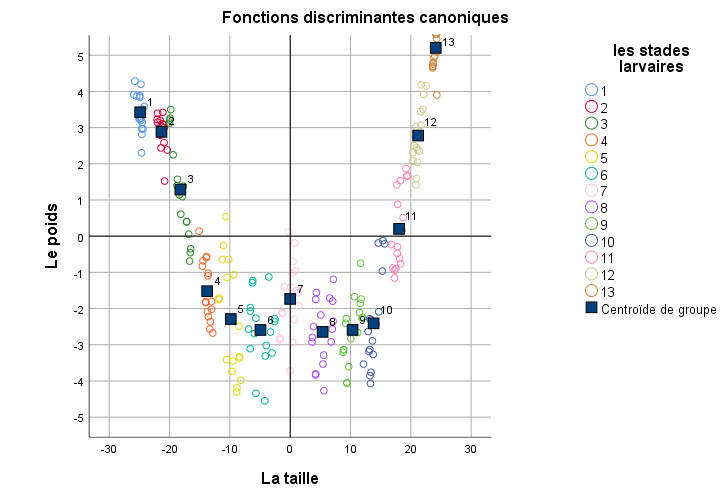
Figure 4.
Analyse discriminante des larves de Rhynchophorus ferrugineus
21Cependant, l’analyse de la variance sur les mesures de la taille (F(12, 208) = 3777; P<0.0001) et de la capsule céphalique (F(12, 208) = 4639; P<0.0001) des larves de l’insecte a montré une différence très hautement significative indiquant la présence de 13 stades larvaires issus de l’élevage en masse sur pommes au laboratoire.
22L’analyse de la variance effectuée sur le poids a montré également une différence hautement significative entre les différents groupes larvaires (F(12, 208) = 3135; P<0.0001) (tableau 2).
Tableau 2.
Valeurs moyennes des différents paramètres biologiques : longueurs (cm), largeurs de la capsule céphalique (mm) et du poids (g) des larves de Rhynchophorus ferrugineus
|
Stade larvaire |
Largeur de capsule céphalique (moyenne±SE) en mm |
Taille de larves (moyenne±SE) en mm |
Poids (moyenne±SE) en mm |
|
1 2 3 4 5 6 7 8 9 10 11 12 13 |
0.69 ± 0.06 a 0.96 ± 0.03 b 1.16 ± 0.05 c 1.87 ± 0.05 d 2.39 ± 0.07 e 3.00 ± 0.08 f 3.77 ± 0.10 g 4.68 ± 0.31 h 5.22 ± 0. 15 i 5.75 ± 0.13 j 6.35 ± 0.08 k 7.10 ± 0.18 l 8.08 ± 0.27 m |
5.26 ± 0.06 a 8.85 ± 0.05 b 12.58 ± 0.18 c 18.02 ± 0.09 d 22.11 ± 0.17 e 26.88± 0.16 f 31.07 ± 0.09 g 36.51 ± 0.12 h 41.15 ± 0.09 i 44.57 ± 0.05 j 47.02 ± 0.05 k 48.70 ± 0.04 l 50.17 ± 0.02 m |
0.22 ±0.04 a* 0.54 ± 0.04 b 0.74 ± 0.04 c 0.94 ± 0.04 d 1.26 ± 0.10 e 1.72 ± 0.17 f 2.26 ± 0.15 g 2.69 ± 0.16 h 3.19 ± 0.18 i 3.71 ± 0.11 j 4.16 ± 0.15 k 4.64± 0.15 l 5.06 ± 0.12m |
23* Les moyennes précédents les standard erreurs (±SE) qui ne sont pas suivies de la même lettre au niveau de la même colonne sont significativement différentes selon test de Tukey au seuil de 5%.
24De même, les analyses de régression linéaire entre la capsule céphalique et le poids des individus a révélé une corrélation positive et hautement significative (R = 0,979 ; P<0.001)
25(Y = 0.06631X-0.2054; R2 = 0.99)
26Le poids des larves a significativement changé en mêle temps que la largeur de la capsule céphalique pour l’ensemble des stades de développement observés. En effet, la largeur céphalique pour les stades larvaires 1,5 et 10 sont de l’ordre de 0,69, 2,39 et 5,75 mm et correspondent respectivement à un poids de 0,22, 1,26 et 3,71 g.
3.2.2 Stades adultes de R. ferrugineus
27Les paramètres morphométriques sur les corps des charançons adultes sont présentés dans le tableau 3.
Tableau 3.
Caractères morphométriques des différentes parties du corps du charançon rouge du palmier, mâles et femelles élevés sur pommes dans le laboratoire (±SE).
|
Les mesures morphométriques |
Mâle |
Femelle |
|
Longueur du corps (mm) |
25.40±2.06 * |
28.10±1.59 |
|
Largeur du corps (mm) |
10.04±0.71 * |
11.23±0.86 |
|
Poids (g) |
0.72±0.19 |
0.87±0.29 |
|
Longueur de pronotum (mm) |
9.18±1.03 * |
10.47±08 |
|
Largeur de pronotum (mm) |
8.65±0.73 * |
9.44±0.55 |
|
Longueur du rostre (mm) |
8.03±0.11 * |
9.71±0.338 |
28*Les moyennes suivies d’une * sur la même ligne sont significativement différentes selon test t de Student au seuil de 5%.
29La longueur et la largeur des corps des mâles et femelles sont significativement différentes (P=0,0042 et P=0,0034). Chez les mâles, la longueur moyenne du corps est de 25,4±2.065 mm et la largeur est de 10,04±0,713mm. Tandis que, chez les femelles, la longueur et la largeur moyennes du corps sont significativement plus élevées que chez les mâles (28,1±1,595 mm et 11,23±0,862 mm) respectivement. Aucune différence significative n’a été décelée entre le poids des deux sexes (P=0,1949).
30La longueur et la largeur de pronotum étaient significativement plus importantes chez les femelles P=0,0071et P =0,0141, respectivement.
31Le rostre est le caractère taxonomique le plus important jusqu'à présent car il montre un fort dimorphisme sexuel des deux sexes. Nous avons trouvé que les mâles ont un rostre significativement plus court que les femelles avec 8.03±0.113 mm chez les mâles et 9.71±0.338 mm chez les femelles (p < 0.0001). Chez les mâles, des soies étaient présentes sur la région dorsale apicale du rostre.
4. Discussion
Le charançon rouge des palmiers est un insecte endophage, qui fuit la lumière et vit caché (Didier et al., 2006). Allant de l’œuf à l’adulte sur milieu artificiel et dans les conditions de laboratoire (T°C = 28 ± 2ºC et HR= 60-70%), la durée totale du cycle du CRP est de 7 mois environ. Après une incubation de 4 jours (conditions de laboratoire), l’œuf éclot et donne naissance à une larve mesurant 5 à 6 mm, de couleur jaune crème. Au total, 13 stades larvaires sont différenciés, entre autres, par la durée de développement larvaire (4 mois), la taille, le poids et la largeur de la capsule céphalique. La nymphose dure 15 jours environ. Il s’ensuit que le cycle complet de l’œuf à l’adulte est de l’ordre de 320 jours. La longévité totale de la femelle de R. ferrugineus est de 74 jours environ, tandis que celle des mâles est de 94 jours (figure 6).
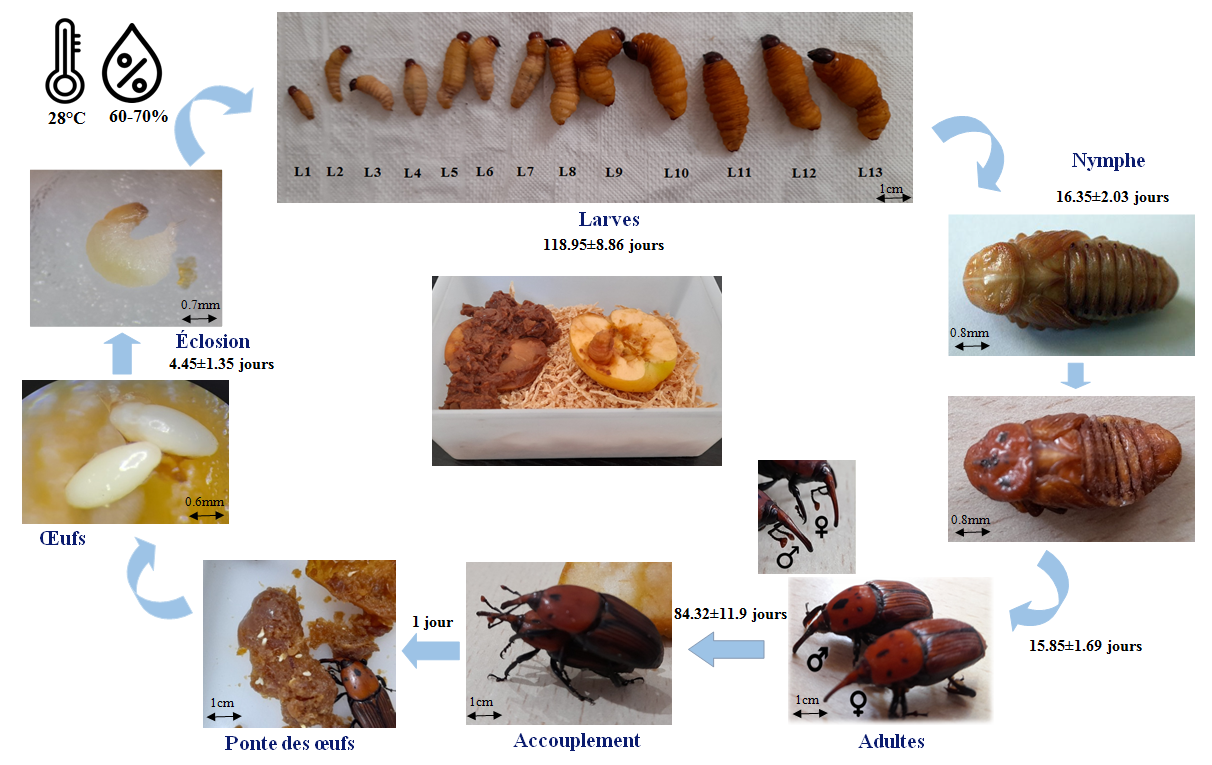
Figure 6.
Cycle biologique de charançon rouge de palmier Rhynchophorus ferrugineus élevés sur pommes
32Plusieurs études ont montré que la durée d’incubation des œufs est variable en fonction du régime alimentaire. En Arabie Saoudite, Rahalkar et al. (1985) ; Abd El Fattah (2010) ont montré que le stade de l'œuf du CRP dure entre 2 et 4 jours lorsqu'il est élevé sur du tourteau de noix de coco et de pomme de terre. Ces résultats sont très similaires à ceux obtenus dans la présente étude. La durée de développement des larves sur pommes est de 118 jours. Cette durée diffère selon le régime d’élevage imposé, allant de 71 à 102 jours sur un régime alimentaire à base d'avoine et d'ananas (Kaakeh, 2005), alors que des régimes à base de pommes de terre et de tourteaux de noix de coco ont conduit respectivement à une durée larvaire de 52 et 45 jours (Hussein, 1998 ; Abd El-Fattah, 2010). Une autre étude a montré que le développement larvaire à base de canne à sucre est de 62±2 jours (Salama et Abdel-Razek, 2002).
Notre étude constate que la nymphose est de 16 jours sur pommes aux conditions de laboratoire. Mahmoud et al. (2015) ont enregistré que la moyenne de la période nymphale était de 10 jours, tandis que la pré-émergence des adultes du cocon était de 9 jours lors de l'élevage du CRP sur pomme de terre. La durée de développement des nymphes a montré une différence avec les divers régimes alimentaires utilisées, et allaient de 16 jours ( feuilles de palmier) à 23 jours ( fibres d'avoine et de palme) (Kaakeh, 2005). Aldhafer et al. (1998) ont montré que la période nymphale a duré 21 jours pour les mâles et 23 jours pour les femelles.
33La longévité totale de la femelle de R. ferrugineus était de 74±5 jours, tandis que celle des mâles était de 94. ±6 jours. Les femelles ont un cycle de vie plus court sur pommes par rapport aux mâles, ce qui corrobore la durée de 74,8 ± 2 jours obtenue par El-Shafie et al. (2013) sur pomme de terre. Alors que pour les mâles la longévité est très proche de celle trouvée par Abd El-Fattah (2010) 97± 6,0 jours. El-Shafie et al. (2013) et Mahmoud et al. (2015) ont montré que la longévité moyenne des mâles de CRP élevés avec un régime semi-artificiel avec de pommes de terre était de 83jours et de 94jours respectivement.
34Les travaux de Wigglesworth (1954) et Stamp, (1990) ont révélé que le nombre de stades larvaires et la nature des mues peuvent être fréquemment modifiés par des facteurs externes, principalement la température, la plante hôte ou le régime alimentaire et leur interaction. Dans le présent travail, treize stades larvaires ont été observés durant la période d’élevage au laboratoire. Martín-Molina (2004) a identifié 17 stades larvaires du CRP sur des mottes de canne à sucre et jusqu'à 15 stades sur des mottes de palmier alors que Ju et al. (2010) n’ont rapporté que huit stades larvaires sur des palmiers des canaries (Phoenix canariensis) et de Washingtonia (Washingtonia sp.). Ils ont également signalé neuf stades larvaires sur d’autres palmiers tels : le Chusan (Trachycarpus fortune), le Pindo (Butiacapitata sp.) et le dattier argenté (Phoenix sylvestris). Sept stades sur canne à sucre et neuf sur le cocotier (Cocos nucifera) ont été enregistrés aux Philippines par Jaya et al. (2000). Treize stades larvaires sur P. canariensis en Espagne (Dembilio et Jacas, 2011). Dans le cas des stades distingués par Martín-Molina (2004) sur des morceaux de canne à sucre et de palmier, la mue a été signalée sans variation de taille et de poids. Dans notre cas, le poids des larves a significativement changé en même temps que la largeur de la capsule céphalique pour l'ensemble des stades de développement observés.
35Très peu d'informations sur la morphométrie de l’adulte sont disponibles. La plupart des rapports publiés ne mentionnent que la longueur et la largeur du corps, principalement sur les individus mâles, ou bien il n'y a aucune mention du sexe. Jusqu'à présent, l’occurrence de soies rostrales est le seul caractère taxonomique qui montre un fort dimorphisme sexuel. Ainsi, nous avons trouvé que les mâles ont un rostre significativement plus court que les femelles. Dutta et al. (2010) ont rapporté que les adultes de CRP de Meghalaya (Inde) mesuraient entre 33 et 34 mm en longueur et 11 à 13 mm en largeur. D'après le rapport de l'EPPO (2007), la longueur du corps du mâle adulte varie de 19 à 42 mm et sa largeur de 8 à 16 mm, alors que la longueur de la femelle adulte est de 26 à 40 mm et sa largeur de 10 à 16 mm. Une ancienne étude réalisée par Wattanapongsiri (1966) a montré que les mâles et les femelles de CRP sont très uniformes dans la taille du corps, à l'exception de la longueur du rostre. Avec respectivement une longueur moyenne des mâles et des femelles de 31 à 39 mm et de 29 à 40, la largeur est de 11 à 15 mm et de 12 à 14 mm. Mizzi et al. (2009) ont trouvé un dimorphisme de taille clair chez R. ferrugineus. Dans notre étude, nous avons observé un dimorphisme sexuel de taille chez les adultes : les femelles sont plus grandes que les mâles pour la longueur et la largeur de l'abdomen, de pronotum ainsi que la longueur du rostre. Cette différence est probablement associée aux caractéristiques de reproduction des femelles. En effet, le dimorphisme de la taille du rostre est généralement attribué à une pression de sélection sur le rostre de la femelle pour une longueur accrue. Le rostre est utilisé dans l'excavation et la préparation des sites de ponte par les femelles adultes. En plus, il remplit le rôle d'un ovipositeur, et semble avoir été un facteur important d’évolution (Danforth et Asher, 1999).
5. Conclusion
36Cette étude systématique a permis de déterminer la durée de chaque stade de développement (de l’œuf à l’adulte) de CRP et le poids de chaque stade larvaire en utilisant les pommes comme régime alimentaire. L'intérêt de l’élevage sur pommes est d'autant plus grand pour le charançon rouge que le mode de vie subcortical des larves empêche de nombreuses et importantes observations par rapport à ce qui se passe en réalité dans le stipe de palmier.
37Ce travail a pu souligner le cycle de vie du CRP sur pommes cependant et pour une meilleure gestion et contrôle de cet insecte, un inventaire des ennemis naturels et leur action sur les différents stades de développement est indispensable. Des observations complémentaires sont actuellement en cours à ce sujet et des tests sont entrepris sur l'élevage complet de l’insecte durant plusieurs générations successives afin d’accroître les possibilités d’étude des moyens de lutte appropriés contre ce ravageur très difficile à observer en conditions naturelles.
Références
38Anonyme. 2017 : Analyse de la filière de dates en 2017 disponible sur : http://www.tunisieindustrie.nat.tn/fr/download/cepi/notes/dattes.pdf [Consulté le 18-03-2022].
39Abd El-Fattah S.M. 2010. Study of some recent trends on Rhynchophorus ferrugineus (Oliv.) infesting date palm trees in Sharkia Governorate. Thèse de Doctorat, Fac. of Agric., Zagazig Univ., 191pp
40Abraham V.A., Shuaibi M.A., Faleiro J.R., Abozuhairah R.A. et Vidyasagar P. S. 1998. An integrated management approach for red palm weevil Rhynchophorus ferrugineus Oliv. A key pest of date palm in the Middle East. Journal of Agricultural and Marine Sciences, 3(1) : 77-83.
41Aldhafer H.M., Alahmadi A.Z. et Alsuhaibani A.M. 1998. Biological studies on the red palm weevil, Rhynchophorus ferrugineus Oliv. (Coleoptera, Curculionidae) in Riyadh, Saudi Arabia. King Saud University Agriculture Research Center, 75: 30-32.
42Allouche L. et Chihaoui S. 2013. Utilisation du système d’information géographique pour la gestion de lutte contre le charançon rouge Rhynchophorus ferrugineus dans la ville de Carthage. Projet de fin d’étude : Protection des plantes et environnement. Tunisie : ISA Chott Meriem, 120p.
43Avand-Faghih A. 2004. Identification et application agronomique de synergistes végétaux de la phéromone du charançon Rhynchophorus ferrugineus (Olivier) 1790. Thèse de Doctorat, INAPG (AgroParisTech), 170p.
44Chebbi H. 2011. First record of Rhynchophorus ferrugineus on Phoenix canariensis in Tunisia. Tunisian Journal of Plant Protection, 6(2): 149-153.
45Danforth B. N. et Ascher J. 1999. Flowers and insect evolution. Science, 283(5399): 143-143.
46Dembilio O., Jacas J.A. et Llàcer E. 2009. Are the new palms Washintonia filifera and Chamaerops humilis suitable hosts for the red palm weevil, Rhynchophorus ferrugineus (Col. Curculionidae)?. Journal of Applied Entomology, 133(7): 565-567. https://doi.org/10.1111/j.1439-0418.2009.01385.x.
47Dembilio O. et Jacas J.A. 2011. Basic bio-ecological parameters of the invasive Red Palm Weevil, Rhynchophorus ferrugineus (Coleoptera: Curculionidae), in Phoenix canariensis under Mediterranean climate. Bulletin of Entomological Research, 101: 153-163. https://doi: 10.1017/S0007485310000283
48DGSVCIA, 2019. Ministère de l’agriculture, des ressources hydrauliques et de la pêche maritime. Rapport sur la stratégie nationale pour l’éradication du charançon rouge des palmiers. Tunisie, 14p.
49Didier R., Chapin E., Ferry M., Arman A. et Luc B. 2006. Le charançon rouge du palmier dans le bassin méditerranéen. Phytoma, 595: 20-24.
50Dyar H.G. 1890. The number of molts of lepidopterous larvae. Psyche: A Journal of Entomology, 5(175-176): 420–422. https://doi.org/10.1155/1890/23871
51Dutta R., Thakur N.S.A., Bag T.K., Anita N., Chandra S. et Ngachan S.V. 2010. New Record of Red Palm Weevil, Rhynchophorus ferrugineus (Coleoptera: Curculionidae) on Arecanut (Areca catechu) from Meghalaya, India. Florida Entomologist, 93(3): 446-448. https://doi.10.1653/024.093.0320
52El-Shafie H.A.F., Faleiro J.R., Abo-El-Saad M.M. et Aleid S.M. 2013. A meridic diet for laboratory rearing of red palm weevil, Rhynchophorus ferrugineus (Coleoptera: Curculionidae). Scientific Research and Essays, 8(39): 1924-1932.
53EPPO. 2007. Rhynchophorus ferrugineus and Rhynchophorus palmarum. European and Mediterranean Plant Protection Organization Bulletin, 37: 571-579.
54Faghih A.A. 1996. The biology of red palm weevil, Rhynchophorus ferrugineus Oliv. (Coleoptera, Curculionidae) in Savaran region (Sistan province, Iran). Applied Entomology and Phytopathology, 63: 16-18.
55Faleiro J. R., Rangnekar P.A. et Satarkar V.R. 2003. Age and fecundity of female red palm weevils Rhynchophorus ferrugineus (Olivier) (Coleoptera: Rhynchophoridae) captured by pheromone traps in coconut plantations of India. Crop Protection, 22(7): 999- 1002.
56Farazmand H., Rassoulian G.R. et Bayat-Assadi H. 2000. Comparative notes on growth and development of red palm weevil, Rhynchophorus ferrugineus Oliv (Col.: Curculionidae), on date palm varieties in Saravan Region. Journal of Entomological Society of Iran, 19: 1–14.
57Hussein K. M.A. 1998. Biological, ecological and control studies on red palm weevil, Rhynchophorus ferrugineus in Sharkia and Ismailia Governorates, Egypt. M.Sc. Theses, Fac. Agric., Zagazig Univ, 289 pp
58Jaya S., Suresh T., Sobhitha-Rani R.S. et Sreekumar S. 2000. Evidence of seven larval instars in the red palm weevil, Rhynchophorus ferrugineus Olivier reared on sugarcane. Journal of Entomological Research, 24: 27–31.
59Ju L., Ringler T. et Gunzburger M. 2011. Voronoi tessellations and their application to climate and global modeling. Numerical Techniques for Global Atmospheric Models, 313–342p. https://doi 10.1007/978-3-642-11640-7_10
60Kaakeh W. 2005. Longevity, fecundity, and fertility of the red palm weevil, Rynchophorus ferrugineus Olivier (Coleoptera: Curculionidae) on natural and artificial diets. Emirates Journal of Food and Agriculture, 5(2): 23-33.
61Mahmoud A.I., Farminhao J. et Viez E.R. 2015. Red palm weevil (Rhynchophorus ferrugineus Olivier, 1790): Threat of Palms. Journal of Biological Sciences, 15(2): 56-67.
62Martín-Molina M.M. 2004. Biología y ecología del curculiónido rojo de las palmeras, Rhynchophorus ferrugineus (Olivo,1790) (Coleoptera: Dryophthoridae). Thèse de Doctorat, Universidad de Almería, Almería, España.
63Mizzi S., Dandria D., Mifsud D. et Longo S. 2009. The Red Palm Weevil, Rhynchophorus ferrugineus (Olivier, 1790) in Malta (Coleoptera: Curculionoidea). Bulletin of the entomological Society of Malta, 2: 111-121.
64Murphy S.T. et Briscoe B.R. 1999. The red palm weevil as an alien invasive: biology and the prospects for biological control as a component of IPM. Biocontrol news and information, 20(1): 35-46.
65Nirula K.K., Anthony J. et Menon K. 1953. The red palm weevil and its control. Indian Coconut Journal, 7 (1): 26-34.
66Olivier, G. 1790. Encyclopédie méthodique. Histoire naturelle. Insectes. Paris : Panckoucke, 793 p.
67Rahalkar G.W., Harwalker M.R., Rananavare H.D., Tamhnkar A.J. et Shantaram K. 1985. The biology of red palm weevil, Rhynchophorus ferrugineus Olivier, A handbook of insect rearing. Elsevier Sci. Pub., B.V.Amsterdam, 1: 279-286.
68Rochat D., Dembilio O., Jaques A.J., Suma P., La pergola A., Hamidi R., Kontodimas D. et Soroker V. 2017. Rhynchophorus Ferrugineus: Taxonomy, distribution, Biology, and Life Cycle. Handbook of Major Palm Pests: Biology and Management, 69-104p.
69Salama H. S. et Abdel-Razek A.S. 2002. Development of the red palm weevil, Rhynchophorus ferrugineus (Olivier) (Coleoptera: Curculionidae) on natural and synthetic diets. Journal of pest science, 75(5): 137-139. https://doi.org/10.1046/j.1472-8206.2002.02039.x
70Stamp N.E. 1990. Growth versus molting time of caterpillars as a function of temperature, nutrient concentration and the phenolic rutin. Oecologia, 82: 107–113. https://doi.org/10.1007/BF00318541
71Suma P., La Pergola A., Longo S. et Soroker V. 2014. The use of sniffing dogs for the detection of Rhynchophorus ferrugineus. Phytoparasitica, 42 (2): 269-274.
72Tambe D.T., Croutelle U., Trepat X., Park C.Y., Kim J.H., Millet E., Butler J.P. et Freberg J.J. 2013. Monolayer Stress Microscopy: Limitations, Artifacts, and Accuracy of Recovered Intercellular Stresses. PLOS ONE, 8(2), e55172. https://doi:10.1371/journal.pone.0055172.
73Wattanapongsiri A. 1966. A revision of the genera Rhynchophorus and Dynamis (Coleoptera: Curculionidae), Bangkok, Thailand. Thèse de Doctorat, Oregon State University.
74Wigglesworth V.B. 1954. The Physiology of Insect Metamorphosis. Cambridge, UK, Cambridge University Press, 152 p.
Informations complémentaires
Contribution de chaque auteur
Méthodologie : S.A, N.A, M.C, M.L.B.J et K.K ; Analyse des données : S.A et S.K ; Rédaction de l’article : S.A et N.A ; Première révision du papier : H.C, S.K et M.L.B.J ; Deuxième révision : M.L.B.J
Déclaration relative aux conflits d’intérêt
75Les auteurs déclarent l’absence de tout conflit d’intérêt.