- Accueil
- Volume 91 - Année 2022
- Numéro 1
- Impact des nanoparticules de silice fumée SiO2 sur des indicateurs du stress oxydatif chez Helix aspersa
Visualisation(s): 3215 (41 ULiège)
Téléchargement(s): 92 (0 ULiège)
Impact des nanoparticules de silice fumée SiO2 sur des indicateurs du stress oxydatif chez Helix aspersa

Document(s) associé(s)
Version PDF originaleRésumé
Dans cette étude nous nous sommes intéressés à l’évaluation de l’impact des nanoparticules de silice fumée (SiO2) sur un organisme bioaccumulateur, bioindicateur de pollution de l’environnement et un indicateur d’état sanitaire des sols, le gastéropode Helix aspersa suite à une exposition via la nourriture. La toxicité des NPs de silice est déterminée chez l'escargot Helix aspersa grâce aux expérimentations réalisées au sein du laboratoire sur des escargots partagés en quatre lots : un lot considéré comme témoin et trois autres traités par des doses croissantes de nanoparticules de silice fumée de 250, 500 et 750 µg/g de nourriture (farine de blé) pendant quatre semaines. Le stress oxydatif a été évalué par le biais d’un suivi de l’activité de certains biomarqueurs biochimiques et enzymatiques : GSH, GST, GPx et CAT dans les tissus hépatopancréatiques et rénaux et un dosage des protéines totales a également été effectué. Les résultats obtenus montrent que la présence des nanoparticules de silice dans la nourriture de H. aspersa provoque des modifications des paramètres testés dont une augmentation du taux des protéines totales. Nos données révèlent une diminution du taux du GSH ainsi que de l’activité de la CAT et de la GPx, parallèlement à l’observation d’une augmentation de l’activité de la GST au niveau de l’hépatopancréas et du rein. Les perturbations notées sont relativement plus significatives au niveau de l’hépatopancréas qu’au niveau du rein. Nos résultats montrent un état de stress oxydatif chez H. aspersa exprimé par le déclenchement du système de lutte contre le stress oxydatif à travers les biomarqueurs de cette réaction métabolique.
Abstract
In this study, we were interested in the evaluation of the impact of fumed silica nanoparticles (SiO2) on a bioaccumulator organism, bioindicator of environmental pollution and an indicator of soil health status, the gastropod Helix aspersa after an exposition via food. The toxicity of silica NPs is determined in the snail H. aspersa by experiments carried out in the laboratory on snails divided into four batches: one batch considered as a control and three others treated with doses of fumed silica nanoparticles of 250, 500 and 750 µg/g of food (wheat flour) for four weeks. Oxidative stress was assessed by monitoring the activity of certain biochemical and enzymatic biomarkers: GSH, GST, GPx and CAT in hepatopancreatic and renal tissues and a complementary measurement of total proteins. The results obtained show that the presence of silica nanoparticles caused modifications in the parameters tested, expressed by an increase in the rate of total proteins. Our data reveal a decrease in the level of GSH, the activity of the catalase and GPx, in parallel with the observation of an increase in the activity of GST measured at the level of the hepatopancreas and the kidney. The disturbances noted are relatively more significant at the level of the hepatopancreas than at the level of the kidney. Our results showed a state of oxidative stress in H. aspersa expressed by the triggering of the anti-oxidative defense system through biomarkers of this system
Table des matières
Manuscrit reçu le 15 janvier 2022 et accepté le 5 avril 2022
Publié selon les termes de la licence Creative Commons CC-BY 4.0
1. Introduction
1Le développement rapide de la nanotechnologie a conduit à une augmentation du nombre de produits manufacturés contenant des matériaux à l'échelle nanométrique. Un des membres les plus importants de cette classe de matériaux est celle des nanoparticules de silice, qui ont trouvé de nombreuses applications dans divers domaines tels que : la biomédecine, l’alimentaire (agent épaississant, additifs alimentaires), les produits cosmétiques ou pharmacologiques (lotions solaires), électronique, textile, les industries chimiques etc impliquant une exposition humaine pendant la production ou l'utilisation (Napierska et al., 2010 ; Nafisi et Hägg, 2014).
2La silice nano-particulaire est biocompatible donc se déplace dans les tissus sans être détruite par les macrophages, en plus elle possède une luminescence qui lui est propre lorsqu’elle est en présence d’un rayonnement infrarouge, elle est donc détectable et identifiable. Ces deux qualités sont primordiales en médecine pour être utilisées comme vecteurs de médicaments, dans la thérapie génique et l'imagerie moléculaire. (Goodman et al., 2008).
3Par ailleurs, les interactions des nanoparticules avec les systèmes biologiques, et leur toxicité potentielle, sont actuellement mal comprises. Le risque sanitaire associé reste donc difficile à évaluer. Cependant, une attention particulière doit être portée à la toxicité des nanoparticules, car celles de la silice (nano-SiO2) sont parmi les cinq nanomatériaux les plus couramment utilisés, répertoriés dans les produits de consommation nanotechnologiques par le Woodrow Wilson International Center for Scholars (Hansen et al., 2008).
4En raison de leur introduction potentielle dans le sol, ainsi que dans le milieu aquatique, l'inclusion d'un ensemble de tests d'écotoxicité dans la caractérisation des risques des NPs est nécessaire. Helix aspersa est un bon indicateur de pollution terrestre, cette espèce est abondante et facilement détectable, sédentaire donc elle reflète les conditions locales, sa taille suffisante permet l’étude de différents tissus et leurs composants et enfin cette espèce peut tolérer les différentes conditions du laboratoire. Le choix préférentiel de cette espèce est principalement lié à sa distribution mondiale, traduisant ses capacités d’adaptation à des biotopes, des sols, et des climats variés, et à sa facilité d’élevage (Gomot, 1997).
5Récemment, le stress oxydatif a souvent été signalé comme mécanisme toxique de l'apoptose et de l'inflammation induites par les nanoparticules de silice dans divers types de cellules, notamment les macrophages, les cellules rénales embryonnaires et les cellules épithéliales (Eom et Choi, 2009 ; Park et Park, 2009 ; Wang et al., 2009). L’augmentation ou la réduction des biomarqueurs du stress oxydatif est le mécanisme le plus important observé en raison de la toxicité des NPs (Cui et al., 2019). Les enzymes antioxydantes sont utilisées comme biomarqueurs de la contamination par les nanomatériaux, qui induisent un stress oxydatif chez les bioindicateurs (Besnaci et al., 2019).
6La majorité des recherches sur Helix parlent de l’hépatopancréas comme un organe cible de bioaccumulation des NPs (Besnaci et al., 2016a ; Besnaci et al., 2016b) ; dans ce travail, il a été réalisé une évaluation toxicologique sur Helix aspersa de l’effet des NPs de silice fumée (avec des doses croissantes durant quatre semaines) et ce à travers des paramètres de stress sur deux organes cibles comparativement, en l’occurrence « l’hépatopancréas et le rein ».
2. Matériel et méthodes
2.1. Matériel chimique
7Le matériel chimique utilisé dans cette expérimentation est l’oxyde de silicium. Les nanoparticules de la silice fumée (SiO2-NPs) sont un produit chimique superfin qui a été acheté auprès de Sigma-Aldrich. Son aspect est une poudre blanche, dont la taille de la particule est de 14 nm et une superficie de 200 ± 25 m2/g ; quant à la pureté, elle est supérieure à 98% (RT).
2.2. Matériel biologique
8Le matériel biologique utilisé dans notre étude est une espèce bioaccumulatrice bioindicatrice de pollution terrestre le gastéropode pulmoné le petit gris, Helix aspersa.
9Les adultes de cet escargot ont été collectés dans un écosystème non contaminé dans la région d’El Kala dans la wilaya d'El-Tarf, au Nord-Est de l'Algérie (Figure 1).
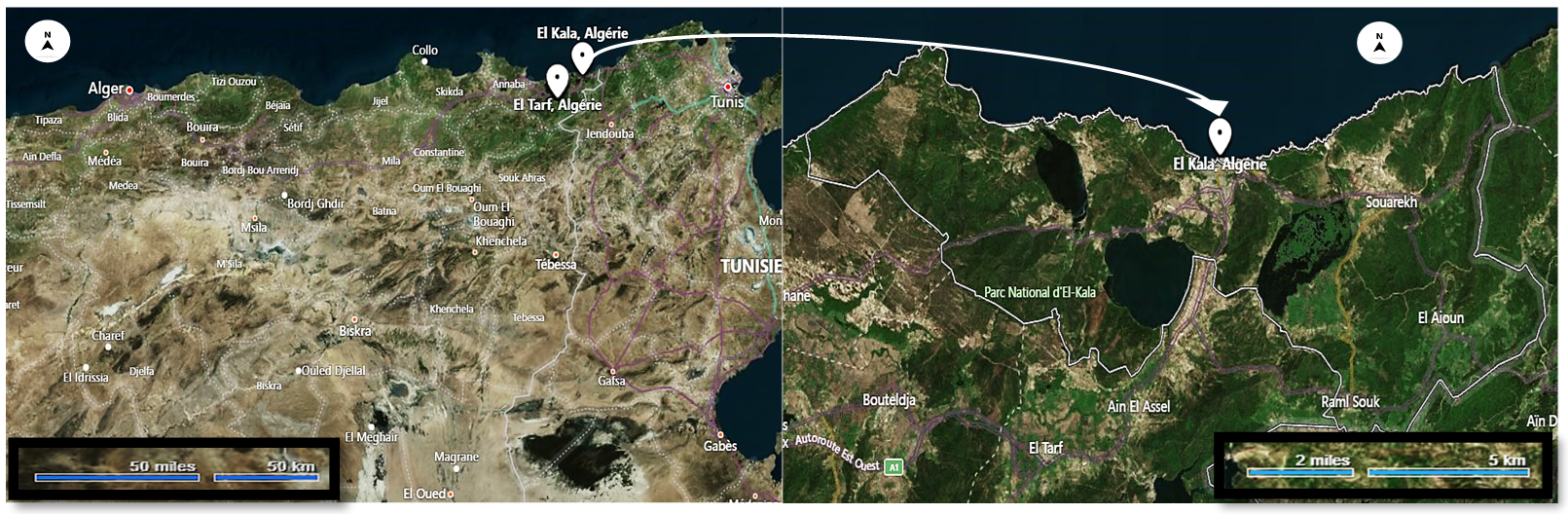
Figure 1
Emplacement géographique du site de collecte des escargots
2.3. Elevage et application du traitement
10Les escargots ont été transportés au laboratoire universitaire où ils ont été mis en adaptation durant sept jours dans des conditions d’environnement optimales et contrôlées de température (20 ± 2°C) et de lumière (photopériode de 18h de lumière/24h d’obscurité).
11Les escargots ont été répartis en quatre (04) lots dont chacun contient dix (10) individus de masse moyenne de 9±0.5g placés dans des boîtes en plastique transparentes à couvercle percé afin d’assurer une oxygénation, l’humidité est maintenue à l’aide d’une éponge mouillée et la nourriture est fournie dans des boites de pétri (Farine de blé) pesée au préalable (même quantité pour tous les lots).
12Le traitement des animaux a été effectué par addition de doses des nanoparticules de silice fumée dans l’alimentation (farine de blé) pendant quatre semaines. Trois doses ont été retenues : 250 µg, 500 µg et 750 µg par gramme de nourriture, en plus d’un milieu témoin sans silice. L’entretien des boîtes (changement de nourriture et nettoyage des boîtes) est effectué deux fois par semaine, la nourriture apportée est renouvelée, même si elle n’est pas consommée.
13A la fin du traitement (4eme semaine), les animaux mis à jeun pendant 24 h pour assurer que leur tube digestif soit vide, ont été sacrifiés par décapitation. La coquille est ensuite enlevée à l’aide de ciseaux en suivant son bord d’enroulement ; par la suite, l’hépatopancréas et le rein ont été prélevés et conservés au congélateur pour servir aux dosages.
2.4. Dosages
14La détermination des paramètres biochimiques indicateurs du stress oxydatif (GSH, GST, GPx et CAT) a été réalisée sur des échantillons de l'hépatopancréas et du rein pour chaque lot (traités et témoin).
15Le dosage est effectué sur 1000 mg de tissu. Pour le glutathion (GSH) la méthode de Weckbecker et Cory (1988) a été suivie après déprotéinisation avec l’acide sulfo-salicylique. Concernant les activités enzymatiques, la glutathion-S-transférase (GST) est déterminée selon la méthode de Habig et al. (1974), la glutathion peroxydase (GPx) selon la méthode de Flohé et Gunzler (1984) et la catalase (CAT) selon la méthode de Aebi (1984). Quant aux protéines totales, elles ont été dosées dans chaque échantillon selon la méthode de Bradford (1976).
2.5. Etude statistique
16Le traitement des données est effectué avec une analyse de la variance (ANOVA) à un critère de classification « AV1 » par les deux tests de comparaison celui de Ficher et de Tuckey. Une analyse de la variance à deux critères de classification « AV2 » est appliquée aussi pour comparer l’effet entre les deux organes. Tous les calculs ont été effectués à l’aide d’un logiciel d’analyse et de traitement des données MINITAB version 16.1. Les différences sont considérées comme (p : Seuil de signification) :
17* Significatives lorsque (p ≤ 0.05).
18** Hautement significatives lorsque (p ≤ 0.01).
19*** Très hautement significatives lorsque (p ≤ 0.001).
3. Résultats
20Le taux des protéines a augmenté que ce soit dans les échantillons de l’hépatopancréas ou du rein. Statistiquement, cette augmentation est très hautement significative pour la totalité des lots traités par rapport au témoin des échantillons de l’hépatopancréas (Figure 2a). Au niveau du rein l’augmentation est significative pour les deux premières doses (250 et 500 µg/g) et très hautement significative pour la troisième dose (750 µg/g) par rapport au témoin (Figure 2b).
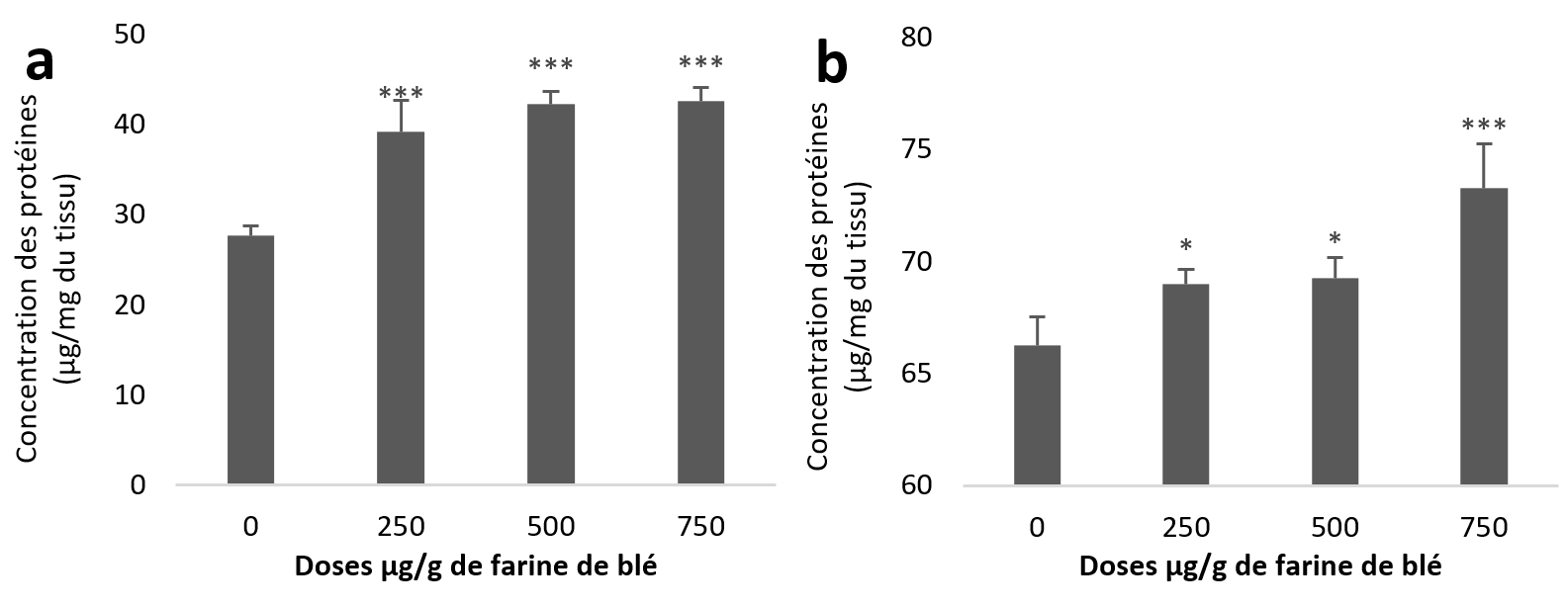
Figure 2
Taux des protéines totales chez Helix aspersa après quatre semaines de traitement avec les NPs de silice, (a) dans l’hépatopancréas (b) dans le rein
21Le traitement statistique de nos résultats montre une diminution très hautement significative (Figure 3 (a et b)) du taux de GSH dans l’hépatopancréas et aussi dans le rein pour les trois groupes traités par rapport aux taux des échantillons témoins.
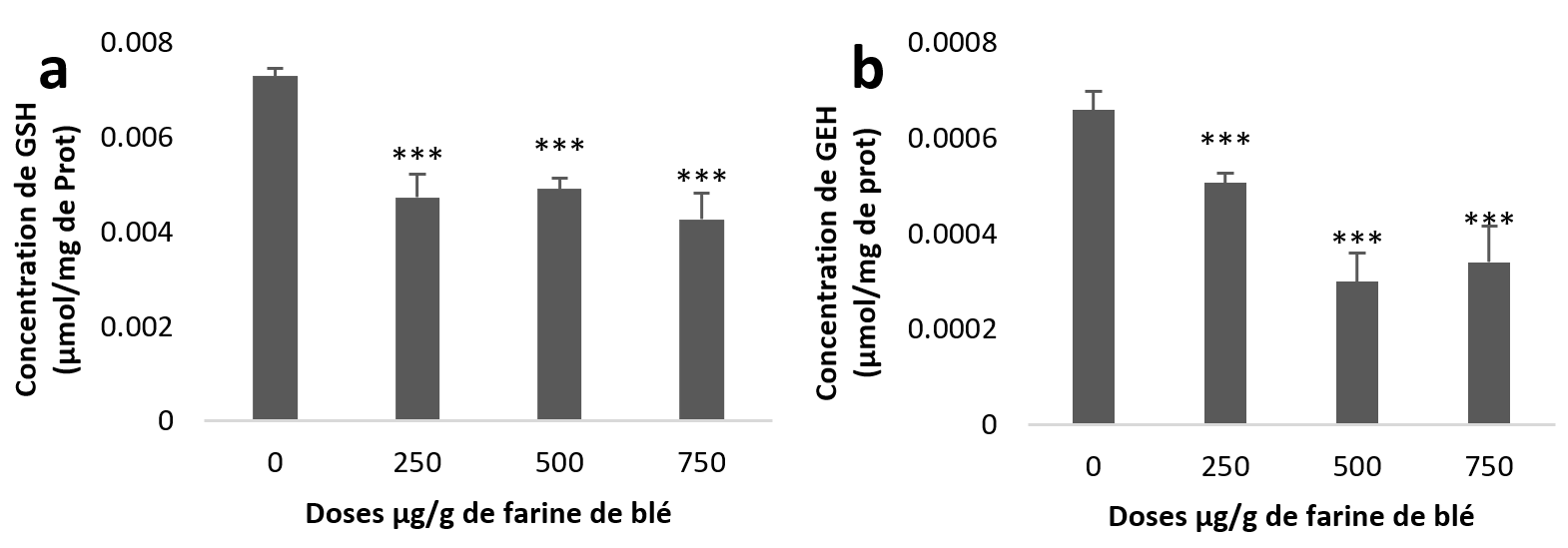
Figure 3
Taux du Glutathion (GSH) chez Helix aspersa après quatre semaines de traitement avec les NPs de silice, (a) dans l’hépatopancréas (b) dans le rein
22Par contre, les résultats statistiques de l’activité GST hépatopancréatique révèlent une augmentation très hautement significative pour les trois groupes traités par rapport au témoin (Figure 4a). Alors que dans les échantillons rénaux, l’augmentation est non significative à la dose (250 µg/g) et très hautement significative aux deux autres doses (Figure 4b).
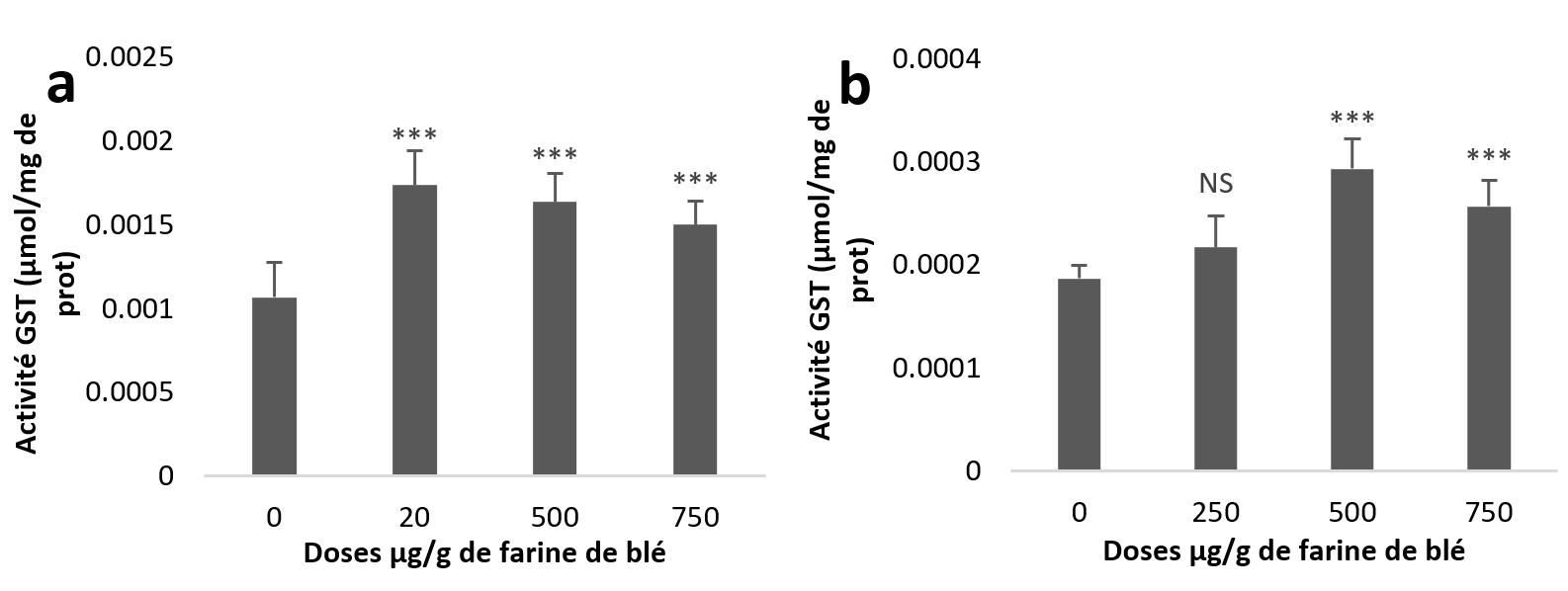
Figure 4
Activités enzymatiques de la glutathion s-transférase chez Helix aspersa après quatre semaines de traitement avec les NPs de silice, (a) dans l’hépatopancréas (b) dans le rein
23Pour l’activité GPx, l’analyse statistique montre une diminution très hautement significative chez tous les groupes traités par rapport au groupe témoin au niveau des échantillons hépatopancréatiques (Figure 5a). Concernant les échantillons rénaux, la diminution était significative aux doses (250 et 500 µg/g) et très hautement significative à la plus haute dose par rapport aux échantillons témoins (Figure 5b).
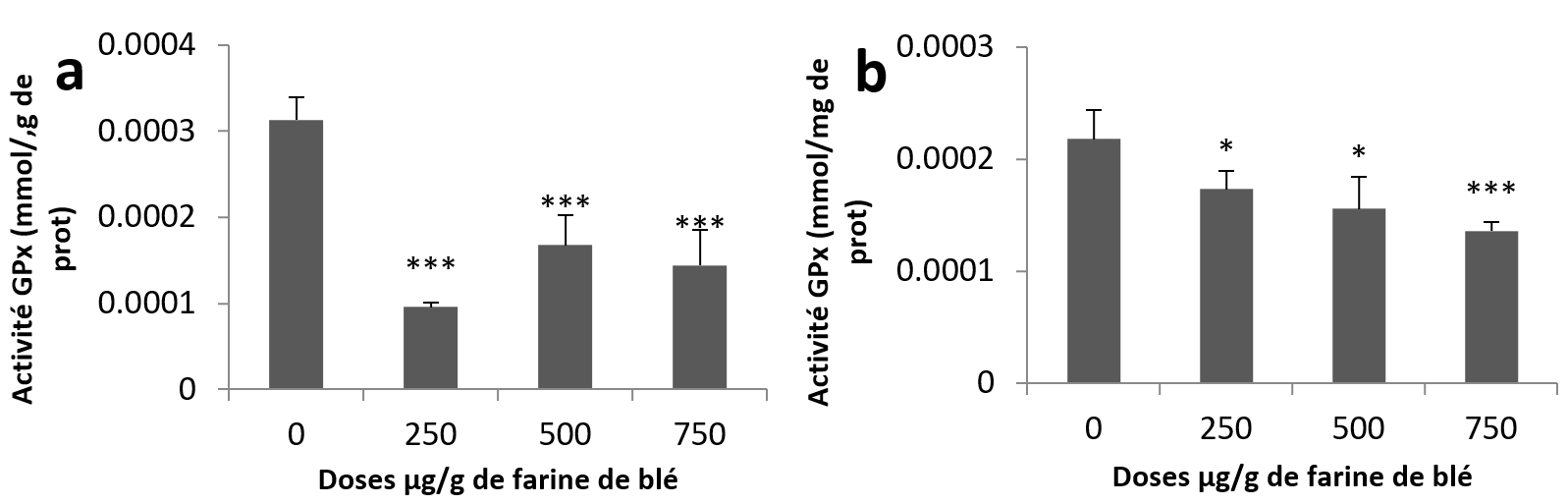
Figure 5
Activités enzymatiques de la glutathion Peroxydase chez Helix aspersa après quatre semaines de traitement avec les NPs de silice, (a) dans l’hépatopancréas (b) dans le rein
24Les moyennes des différents groupes étudiés font ressortir une diminution de l’activité de la CAT hépatopancréatique et rénale. L’étude statistique de cette diminution est très hautement significative pour la totalité des lots traités par rapport au témoin (Figure 6 (a et b)).
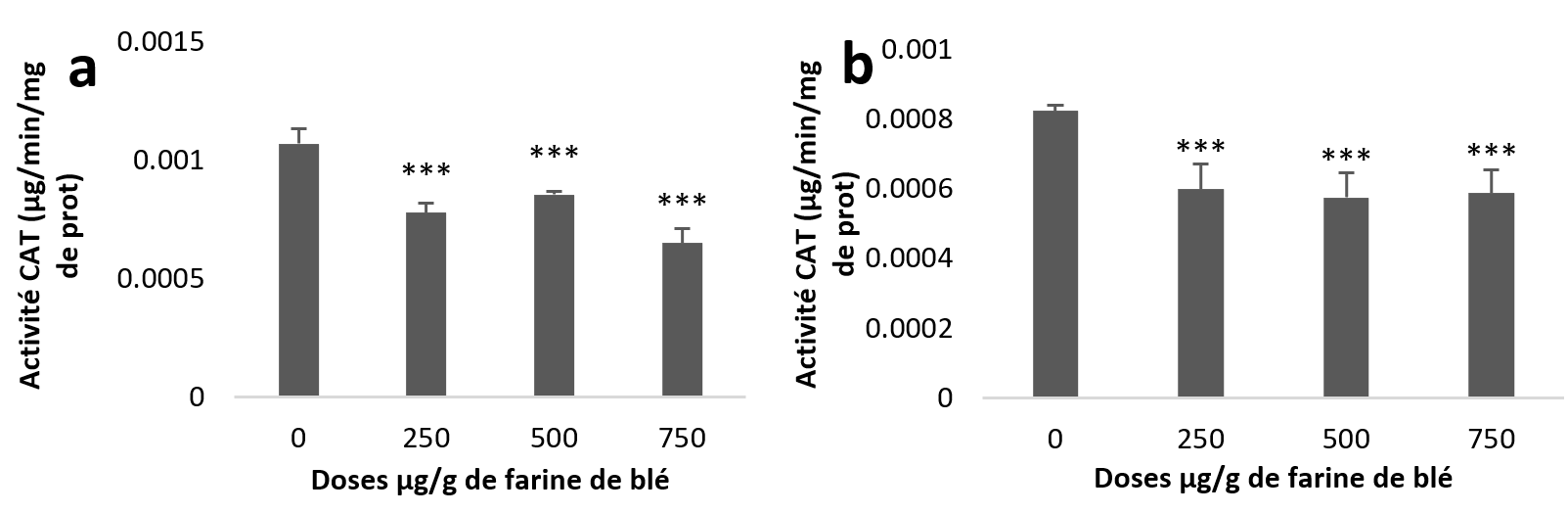
Figure 6
Activités enzymatiques de la catalase chez Helix aspersa après quatre semaines de traitement avec les NPs de silice, (a) dans l’hépatopancréas (b) dans le rein
25La comparaison entre les lots traités des deux organes (hépatopancréas et rein) en utilisant l’AV2 pour tous les paramètres étudiés n’a montré aucune différence significative.
4. Discussion
26Les paramètres biochimiques chez les espèces exposées à des substances toxiques sont considérés comme des bons biomarqueurs et peuvent constituer un important outil de diagnostic pour évaluer l'exposition et les effets des xénobiotiques (Mcloughlin et al., 2000).
27L'évolution du taux de protéines totales des escargots traités montre une augmentation mais d’une manière plus significative au niveau des échantillons traités de la glande digestive par rapport aux témoins, que dans ceux du rein, résultat qui illustre le rôle majeur de l’hépatopancréas dans la régulation métabolique. Les protéines sont les premiers biomarqueurs de perturbation métabolique, sans oublier que les enzymes sont de nature protéique, ce phénomène pourrait être considéré comme un biomarqueur précoce de l'exposition aux contaminants chimiques stimulant la synthèse d’enzymes du système de détoxification. Les protéines sont principalement impliquées dans l'architecture de la cellule ; elles peuvent également lier les toxines et jouer le rôle des protéines de transport (Cui et al., 2010). Nos résultats sont en accord avec ceux de Boucenna (2016) qui a trouvé une augmentation significative du taux des protéines hépatopancréatiques et rénales chez H. aspersa exposée à différentes doses des Nps d’oxyde de fer et d’oxyde d’aluminium. Pareillement, la silice nanométrique a induit une augmentation des protéines chez l’escargot de l’eau douce Pila virens (Srikanth et al., 2021).
28Plusieurs études ont testé des nanoparticules d’oxydes métalliques, citant le ZnO (Abdel-Azeem et Osman, 2021), le TiO2 (Abdel-Halim et al., 2021) le Fe2O3 (Besnaci et al., 2019) et le Al2O3 (Boucenna, 2016) sur H. aspersa qui, presque de la même manière, ont toutes noté un stress oxydant.
29Une diminution très hautement significative de la concentration du glutathion a été constatée pour tous les échantillons de l’hépatopancréas et du rein. Les mêmes variations ont été induites par les NPs de silice chez P. virens (Srikanth et al., 2021). Plusieurs autres études faites sur les NPs de silice ont noté cette diminution de ce paramètre dans les cellules du foie et du rein des rats males « in vivo » (Azouz et Korany, 2021), dans les cellules épithéliales pulmonaires humaines (A549) (Ahamed, 2013), dans les cellules humaines périphériques mononucléaires du sang (Mendoza et al., 2014) et dans les cellules de fibroblastes pulmonaires humains MRC-5 (Petrache-Voicu et al., 2015). Le glutathion est considéré comme un composant majeur dans la protection des cellules contre l'intervention oxydative par les espèces réactives de l'oxygène (Ali et al., 2020). Ces mêmes auteurs ont trouvé une diminution car le glutathion est considéré comme un agent réducteur et est considéré comme capturant tous les radicaux libres et agit également comme substrat pour les enzymes liées au glutathion (Ali et al., 2020).
30Nous observons une augmentation de l’activité GST, cela s'explique par l'importance de la GST dans la catalyse de la conjugaison des substrats électrophiles pour réduire le glutathion afin de protéger la cellule des effets des xénobiotiques (Ferrari et al., 2007). Nos résultats sont en accord avec ceux de Passagne et al. (2012) qui ont travaillé sur des cellules rénales et Munteanu et al. (2010) qui ont travaillé sur les cellules MRC-5. Ces auteurs ont suggéré que ces cellules pourraient affronter le stress oxydatif induit par les nanoparticules de silice. Cette augmentation a été observée chez H. aspersa suite à des traitements aux NPs de ZnO (Abdel-Azeem et Osman, 2021) ; d’oxyde de fer (Besnaci et al., 2019) ; d’Al2O3 (Boucenna, 2016) ; de TiO2 (Abdel-Halim et al., 2021).
31Les activités de la CAT et de la GPx ont subi une diminution, très remarquable dans les échantillons hépato-pancréatiques pour la GPx. Cette diminution suggère une intégrité mitochondriale moins préservée car la GPx et la CAT sont capables de réduire le peroxyde d’hydrogène (H2O2 molécule toxique pour la cellule et abondante au sein des mitochondries) en eau. On peut postuler que les NPs de la silice fumée ont inhibé l’activité enzymatique GPx et CAT.
32La GPx réduit les hydroperoxydes lipidiques en dérivés lipidiques hydroxylés, sa diminution signifie que la génération de peroxyde d'hydrogène est plus importante que celle de la peroxydation lipidique (Munteanu et al., 2010). Selon Escobar et al. (1996) la diminution de la GPx pourrait être due à une surproduction des ROS et l'épuisement du niveau de son substrat (GSH). Nos résultats corroborent ceux d’Ali et al. (2014) qui ont observé cette diminution chez les escargots pulmonaires d'eau douce Lymnaea luteola exposés aux nanos-Ag à des doses croissantes. Akhtar et al. (2010) étudiant la nanotoxicité de la silice pure sur les cellules épithéliales pulmonaires humaines ont trouvé la même variation de l’activité GPx. Siddiqui et al. (2015) aussi signalent une diminution dans l’activité catalase et ils suggèrent que le stress oxydatif induit par les Mo-NPs (molybdène NPs) pourrait être le principal mécanisme de la toxicité, traduit par la diminution de l'activité enzymatique de catalase antioxydant. Sur Helix aspersa, Besnaci et al. (2019) ont noté également cette diminution pour l’activité catalase suite à un traitement aux NPs de Fe2O3.
5. Conclusion
33Les nanotechnologies forment un domaine d’activité en pleine expansion, avant tout en raison du fait que les NPs révèlent des propriétés chimiques et physiques radicalement différentes des substances de même composition mais de plus grande taille. En effet, les connaissances actuelles des effets toxiques des nanoparticules de silice sont relativement limitées, il existe une incertitude réelle quant à leurs impacts sur les humains et l’environnement.
34Nos résultats montrent que la silice fumée nanométrique affecte l’hépatopancréas et le rein chez H. aspersa en induisant un stress oxydatif mis en évidence dans notre étude par la diminution du niveau de GSH et l’augmentation du niveau de protéines et de l’activité de la GST. La diminution des activités CAT et GPx observée, enzymes possiblement inhibées par les NP-SiO2 et/ou la chute du niveau de GSH, permet également de s’attendre à un stress oxydatif plus élevé. Ces résultats prouvent que les nanoparticules présentent une grande capacité de pénétration et d’internalisation au niveau cellulaire accompagnée par le déclenchement d’un stress oxydant qui suggère une augmentation du taux des radicaux libres qui sont responsables des lésions tissulaires.
Bibliographie
Abdel-Azeem H.H., Osman G.Y., 2021. Oxidative stress and histopathological effect of zinc oxide nanoparticles on the garden snail Helix aspersa. Environmental Science and Pollution Research, 28(8) : 9913-9920. https://doi.org/10.1007/s11356-020-11438-z
Abdel-Halim K.Y., Osman S.R., El-Danasoury H.T.M., Ziada R.M., 2021. Potential toxic effects of titanium dioxide nanoparticles and carbon nanotubes on land snail Helix aspersa : use of oxidative stress as a reliable biomarker for ecotoxicology assessment. Invertebrate Survival Journal, 18(1) : 119-129. https://doi.org/10.25431/1824-307X/isj.v18i1.119-129
Aebi H., 1984. Catalase in vitro. Methods in enzymology, 105 : 121-126. https://doi.org/10.1016/S0076-6879(84)05016-3
Ahamed M., 2013. Silica nanoparticles-induced cytotoxicity, oxidative stress and apoptosis in cultured A431 and A549 cells. Human & experimental toxicology, 32(2) : 186-195. https://doi.org/10.1177/0960327112459206
Akhtar M.J., Ahamed M., Kumar S., Siddiqui H., Patil G., Ashquin M., Ahmad I., 2010. Nanotoxicity of pure silica mediated through oxidant generation rather than glutathione depletion in human lung epithelial cells. Toxicology, 276(2) : 95-102. https://doi.org/10.1016/j.tox.2010.07.010
Ali D., Yadav P.G., Kumar S., Ali H., Alarifi S., Harrath A.H., 2014. Sensitivity of freshwater pulmonate snail Lymnaea luteola L., to silver nanoparticles. Chemosphere, 104 : 134-140. https://doi.org/10.1016/j.chemosphere.2013.10.081
Ali S.S., Ahsan H., Zia M.K., Siddiqui T., Khan F.H., 2020. Understanding oxidants and antioxidants: Classical team with new players. Journal of food biochemistry, 44(3) : e13145. https://doi.org/10.1111/jfbc.13145
Azouz R.A., Korany R., 2021. Toxic impacts of amorphous silica nanoparticles on liver and kidney of male adult rats: an in vivo study. Biological Trace Element Research, 199(7) : 2653-2662. https://doi.org/10.1007/s12011-020-02386-3
Besnaci S., Bensoltane S., Zerari L., Chrairia S., Ait-Hamlet S., Berrebbah H., 2016a. Impact of nanometric iron oxide in the hepatopancreas of terrestrial gastropod Helix Aspersa: Histological Changes and Biochemical Parameters. International Journal of Pharmaceutical Sciences Review and Research, 36(2) : 234-241. https://doi.org/10.13140/RG.2.2.10749.92644
Besnaci S., Bensoltane S., Braia F.M.H., Zerari L., Khadri S., Loucif, H., 2016b. Embryotoxicity evaluation of iron oxide Fe2O3 on land snails: Helix aspersa. J. Entomol. Zool. Stud., 4b: 317-323.
Besnaci S., Bensoltane S., Djekoun M., 2019. Oxidative stress and histological changes induced by the nano-Fe2O3 in Helix aspersa. Scientific Study & Research. Chemistry & Chemical Engineering, Biotechnology, Food Industry., 20(2) : 119-133.
Boucenna M., 2016. Etude de la toxicité des particules métalliques d’origine industrielle chez Helix aspersa. Evaluation nanotoxicologique du Fe2O3 et Al2O3. Thèse de Doctorat Université Badji Mokhtar-Annaba. 193p.
Bradford M.M., 1976. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein dye binding. Anal Biochem, 72 : 278‐254. https://doi.org/10.1016/0003-2697(76)90527-3
Cui Y., Gong X., Duan Y., Li N., Hu R., Liu H., Hong M., Zhou M., Wang L., Wang H., Hong F., 2010. Hepatocyte apoptosis and its molecular mechanisms in mice caused by titanium dioxide nanoparticles. Journal of Hazardous Materials, 183 : 874-880. https://doi.org/10.1016/j.jhazmat.2010.07.109
Cui Y., Melby E.S., Mensch A.C., Laudadio E.D., Hang M.N., Dohnalkova A., Hu D., Hamers R.J., Orr G., 2019. Quantitative mapping of oxidative stress response to lithium cobalt oxide nanoparticles in single cells using multiplexed in situ gene expression analysis. Nano letters, 19(3) : 1990-1997. https://doi.org/10.1021/acs.nanolett.8b05172
Eom H.J., Choi J., 2009. Oxidative stress of silica nanoparticles in human bronchial epithelial cell, Beas-2B. Toxicology in Vitro, 23(7) : 1326-1332. https://doi.org/10.1016/j.tiv.2009.07.010
Escobar J.A., Rubio M.A., Lissi, E.A., 1996. SOD and catalase inactivation by singlet oxygen and peroxyl radicals. Free Radical Biology and Medicine, 20(3) : 285-290. https://doi.org/10.1016/0891-5849(95)02037-3
Ferrari A., Venturino A., de D’Angelo A.M.P., 2007. Effects of carbaryl and azinphos methyl on juvenile rainbow trout (Oncorhynchus mykiss) detoxifying enzymes. Pesticide Biochemistry and Physiology, 88(2) : 134-142. https://doi.org/10.1016/j.pestbp.2006.10.005
Flohé L., Günzler W.A., 1984. Assays of glutathione peroxidase. Methods in enzymology, 105 : 114-120. https://doi.org/10.1016/S0076-6879(84)05015-1
Gomot A., 1997. Dose-dependent effects of cadmium on the growth of snails in toxicity bioassays. Arch. Environ.Contam. Toxicol. 33 : 209-216. https://doi.org/10.1007/s002449900245
Goodman T.T., Chen J., Matveev K., Pun, S.H., 2008. Spatio-temporal modelling of nanoparticle delivery to multicellular tumor spheroids. Biotechnology and Bioengineering, 101(2) : 388–399. https://doi.org/10.1002/bit.21910
Habig WH., Pabst M.J., Jakoby WB., 1974. Glutathione S-transferases. The first enzymatic step in mercapturic acid formation. Journal of Biological Chemistry, 249 : 7130-7139. https://doi.org/10.1016/S0021-9258(19)42083-8
Hansen S.F., Michelson E.S., Kamper A., Borling P., Stuer-Lauridsen F., Baun A., 2008. Categorization framework to aid exposure assessment of nanomaterials in consumer products. Ecotoxicology, 17(5) : 438-447. https://doi.org/10.1007/s10646-008-0210-4
McLoughlin N., Yin D., Maltby L., Wood R.M., Yu H., 2000. Evaluation of sensitivity and specificity of two crustacean biochemical biomarkers. Environmental Toxicology and Chemistry, 19 : 2085‐2092. https://doi.org/10.1002/etc.5620190818
Mendoza A., Torres-Hernandez J.A., Ault J.G., Pedersen-Lane J.H., Gao D., Lawrence D.A., 2014. Silica nanoparticles induce oxidative stress and inflammation of human peripheral blood mononuclear cells. Cell Stress and Chaperones, 19(6) : 777-790. https://doi.org/10.1007/s12192-014-0502-y
Munteanu M.C., Radu M., Hermenean A., Sima C., Dinu D., Costache M., Grigoriu C., Dinischiotu A., 2010. Antioxidative response induced by SiO2 nanoparticles in MRC5 cell line. Rom Biotechnol Lett, 15(1) : 5000-5007.
Nafisi V., Hägg M.B., 2014. Development of dual layer of ZIF-8/PEBAX-2533 mixed matrix membrane for CO2 capture. Journal of Membrane Science, 459 : 244-255. https://doi.org/10.1016/j.memsci.2014.02.002
Napierska D., Thomassen L.C., Lison D., Martens J.A., Hoet P.H., 2010. The nanosilica hazard: another variable entity. Particle and fibre toxicology, 7(1) : 1-32. https://doi.org/10.1186/1743-8977-7-39
Park E.J., Park K., 2009. Oxidative stress and pro-inflammatory responses induced by silica nanoparticles in vivo and in vitro. Toxicology letters, 184(1) : 18-25. https://doi.org/10.1016/j.toxlet.2008.10.012
Passagne I., Morille M., Rousset M., Pujalté I., L’azou B., 2012. Implication of oxidative stress in size-dependent toxicity of silica nanoparticles in kidney cells. Toxicology, 299(2-3) :112-124. https://doi.org/10.1016/j.tox.2012.05.010
Petrache-Voicu S.N., Dinu D., Sima C., Hermenean A., Ardelean A., Codrici E., Dinischiotu A., 2015. Silica nanoparticles induce oxidative stress and autophagy but not apoptosis in the MRC-5 cell line. International Journal of molecular sciences, 16(12) : 29398-29416. https://doi.org/10.3390/ijms161226171
Siddiqui M.A., Saquib Q., Ahamed M., Farshori N.N., Ahmad J., Wahab R., Pant A.B., 2015. Molybdenum nanoparticles-induced cytotoxicity, oxidative stress, G2/M arrest, and DNA damage in mouse skin fibroblast cells (L929). Colloids and Surfaces B: Biointerfaces, 125 : 73-81. https://doi.org/10.1016/j.colsurfb.2014.11.014
Srikanth K., Raju N.V., Pamanji R, Nutalapati V., 2021. Pila virens as sentinel of silica nanoparticles toxicity induced oxidative stress. Materials Letters, 300 : 130-185. https://doi.org/10.1016/j.matlet.2021.130185
Wang F., Gao F., Lan M., Yuan H., Huang Y., Liu J., 2009. Oxidative stress contributes to silica nanoparticle-induced cytotoxicity in human embryonic kidney cells. Toxicology in vitro, 23(5) : 808-815. https://doi.org/10.1016/j.tiv.2009.04.009
Weckbecker G., Cory J.G., 1988. Ribonucleotide reductase activity and growth of glutathione-depleted mouse leukemia L 1210 cells in vitro. Cancer Letters, 40 : 257-264. https://doi.org/10.1016/0304-3835(88)90084-5